Method Article
Визуализация сигналов Ca2+ в мелких легочных венах при физиологическом внутрипросветном давлении
В этой статье
Резюме
В этом протоколе мы представляем новую методику регистрации и анализа сигналов Ca2+ во внутрилегочных венах (малых легочных венах или ЛВ) при физиологическом внутрипросветном давлении. Метод включает в себя выделение небольших PV, их инкубацию с индикатором Ca2+ , канюлирование и нагнетание давления, конфокальную визуализацию сигналов Ca2+ и анализ данных.
Аннотация
Легочные вены (ЛВ) несут богатую кислородом кровь из легких обратно к левым отделам сердца, тем самым выполняя важную функцию в доставке богатой кислородом крови к жизненно важным органам. Тем не менее, большинство исследований легочной сосудистой сети были сосредоточены на легочных артериях и капиллярах в нормальных и болезненных условиях. Сигналы Ca2+ являются важнейшими регуляторами функции сосудов. Несмотря на критическую физиологическую роль ЛВ, сигналы Ca2+ в небольших внутрилегочных ВП не регистрировались в физиологических условиях. В данной работе мы описываем метод регистрации активности сигнала Ca2+ в мышиных ПВ, изолированных, канюлированных и находящихся под давлением 5 мм рт.ст. Включив индикатор Ca2+ , мы можем изучать сигналы Ca2+ в слое миоцитов малых PV с помощью высокоскоростной конфокальной визуализации вращающегося диска в физиологических условиях. Наши репрезентативные данные указывают на то, что сигналы Ca2+ в малых миоцитах PV опосредованы открытием ионных каналов рецептора рианодина. Этот метод будет представлять значительный интерес для исследователей в области физиологии и нарушений легочных сосудов.
Введение
Легочная сосудистая сеть играет важную роль в обмене газов, добавлении кислорода, удалении углекислого газа из крови 1,2. Легочные артерии (ЛТ) получают бедную кислородом кровь от правых отделов сердца. Газообмен происходит на уровне капилляров (альвеолярных капилляров), а богатая кислородом кровь доставляется в левое отделение сердца по легочным венам (ЛВ). В отличие от других вен, несущих бедную кислородом кровь, ПВ выполняют важную функцию доставки богатой кислородом крови к левым отделам сердца и, следовательно, к жизненно важным органам тела. Тем не менее, сигнальные механизмы, которые регулируют функцию ФВ в нормальных и болезненных условиях, плохо изучены.
Исследования легочной сосудистой сети в основном были сосредоточены на ПА и легочных капиллярах. Недавние исследования показывают, что сигналы Ca2+ в слоях эндотелиальных и гладкомышечных клеток имеют решающее значение в регуляции функции PAs 3,4,5. Кроме того, аномальные механизмы передачи сигналов Ca2+ ответственны за нарушение функции ПА и легочных капилляров в условиях заболевания 6,7,8,9,10. Тем не менее, исследования внутрилегочных вен (небольших ВП) остаются недостаточными. Эктопическая активность в больших ЛВ, прилегающих к левым отделам сердца (сердечные ВП), была предложена в качестве источника фибрилляции предсердий у людей11,12, а спонтанная пульсация13 и сигналы Ca2+ 12,14,15 также были продемонстрированы при больших ВП. Малые ВП доставляют богатую кислородом кровь к большим ВП. Тем не менее, механизмы передачи сигналов Ca2+ в малых PV не изучались при физиологическом внутрипросветном давлении.
В этой рукописи мы представляем новый метод выделения, канюлирования и создания давления в малых ЛВ и визуализации сигналовCa2+ в миоцитах ПВ с помощью высокоскоростной конфокальной микроскопии с вращающимся диском. Общая цель этого метода заключается в регистрации спонтанных и индуцированных сигналовCa2+ в малых миоцитах PV при физиологическом внутрипросветном давлении. Внутрипросветное давление играет решающую роль в регуляции сигналовCa2+ в миоцитах16. Как правило, ПВ подвергаются физиологическому внутрипросветному давлению в диапазоне от 4 до 10 мм рт.ст.17,18. Изменения внутрипросветного давления на протяжении сердечного цикла могут влиять на сигналыCa2+ в миоцитах ФВ. Поэтому важно использовать методику, позволяющую изучать эти сигналы в физиологических условиях и изучать, как на них влияют различные внутрипросветные давления. Кроме того, большинство предыдущих исследований ВП были сосредоточены на более крупных сердечных ВП. В настоящее время метод фокусируется на небольших ЛВ, расположенных глубоко в легких, что может быть более актуальным для понимания регуляции функции легких как в здоровом, так и в заболеваемом состоянии.
протокол
Все протоколы для животных были одобрены Комитетом по уходу за животными и их использованию Университета Вирджинии (протоколы 4100 и 4120). Мышей C57BL6/J в возрасте 10-12 недель усыпляют пентобарбиталом (90 мг/кг; внутрибрюшинно) с последующим вывихом шейки матки для забора легочной ткани 3,4,19,20.
1. Изоляция малых фотоэлектрических установок
- Очистите инструменты для вскрытия и посуду 100% этанолом с последующим мытьем деионизированной водой.
- С помощью ножниц откройте грудную полость. С помощью щипцов аккуратно удаляют сердце и легкие из грудной полости с минимальным прикосновением к легким.
- Поместите салфетку на пластину, покрытую покрытием Sylgard, содержащую холодный (4-10 °C) физиологический раствор физиологической соли, буферизованный методом HEPES (HEPES-PSS, в мМ, 10 HEPES, 134 NaCl, 6 KCl, 1 MgCl2 гексагидрата, 2 CaCl2 дигидрата и 7 декстрозы, pH скорректирован до 7,4 с использованием 1 M NaOH)3,4,19. Используйте диссекционные штифты, чтобы зафиксировать сердце и легкие таким образом, чтобы большие ПВ и ПА были хорошо видны, а левая доля легкого была слегка растянута, как показано на рисунке 1.
- Используя большие легочные вены (ЛВ) в качестве точек отсчета, аккуратно удалите ткань, окружающую мелкие внутрилегочные вены (небольшие ЛВ, примерно 50-100 мкм в диаметре, обозначенные пунктирным прямоугольником на рисунке 1) с помощью тонких ножниц. Избегайте прямого контакта с маленькими ПВ. Аккуратно изолируйте маленькие ПВ от окружающих тканей.
- Изолируйте сегменты малых фотоэлектрических панелей длиной примерно 1-2 мм. Поместите маленькие фотоэлектрические батареи при температуре 4-10 °C HEPES-PSS.
2. Загрузка небольших фотоэлектрических модулей с индикатором Ca2+
ПРИМЕЧАНИЕ: С небольшими ПВ следует обращаться осторожно, следя за тем, чтобы щипцы касались только кончиков ПВ. Данный способ является модификацией описанной ранее методики 3,7,20,21.
- Приготовьте стоковую концентрацию 2,5 мМ Fluo-4 AM с ДМСО 3,4. Используя вышеуказанный исходный раствор, приготовьте 10 мкМ флуо-4 АМ и 0,04% плуроновую кислоту с HEPES-PSS.
- Поместите небольшие ПВ в пробирку объемом 1,5 мл с загрузочным раствором (10 мкМ флуо-4 АМ и 0,04% плуроновой кислоты в HEPES-PSS)3,4. Накройте пробирку алюминиевой фольгой и поставьте на водяную баню для инкубации при температуре 37 °C на 1 ч.
- После инкубации осторожно замените загрузочный раствор на 4-10 °C HEPES-PSS и выдержите на льду в течение 30 минут в качестве этапа промывки.
3. Канюляция малых фотоэлектрических панелей
Примечание: Данный способ является модификацией методики, описанной ранее 3,20,21.
- Подготовьте камеру для миографии под давлением с двумя стеклянными канюлями, по одной с каждой стороны. Заполните канюли PSS (119 мМ NaCl, 4,7 мМ KCl, 1,2 мМ KH2PO4, 1,2 мМ MgCl2 160 гексагидрат, 2,5 мМ CaCl2 дигидрат 3,4,21,22, 7 мМ декстроза и 24 мМ NaHCO 3, поддерживаемые на уровне pH 7,4 путем барботирования раствора 21% O 2 и 5% CO 2) с помощью шприца объемом 10 мл.
- Извлеките небольшой фотоэлектрический фильтр из моющего раствора и поместите его в камеру для миографии под давлением. С помощью щипцов с тонкими наконечниками осторожно канюлируйте один конец маленького PV на одну из канюль. Затем с помощью микронити, изготовленной из нейлоновой нити, завяжите узел вокруг канюлированного конца маленького ПВ и кончика канюли, чтобы закрепить его.
- Осторожно протолкните PSS через канюлю, чтобы удалить кровь внутри PV. С помощью нейлоновой нити перевяжите другой конец стеклянной канюлей с помощью микронитей, как показано на рисунке 1.
4. Нагнетание давления и визуализация Ca2+ малых фотоэлектрических модулей
Примечание: Данный способ является модификацией способа, описанногоранее 3,21.
- С помощью серворегулятора давления, прикрепленного к трубке, содержащей PSS, нагнетайте давление в маленькую фотоэлектрическую энергию с одного конца под давлением 5 мм рт.ст. Используйте перистальтический насос, подключенный как к входному, так и к выходному отверстию, чтобы переплавить PSS. Поддерживайте температуру суперфузата на уровне 37 °C.
- По истечении периода равновесия получите изображения Ca2+ в течение 1000 кадров (частота кадров: 30 кадров в секунду) с помощью объектива с 40-кратным погружением в воду (NA 0,8) и системы конфокальной визуализации с вращающимся диском. Возбуждайте Fluo-4 с помощью твердотельного лазера с длиной волны 488 нм и захватывайте излучаемую флуоресценцию с помощью полосового фильтра 525/36 нм.
- Нанесите антагонист рианодиновых рецепторов (RyR) рианодин (5 мкМ)21,23 на суперфузат. Подождите 5 минут. Повторите съемку изображений Ca2+, как описано выше, захватив еще 1000 кадров со скоростью 30 кадров/с.
5. Анализ изображений Ca2+
Примечание: Данный способ является модификацией методики, описанной ранеев пунктах 21,22,24. Изменения в активности сигналов Ca2+ в миоцитах ФВ могут дать важную информацию об ингибировании или усилении связи возбуждения-сокращения в ФВ.
- Используйте специально разработанное программное обеспечение (разработанное доктором Адрианом Боневым, https://github.com/vesselman/SparkAn) для анализа изображений Ca2+ .
- Сглаживание изображений с помощью фильтра 5 x 5 boxcar и фильтра 5 x 5 медианы. Используйте рамку, обрисовывающую плоскую область фотогальванической панели с несколькими ячейками для автоматического обнаружения событий.
- Нажмите « Просмотр и автоопределение событий». Используйте следующие настройки: порог события при амплитуде 1,3 F/F0, допуск 20%, поле сканирования 7 x 7 пикселей и среднее значение 7 изображений. Автоматически генерируйте усредненные изображения каждые 10 изображений, начиная с первого изображения.
- Нажмите « Начать поиск» (значок глаза). Найдите таблицу событий, сохраненную в виде файла Маркировки, в меню Файл. Чтобы рассчитать события на мкм², разделите количество обнаруженных сигналов Ca2+ на площадь выбранного кадра.
Результаты
На рисунке 2А показано поле зрения с небольшой фотоэлектрической установки при внутрипросветном давлении 5 мм рт.ст. Символы + обозначают автоматически обнаруженные сигналы Ca2+ в пределах выбранного кадра (видео 1), обозначенные зеленым контуром. От каждой ЛП записывалось одно поле зрения, и от каждой мыши использовалось по одному ПВ. Одна маленькая PV рассматривалась как n=1. Количество сигналов Ca2+ на мкм2 в минуту сравнивали до и через 5 мин после добавления ингибитора RyR рианодина (5 мкМ)23 в парных экспериментах. Парный t-критерий был использован для статистических сравнений с целью выявления значимых различий. Количество спонтанно возникающих сигналов Ca2+ составляло 0,73 ± 0,2 события в минуту намкм2 (рис. 2B,C) в описанных выше условиях. Лечение рианодином почти полностью ингибировало сигналыCa2+ в небольших ПВ (рис. 2C, видео 2), о чем свидетельствует резкое снижение количества событий в минуту на мкм2. Эти данные показывают, что спонтанная активность сигналов Ca2+ в слое миоцитов от малых PV под давлением представляет собой открытие RyR. Эти результаты свидетельствуют о том, что активность сигналов Ca2+ может быть изучена в небольших PV при физиологических внутрипросветных давлениях. Этот метод облегчит будущие исследования влияния внутрипросветного давления и нейрогуморальных медиаторов на передачу сигналов Ca2+ в малых миоцитах PV, потенциально предлагая ценную информацию о регуляции функции PV. В то время как текущее исследование сосредоточено на количестве сигналов RyR Ca2+, также можно проанализировать кинетические свойства этих сигналов, включая продолжительность, амплитуду, пространственный разброс и время нарастания. Понимание того, как физиологические и патологические стимулы влияют на кинетические свойства сигналов RyR Ca2+, может предоставить важную информацию о регуляции функции ФВ как в здоровом, так и в больном состоянии.
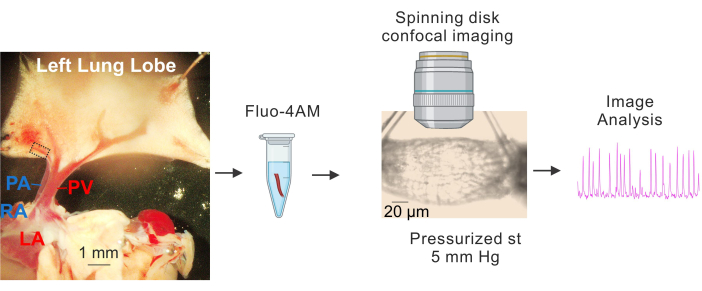
Рисунок 1: Подготовка и визуализация Ca2+ ЛВ. Последовательные изображения, показывающие идентификацию и выделение малых ФВ, инкубацию fluo4-AM, канюляцию и нагнетание давления (5 мм рт.ст.), высокоскоростную конфокальную визуализацию с вращающимся диском и анализ изображений. Пунктирный прямоугольник на изображении слева представляет PV, использованный для исследования. Сокращения: PA = легочная артерия; RA = правое предсердие; PV = легочная вена; LA = левое предсердие. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
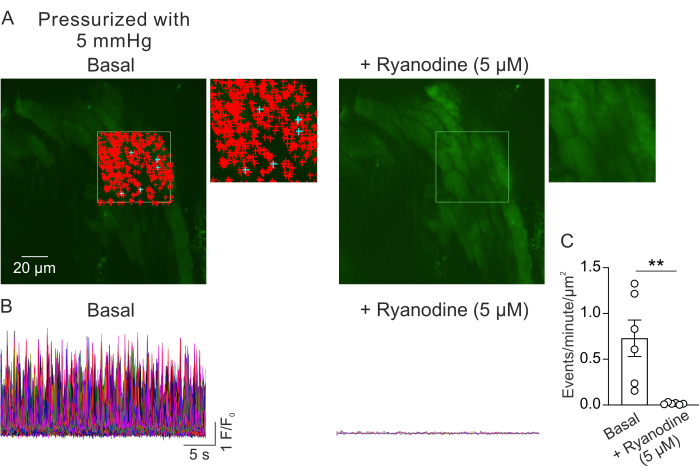
Рисунок 2: Анализ изображений Ca2+ . (A) Изображения поля зрения с находящейся под давлением (5 мм рт.ст.), нагруженной флуоре-4, малой PV при отсутствии (слева) или присутствии рианодина (5 мкМ; Ингибитор RyR, справа). Зеленым прямоугольником обозначена область, которая была выбрана для автоопределения сигналов Ca2+ . Знаки + представляют собой автоматически обнаруженные события в кадре. Красными знаками обозначены сигналы площадью менее 3000мкм2, а синими – сигналы, занимающие площадь более 3000мкм2. Каждый знак + обозначает одно событие или сигнал Ca2+ . (B) F/F0 следы обнаруженных событий из выбранной области, обозначенной в A, показывающие активность сигналов Ca2+ в слое миоцитов от находящихся под давлением малых PV в базальных условиях (слева) и в присутствии рианодина (справа). (C) Количественная оценка событий в минуту намкм2 сигналов Ca2+ в малых PV до и после добавления рианодина (1 PV на мышь; n=6 мышей; **p < 0,01 против базала; парный t-критерий). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Видео 1: Ca2+ сигнализирует в небольшой фотоэлектрической камере под давлением 5 мм рт.ст. перед обработкой рианодином. Поле зрения представляет собой выбранный кадр, показанный зеленым цветом на рисунке 2. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 2: Ca2+ сигнализирует в небольшом фотоэлектрическом фильтре под давлением 5 мм рт.ст. после обработки рианодином (5 мкМ). Поле зрения представляет собой выбранный кадр, показанный зеленым цветом на рисунке 2. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Обсуждение
Сигналы Ca2+ в гладкомышечных клетках играют решающую роль в регуляции функции сосудов25. ЛВ являются важным, но относительно малоизученным сосудистым руслом, ответственным за доставку богатой кислородом крови к левым отделам сердца26. Тем не менее, механизмы передачи сигналов Ca2+ в небольших ЛВ и их влияние на физиологическую функцию неизвестны. Целью данной рукописи является описание нового метода выделения, канюлирования и давления малых ПВ для регистрации сигналов Ca2+ в слое миоцитов и анализа этих сигналов Ca2+ . Возможность визуализации сигналов Ca2+ в небольших фотоэлектрических модулях может помочь нам лучше понять, как эти сигналы работают в нормальных и болезненных условиях. В то время как изучение сигналов Ca2+ в ЛВ в интактном легком дало бы физиологически более релевантные данные, небольшие ЛВ не видны четко в интактном легком, что может создать технические проблемы с нагрузкой красителей Ca2+ и конфокальной визуализацией. Изоляция и нагнетание давления в малых фотоэлектрических системах предлагает альтернативный способ наблюдения сигналов Ca2+ при физиологическом внутрипросветном давлении, температуре и ионных растворах.
Визуализация ЛВ Ca2+, описанная в данной рукописи, основана на нашей хорошо зарекомендовавшей себя процедуре визуализации Ca2+ в системных артериях 21,22,27. Полученные данные свидетельствуют о том, что большинство сигналов Ca2+ в малых PV-миоцитах обусловлены открытием ионных каналов RyR. Таким образом, протокол, изложенный в данной рукописи, позволит в будущем изучить регуляцию RyR и ее влияние на функцию RyR в нормальных условиях и при заболеваниях. Активность RyR2 необходима для сокращений сердечных миоцитов28, в то время как в клетках артериальных гладких мышц она связана с расслаблением29. Точное влияние активности RyR на небольшое сокращение PV остается неизвестным. Миография давлением является широко используемым методом для мониторинга изменений в сокращении мелких кровеносных сосудов. Таким образом, вполне вероятно, что подготовка фотоэлектрических панелей под давлением также может быть использована для мониторинга небольших сокращений фотоэлектрических панелей.
Рианодин проявляет зависящее от концентрации влияние на активность RyR, увеличивая ее при субмикромолярных концентрациях и уменьшая при микромолярныхконцентрациях23. Рианодин также может оказывать косвенное ингибирующее действие на другие сигналыCa2+ в небольших PV, возможность чего не была проверена. При используемой концентрации мы не наблюдали компенсаторного увеличения сигналовCa2+ в PV. Регуляция сигналов Ca2+ в изолированных и находящихся под давлением PV может отличаться от регуляции в PV в неповрежденном легком, и эту возможность еще предстоит изучить. Тем не менее, регистрация сигналов Ca2+ в небольших ЛВ в интактном легком от мыши, находящейся под наркозом, представляет собой значительные проблемы, возникающие из-за расположения легкого в грудной полости и трудности избирательной загрузки индикатора Ca2+ в ВП у мышей, находящихся под наркозом.
Известно, что напряжение сдвига кровотока изменяет функцию кровеносных сосудов. Несмотря на то, что используемый в настоящее время метод позволяет изолировать влияние внутрипросветного давления на сигналы Ca2+ в небольших фотоэлектрических установках, отсутствие течения или напряжения сдвига является потенциальным ограничением. Тем не менее, напряжение потока или сдвига может быть легко включено и выполнено в сочетании с визуализацией Ca2+ с использованием установок, описанных ранее21. Возможно, что напряжение потока/сдвига изменяет активность сигналов Ca2+ в небольших фотоэлектрических батареях, что может стать интересной темой для будущих исследований.
Мы использовали fluo-4-AM в качестве индикатора Ca2+ для регистрации сигналов Ca2+ в небольших PV. В зависимости от экспериментальных потребностей, должна быть возможность использовать другие индикаторы Ca2+ , которые могут возбуждаться на длине волны 488 нм (Calbryte 520 AM)7 или 560 нм (Calbryte 590 AM)30. Использование конфокальной системы визуализации с вращающимся диском позволяет визуализировать сигналы Ca2+ , в частности, в миоцитах PV. Несмотря на то, что в настоящем исследовании это не изучалось, сосредоточение внимания на слое эндотелиальных клеток позволит регистрировать эндотелиальные сигналыCa2+ в небольших ЛП. ПА и ЛВ функционально различаются и подвергаются воздействию различных микросред. Таким образом, сравнение миоцитарных и эндотелиальных сигналовCa2+ между малыми и малыми ПА может дать решающее представление об их функциональных различиях.
Вполне вероятно, что сигналы Ca2+ в небольших ВП регулируют поток богатой кислородом крови через ВП. Давление внутри левого предсердия изменяется от 4 мм рт.ст. до 12 мм рт.ст. в течение каждого сердечного цикла17,18. Поскольку ВП снабжают кровью левое предсердие, вполне вероятно, что давление внутри ВП также меняется в течение сердечного цикла. Предыдущие исследования показали, что RyR может активироваться внутрипросветным давлением в мелких артериях16. Таким образом, измерение влияния внутрипросветного давления на сигналы PV Ca2+ может дать новое представление о доставке богатой кислородом крови от PV к левым отделам сердца. Нервная стимуляция и гуморальные медиаторы в кровотоке также могут активировать сигналы Са2+ гладкой мускулатуры. Данный метод облегчит будущие исследования влияния нейрогуморальных медиаторов на сигналы ПВ Ca2+ и функцию ФВ.
В протоколе есть несколько важных шагов, о которых следует позаботиться. Тщательная диссекция легочных вен (ЛВ) чрезвычайно важна. Крайне важно избегать прикосновения к области визуализации фотоаппаратов инструментами для препарирования, так как это может негативно сказаться на их здоровье. Прикасаться следует только к концам фотоэлектрических панелей. Сокращение времени вскрытия может повысить вероятность успеха. Недостаточная загрузка красителя может привести к снижению соотношения сигнал/шум и увеличить вероятность ложных срабатываний во время автообнаружения событий. Следование описанному здесь протоколу должно обеспечить адекватную загрузку красителя в миоцитах ФВ.
Таким образом, мы представили метод регистрации сигналовCa2+ в небольших PV, который позволяет исследовать механизмы передачи сигналов Ca2+ в этом важном, но часто упускаемом из виду сосудистом русле. Важно отметить, что возможность регистрировать сигналы Ca2+ в небольших ЛВ в нормальных условиях может обеспечить ценное понимание патологических механизмов заболеваний легких, включая легочную гипертензию, повреждение легких и отек легких, вызванный сердечной недостаточностью.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование финансировалось грантами от NHLBI (HL167208, HL157407 и HL146914) SKS и NIDDK (DK138271) до YLC.
Материалы
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
Ссылки
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. Thorax, heart pulmonic valve. , StatPearls Publishing. Treasure Island, FL, USA. (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118(2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777(2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553(2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. XXII Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347(2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. Pulmonary capillary wedge pressure. , StatPearls Publishing. Treasure Island, FL, USA. (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186(2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157(2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403(2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. Physiology, pulmonary circulation. , StatPearls Publishing. Treasure Island, FL, USA. (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены