Method Article
Fizyolojik intraluminal basınçlarda küçük pulmoner venlerde Ca2+ sinyallerinin görüntülenmesi
Bu Makalede
Özet
Bu protokolde, intrapulmoner venlerde (küçük pulmoner venler veya PV'ler) fizyolojik intraluminal basınçlarda Ca2+ sinyallerinin kaydedilmesi ve analiz edilmesi için yeni bir teknik sunuyoruz. Teknik, küçük PV'lerin izole edilmesini, bunların bir Ca2+ göstergesi ile inkübe edilmesini, kanüle edilmesini ve basınçlandırılmasını, Ca2 + sinyallerinin konfokal görüntülemesini ve veri analizini içerir.
Özet
Pulmoner venler (PV'ler) oksijen açısından zengin kanı akciğerlerden sol kalbe geri taşır ve böylece oksijen açısından zengin kanın hayati organlara iletilmesinde önemli bir işlev görür. Bununla birlikte, pulmoner vasküler sistem ile ilgili çoğu çalışma, normal ve hastalık koşulları altında pulmoner arterler ve kılcal damarlar üzerine odaklanmıştır. Ca2+ sinyalleri vasküler fonksiyonun kritik düzenleyicileridir. PV'lerin kritik fizyolojik rollerine rağmen, küçük intrapulmoner PV'lerdeki Ca2+ sinyalleri fizyolojik koşullar altında kaydedilmemiştir. Burada, 5 mmHg'de izole edilmiş, kanüle edilmiş ve basınçlı fare PV'lerinde Ca2+ sinyal aktivitesini kaydetmek için bir teknik açıklıyoruz. Bir Ca2 + göstergesi ekleyerek, fizyolojik koşullar altında yüksek hızlı, dönen disk konfokal görüntüleme kullanarak küçük PV'lerin miyosit tabakasındaki Ca2 + sinyallerini inceleyebiliriz. Temsili verilerimiz, küçük PV miyositlerindeki Ca2 + sinyallerine riyanodin reseptör iyon kanallarının açıklıklarının aracılık ettiğini göstermektedir. Bu yöntem, pulmoner vasküler fizyoloji ve bozukluklar alanındaki araştırmacılar için büyük ilgi görecektir.
Giriş
Pulmoner vaskülatür, gaz alışverişinde, oksijen eklenmesinde ve kandaki karbondioksitin uzaklaştırılmasında önemli bir rol oynar 1,2. Pulmoner arterler (PA'lar) sağ kalpten oksijenden fakir kan alır. Gaz değişimi kılcal damarlar (alveolar kılcal damarlar) seviyesinde gerçekleşir ve oksijen açısından zengin kan, pulmoner venler (PV'ler) tarafından sol kalbe iletilir. Oksijen bakımından fakir kan taşıyan diğer damarların aksine, PV'ler oksijen açısından zengin kanı sol kalbe ve dolayısıyla vücuttaki hayati organlara iletmek için önemli bir işleve sahiptir. Bununla birlikte, normal ve hastalık koşulları altında PV fonksiyonunu düzenleyen sinyal mekanizmaları tam olarak anlaşılamamıştır.
Pulmoner vasküler sistem ile ilgili çalışmalar ağırlıklı olarak PA'lar ve pulmoner kapillerler üzerine yoğunlaşmıştır. Son çalışmalar, endotel ve düz kas hücre katmanlarındaki Ca2+ sinyallerinin PA'ların 3,4,5 fonksiyonunu düzenlemede çok önemli olduğunu göstermektedir. Ayrıca, anormal Ca2+ sinyal mekanizmaları, 6,7,8,9,10 hastalık koşullarında PA'ların ve pulmoner kılcal damarların bozulmuş fonksiyonundan sorumludur. Bununla birlikte, intrapulmoner venler (küçük PV'ler) ile ilgili çalışmalar azdır. Sol kalbe bitişik büyük PV'lerde (kardiyak PV'ler) ektopik aktivite, insanlarda atriyal fibrilasyon kaynağı olarak önerilmiştir11,12 ve spontan nabız13 ve Ca2+ sinyalleri 12,14,15 de büyük PV'lerde gösterilmiştir. Küçük PV'ler, büyük PV'lere oksijen açısından zengin kan sağlar. Bununla birlikte, küçük PV'lerdeki Ca2 + sinyal mekanizmaları fizyolojik intraluminal basınçlar altında incelenmemiştir.
Bu yazıda, yüksek hızlı eğirme diski konfokal mikroskobu kullanarak PV miyositlerinde küçük PV'leri ve Ca2+ sinyallerini izole etmek, kanüle etmek ve basınçlandırmak için yeni bir yöntem sunuyoruz. Bu yöntemin genel amacı, fizyolojik intraluminal basınçlar altında küçük PV miyositlerinde spontan ve indüklenmiş Ca2+ sinyallerini kaydetmektir. İntraluminal basınç, miyositlerde16 Ca2+ sinyallerinin düzenlenmesinde kritik bir rol oynar. Tipik olarak, PV'ler 4 ila 10 mm Hg17,18 arasında değişen fizyolojik intraluminal basınçlara maruz kalır. Kardiyak döngü boyunca intraluminal basınçtaki değişiklikler, PV miyositlerindeki Ca2+ sinyallerini etkileyebilir. Bu nedenle, bu sinyalleri fizyolojik koşullar altında incelememize ve değişen intraluminal basınçların onları nasıl etkilediğini incelememize izin veren bir teknik kullanmak önemlidir. Ek olarak, PV'lerle ilgili önceki araştırmaların çoğu daha büyük kardiyak PV'lere odaklanmıştır. Mevcut teknik, akciğerlerin derinliklerinde bulunan ve hem sağlık hem de hastalıkta akciğer fonksiyonunun düzenlenmesini anlamak için daha uygun olabilecek küçük PV'lere odaklanmaktadır.
Protokol
Tüm hayvan protokolleri, Virginia Üniversitesi Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmıştır (protokoller 4100 ve 4120). C57BL6 / J 10-12 haftalık fareler, pentobarbital (90 mg / kg; intraperitoneal olarak) ile ötenazi yapılır, ardından akciğer dokusununtoplanması için servikal çıkık 3,4,19,20.
1. Küçük PV'lerin izolasyonu
- Diseksiyon aletlerini ve bulaşıkları %100 etanol ile temizleyin, ardından deiyonize su ile yıkayın.
- Göğüs boşluğunu açmak için makas kullanın. Akciğerlere en az dokunuşla kalbi ve akciğerleri göğüs boşluğundan dikkatlice çıkarmak için forseps kullanın.
- Dokuyu soğuk (4-10 °C) HEPES tamponlu fizyolojik tuz çözeltisi (HEPES-PSS, mM cinsinden, 10 HEPES, 134 NaCl, 6 KCl, 1 MgCl2 hekzahidrat, 2 CaCl2 dihidrat ve 7 dekstroz, pH 1 M NaOH kullanılarak 7.4'e ayarlanmış) içeren Sylgard kaplı bir plakaya yerleştirin)3,4,19. Şekil 1'de gösterildiği gibi, kalbi ve akciğerleri, büyük PV'ler ve PA'lar açıkça görülebilecek ve akciğerin sol lobu hafifçe gerilecek şekilde sabitlemek için diseksiyon pimleri kullanın.
- Büyük pulmoner venleri (PV'ler) referans noktaları olarak kullanarak, küçük intrapulmoner venleri çevreleyen dokuyu (Şekil 1'de kesikli dikdörtgenle gösterilen yaklaşık 50-100 μm çapında küçük PV'ler) ince makasla dikkatlice çıkarın. Küçük PV'lerle doğrudan temastan kaçındığınızdan emin olun. Küçük PV'leri çevredeki dokudan nazikçe izole edin.
- Küçük PV'lerin yaklaşık 1-2 mm uzunluğundaki segmentlerini izole edin. Küçük PV'leri 4-10 °C HEPES-PSS'ye yerleştirin.
2. Küçük PV'lerin Ca2+ göstergesi ile yüklenmesi
NOT: Küçük PV'ler, forsepslerin PV'lerin yalnızca uçlarına temas ettiğinden emin olarak dikkatli bir şekilde kullanılmalıdır. Bu yöntem, daha önceaçıklanan tekniğin bir modifikasyonudur 3,7,20,21.
- DMSO2.5 ile 4 mM Fluo-3,4'lik bir stok konsantrasyonu hazırlayın. Yukarıdaki stok çözeltisini kullanarak, HEPES-PSS ile 10 μM fluo-4 ve% 0.04 pluronik asit hazırlayın.
- Küçük PV'leri yükleme solüsyonu ile 1,5 mL'lik bir tüpe yerleştirin (HEPES-PSS'de 10 μM fluo-4 ve %0,04 pluronik asit)3,4. Tüpü alüminyum folyo ile örtün ve 37 ° C'de 1 saat inkübasyon için bir su banyosuna koyun.
- İnkübasyondan sonra, yükleme solüsyonunu dikkatlice 4-10 °C HEPES-PSS ile değiştirin ve yıkama adımı olarak 30 dakika buz üzerinde tutun.
3. Küçük PV'lerin kanülasyonu
NOT: Bu yöntem, daha önce 3,20,21'de açıklanan tekniğin bir modifikasyonudur.
- Basınçlı miyografi odasını her iki tarafta birer tane olmak üzere iki cam kanül ile hazırlayın. Kanülleri PSS (119 mM NaCl, 4.7 mM KCl, 1.2 mM KH2PO4, 1.2 mM MgCl2 160 hekzahidrat, 2.5 mM CaCl2 dihidrat 3,4,21,22, 7 mM dekstroz ve 24 mM NaHCO3 ile doldurun, çözeltiyi %21 O2 ve% 5 CO2 ile köpürterek pH 7.4'te tutulun) 10 mL'lik bir şırınga kullanarak.
- Yıkama solüsyonundan küçük bir PV'yi çıkarın ve basınçlı miyografi odasına yerleştirin. İnce uçlu forsepsler kullanarak, küçük PV'nin bir ucunu kanüllerden birine dikkatlice kanül edin. Ardından, naylon iplikten yapılmış bir mikrofilament kullanarak, sabitlemek için küçük PV'nin kanüllü ucuna ve kanülün ucuna bir düğüm atın.
- PV içindeki kanı çıkarmak için PSS'yi kanülden nazikçe itin. Şekil 1'de gösterildiği gibi, diğer ucunu mikrofilamentler kullanarak bir cam kanül ile bağlamak için naylon iplik kullanın.
4. Küçük PV'nin basınçlandırılması ve Ca2+ görüntülenmesi
NOT: Bu yöntem, daha önceaçıklanan tekniğin bir modifikasyonudur 3,21.
- PSS içeren bir boruya bağlı bir servo basınç kontrolörü kullanarak, küçük PV'yi bir uçtan 5 mm Hg'de basınçlandırın. PSS'yi süper kaynaştırmak için hem girişe hem de çıkışa bağlı peristaltik bir pompa kullanın. Süperfüzyonun sıcaklığını 37 °C'de tutun.
- Dengeleme süresinden sonra, 40x su daldırma objektifi (NA 0.8) ve dönen disk konfokal görüntüleme sistemi kullanarak 1000 kare (kare hızı: saniyede 30 kare) için Ca2+ görüntü elde edin. 488 nm katı hal lazeri kullanarak Fluo-4'ü uyarın ve 525/36 nm bant geçiren filtre kullanarak yayılan floresansı yakalayın.
- Ryanodin reseptörü (RyR) antagonisti ryanodin (5 μM)21,23 süper fuzata uygulayın. 5 dk bekleyin. Ca2+ görüntüleri yukarıda açıklandığı gibi yeniden çekin ve 30 kare/sn hızında 1000 kare daha yakalayın.
5. Ca2+ görüntü analizi
NOT: Bu yöntem, daha önce 21,22,24 açıklanan tekniğin bir modifikasyonudur. PV miyositlerindeki Ca2+ sinyallerinin aktivitesindeki değişiklikler, PV'lerde uyarma-kasılma eşleşmesinin inhibisyonu veya arttırılması hakkında önemli bilgiler sağlayabilir.
- Ca2+ görüntülerini analiz etmek için özel olarak tasarlanmış yazılımı (Dr. Adrian Bonev, https://github.com/vesselman/SparkAn tarafından geliştirilmiştir) kullanın.
- 5 x 5 boxcar filtre ve 5 x 5 medyan filtre kullanarak pürüzsüz görüntüler. Olay otomatik algılama için birden çok hücreli düz bir PV bölgesini özetleyen bir çerçeve kullanın.
- Görüntüle ve Olay Otomatik Algılama'ya tıklayın. Şu ayarları kullanın: 1,3 F/F0 genliğinde olay eşiği, %20 tolerans, 7 x 7 piksel tarama kutusu ve çalışma ortalaması 7 görüntü. İlk görüntüden başlayarak her 10 görüntüde bir otomatik olarak ortalama görüntüler oluşturun.
- Aramayı Başlat'a tıklayın (göz simgesi). Dosya menüsü altında Dosya İşaretle olarak kaydedilen olaylar tablosunu bulun. μm² başına olayları hesaplamak için, algılanan Ca2+ sinyallerinin sayısını seçilen çerçevenin alanına bölün.
Sonuçlar
Şekil 2A, 5 mm Hg intraluminal basınçta küçük bir PV'den bir görüş alanını göstermektedir. + sembolleri, yeşil anahat ile gösterilen seçili bir çerçeve (Video 2) içinde otomatik olarak algılanan Ca1+ sinyallerini gösterir. Her PV'den bir görüş alanı kaydedildi ve her fareden bir PV kullanıldı. Küçük bir PV n=1 olarak kabul edildi. Dakikada μm2 başına Ca2+ sinyallerinin sayısı, eşleştirilmiş deneylerde RyR inhibitörü ryanodin (5 μM) 23 ilavesinden önce ve 5 dakika sonra karşılaştırıldı. Anlamlı farklılıkları tespit etmek için istatistiksel karşılaştırmalar için eşleştirilmiş bir t-testi kullanıldı. Kendiliğinden meydana gelen Ca2+ sinyallerinin sayısı, yukarıda açıklanan koşullar altında μm2 başına dakikada 0.73 ± 0.2 olaydı (Şekil 2B, C). Riyanodin tedavisi, μm 2 başına dakika başına olaylarda ciddi bir azalma ile gösterildiği gibi, küçük PV'lerde Ca2 + sinyallerini neredeyse tamamen inhibe etti (Şekil 2C, Video 2). Bu veriler, basınçlı küçük PV'lerden gelen miyosit tabakasındaki Ca2+ sinyallerinin spontan aktivitesinin RyR'lerin açıklıklarını temsil ettiğini göstermektedir. Bu sonuçlar, Ca2 + sinyallerinin aktivitesinin fizyolojik intraluminal basınçlar altında küçük PV'lerde incelenebileceğine dair kanıt sağlar. Bu yöntem, intraluminal basınç ve nörohumoral mediatörlerin küçük PV miyositlerinde Ca2 + sinyalizasyonu üzerindeki etkileri üzerine gelecekteki çalışmaları kolaylaştıracak ve potansiyel olarak PV fonksiyonunun düzenlenmesi hakkında değerli bilgiler sunacaktır. Mevcut çalışma RyR Ca2+ sinyallerinin sayısına odaklanırken, bu sinyallerin süre, genlik, uzamsal yayılma ve yükselme süresi dahil olmak üzere kinetik özelliklerini analiz etmek de mümkündür. Fizyolojik ve patolojik uyaranların RyR Ca2+ sinyallerinin kinetik özelliklerini nasıl etkilediğini anlamak, hem sağlıklı hem de hastalıklı durumlarda PV fonksiyonunun düzenlenmesi ile ilgili önemli bilgiler sağlayabilir.
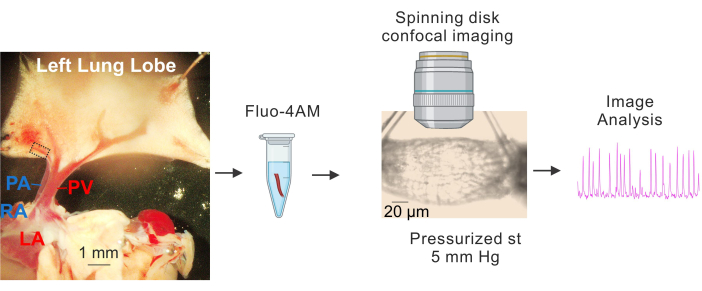
Şekil 1: PV'lerin hazırlanması ve Ca2+ görüntülemesi. Küçük PV'lerin tanımlanması ve izolasyonu, fluo4-'nin inkübasyonu, kanülasyon ve basınçlandırma (5 mm Hg), eğirme diski yüksek hızlı konfokal görüntüleme ve görüntü analizini gösteren sıralı görüntüler. Soldaki resimde yer alan kesikli dikdörtgen, etüt için kullanılan PV'yi temsil eder. Kısaltmalar: PA = pulmoner arter; RA = sağ atriyum; PV = pulmoner ven; LA = sol atriyum. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
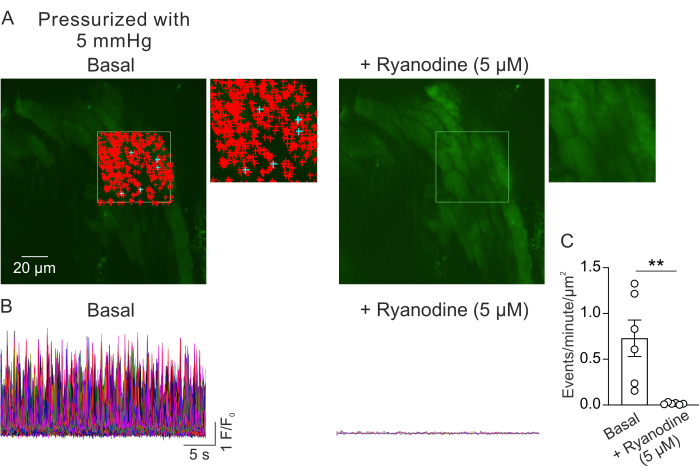
Şekil 2: Ca2+ görüntülemenin analizi. (A) Basınçlı (5 mm Hg), fluo-4 yüklü, ryanodin (solda) veya varlığında küçük bir PV'den (5 μM; RyR inhibitörü, sağda). Yeşil dikdörtgen, otomatik algılama Ca2+ sinyalleri için seçilen alanı belirtir. + işaretleri, çerçeve içinde otomatik olarak algılanan olayları temsil eder. Kırmızı işaretler 3000 μm2'den daha az alana sahip sinyalleri gösterirken, mavi işaretler 3000 μm2'den fazla bir alanı kaplayan sinyalleri gösterir. Her + işareti bir Ca2+ olayını veya sinyalini gösterir. (B) Bazal koşullar altında (solda) ve riyanodin varlığında (sağda) basınçlı küçük PV'lerden miyosit tabakasındaki Ca2+ sinyallerinin aktivitesini gösteren, A'da belirtilen seçili alandan tespit edilen olayların F/F0 izleri. (C) Riyanodin ilavesinden önce ve sonra küçük PV'lerde Ca2+ sinyallerinin μm2'si başına dakika başına olayların ölçülmesi (fare başına 1 PV; n = 6 fare; ** p < 0.01'e karşı Bazal; eşleştirilmiş t-testi). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Video 1: Riyanodin ile muameleden önce 5 mm Hg'de basınçlandırılan küçük bir PV'deki Ca2+ sinyalleri. Görüş alanı, Şekil 2'de yeşil renkle gösterilen seçili çerçeveyi temsil eder. Bu videoyu indirmek için lütfen buraya tıklayın.
Video 2: Ryanodin (5 μM) ile muameleden sonra 5 mm Hg'de basınçlandırılan küçük bir PV'de Ca2 + sinyalleri. Görüş alanı, Şekil 2'de yeşil renkle gösterilen seçili çerçeveyi temsil eder. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Düz kas hücrelerindeki Ca2+ sinyalleri, vasküler fonksiyonun düzenlenmesinde çok önemli bir rol oynar25. PV'ler, sol kalbe oksijen açısından zengin kan vermekten sorumlu önemli ancak nispeten az çalışılmış bir vasküler yataktır26. Bununla birlikte, küçük PV'lerdeki Ca2+ sinyal mekanizmaları ve bunların fizyolojik fonksiyon üzerindeki etkileri bilinmemektedir. Bu makalenin amacı, miyosit tabakasındaki Ca2+ sinyallerini kaydetmek ve bu Ca2+ sinyallerini analiz etmek için küçük PV'leri izole etmek, kanüle etmek ve basınçlandırmak için yeni bir yöntem tanımlamaktır. Küçük PV'lerde Ca2 + sinyallerini görselleştirme yeteneği, bu sinyallerin normal ve hastalıklı koşullar altında nasıl çalıştığına dair anlayışımızı geliştirmemize yardımcı olabilir. Sağlam akciğerdeki PV'lerde Ca2 + sinyallerini incelemek fizyolojik olarak daha ilgili veriler sağlarken, küçük PV'ler sağlam akciğerde açıkça görülemez, bu da Ca2 + boyalarının yüklenmesi ve konfokal görüntüleme ile ilgili teknik zorluklara neden olabilir. Küçük PV'leri izole etmek ve basınçlandırmak, fizyolojik intraluminal basınçlar, sıcaklık ve iyonik çözeltiler altında Ca2+ sinyallerini gözlemlemek için alternatif bir yol sunar.
Bu yazıda açıklanan PV'lerin Ca2+ görüntülemesi, sistemik arterlerde Ca2+ görüntüleme için iyi bilinen prosedürümüz dayanmaktadır 21,22,27. Veriler, küçük PV miyositlerindeki Ca2+ sinyallerinin çoğunun RyR iyon kanallarının açıklıklarından kaynaklandığını göstermektedir. Bu nedenle, bu yazıda özetlenen protokol, RyR regülasyonu ve bunun normal koşullar altında ve hastalıklarda PV işlevi üzerindeki etkisi ile ilgili gelecekteki çalışmaları mümkün kılacaktır. RyR2 aktivitesi, kardiyak miyositlerdeki(28) kasılmalar için gereklidir, arteriyel düz kas hücrelerinde ise gevşeme29 ile ilişkilendirilmiştir. RyR aktivitesinin küçük PV kasılması üzerindeki kesin etkisi bilinmemektedir. Basınç miyografisi, küçük kan damarlarının kasılmasındaki değişiklikleri izlemek için yaygın olarak kullanılan bir tekniktir. Bu nedenle, basınçlı PV hazırlığının küçük PV kasılmalarını izlemek için de kullanılması muhtemeldir.
Ryanodin, RyR aktivitesi üzerinde konsantrasyona bağlı etkiler gösterir, onu submikromolar konsantrasyonlarda arttırır ve mikromolar konsantrasyonlarda azaltır23. Ryanodin ayrıca küçük PV'lerde diğer Ca2 + sinyalleri üzerinde dolaylı bir inhibitör etkiye sahip olabilir, bu test edilmemiş bir olasılıktır. Kullanılan konsantrasyonda, PV'lerde Ca2+ sinyallerinde telafi edici bir artış gözlemlemedik. İzole edilmiş ve basınçlı PV'lerdeki Ca2 + sinyallerinin düzenlenmesi, sağlam bir akciğer içindeki PV'lerdekilerden farklı olabilir, bu henüz araştırılmamış bir olasılıktır. Bununla birlikte, anestezi uygulanmış bir fareden alınan sağlam akciğerdeki küçük PV'lerde Ca2+ sinyallerinin kaydedilmesi, akciğerin göğüs boşluğundaki konumundan ve anestezi uygulanmış bir farede PV'lerde seçici olarak bir Ca2+ göstergesinin yüklenmesinin zorluğundan kaynaklanan önemli zorluklar sunar.
Kan akışı kesme stresinin kan damarlarının işlevini değiştirdiği bilinmektedir. Mevcut yöntem, küçük PV'lerde intraluminal basıncın Ca2+ sinyalleri üzerindeki etkisinin izole edilmesine izin verse de, akış veya kesme gerilimi eksikliği potansiyel bir sınırlamadır. Bununla birlikte, akış veya kesme gerilimi, daha önce açıklanan kurulumlar kullanılarak Ca2+ görüntüleme ile birlikte kolayca dahil edilebilir ve gerçekleştirilebilir21. Akış/kesme geriliminin küçük PV'lerde Ca2+ sinyallerinin aktivitesini değiştirmesi mümkündür, bu da gelecekteki araştırmalar için ilginç bir konu olacaktır.
Küçük PV'lerde Ca 2+ sinyallerini kaydetmek için Ca2+ göstergesi olarak fluo-4-kullandık. Deneysel ihtiyaçlara bağlı olarak, 488 nm (Calbryte 520)7 veya 560 nm'de (Calbryte 590)30 uyarılabilen diğer Ca 2+ göstergelerini kullanmak mümkün olmalıdır. Dönen disk konfokal görüntüleme sisteminin kullanılması, özellikle PV miyositlerinde Ca2+ sinyallerinin görüntülenmesine izin verir. Bu çalışmada çalışılmamış olmasına rağmen, endotel hücre tabakasına odaklanmak, küçük PV'lerde endotelyal Ca2 + sinyallerinin kaydedilmesine izin verecektir. PA'lar ve PV'ler işlevsel olarak farklıdır ve farklı mikro ortamlara maruz kalırlar. Bu nedenle, küçük PA'lar ve küçük PV'ler arasındaki miyosit ve endotelyal Ca2 + sinyallerinin karşılaştırılması, fonksiyonel farklılıkları hakkında önemli bilgiler sağlayabilir.
Küçük PV'lerdeki Ca2+ sinyallerinin PV'ler aracılığıyla oksijen açısından zengin kan akışını düzenlemesi akla yatkındır. Sol atriyum içindeki basınç her kardiyak siklus sırasında 4 mmHg'dan 12 mmHg'ye değişir17,18. PV'ler sol atriyuma kan sağladığından, PV'lerin içindeki basıncın da kardiyak döngü sırasında değişmesi muhtemeldir. Önceki çalışmalar, RyR'lerin küçük arterlerde intraluminal basınçla aktive edilebileceğini göstermiştir16. Bu nedenle, intraluminal basıncın PV Ca2+ sinyalleri üzerindeki etkisinin ölçülmesi, oksijen açısından zengin kanın PV'lerden sol kalbe iletilmesi hakkında yeni bilgiler sağlayabilir. Kan dolaşımındaki sinir stimülasyonu ve humoral aracılar da düz kas Ca2+ sinyallerini aktive edebilir. Mevcut yöntem, nörohumoral mediatörlerin PV Ca2+ sinyalleri ve PV fonksiyonu üzerindeki etkisi üzerine gelecekteki çalışmaları kolaylaştıracaktır.
Protokol içinde dikkat edilmesi gereken birkaç kritik adım vardır. Pulmoner venlerin (PV'ler) dikkatli bir diseksiyonu son derece önemlidir. PV'lerin görüntüleme alanına diseksiyon araçlarıyla dokunmaktan kaçınmak çok önemlidir, çünkü bu onların sağlığını olumsuz yönde etkileyebilir. PV'lerin sadece uçlarına dokunulmalıdır. Diseksiyon süresinin kısaltılması başarı oranını artırabilir. Yetersiz boya yüklemesi, daha düşük bir sinyal-gürültü oranına neden olabilir ve olay otomatik algılama sırasında yanlış pozitifler olasılığını artırabilir. Burada özetlenen protokolün izlenmesi, PV miyositlerinde yeterli boya yüklemesini sağlamalıdır.
Özetle, bu önemli ancak genellikle gözden kaçan vasküler yatakta Ca2+ sinyal mekanizmalarının araştırılmasına olanak tanıyan küçük PV'lerde Ca2+ sinyallerini kaydetmek için bir yöntem sunduk. Daha da önemlisi, normal koşullar altında küçük PV'lerde Ca2 + sinyallerini kaydetme yeteneği, pulmoner hipertansiyon, akciğer hasarı ve kalp yetmezliğine bağlı akciğer ödemi dahil olmak üzere akciğer hastalıkları için patolojik mekanizmaların değerli bir şekilde anlaşılmasını sağlayabilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu araştırma, NHLBI'den (HL167208, HL157407 ve HL146914) SKS'ye ve NIDDK'dan (DK138271) YLC'ye verilen ödüllerle finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
Referanslar
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. . Thorax, heart pulmonic valve. , (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118 (2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777 (2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553 (2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347 (2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. . Pulmonary capillary wedge pressure. , (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186 (2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157 (2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403 (2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. . Physiology, pulmonary circulation. , (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır