Method Article
生理学的管腔内圧下での小さな肺静脈におけるCa2+ シグナルのイメージング
要約
このプロトコルでは、生理学的管腔内圧で肺内静脈(小肺静脈またはPV)のCa2+ シグナルを記録および分析するための新しい技術を紹介します。この手法には、小さなPVの単離、Ca2+ インジケーターによるインキュベート、カニューレ挿入と加圧、Ca2+ シグナルの共焦点イメージング、およびデータ解析が含まれます。
要約
肺静脈(PV)は、酸素が豊富な血液を肺から左心に戻して運ぶため、酸素が豊富な血液を重要な臓器に送達する重要な機能を果たしています。しかし、肺血管系に関するほとんどの研究は、正常状態および疾患条件下での肺動脈と毛細血管に焦点を当てています。Ca2+ シグナルは、血管機能の重要な調節因子です。PVの重要な生理学的役割にもかかわらず、小さな肺内PVのCa2+ シグナルは生理学的条件下では記録されていません。ここでは、マウスPVを単離し、カニューレ挿入し、5mmHgで加圧したCa2+ シグナル活性を記録する技術について説明します。Ca2+ インジケーターを組み込むことで、生理学的条件下での高速回転ディスク共焦点イメージングを使用して、小さなPVの筋細胞層のCa2+ シグナルを研究することができます。私たちの代表的なデータは、小さなPV筋細胞のCa2+ シグナルがリアノジン受容体イオンチャネルの開口部によって媒介されることを示しています。この方法は、肺血管生理学および疾患分野の研究者にとって非常に興味深いものとなるでしょう。
概要
肺血管系は、ガスの交換、酸素の追加、および血液からの二酸化炭素の除去に重要な役割を果たします1,2。肺動脈(PA)は、右心臓から酸素の少ない血液を受け取ります。ガス交換は毛細血管(肺胞毛細血管)のレベルで起こり、酸素が豊富な血液は肺静脈(PV)によって左心に送達されます。酸素の少ない血液を運ぶ他の静脈とは異なり、PVは酸素が豊富な血液を左心に供給し、その結果、体内の重要な臓器に送るという重要な機能を果たします。しかし、正常状態および疾患条件下でPV機能を調節するシグナル伝達メカニズムは十分に理解されていません。
肺血管系に関する研究は、主にPAと肺毛細血管に焦点を当ててきました。最近の研究では、内皮細胞層と平滑筋細胞層のCa2+シグナルがPAの機能調節に重要であることが示されています3,4,5。さらに、異常なCa2+シグナル伝達メカニズムは、疾患状態におけるPAおよび肺毛細血管の機能障害の原因である6,7,8,9,10。しかし、肺内静脈(小さなPV)に関する研究はまだ少ないままです。左心に隣接する大きなPV(心PV)における異所性活動は、ヒトの心房細動の原因として提案されており11,12、そして自発的な脈動13およびCa2+信号12,14,15も大きなPVで示されている。しかし、小さなPVにおけるCa2+シグナル伝達メカニズムは、生理学的管腔内圧下では研究されていません。
この論文では、高速スピニングディスク共焦点顕微鏡を使用して、小さなPVを分離、カニューレ挿入、加圧し、PV筋細胞のCa2+シグナルをイメージングする新しい方法を紹介します。この方法の全体的な目標は、生理学的管腔内圧下で小さなPV筋細胞の自発的および誘導されたCa2+シグナルを記録することです。管腔内圧は、筋細胞のCa2+シグナルの調節に重要な役割を果たします16。典型的には、PVは4〜10mmHgの範囲の生理学的管腔内圧にさらされる17,18。心周期全体の管腔内圧の変化は、PV筋細胞のCa2+シグナルに影響を与える可能性があります。したがって、生理学的条件下でこれらの信号を研究し、さまざまな管腔内圧力がそれらにどのように影響するかを調べることができる技術を採用することが不可欠です。さらに、PVに関する先行研究のほとんどは、より大きな心臓PVに集中しています。現在の技術は、肺の深部に位置する小さなPVに焦点を当てており、健康と疾患の両方における肺機能の調節を理解するためにより関連性が高い可能性があります。
プロトコル
すべての動物プロトコルは、バージニア大学の動物管理および使用委員会(プロトコル4100および4120)によって承認されました。C57BL6/Jマウス、10-12週齢、ペントバルビタール(90 mg / kg;腹腔内)で安楽死させ、続いて肺組織3,4,19,20を採取するための頸部脱臼を行う。
1. 小型PVの分離
- 解剖ツールと皿を100%エタノールで洗浄し、その後脱イオン水で洗浄します。
- はさみを使用して胸腔を開きます。鉗子を使用して、肺への接触を最小限に抑えながら、心臓と肺を胸腔から慎重に取り除きます。
- 冷(4-10°C)HEPES緩衝生理塩溶液(HEPES-PSS、mM、10 HEPES、134 NaCl、6 KCl、1 MgCl2ヘキサハイドレート、2 CaCl2二水和物、および7デキストロース、1 M NaOHを使用してpHを7.4に調整)3,4,19。図1に示すように、解剖ピンを使用して心臓と肺を固定し、大きなPVとPAがはっきりと見え、肺の左葉がわずかに伸びるようにします。
- 大肺静脈(PV)を基準点として、小さな肺内静脈(直径約50〜100μmの小さなPV、 図1の破線の長方形で示されている)の周囲の組織を細いハサミで慎重に除去します。小さなPVに直接触れないように注意し、小さなPVを周囲の組織から優しく分離します。
- 小さなPVの約1〜2 mmの長さのセグメントを分離し、小さなPVを4〜10°CのHEPES-PSSに配置します。
2. Ca 2+インジケーターによる小型PVの装填
注意: 小さなPVは慎重に取り扱って、鉗子がPVの先端だけに触れるようにする必要があります。この方法は、前述の3、7、20、21の手法を変形させたものである。
- DMSO 3,4を使用して、2.5 mM Fluo-4 AMのストック濃度を調製します。上記のストック溶液を使用して、10 μM fluo-4 AMおよび0.04%プルロン酸をHEPES-PSSで調製します。
- ローディング溶液(10 μM fluo-4 AMおよびHEPES-PSS中の0.04%プルロン酸)3,4を入れた1.5 mLチューブに小さなPVを入れます。チューブをアルミホイルで覆い、水浴に入れて37°Cで1時間インキュベートします。
- インキュベーション後、ローディング溶液を4〜10°CのHEPES-PSSと慎重に交換し、洗浄ステップとして30分間氷上に保ちます。
3. 小型PVのカニューレ挿入
注:この方法は、前述の3,20,21の手法の修正版です。
- 圧力筋電図チャンバーを両側に1つずつ、2つのガラスカニューレで準備します。10 mLシリンジを使用して、溶液を21% O2および5% CO2でバブリングすることにより、pH 7.4に維持されたPSS(119 mM NaCl、4.7 mM KCl、1.2 mM KH2PO4、1.2 mM MgCl2 160ヘキサハイドレート、2.5 mM CaCl2二水和物3、4、21、21,22、7 mMデキストロース、および24 mM NaHCO3)をカニューレに充填します。
- 洗浄液から小さなPVを取り出し、圧力筋造影チャンバーに入れます。先端の細い鉗子を使用して、小さなPVの一方の端をカニューレの1つに慎重にカニューレを挿入します。次に、ナイロン糸から作られたマイクロフィラメントを使用して、小さなPVのカニューレの端とカニューレの先端に結び目を結び、固定します。
- PSSをカニューレにそっと押し込み、PV内の血液を取り除きます。 図1に示すように、ナイロン糸を使用して、マイクロフィラメントを使用してガラスカニューレでもう一方の端を結びます。
4. 小型PVの加圧とCa2+イメージング
注:この方法は、前述の3,21の手法を変更したものです。
- PSSを含むチューブに取り付けられたサーボ圧力コントローラーを使用して、小さなPVを一方の端から5mmHgで加圧します。入口と出口の両方に接続された蠕動ポンプを使用して、PSSをスーパーフュージョンします。スーパーフュージネートの温度を37°Cに維持します。
- 平衡化期間後、40倍水浸対物レンズ(NA 0.8)とスピニングディスク共焦点イメージングシステムを使用して、1000フレーム(フレームレート:30フレーム/秒)のCa2+ 画像を取得します。488 nmの固体レーザーを使用してFluo-4を励起し、525/36 nmのバンドパスフィルターを使用して放出蛍光を捕捉します。
- リアノジン受容体(RyR)アンタゴニストのリアノジン(5 μM)21,23をスーパーフューセートに適用します。5分間待ちます。上記のようにCa2+画像を撮り直し、さらに1000フレームを30フレーム/秒の速度でキャプチャします。
5. Ca2+ 画像解析
注:この方法は、前述の21、22、24の手法の修正です。PV筋細胞におけるCa2+ シグナルの活性の変化は、PVにおける興奮-収縮結合の阻害または増強に関する重要な洞察を提供することができる。
- カスタム設計のソフトウェア(Adrian Bonev博士、https://github.com/vesselman/SparkAn によって開発されました)を使用して、Ca2+ 画像を分析します。
- 5 x 5 ボックスカー フィルターと 5 x 5 メディアン フィルターを使用して画像を滑らかにします。イベントの自動検出には、複数のセルを持つ PV の平坦な領域を囲むフレームを使用します。
- [表示とイベント自動検出]をクリックします。次の設定を使用します:1.3 F/ F 0の振幅でのイベントしきい値、20%の許容範囲、7 x 7ピクセルのスキャンボックス、および7つの画像の移動平均。最初の画像から始めて、10 画像ごとに平均画像を自動的に生成します。
- [検索の開始](目のアイコン)をクリックします。[ファイル] メニューで [マーク ファイル] として保存されているイベント テーブルを見つけます。μm²あたりのイベント数を計算するには、検出されたCa2+信号の数を選択したフレームの面積で割ります。
結果
図2Aは、5mmHgの管腔内圧での小さなPVからの視野を示しています。+記号は、選択したフレーム(ビデオ1)内で自動的に検出されたCa2+信号を示し、緑色の枠線で示されます。各PVから1つの視野を記録し、各マウスから1つのPVを使用しました。1つの小さなPVはn=1と考えられました。1分あたりμm2のCa2+シグナルの数を、対になった実験でRyR阻害剤リアノジン(5μM)23の添加前と5分後に比較した。対応のあるt検定は、有意差を検出するための統計的比較に使用されました。自発的に発生するCa2+シグナルの数は、上記の条件下では、μm2あたり毎分0.73±0.2イベントでした(図2B、C)。ライアノジン処理は、μm2あたり1分あたりのイベント数の劇的な減少によって示されるように、小さなPVのCa2+シグナルをほぼ完全に阻害しました(図2C、ビデオ2)。これらのデータは、加圧された小さなPVからの筋細胞層におけるCa2+シグナルの自発的な活動がRyRsの開口部を表していることを示しています。これらの結果は、Ca2+シグナルの活性が生理学的管腔内圧下で小さなPVで研究できるという証拠を提供します。この方法は、小さなPV筋細胞のCa2+シグナル伝達に対する管腔内圧および神経液性メディエーターの影響に関する将来の研究を促進し、PV機能の調節に関する貴重な洞察を提供する可能性があります。現在の研究では、RyR Ca2+信号の数に焦点を当てていますが、これらの信号の時間、振幅、空間拡散、立ち上がり時間などの速度論的特性を解析することも可能です。生理学的および病理学的刺激がRyR Ca2+シグナルの速度論的特性にどのように影響するかを理解することは、健康な状態と病気の状態の両方でPV機能の調節に関する重要な情報を提供する可能性があります。
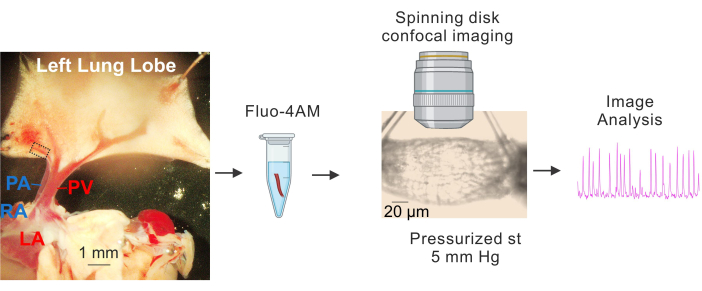
図1:PVの調製とCa2+ イメージング。 低分子PVの同定と単離、fluo4-AMのインキュベーション、カニューレ挿入と加圧(5 mm Hg)、スピニングディスク高速共焦点イメージング、画像解析を示すシーケンシャル画像。左の画像の破線の長方形は、スタディに使用したPVを表しています。略語:PA =肺動脈;RA =右心房;PV = 肺静脈;LA = 左心房。 この図の拡大版を表示するには、ここをクリックしてください。
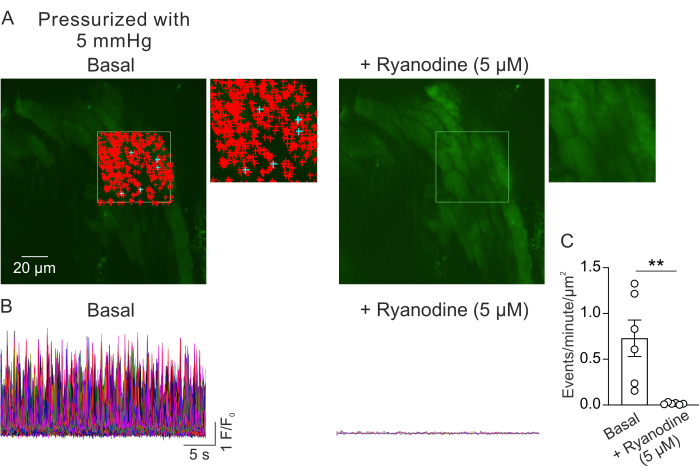
図2:Ca2+イメージングの解析 (A)加圧された(5 mm Hg)、fluo-4を負荷した、リアノジンの不存在下(左)またはリアノジンの存在下(5 μM;RyR阻害剤、右)。緑色の長方形は、自動検出 Ca2+ 信号用に選択された領域を示します。+ 記号は、フレーム内で自動検出されたイベントを表します。赤色の符号は3000μm2未満の信号を示し、青色の符号は3000μm2を超える面積を占める信号を示します。各 + 記号は、1 つの Ca2+ イベントまたは信号を示します。(B)Aで示されている選択領域から検出されたイベントのF / F0トレースは、基礎条件下(左)およびリアノジンの存在下(右)で、加圧された小さなPVからの筋細胞層のCa2+シグナルの活性を示しています。(C)リアノジン添加前後の小さなPVにおけるCa2+シグナルのμm2あたりの1分あたりのイベントの定量化(マウスあたり1PV、n = 6マウス、**p < 0.01対Basal;対応t検定)。この図の拡大版を表示するには、ここをクリックしてください。
ビデオ1: リアノジンで処理する前に5 mm Hgで加圧した小さなPV中のCa2+ シグナル。視野は、 図 2 に緑色で示されている、選択したフレームを表します。 このビデオをダウンロードするには、ここをクリックしてください。
ビデオ2: リアノジン(5 μM)で処理した後、5 mm Hgで加圧した小さなPV中のCa2+ シグナル。視野は、 図 2 に緑色で示されている、選択したフレームを表します。 このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
平滑筋細胞のCa2+ シグナルは、血管機能の調節に重要な役割を果たしている25。PVは、酸素が豊富な血液を左心に送る役割を担う重要でありながら比較的研究が進んでいない血管床です26。しかし、小さなPVにおけるCa2+ シグナル伝達メカニズムと、それらが生理機能に与える影響は不明です。この論文の目標は、小さなPVを分離、カニューレ挿入、および加圧して、筋細胞層にCa2+ シグナルを記録し、これらのCa2+ シグナルを分析するための新しい方法を説明することです。小さなPVでCa2+ シグナルを可視化する能力は、これらのシグナルが正常条件下でも病気の条件下でもどのように機能するかについての理解を深めるのに役立つ可能性があります。無傷の肺内のPVのCa2+ シグナルを研究すると、生理学的により関連性の高いデータが得られますが、小さなPVは無傷の肺でははっきりと見えないため、Ca2+ 色素のローディングや共焦点イメージングに技術的な課題が生じる可能性があります。小さなPVを単離して加圧することは、生理的な管腔内圧力、温度、およびイオン溶液下でCa2+ シグナルを観察する別の方法を提供します。
この原稿に記載されているPVのCa2+イメージングは、全身動脈21,22,27におけるCa2+イメージングの確立された手順に基づいています。このデータは、小さなPV筋細胞におけるCa2+シグナルの大部分がRyRイオンチャネルの開口部によるものであることを示しています。したがって、この論文で概説されているプロトコルは、RyR制御と、正常な条件下でのPV機能への影響と疾患におけるRyR制御の将来の研究を可能にします。RyR2活性は、心筋細胞28の収縮に不可欠であり、一方、動脈平滑筋細胞では、弛緩29と関連している。RyR活性が小さなPV収縮に及ぼす正確な影響は、まだ不明です。圧力筋造影は、小さな血管の収縮の変化を監視するために一般的に使用される技術です。したがって、加圧PV調製物は、小さなPV収縮を監視するためにも使用できます。
ライアノジンは、RyR活性に対して濃度依存的な効果を示し、サブマイクロモル濃度で増加させ、マイクロモル濃度で減少させる23。ライアノジンは、小さなPVの他のCa2+ シグナルに対して間接的な阻害効果も持つ可能性がありますが、その可能性はテストされていません。使用した濃度では、PVのCa2+ シグナルの代償的な増加は観察されませんでした。単離および加圧されたPVにおけるCa2+ シグナルの調節は、無傷の肺内のPVにおける調節とは異なる可能性があり、その可能性はまだ調査されていません。しかし、麻酔をかけたマウスから無傷の肺の小さなPVにCa2+ シグナルを記録することは、胸腔内の肺の位置や、麻酔をかけたマウスのPVにCa2+ インジケーターを選択的にロードすることの難しさから生じる大きな課題を提示します。
血流せん断応力は、血管の機能を変化させることが知られています。現在の方法では、小さなPVのCa2+ シグナルに対する管腔内圧の影響を分離できますが、流れ応力やせん断応力の欠如が潜在的な制限です。しかし、流動応力またはせん断応力は、前述のセットアップを使用してCa2+ イメージングと組み合わせて容易に組み込み、実行することができる21。流れ/せん断応力が小さなPVのCa2+ 信号の活性を変化させる可能性があり、これは将来の研究にとって興味深いトピックとなるでしょう。
我々は、小さなPVでCa2+シグナルを記録するためのCa2+インジケーターとしてfluo-4-AMを使用した。実験のニーズに応じて、488 nm(Calbryte 520 AM)7または560 nm(Calbryte 590 AM)30で励起できる他のCa2+インジケーターを使用できるはずである。スピニングディスク共焦点イメージングシステムの使用により、特にPV筋細胞におけるCa2+シグナルのイメージングが可能になります。現在の研究では研究されていませんが、内皮細胞層に焦点を当てることで、小さなPVで内皮Ca2+シグナルを記録することができます。したがって、小さなPAと小さなPVの間の筋細胞と内皮のCa2+シグナルの比較は、それらの機能的な違いについて重要な洞察を提供する可能性があります。
小さなPVのCa2+シグナルが、PVを介した酸素が豊富な血液の流れを調節していると考えられます。左心房内の圧力は、各心周期17,18の間に4mmHgから12mmHgに変化する。PVは左心房に血液を供給するため、心周期中にPV内の圧力も変化する可能性があります。以前の研究では、RyRsは小さな動脈の管腔内圧によって活性化できることが示されています16。したがって、PV Ca2+シグナルに対する管腔内圧の影響を測定することで、PVから左心への酸素が豊富な血液の送達に関する新たな洞察が得られる可能性があります。血流中の神経刺激と体液性メディエーターも、平滑筋Ca2+シグナルを活性化することができます。現在の方法は、PV Ca2+シグナルとPV機能に対する神経液性メディエーターの影響に関する将来の研究を促進します。
プロトコル内には、注意すべきいくつかの重要なステップがあります。肺静脈(PV)の慎重な解剖は非常に重要です。解剖ツールでPVのイメージング領域に触れると、PVの健康に悪影響を及ぼす可能性があるため、避けることが重要です。PVの端だけを触れてください。解剖時間を短縮することで、解剖成功率を高めることができます。色素のローディングが不十分な場合、S/N比が低下し、イベント自動検出時の誤検出の可能性が高まる可能性があります。ここで概説されているプロトコルに従うことで、PV筋細胞に適切な色素負荷を確保できるはずです。
要約すると、私たちは小さなPVでCa2+ シグナルを記録する方法を提示しました。これにより、この重要でありながら見過ごされがちな血管床におけるCa2+ シグナル伝達メカニズムを調査することができます。重要なことに、正常な条件下で小さなPVにCa2+ シグナルを記録する能力は、肺高血圧症、肺損傷、心不全誘発性肺水腫などの肺疾患の病理学的メカニズムの貴重な理解を提供する可能性があります。
開示事項
著者は何も開示していません。
謝辞
この研究は、NHLBI(HL167208、HL157407、HL146914)からSKSに、NIDDK(DK138271)からYLCに授与された賞によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
参考文献
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. . Thorax, heart pulmonic valve. , (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118 (2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777 (2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553 (2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347 (2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. . Pulmonary capillary wedge pressure. , (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186 (2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157 (2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403 (2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. . Physiology, pulmonary circulation. , (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved