Method Article
Imagerie des signaux Ca2+ dans les petites veines pulmonaires à des pressions intraluminales physiologiques
Dans cet article
Résumé
Dans ce protocole, nous présentons une nouvelle technique d’enregistrement et d’analyse des signaux Ca2+ dans les veines intrapulmonaires (petites veines pulmonaires ou PV) à des pressions intraluminales physiologiques. La technique consiste à isoler de petits PV, à les incuber avec un indicateur Ca2+ , à les canuler et à les pressuriser, à l’imagerie confocale des signaux Ca2+ et à l’analyse des données.
Résumé
Les veines pulmonaires (PV) transportent le sang riche en oxygène des poumons vers le cœur gauche, remplissant ainsi une fonction importante dans l’acheminement du sang riche en oxygène vers les organes vitaux. Cependant, la plupart des études sur le système vasculaire pulmonaire se sont concentrées sur les artères et les capillaires pulmonaires dans des conditions normales et pathologiques. Les signaux Ca2+ sont des régulateurs essentiels de la fonction vasculaire. Malgré les rôles physiologiques critiques des PV, les signaux Ca2+ dans les petits PV intrapulmonaires n’ont pas été enregistrés dans des conditions physiologiques. Ici, nous décrivons une technique pour enregistrer l’activité du signal Ca2+ dans des PV de souris isolés, canulés et pressurisés à 5 mmHg. En incorporant un indicateur Ca2+ , nous pouvons étudier les signaux Ca2+ dans la couche myocytaire de petits PV à l’aide de l’imagerie confocale à disque rotatif à grande vitesse dans des conditions physiologiques. Nos données représentatives indiquent que les signaux Ca2+ dans les petits myocytes PV sont médiés par les ouvertures des canaux ioniques du récepteur de la ryanodine. Cette méthode sera d’un intérêt considérable pour les chercheurs dans le domaine de la physiologie et des troubles vasculaires pulmonaires.
Introduction
Le système vasculaire pulmonaire joue un rôle important dans l’échange de gaz, l’ajout d’oxygène et l’élimination du dioxyde de carbone dusang1,2. Les artères pulmonaires (AP) reçoivent du sang pauvre en oxygène du cœur droit. L’échange gazeux se produit au niveau des capillaires (capillaires alvéolaires), et le sang riche en oxygène est acheminé vers le cœur gauche par les veines pulmonaires (PV). Contrairement à d’autres veines qui transportent du sang pauvre en oxygène, les PV remplissent une fonction importante de livraison de sang riche en oxygène au cœur gauche et, par conséquent, aux organes vitaux du corps. Cependant, les mécanismes de signalisation qui régulent la fonction PV dans des conditions normales et pathologiques sont mal compris.
Les études sur le système vasculaire pulmonaire se sont principalement concentrées sur les AP et les capillaires pulmonaires. Des études récentes montrent que les signaux Ca2+ dans les couches cellulaires endothéliales et musculaires lisses sont cruciaux dans la régulation de la fonction des PA 3,4,5. De plus, des mécanismes anormaux de signalisation Ca2+ sont responsables de l’altération de la fonction des AP et des capillaires pulmonaires dans des conditions pathologiques 6,7,8,9,10. Cependant, les études sur les veines intrapulmonaires (petits PV) restent rares. L’activité ectopique dans les grands PV adjacents au cœur gauche (PV cardiaques) a été proposée comme source de fibrillation auriculaire chez l’homme11,12, et la pulsation spontanée13 et les signaux Ca2+ 12,14,15 ont également été montrés dans les grands PV. Cependant, les mécanismes de signalisation Ca2+ dans les petits PV n’ont pas été étudiés sous des pressions intraluminales physiologiques.
Dans ce manuscrit, nous présentons une nouvelle méthode pour isoler, canuler et pressuriser de petits PV et imager les signaux Ca2+ dans les myocytes PV à l’aide de la microscopie confocale à disque rotatif à grande vitesse. L’objectif global de cette méthode est d’enregistrer les signaux Ca2+ spontanés et induits dans de petits myocytes PV sous des pressions intraluminales physiologiques. La pression intraluminale joue un rôle essentiel dans la régulation des signaux Ca2+ dans les myocytes16. En règle générale, les PV sont soumis à des pressions intraluminales physiologiques allant de 4 à 10 mm Hg 17,18. Les changements de pression intraluminale tout au long du cycle cardiaque peuvent influencer les signaux Ca2+ dans les myocytes PV. Par conséquent, il est essentiel d’employer une technique qui nous permet d’étudier ces signaux dans des conditions physiologiques et d’examiner comment les variations des pressions intraluminales les affectent. De plus, la plupart des recherches antérieures sur les PV se sont concentrées sur les PV cardiaques plus grands. La technique actuelle se concentre sur de petits PV situés profondément dans les poumons, ce qui pourrait être plus pertinent pour comprendre la régulation de la fonction pulmonaire dans la santé et la maladie.
Protocole
Tous les protocoles pour les animaux ont été approuvés par le comité de protection et d’utilisation des animaux de l’Université de Virginie (protocoles 4100 et 4120). Les souris C57BL6/J, âgées de 10 à 12 semaines, sont euthanasiées avec du pentobarbital (90 mg/kg ; par voie intrapéritonéale), suivie d’une luxation cervicale pour le prélèvement de tissu pulmonaire 3,4,19,20.
1. Isolation des petits PV
- Nettoyez les outils de dissection et la vaisselle avec de l’éthanol à 100 %, puis lavez-les à l’eau déminéralisée.
- Utilisez des ciseaux pour ouvrir la cavité thoracique. À l’aide d’une pince, vous pouvez retirer avec précaution le cœur et les poumons de la cavité thoracique en touchant le moins possible les poumons.
- Placez le tissu sur une plaque recouverte de Sylgard contenant une solution saline physiologique tamponnée à HEPES froide (4-10 °C) (HEPES-PSS, en mM, 10 HEPES, 134 NaCl, 6 KCl, 1 MgCl2 hexahydraté, 2 CaCl2 dihydraté et 7 dextrose, pH ajusté à 7,4 en utilisant 1 M NaOH)3,4,19. Utilisez des broches de dissection pour déterminer le cœur et les poumons de manière à ce que les grands PV et PA soient clairement visibles et que le lobe gauche du poumon soit légèrement étiré, comme le montre la figure 1.
- En utilisant les grosses veines pulmonaires (PV) comme points de référence, retirez soigneusement le tissu entourant les petites veines intrapulmonaires (petites veines pulmonaires, d’environ 50 à 100 μm de diamètre, indiquées par le rectangle pointillé de la figure 1) avec des ciseaux fins. Assurez-vous d’éviter tout contact direct avec les petits PV. Isolez délicatement les petits PV des tissus environnants.
- Isolez des segments d’environ 1 à 2 mm de long de petits PV. Placez les petits PV dans des HEPES-PSS de 4 à 10 °C.
2. Chargement de petits PV avec un indicateur Ca2+
REMARQUE : Les petits PV doivent être manipulés avec soin, en veillant à ce que les pinces ne touchent que les pointes des PV. Cette méthode est une modification de la technique décrite précédemment 3,7,20,21.
- Préparer une concentration de matière de 2,5 mM Fluo-4 AM avec DMSO 3,4. À l’aide de la solution mère ci-dessus, préparer 10 μM de fluo-4 AM et 0,04 % d’acide pluronique avec HEPES-PSS.
- Placez les petits PV dans un tube de 1,5 mL avec la solution de charge (10 μM fluo-4 AM et 0,04 % d’acide pluronique dans HEPES-PSS)3,4. Couvrir le tube d’une feuille d’aluminium et le placer dans un bain-marie pour une incubation à 37 °C pendant 1 h.
- Après l’incubation, remplacez soigneusement la solution de chargement par 4-10 °C HEPES-PSS et maintenez-la sur de la glace pendant 30 minutes en guise d’étape de lavage.
3. Canulation de petits PV
REMARQUE : Cette méthode est une modification de la technique décrite précédemment 3,20,21.
- Préparez la chambre de myographie sous pression avec deux canules en verre, une de chaque côté. Remplissez les canules avec du PSS (119 mM de NaCl, 4,7 mM de KCl, 1,2 mM de KH2PO4, 1,2 mM de MgCl2 160 hexahydraté, 2,5 mM de CaCl2 dihydraté 3,4,21,22, 7 mM de dextrose et 24 mM de NaHCO 3, maintenus à pH 7,4 en faisant bouillir la solution avec 21 % d’O 2 et 5 % de CO 2) à l’aide d’une seringue de 10 mL.
- Retirez un petit PV de la solution de lavage et placez-le dans la chambre de myographie sous pression. À l’aide d’une pince à pointe fine, canulez soigneusement une extrémité du petit PV sur l’une des canules. Ensuite, à l’aide d’un microfilament en fil de nylon, faites un nœud autour de l’extrémité canulée du petit PV et de l’extrémité de la canule pour le fixer.
- Poussez doucement le PSS à travers la canule pour éliminer le sang à l’intérieur du PV. Utilisez du fil de nylon pour attacher l’autre extrémité avec une canule en verre à l’aide de microfilaments, comme illustré à la figure 1.
4. Pressurisation et imagerie Ca2+ de petits PV
REMARQUE : Cette méthode est une modification de la technique décrite précédemment 3,21.
- À l’aide d’un servorégulateur de pression fixé à un tube contenant du PSS, pressurisez le petit PV d’une extrémité à 5 mm Hg. Utilisez une pompe péristaltique connectée à la fois à une entrée et à une sortie, pour superfuser le PSS. Maintenez la température du superfusate à 37 °C.
- Après la période d’équilibre, acquérez des images Ca2+ pour 1000 images (fréquence d’images : 30 images par seconde) à l’aide de l’objectif à immersion dans l’eau 40x (NA 0,8) et d’un système d’imagerie confocale à disque rotatif. Excitez Fluo-4 à l’aide d’un laser à semi-conducteurs de 488 nm et capturez la fluorescence émise à l’aide d’un filtre passe-bande de 525/36 nm.
- Appliquer l’antagoniste du récepteur de la ryanodine (RyR) ryanodine (5 μM)21,23 sur le superfusate. Attendez 5 min. Reprenez les images Ca2+ comme décrit ci-dessus, en capturant 1000 images supplémentaires à une vitesse de 30 images/s.
5. Analyse d’image Ca2+
REMARQUE : Cette méthode est une modification de la technique décrite précédemment 21,22,24. Les modifications de l’activité des signaux Ca2+ dans les myocytes PV peuvent fournir des informations importantes sur l’inhibition ou l’amélioration du couplage excitation-contraction dans les PV.
- Utilisez un logiciel conçu sur mesure (développé par le Dr Adrian Bonev, https://github.com/vesselman/SparkAn) pour analyser les images Ca2+ .
- Fluidifiez les images à l’aide du filtre de wagon 5 x 5 et du filtre médian 5 x 5. Utilisez une trame décrivant une région plate de PV avec plusieurs cellules pour la détection automatique des événements.
- Cliquez sur Afficher et détecter automatiquement les événements. Utilisez les paramètres suivants : seuil d’événement à une amplitude de 1,3 F/F0, tolérance de 20 %, boîte de balayage de 7 x 7 pixels et moyenne mobile de 7 images. Générez automatiquement des images moyennes toutes les 10 images, à partir de la première image.
- Cliquez sur Démarrer la recherche (l’icône en forme d’œil). Recherchez la table d’événements enregistrée en tant que fichier de marquage dans le menu Fichier. Pour calculer les événements par μm², divisez le nombre de signaux Ca2+ détectés par la surface de la trame sélectionnée.
Résultats
La figure 2A montre un champ de vision à partir d’un petit PV à une pression intraluminale de 5 mm Hg. Les symboles + indiquent les signaux Ca2+ détectés automatiquement dans une image sélectionnée (Vidéo 1), indiqués par le contour vert. Un champ de vision a été enregistré à partir de chaque PV, et un PV a été utilisé à partir de chaque souris. Un petit PV a été considéré comme n=1. Le nombre de signaux Ca2+ par μm2 par minute a été comparé avant et 5 min après l’ajout de ryanodine (5 μM)23 inhibiteur de RyR dans des expériences appariées. Un test t apparié a été utilisé pour des comparaisons statistiques afin de détecter des différences significatives. Le nombre de signaux Ca2+ se produisant spontanément était de 0,73 ± 0,2 événement par minute par μm2 (Figure 2B,C) dans les conditions décrites ci-dessus. Le traitement à la ryanodine a presque complètement inhibé les signaux Ca2+ dans les petits PV (Figure 2C, Vidéo 2), comme l’indique une réduction drastique des événements par minute par μm2. Ces données montrent que l’activité spontanée des signaux Ca2+ dans la couche myocytaire à partir de petits PV pressurisés représente des ouvertures de RyR. Ces résultats fournissent la preuve que l’activité des signaux Ca2+ peut être étudiée dans de petits PV sous des pressions intraluminales physiologiques. Cette méthode facilitera les études futures sur les effets de la pression intraluminale et des médiateurs neurohumoraux sur la signalisation Ca2+ dans les petits myocytes PV, offrant potentiellement des informations précieuses sur la régulation de la fonction PV. Bien que l’étude actuelle se concentre sur le nombre de signaux RyR Ca2+, il est également possible d’analyser les propriétés cinétiques de ces signaux, notamment la durée, l’amplitude, l’étalement spatial et le temps de montée. Comprendre comment les stimuli physiologiques et pathologiques affectent les propriétés cinétiques des signaux RyR Ca2+ peut fournir des informations importantes concernant la régulation de la fonction PV dans les états sains et malades.
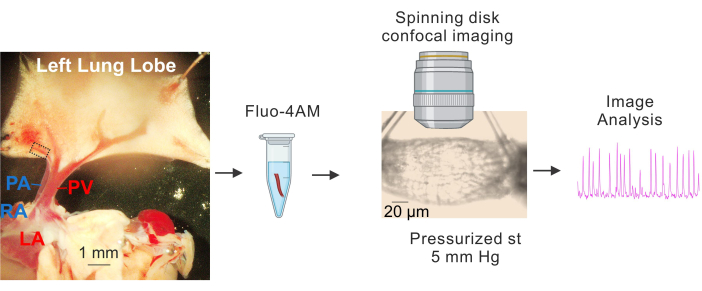
Figure 1 : Préparation et imagerie Ca2+ des PV. Images séquentielles montrant l’identification et l’isolement de petits PV, l’incubation de fluo4-AM, la canulation et la pressurisation (5 mm Hg), l’imagerie confocale à haute vitesse à disque rotatif et l’analyse d’images. Le rectangle en pointillés dans l’image de gauche représente le PV utilisé pour l’étude. Abréviations : PA = artère pulmonaire ; RA = oreillette droite ; PV = veine pulmonaire ; LA = oreillette gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
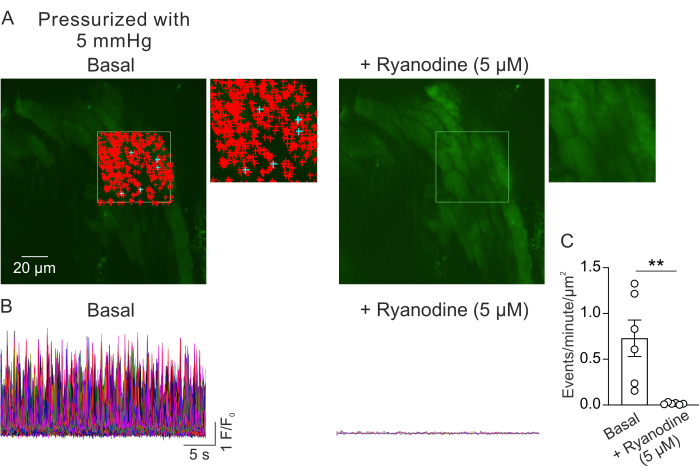
Figure 2 : Analyse de l’imagerie Ca2+. (A) Images d’un champ de vision d’un petit PV pressurisé (5 mm Hg), chargé en fluo-4, en l’absence (à gauche) ou en présence de ryanodine (5 μM ; Inhibiteur de RyR, à droite). Le rectangle vert indique la zone sélectionnée pour la détection automatique des signaux Ca2+. Les signes + représentent les événements détectés automatiquement dans le cadre. Les panneaux rouges indiquent les signaux dont la superficie est inférieure à 3000 μm2, tandis que les panneaux bleus indiquent les signaux qui occupent une zone de plus de 3000 μm2. Chaque signe + indique un événement ou un signal Ca2+. (B) Traces F/F0 des événements détectés dans la zone sélectionnée indiquée en A, montrant l’activité des signaux Ca2+ dans la couche myocytaire à partir de petits PV pressurisés dans des conditions basales (à gauche) et en présence de ryanodine (à droite). (C) Quantification des événements par minute par μm2 de signaux Ca2+ dans de petits PV avant et après l’ajout de ryanodine (1 PV par souris ; n = 6 souris ; **p < 0,01 vs Basal ; test t apparié). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo 1 : Signaux Ca2+ dans un petit PV pressurisé à 5 mm Hg avant traitement à la ryanodine. Le champ de vision représente le cadre sélectionné, illustré en vert sur la figure 2. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 2 : Signaux Ca2+ dans un petit PV pressurisé à 5 mm Hg après traitement à la ryanodine (5 μM). Le champ de vision représente le cadre sélectionné, illustré en vert sur la figure 2. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Les signaux Ca2+ dans les cellules musculaires lisses jouent un rôle crucial dans la régulation de la fonction vasculaire25. Les PV sont un lit vasculaire important mais relativement peu étudié, responsable de l’apport de sang riche en oxygène au cœur gauche26. Cependant, les mécanismes de signalisation Ca2+ dans les petits PV et leur impact sur la fonction physiologique sont inconnus. L’objectif de ce manuscrit est de décrire une nouvelle méthode d’isolement, de canulation et de pressurisation de petits PV afin d’enregistrer les signaux Ca2+ dans la couche myocytaire et d’analyser ces signaux Ca2+ . La capacité de visualiser les signaux Ca2+ dans de petits panneaux photovoltaïques pourrait nous aider à mieux comprendre comment ces signaux fonctionnent dans des conditions normales et malades. Alors que l’étude des signaux Ca2+ dans les PV dans le poumon intact fournirait des données physiologiquement plus pertinentes, les petits PV ne sont pas clairement visibles dans le poumon intact, ce qui peut présenter des défis techniques avec le chargement des colorants Ca2+ et l’imagerie confocale. L’isolement et la pressurisation de petits panneaux photovoltaïques offrent un moyen alternatif d’observer les signaux Ca2+ sous des pressions intraluminales physiologiques, la température et des solutions ioniques.
L’imagerie Ca2+ des PV décrite dans ce manuscrit est basée sur notre procédure bien établie pour l’imagerie Ca2+ dans les artères systémiques 21,22,27. Les données indiquent que la majorité des signaux Ca2+ dans les petits myocytes PV sont dus à l’ouverture des canaux ioniques RyR. Par conséquent, le protocole décrit dans ce manuscrit permettra d’étudier à l’avenir la régulation de RyR et son impact sur la fonction PV dans des conditions normales et dans les maladies. L’activité de RyR2 est essentielle pour les contractions dans les myocytes cardiaques28, tandis que dans les cellules musculaires lisses artérielles, elle a été associée à la relaxation29. L’effet précis de l’activité RyR sur la contraction des petits PV reste inconnu. La myographie de pression est une technique couramment utilisée pour surveiller les changements dans la contraction des petits vaisseaux sanguins. Par conséquent, il est probable que la préparation PV sous pression puisse également être utilisée pour surveiller les petites contractions PV.
La ryanodine présente des effets dépendants de la concentration sur l’activité RyR, l’augmentant à des concentrations submicromolaires et la diminuant à des concentrations micromolaires23. La ryanodine peut également avoir un effet inhibiteur indirect sur d’autres signaux Ca2+ dans les petits PV, une possibilité qui n’a pas été testée. À la concentration utilisée, nous n’avons pas observé d’augmentation compensatoire des signaux Ca2+ dans les PV. La régulation des signaux Ca2+ dans les PV isolés et pressurisés peut différer de celle des PV dans un poumon intact, une possibilité qui n’a pas encore été explorée. Cependant, l’enregistrement des signaux Ca2+ dans de petits PV dans le poumon intact à partir d’une souris anesthésiée présente des défis importants, découlant de l’emplacement du poumon dans la cavité thoracique et de la difficulté de charger sélectivement un indicateur Ca2+ dans les PV d’une souris anesthésiée.
La contrainte de cisaillement du flux sanguin est connue pour altérer la fonction des vaisseaux sanguins. Bien que la méthode actuelle permette d’isoler l’effet de la pression intraluminale sur les signaux Ca2+ dans les petits PV, l’absence de contrainte d’écoulement ou de cisaillement est une limitation potentielle. Cependant, la contrainte d’écoulement ou de cisaillement peut être facilement incorporée et réalisée en combinaison avec l’imagerie Ca2+ à l’aide des configurations décrites précédemment21. Il est possible que la contrainte d’écoulement/cisaillement modifie l’activité des signaux Ca2+ dans les petits PV, ce qui serait un sujet intéressant pour des recherches futures.
Nous avons utilisé fluo-4-AM comme indicateur Ca2+ pour enregistrer des signaux Ca2+ dans de petits PV. Selon les besoins expérimentaux, il devrait être possible d’utiliser d’autres indicateurs Ca2+ qui peuvent être excités à 488 nm (Calbryte 520 AM)7 ou 560 nm (Calbryte 590 AM)30. L’utilisation d’un système d’imagerie confocale à disque rotatif permet d’imager les signaux Ca2+ , en particulier dans les myocytes PV. Bien que cela n’ait pas été étudié dans la présente étude, le fait de se concentrer sur la couche de cellules endothéliales permettra d’enregistrer les signaux endothéliales Ca2+ dans les petits PV. Les PA et les PV sont fonctionnellement différents et sont exposés à des microenvironnements distincts. Par conséquent, une comparaison des signaux myocytaires et endothéliales Ca2+ entre les petits PA et les petits PV peut fournir des informations cruciales sur leurs différences fonctionnelles.
Il est plausible que les signaux Ca2+ dans les petits PV régulent le flux de sang riche en oxygène à travers les PV. La pression à l’intérieur de l’oreillette gauche passe de 4 mmHg à 12 mmHg au cours de chaque cycle cardiaque17,18. Étant donné que les PV fournissent du sang à l’oreillette gauche, il est probable que la pression à l’intérieur des PV change également au cours du cycle cardiaque. Des études antérieures ont montré que les RyR peuvent être activés par la pression intraluminale dans les petites artères16. Par conséquent, la mesure de l’effet de la pression intraluminale sur les signaux PV Ca2+ peut fournir de nouvelles informations sur l’apport de sang riche en oxygène des PV au cœur gauche. La stimulation nerveuse et les médiateurs humoraux dans la circulation sanguine peuvent également activer les signaux Ca2+ des muscles lisses. La méthode actuelle facilitera les études futures sur l’impact des médiateurs neurohumoraux sur les signaux PV Ca2+ et la fonction PV.
Il y a quelques étapes critiques dans le protocole qui doivent être prises en charge. Une dissection soigneuse des veines pulmonaires (PV) est extrêmement importante. Il est crucial d’éviter de toucher la zone d’imagerie des PV avec des outils de dissection, car cela peut nuire à leur santé. Seules les extrémités des PV doivent être touchées. La réduction du temps de dissection peut améliorer le taux de réussite. Une charge insuffisante de colorant peut entraîner une baisse du rapport signal/bruit et augmenter la probabilité de faux positifs lors de la détection automatique d’événements. Le respect du protocole décrit ici devrait garantir une charge adéquate de colorant dans les myocytes PV.
En résumé, nous avons présenté une méthode d’enregistrement des signaux Ca2+ dans de petits PV, qui permet d’étudier les mécanismes de signalisation Ca2+ dans ce lit vasculaire important mais souvent négligé. Il est important de noter que la capacité d’enregistrer les signaux Ca2+ dans de petits PV dans des conditions normales pourrait fournir une compréhension précieuse des mécanismes pathologiques des maladies pulmonaires, notamment l’hypertension pulmonaire, les lésions pulmonaires et l’œdème pulmonaire induit par l’insuffisance cardiaque.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée par des subventions du NHLBI (HL167208, HL157407 et HL146914) à SKS et du NIDDK (DK138271) à YLC.
matériels
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
Références
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. . Thorax, heart pulmonic valve. , (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118 (2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777 (2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553 (2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347 (2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. . Pulmonary capillary wedge pressure. , (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186 (2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157 (2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403 (2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. . Physiology, pulmonary circulation. , (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon