Method Article
Imaging dei segnali Ca2+ in piccole vene polmonari a pressioni intraluminali fisiologiche
In questo articolo
Riepilogo
In questo protocollo, presentiamo una nuova tecnica per la registrazione e l'analisi dei segnali di Ca2+ nelle vene intrapolmonari (piccole vene polmonari o PV) a pressioni intraluminali fisiologiche. La tecnica prevede l'isolamento di piccoli PV, l'incubazione con un indicatore di Ca2+ , l'incannulamento e la pressurizzazione, l'imaging confocale dei segnali di Ca2+ e l'analisi dei dati.
Abstract
Le vene polmonari (PV) trasportano il sangue ricco di ossigeno dai polmoni al cuore sinistro, svolgendo così un'importante funzione nella consegna di sangue ricco di ossigeno agli organi vitali. Tuttavia, la maggior parte degli studi sulla vascolarizzazione polmonare si è concentrata sulle arterie polmonari e sui capillari in condizioni normali e di malattia. I segnali del Ca2+ sono regolatori critici della funzione vascolare. Nonostante i ruoli fisiologici critici dei PV, i segnali di Ca2+ nei piccoli PV intrapolmonari non sono stati registrati in condizioni fisiologiche. Qui, descriviamo una tecnica per registrare l'attività del segnale Ca2+ in PV di topo isolati, cannulati e pressurizzati a 5 mmHg. Incorporando un indicatore di Ca2+ , possiamo studiare i segnali di Ca2+ nello strato miocitario di piccoli PV utilizzando l'imaging confocale a disco rotante ad alta velocità in condizioni fisiologiche. I nostri dati rappresentativi indicano che i segnali del Ca2+ nei piccoli miociti PV sono mediati dalle aperture dei canali ionici del recettore della rianodina. Questo metodo sarà di notevole interesse per i ricercatori nel campo della fisiologia e dei disturbi vascolari polmonari.
Introduzione
Il sistema vascolare polmonare svolge un ruolo importante nello scambio di gas, nell'aggiunta di ossigeno e nella rimozione dell'anidride carbonica dal sangue 1,2. Le arterie polmonari (PA) ricevono sangue povero di ossigeno dal cuore destro. Lo scambio gassoso avviene a livello dei capillari (capillari alveolari) e il sangue ricco di ossigeno viene consegnato al cuore sinistro dalle vene polmonari (PV). A differenza di altre vene che trasportano sangue povero di ossigeno, i PV svolgono un'importante funzione di fornire sangue ricco di ossigeno al cuore sinistro e, di conseguenza, agli organi vitali del corpo. Tuttavia, i meccanismi di segnalazione che regolano la funzione PV in condizioni normali e di malattia sono scarsamente compresi.
Gli studi sulla vascolarizzazione polmonare si sono concentrati principalmente sui PA e sui capillari polmonari. Studi recenti dimostrano che i segnali del Ca2+ negli strati endoteliali e nelle cellule muscolari lisce sono cruciali nella regolazione della funzione dei PA 3,4,5. Inoltre, meccanismi di segnalazione anomali del Ca2+ sono responsabili della compromissione della funzione dei PA e dei capillari polmonari in condizioni di malattia 6,7,8,9,10. Tuttavia, gli studi sulle vene intrapolmonari (piccole PV) rimangono scarsi. L'attività ectopica in grandi PV adiacenti al cuore sinistro (PV cardiaci) è stata proposta come fonte di fibrillazione atriale nell'uomo11,12, e la pulsazione spontanea13 e i segnali Ca2+ 12,14,15 sono stati dimostrati anche in PV di grandi dimensioni. I PV piccoli forniscono sangue ricco di ossigeno ai PV di grandi dimensioni. Tuttavia, i meccanismi di segnalazione del Ca2+ in piccoli PV non sono stati studiati sotto pressioni intraluminali fisiologiche.
In questo manoscritto, introduciamo un nuovo metodo per isolare, incannulare e pressurizzare piccoli PV e imaging di segnali Ca2+ nei miociti PV utilizzando la microscopia confocale a disco rotante ad alta velocità. L'obiettivo generale di questo metodo è quello di registrare segnali Ca2+ spontanei e indotti in piccoli miociti PV sotto pressioni intraluminali fisiologiche. La pressione intraluminale svolge un ruolo fondamentale nella regolazione dei segnali del Ca2+ nei miociti16. Tipicamente, i PV sono sottoposti a pressioni intraluminali fisiologiche che vanno da 4 a 10 mm Hg17,18. Le variazioni della pressione intraluminale durante il ciclo cardiaco possono influenzare i segnali del Ca2+ nei miociti PV. Pertanto, è essenziale utilizzare una tecnica che ci permetta di studiare questi segnali in condizioni fisiologiche ed esaminare come le variazioni delle pressioni intraluminali li influenzano. Inoltre, la maggior parte delle ricerche precedenti sui PV si è concentrata sui PV cardiaci più grandi. La tecnica attuale si concentra su piccoli PV situati in profondità nei polmoni, che possono essere più rilevanti per comprendere la regolazione della funzione polmonare sia in salute che in malattia.
Protocollo
Tutti i protocolli per gli animali sono stati approvati dal Comitato per la cura e l'uso degli animali dell'Università della Virginia (protocolli 4100 e 4120). I topi C57BL6/J, di età compresa tra 10 e 12 settimane, vengono soppressi con pentobarbital (90 mg/kg; per via intraperitoneale), seguiti da lussazione cervicale per la raccolta di tessuto polmonare 3,4,19,20.
1. Isolamento di piccoli PV
- Pulire gli strumenti di dissezione e le stoviglie con etanolo al 100%, quindi lavarli con acqua deionizzata.
- Usa le forbici per aprire la cavità toracica. Usa una pinza per rimuovere con cura il cuore e i polmoni dalla cavità toracica con un tocco minimo dei polmoni.
- Porre il tessuto su una piastra rivestita di Sylgard contenente una soluzione salina fisiologica tamponata con HEPES fredda (4-10 °C) (HEPES-PSS, in mM, 10 HEPES, 134 NaCl, 6 KCl, 1 MgCl2 esaidrato, 2 CaCl2 diidrato e 7 destrosio, pH regolato a 7,4 utilizzando 1 M NaOH)3,4,19. Utilizzare perni di dissezione per bloccare il cuore e i polmoni in modo tale che i grandi PV e PA siano chiaramente visibili e il lobo sinistro del polmone sia leggermente allungato, come mostrato nella Figura 1.
- Utilizzando le grandi vene polmonari (PV) come punti di riferimento, rimuovere con cura il tessuto che circonda le piccole vene intrapolmonari (piccole PV, circa 50-100 μm di diametro, indicate dal rettangolo tratteggiato nella Figura 1) con forbici sottili. Assicurati di evitare il contatto diretto con i piccoli PV. Isolare delicatamente i piccoli PV dal tessuto circostante.
- Isolare segmenti lunghi circa 1-2 mm di piccoli PV. Posizionare i piccoli PV in HEPES-PSS a 4-10 °C.
2. Caricamento di piccoli PV con un indicatore Ca2+
NOTA: I PV piccoli devono essere maneggiati con cura, assicurandosi che le pinze tocchino solo le punte dei PV. Questo metodo è una modifica della tecnica descritta in precedenza 3,7,20,21.
- Preparare una concentrazione stock di 2,5 mM Fluo-4 AM con DMSO 3,4. Utilizzando la soluzione madre di cui sopra, preparare 10 μM di fluo-4 AM e acido pluronico allo 0,04% con HEPES-PSS.
- Posizionare piccoli PV in una provetta da 1,5 mL con la soluzione di carico (10 μM di fluo-4 AM e 0,04% di acido pluronico in HEPES-PSS)3,4. Coprire la provetta con un foglio di alluminio e metterla a bagnomaria per l'incubazione a 37 °C per 1 ora.
- Dopo l'incubazione, sostituire con cura la soluzione di carico con HEPES-PSS a 4-10 °C e tenere in ghiaccio per 30 minuti come fase di lavaggio.
3. Incannulamento di piccoli PV
NOTA: Questo metodo è una modifica della tecnica descritta in precedenza 3,20,21.
- Preparare la camera per miografia a pressione con due cannule di vetro, una per lato. Riempire le cannule con PSS (119 mM NaCl, 4,7 mM KCl, 1,2 mM KH2PO4, 1,2 mM MgCl2 160 esaidrato, 2,5 mM CaCl2 diidrato 3,4,21,22, 7 mM destrosio e 24 mM NaHCO3, mantenuto a pH 7,4 facendo gorgogliare la soluzione con 21% O2 e 5% CO2) utilizzando una siringa da 10 mL.
- Rimuovere un piccolo PV dalla soluzione di lavaggio e posizionarlo nella camera di miografia a pressione. Usando una pinza a punta fine, incannula con cura un'estremità del piccolo PV su una delle cannule. Quindi, utilizzando un microfilamento di filo di nylon, fare un nodo attorno all'estremità cannulata del piccolo PV e alla punta della cannula per fissarlo.
- Spingere delicatamente il PSS attraverso la cannula per rimuovere il sangue all'interno del PV. Utilizzare un filo di nylon per legare l'altra estremità con una cannula di vetro utilizzando microfilamenti, come mostrato nella Figura 1.
4. Pressurizzazione eimaging al Ca2+ di piccole PV
NOTA: Questo metodo è una modifica della tecnica descritta in precedenza 3,21.
- Utilizzando un servoregolatore di pressione collegato a un tubo contenente PSS, pressurizzare il piccolo PV da un'estremità a 5 mm Hg. Utilizzare una pompa peristaltica collegata sia a un ingresso che a un'uscita, per sovrafondere il PSS. Mantenere la temperatura del superfusato a 37 °C.
- Dopo il periodo di equilibrio, acquisire immagini Ca2+ per 1000 fotogrammi (frame rate: 30 fotogrammi al secondo) utilizzando l'obiettivo a immersione in acqua 40x (NA 0,8) e un sistema di imaging confocale a disco rotante. Eccita Fluo-4 utilizzando un laser a stato solido a 488 nm e cattura la fluorescenza emessa utilizzando un filtro passa-banda a 525/36 nm.
- Applicare l'antagonista del recettore della rianodina (RyR) rianodina (5 μM)21,23 al superfusato. Attendere 5 minuti. Ripeti le immagini Ca2+ come descritto sopra, catturando altri 1000 fotogrammi a una velocità di 30 fotogrammi/s.
5. Analisi delle immagini Ca2+
NOTA: Questo metodo è una modifica della tecnica descritta in precedenza 21,22,24. I cambiamenti nell'attività dei segnali del Ca2+ nei miociti PV possono fornire importanti informazioni sull'inibizione o sul miglioramento dell'accoppiamento eccitazione-contrazione nei PV.
- Utilizza un software progettato su misura (sviluppato dal Dr. Adrian Bonev, https://github.com/vesselman/SparkAn) per analizzare le immagini Ca2+ .
- Immagini fluide utilizzando il filtro boxcar 5 x 5 e il filtro mediano 5 x 5. Utilizzare un frame che delinea una regione piatta di PV con più celle per il rilevamento automatico degli eventi.
- Fare clic su Visualizza e rilevamento automatico eventi. Utilizzare le seguenti impostazioni: soglia evento a un'ampiezza di 1,3 F/F0, tolleranza del 20%, casella di scansione di 7 x 7 pixel e media corrente di 7 immagini. Genera automaticamente immagini medie ogni 10 immagini, a partire dalla prima immagine.
- Fare clic su Avvia ricerca (l'icona a forma di occhio). Individuare la tabella degli eventi salvata come file di contrassegno nel menu File. Per calcolare gli eventi per μm², dividere il numero di segnali Ca2+ rilevati per l'area del frame selezionato.
Risultati
La Figura 2A mostra un campo visivo da un piccolo PV a una pressione intraluminale di 5 mm Hg. I simboli + indicano i segnali Ca2+ rilevati automaticamente all'interno di un fotogramma selezionato (Video 1), indicato dal contorno verde. Un campo visivo è stato registrato da ogni PV e un PV è stato utilizzato da ciascun mouse. Un piccolo PV è stato considerato come n=1. Il numero di segnali Ca2+ per μm2 al minuto è stato confrontato prima e 5 minuti dopo l'aggiunta dell'inibitore RyR rianodina (5 μM)23 in esperimenti accoppiati. Un t-test accoppiato è stato utilizzato per confronti statistici per rilevare differenze significative. Il numero di segnali di Ca2+ che si verificano spontaneamente è stato di 0,73 ± 0,2 eventi al minuto per μm2 (Figura 2B, C) nelle condizioni sopra descritte. Il trattamento con rianodina ha inibito quasi completamente i segnali di Ca2+ in piccoli PV (Figura 2C, Video 2), come indicato da una drastica riduzione degli eventi al minuto per μm2. Questi dati mostrano che l'attività spontanea dei segnali di Ca2+ nello strato miocitario da piccoli PV pressurizzati rappresenta un'apertura di RyR. Questi risultati forniscono la prova che l'attività dei segnali di Ca2+ può essere studiata in piccoli PV sotto pressioni intraluminali fisiologiche. Questo metodo faciliterà studi futuri sugli effetti della pressione intraluminale e dei mediatori neuroumorali sulla segnalazione del Ca2+ nei piccoli miociti PV, offrendo potenzialmente preziose informazioni sulla regolazione della funzione PV. Mentre l'attuale studio si concentra sul numero di segnali RyR Ca2+ , è anche possibile analizzare le proprietà cinetiche di questi segnali, tra cui la durata, l'ampiezza, la diffusione spaziale e il tempo di salita. Comprendere come gli stimoli fisiologici e patologici influenzano le proprietà cinetiche dei segnali RyR Ca2+ può fornire importanti informazioni sulla regolazione della funzione PV sia in stati sani che malati.
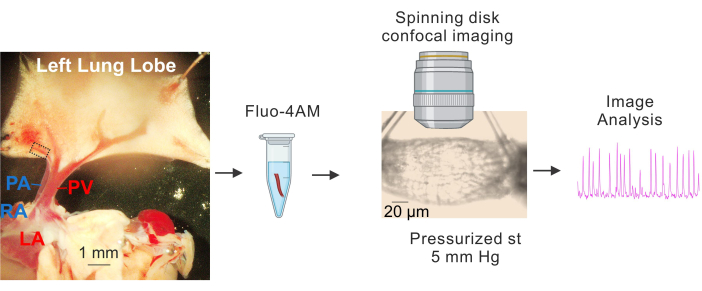
Figura 1: Preparazione e imaging del Ca2+ dei PV. Immagini sequenziali che mostrano l'identificazione e l'isolamento di piccole PV, l'incubazione di fluo4-AM, l'incannulamento e la pressurizzazione (5 mm Hg), l'imaging confocale ad alta velocità del disco rotante e l'analisi delle immagini. Il rettangolo tratteggiato nell'immagine a sinistra rappresenta il PV utilizzato per lo studio. Abbreviazioni: PA = arteria polmonare; RA = atrio destro; PV = vena polmonare; LA = atrio sinistro. Clicca qui per visualizzare una versione più grande di questa figura.
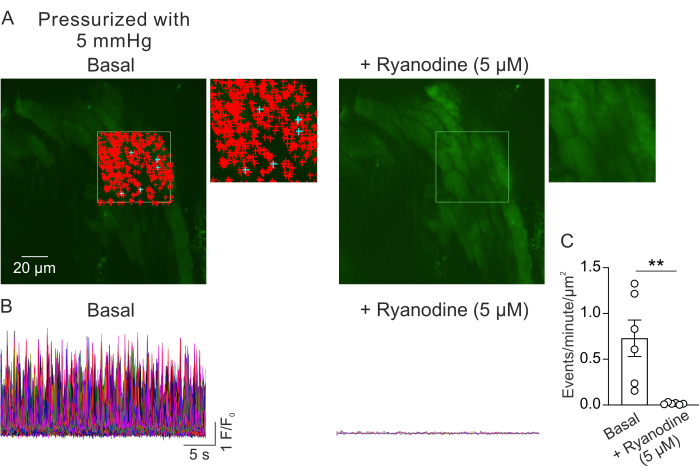
Figura 2: Analisi dell'imaging al Ca2+ . (A) Immagini di un campo visivo da un piccolo PV pressurizzato (5 mm Hg), caricato con fluo-4, in assenza (a sinistra) o in presenza di rianodina (5 μM; Inibitore di RyR, a destra). Il rettangolo verde indica l'area selezionata per il rilevamento automatico dei segnali Ca2+ . I segni + rappresentano gli eventi rilevati automaticamente all'interno del frame. I segnali rossi indicano segnali con un'area inferiore a 3000 μm2, mentre i segnali blu indicano segnali che occupavano un'area superiore a 3000 μm2. Ogni segno + indica un evento o un segnale Ca2+ . (B) F/F0 tracce di eventi rilevati dall'area selezionata indicata in A, che mostrano l'attività di segnali Ca2+ nello strato miocitario da piccoli PV pressurizzati in condizioni basali (a sinistra) e in presenza di rianodina (a destra). (C) Quantificazione di eventi al minuto per μm2 di segnali Ca2+ in piccoli PV prima e dopo l'aggiunta di rianodina (1 PV per topo; n=6 topi; **p < 0,01 vs Basale; t-test accoppiato). Clicca qui per visualizzare una versione più grande di questa figura.
Video 1: Segnali di Ca2+ in un piccolo PV pressurizzato a 5 mm Hg prima del trattamento con rianodina. Il campo visivo rappresenta il fotogramma selezionato, mostrato in colore verde nella Figura 2. Clicca qui per scaricare questo video.
Video 2: Segnali Ca2+ in un piccolo PV pressurizzato a 5 mm Hg dopo il trattamento con rianodina (5 μM). Il campo visivo rappresenta il fotogramma selezionato, mostrato in colore verde nella Figura 2. Clicca qui per scaricare questo video.
Discussione
I segnali del Ca2+ nelle cellule muscolari lisce svolgono un ruolo cruciale nella regolazione della funzione vascolare25. I PV sono un letto vascolare importante ma relativamente poco studiato responsabile della fornitura di sangue ricco di ossigeno al cuore sinistro26. Tuttavia, i meccanismi di segnalazione del Ca2+ nei piccoli PV e il loro impatto sulla funzione fisiologica sono sconosciuti. L'obiettivo di questo manoscritto è quello di descrivere un nuovo metodo per isolare, incannulare e pressurizzare piccoli PV per registrare segnali di Ca2+ nello strato di miociti e per analizzare questi segnali di Ca2+ . La capacità di visualizzare i segnali di Ca2+ in piccoli PV potrebbe aiutare a far progredire la nostra comprensione di come funzionano questi segnali in condizioni normali e malate. Mentre lo studio dei segnali di Ca2+ nelle PV all'interno del polmone intatto fornirebbe dati fisiologicamente più rilevanti, le piccole PV non sono chiaramente visibili nel polmone intatto, il che può introdurre sfide tecniche con il carico di coloranti Ca2+ e l'imaging confocale. L'isolamento e la pressurizzazione di piccoli PV offre un modo alternativo per osservare i segnali di Ca2+ sotto pressioni intraluminali fisiologiche, temperatura e soluzioni ioniche.
L'imaging del Ca2+ dei PV descritto in questo manoscritto si basa sulla nostra procedura consolidata per l'imaging del Ca2+ nelle arterie sistemiche 21,22,27. I dati indicano che la maggior parte dei segnali di Ca2+ nei piccoli miociti PV sono dovuti all'apertura dei canali ionici RyR. Pertanto, il protocollo delineato in questo manoscritto consentirà studi futuri sulla regolazione del RyR e sul suo impatto sulla funzione del PV in condizioni normali e nelle malattie. L'attività di RyR2 è essenziale per le contrazioni nei miociti cardiaci28, mentre nelle cellule muscolari lisce arteriose è stata associata al rilassamento29. L'effetto preciso dell'attività di RyR sulla contrazione di piccole PV rimane sconosciuto. La miografia pressoria è una tecnica comunemente usata per monitorare i cambiamenti nella contrazione dei piccoli vasi sanguigni. Pertanto, è probabile che la preparazione fotovoltaica pressurizzata possa essere utilizzata anche per monitorare piccole contrazioni fotovoltaiche.
La rianodina mostra effetti concentrazione-dipendenti sull'attività di RyR, aumentandola a concentrazioni submicromolari e diminuendola a concentrazioni micromolari23. La rianodina può anche avere un effetto inibitorio indiretto su altri segnali del Ca2+ in piccoli PV, una possibilità che non è stata testata. Alla concentrazione utilizzata, non abbiamo osservato un aumento compensatorio dei segnali di Ca2+ nei PV. La regolazione dei segnali di Ca2+ nei PV isolati e pressurizzati può differire da quella dei PV all'interno di un polmone intatto, una possibilità che deve ancora essere esplorata. Tuttavia, la registrazione di segnali di Ca2+ in piccoli PV nel polmone intatto da un topo anestetizzato presenta sfide significative, derivanti dalla posizione del polmone nella cavità toracica e dalla difficoltà di caricare selettivamente un indicatore di Ca2+ nei PV in un topo anestetizzato.
È noto che lo stress da taglio del flusso sanguigno altera la funzione dei vasi sanguigni. Sebbene il metodo attuale consenta di isolare l'effetto della pressione intraluminale sui segnali di Ca2+ in piccoli PV, la mancanza di flusso o di sforzo di taglio è una potenziale limitazione. Tuttavia, lo sforzo di flusso o di taglio può essere facilmente incorporato ed eseguito in combinazione con l'imaging Ca2+ utilizzando le configurazioni descritte in precedenza21. È possibile che lo sforzo di flusso/taglio modifichi l'attività dei segnali di Ca2+ in piccoli PV, il che sarebbe un argomento interessante per future indagini.
Abbiamo utilizzato il fluo-4-AM come indicatore di Ca2+ per registrare segnali di Ca2+ in piccoli PV. A seconda delle esigenze sperimentali, dovrebbe essere possibile utilizzare altri indicatori di Ca2+ che possono essere eccitati a 488 nm (Calbryte 520 AM)7 o 560 nm (Calbryte 590 AM)30. L'uso di un sistema di imaging confocale a disco rotante consente l'imaging di segnali di Ca2+ , in particolare nei miociti PV. Sebbene non sia stato studiato nel presente studio, concentrarsi sullo strato cellulare endoteliale consentirà la registrazione di segnali endoteliali di Ca2+ in piccoli PV. PA e PV sono funzionalmente diversi e sono esposti a microambienti distinti. Pertanto, un confronto dei segnali Ca2+ dei miociti e dell'endotelio tra piccoli PA e piccoli PV può fornire informazioni cruciali sulle loro differenze funzionali.
È plausibile che i segnali di Ca2+ in piccoli PV regolino il flusso di sangue ricco di ossigeno attraverso i PV. La pressione all'interno dell'atrio sinistro varia da 4 mmHg a 12 mmHg durante ogni ciclo cardiaco 17,18. Poiché i PV forniscono sangue all'atrio sinistro, è probabile che anche la pressione all'interno dei PV cambi durante il ciclo cardiaco. Studi precedenti hanno dimostrato che i RyR possono essere attivati dalla pressione intraluminale nelle piccole arterie16. Pertanto, la misurazione dell'effetto della pressione intraluminale sui segnali PV Ca2+ può fornire nuove informazioni sulla consegna di sangue ricco di ossigeno dai PV al cuore sinistro. La stimolazione nervosa e i mediatori umorali nel flusso sanguigno possono anche attivare i segnali Ca2+ della muscolatura liscia. L'attuale metodo faciliterà gli studi futuri sull'impatto dei mediatori neuroumorali sui segnali PV Ca2+ e sulla funzione PV.
Ci sono alcuni passaggi critici all'interno del protocollo che dovrebbero essere curati. Un'attenta dissezione delle vene polmonari (PV) è estremamente importante. È fondamentale evitare di toccare l'area di imaging dei PV con strumenti di dissezione, poiché ciò può influire negativamente sulla loro salute. Devono essere toccate solo le estremità dei PV. Ridurre il tempo di dissezione può aumentare il tasso di successo. Un carico insufficiente di colorante può comportare un rapporto segnale/rumore inferiore e aumentare la probabilità di falsi positivi durante il rilevamento automatico degli eventi. Seguire il protocollo qui delineato dovrebbe garantire un adeguato carico di colorante nei miociti PV.
In sintesi, abbiamo presentato un metodo per registrare i segnali di Ca2+ in piccoli PV, che consente di studiare i meccanismi di segnalazione del Ca2+ in questo letto vascolare importante ma spesso trascurato. È importante sottolineare che la capacità di registrare i segnali di Ca2+ in piccoli PV in condizioni normali potrebbe fornire una preziosa comprensione dei meccanismi patologici per le malattie del polmone, tra cui l'ipertensione polmonare, il danno polmonare e l'edema polmonare indotto da insufficienza cardiaca.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata da premi dal NHLBI (HL167208, HL157407 e HL146914) a SKS e NIDDK (DK138271) a YLC.
Materiali
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
Riferimenti
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. . Thorax, heart pulmonic valve. , (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118 (2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777 (2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553 (2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347 (2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. . Pulmonary capillary wedge pressure. , (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186 (2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157 (2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403 (2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. . Physiology, pulmonary circulation. , (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon