A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
آثار الطرق الميكانيكية المستخدمة في علاج التهاب ما حول الزرع على إزالة التلوث من سطح الزرع وخشونته
In This Article
Summary
يصف البروتوكول الحالي نموذجا تجريبيا يعتمد على تلطيخ الحبر والذي يمكن استخدامه لإزالة التلوث من سطح الغرسة في المختبر وأبحاث الخشونة للمساهمة في اتخاذ القرارات السريرية.
Abstract
تم اقتراح طرق ميكانيكية مختلفة لتطهير أسطح زراعة الأسنان بنجاح متفاوت. قيمت هذه الدراسة المختبرية كفاءة إزالة التلوث لنظام تآكل الهواء (AA) باستخدام مسحوق الإريثريتول ، وطرف بالموجات فوق الصوتية من البولي إيثر إيثر كيتون (PEEK) ، وكشطات التيتانيوم (TIT) وتأثيراتها على تضاريس سطح الزرع باستخدام المجهر الإلكتروني الماسح (SEM). تم تلطيخ ما مجموعه 60 غرسة بحبر أحمر دائم ووضعها في عيوب التهاب ما حول الزرع من الفئة 1A و 1B مطبوعة ثلاثية الأبعاد ، وتشكيل ست مجموعات (ن = 10 لكل مجموعة) بناء على نوع العيب وبروتوكول العلاج. بالإضافة إلى ذلك ، تم استخدام غرسة تحكم إيجابية وواحدة سلبية. تم تطبيق مسحوق الإريثريتول ، ونصائح الموجات فوق الصوتية PEEK ، وكريت التيتانيوم لمدة دقيقتين في عيوب الفئة 1A و 3 دقائق في عيوب الفئة 1B. تم قياس مناطق الحبر الأحمر المتبقية باستخدام البرامج الرقمية ، وتم تحليل التغييرات في سطح الزرع باستخدام SEM و EDS. لم تحقق أي من الطرق إزالة التلوث الكامل. ومع ذلك ، كان مسحوق الإريثريتول هو الأكثر فعالية بشكل ملحوظ ، حيث ترك معدل حبر متبقي يتراوح بين 24٪ ± 6٪ (ص < 0.001). نتج عن أطراف الموجات فوق الصوتية PEEK 41٪ ± 4٪ حبر متبقي ، بينما تركت كشطات التيتانيوم 55٪ ± 3٪. لوحظت اختلافات ذات دلالة إحصائية بين جميع الطرق. لم يتم العثور على فرق كبير في فعالية إزالة التلوث بين عيوب الفئة 1A و Class 1B. أظهر تحليل SEM الحد الأدنى من الضرر السطحي باستخدام مسحوق الإريثريتول وأطراف PEEK ، في حين تسببت كشطات التيتانيوم في أضرار متوسطة إلى شديدة. استنادا إلى كل من كفاءة إزالة التلوث والحفاظ على السطح ، يعد مسحوق الإريثريتول وأطراف PEEK خيارين آمنين وفعالين لعلاج التهاب ما حول الزرع ، في حين أن كشطات التيتانيوم أقل فعالية وتسبب أضرارا كبيرة للسطح. قد تساعد هذه النتائج الأطباء في التخطيط لعلاج التهاب ما حول الزرع.
Introduction
علاج زراعة الأسنان هو البروتوكول الأكثر شيوعا والمفضل لاستبدال الأسنان المفقودة في جميع أنحاء العالم. أظهرت دراسات المتابعة طويلة المدى أن استخدام الترميمات المدعومة بالزرع في علاج التهاب الأسنانم الكلي أو الجزئي يوفر نتائج يمكن التنبؤ بها ومعدلات نجاح عالية من حيث البقاء على قيد الحياة. ومع ذلك ، قد تنشأ مضاعفات مختلفة تؤثر على الأنسجة الصلبة والرخوة بعد التنسيب الجراحي وترميم الغرسات1. في عام 2017 ، قدمت ورشة العمل العالمية حول تصنيف أمراض وحالات اللثة وحول الزرع تعريفات وتشخيصات تفريقية للأمراض التي تصيب الأنسجة المحيطة بالزرع2. وفقا لهذا التعريف ، فإن التهاب ما حول الزرع هو حالة مرضية لا رجعة فيها تتميز بعلامات سريرية للالتهاب ، بما في ذلك النزيف عند الفحص و / أو التقيح ، وزيادة أعماق الفحص ، و / أو تراجع الهامش المخاطي في الغشاء المخاطي حول الزرع ، وفقدان التصوير الشعاعي للعظم الداعم2. مسببات الأمراض المحيطة بالزرع متعددة العوامل ، وبعض الأفراد أكثر عرضة لهذه الحالة من غيرهم. قد تزيد الاستعدادات المحددة للأفراد من خطر تطور مرض ما حول الزرع ، مما قد يؤدي إلى فقدان الزرع. العوامل الأخرى التي تلعب دورا في مسببات الأمراض المحيطة بالزرع هي العوامل المتعلقة بالمريض (التدخين ، والأمراض الجهازية ، وتاريخ أمراض اللثة ، ونظافة الفم). حالة الغشاء المخاطي الكيراتيني وكمية ونوعية العظام والأنسجة الرخوة في موقع الزرع ؛ القوى على الغرسة والأنسجة المحيطة بها ؛ المضاعفات التي تمت مواجهتها أثناء وضع الزرع ؛ وخبرة ومهارة الطبيب الذي يقوم بإجراء العلاجات الجراحية والأطرافالاصطناعية 2. بالإضافة إلى ذلك، تم مؤخرا إدخال مفهوم جديد لتقييم المخاطر وعلاجها، وهو أداة تقييم مخاطر أمراض الزرع (IDRA)3. تم تطوير هذه الأداة كرسم تخطيطي وظيفي يتكون من ثماني معلمات ، لكل منها ارتباط موثق بالتهاب ما حول الزرع. نواقل المثمن هي تاريخ التهاب دواعم السن ، والنسبة المئوية لمواقع الزرع والأسنان مع النزيف عند الفحص (BoP) ، وعدد الأسنان / الغرسات ذات أعماق الجيب ≥ 5 مم ، ومعدل فقدان عظام اللثة (الصور الشعاعية فيما يتعلق بعمر المريض) ، والقابلية لالتهاب دواعم السن ، وتكرار علاج اللثة الداعم (SPT) ، وتصميم الطرف الاصطناعي.
أظهرت المراجعات المنهجية الحديثة أن انتشار التهاب ما حول الزرع هو 19.53٪ على مستوى المريض و 12.53٪ على مستوى الزرع3. فيما يتعلق بوضع ما يقرب من 5 ملايين غرسة كل عام في جميع أنحاء العالم ، بحجم سوق يزيد عن 4 مليارات دولار أمريكي ، يمثل التهاب ما حول الزرع مشكلة صحية كبيرة للسكان. إذا ترك دون علاج ، فإن التهاب ما حول الزرع يؤدي إلى فقدان الغرسة المصابة والأطراف الاصطناعية المدعومة بالغرسة ، مما يسبب ضائقة كبيرة لكل من طبيب الأسنان والمريض.
يمكن تقسيم علاج أمراض ما حول الزرع إلى طرق غير جراحية وجراحية. على الرغم من وجود توقع معقول لنجاح نقاط النهاية في علاج التهاب دواعم السن4، إلا أن البينات المماثلة لعلاج التهاب ما حول الزرع لا تزال نادرة. لذلك ، فإن الأساس المنطقي للنهج المرحلي والعلاج غير الجراحي لالتهاب ما حول الزرع هو محاولة السيطرة على الأغشية الحيوية والالتهابات بطرق بسيطة نسبيا قبل زيادة الغاز العلاجي وتنفيذ الخطوة الجراحية عند تحقيق تحكم أفضل في الأغشية الحيوية وعامل الخطر. يتضمن ذلك تعليمات OH والدوافع ، والتحكم في عوامل الخطر ، والتحكم في عوامل الاحتفاظ بالغشاء الحيوي ، وتنظيف / إزالة / تعديل الأطراف الاصطناعية ، بما في ذلك تقييم مكونات الأطراف الاصطناعية ، والأجهزة فوق الهامشية وشبه الهامشية ، وعلاج اللثة المصاحب عند الحاجة. وبالتالي ، يجب أن يكون العلاج غير الجراحي دائما هو الخطوة الأولى5. بالنسبة لالتهاب ما حول الزرع المبكر ، قد يكون تقليل عوامل الخطر والعلاج غير الجراحي كافيا ، ولكن غالبا ما تكون إزالة الأغشية الحيوية الكاملة في الجيوب العميقة بعد فقدان العظام أمرا صعبا. خلال مرحلة إعادة التقييم بعد العلاج غير الجراحي ، تشير أعماق الجيب المستمرة (≥ 6 مم) والنزيف عند الفحص (BoP) إلى تطور محتمل لالتهاب ما حول الزرع. في حالة وجود هذه العلامات ، يوصى بالتدخلات الجراحية6. يشمل العلاج الجراحي لالتهاب ما حول الزرع (1) تنضير السديلة المفتوحة ، (2) جراحة السديلة الاستئصالية ، (3) إدارة العيوب العظمية المحيطة بالزرع باستخدام الأساليب الترميمية ، (4) طرق إضافية لإزالة التلوث من سطح الزرع و (5) الاستخدام المساعد للمضادات الحيوية المحلية /الجهازية 7.
العامل المسبب الرئيسي لالتهاب ما حول الزرع هو الأغشية الحيوية المسببة للأمراض المستمرة على سطحالغرسة 6. إزالة هذا الأغشية الحيوية هو المبدأ الرئيسي والهدف لجميع بروتوكولات العلاج ، والتي تتضمن طرق إزالة التلوث الميكانيكية والكيميائية والليزر7.
يستخدم التنضير الميكانيكي مكشطات بلاستيكية وكربونية وتيتانيوم ، وأجهزة الموجات فوق الصوتية ذات الأطراف البلاستيكية والمعدنية ، وفرش التيتانيوم ، وأنظمة كاشطة الهواء (AA) مع مساحيق مختلفة. على الرغم من صعوبة التخلص الكامل من الأغشية الحيوية ، إلا أن هذه العلاجات توفر فوائد سريرية. تم استخدام العديد من التدخلات السريرية ، بما في ذلك بروتوكولات التنضير الميكانيكي مع أو بدون المطهرات8 ، والمضادات الحيوية9 ، بالإضافة إلى الجراحة الاستئصاليةوالتجديدية 10 ، بدرجات متفاوتة من النجاح السريري. ومع ذلك ، فإنها تؤدي أيضا إلى تغييرات في الخصائص الكيميائية والفيزيائية لسطح الزرع ، مما قد يعقد تكوين العظام الجديدة وإعادة الاندماج العظمي.
من بين الطرق الميكانيكية ، أظهرت إجراءات AA باستخدام تركيبات مسحوق مختلفة أفضل فعالية تنظيف11،12،13. ومع ذلك ، فإن وجود الجسيمات المتبقية يمكن أن يغير تضاريس السطح ويقلل من التوافق الحيوي14. الجلايسين ، يليه بيكربونات الصوديوم ، هو المسحوق الأكثر استخداما في أنظمة AA8. في الآونة الأخيرة ، اكتسبت جزيئات الهواء الكاشطة الأصغر مثل الإريثريتول (14 ميكرومتر) اهتماما بإزالة التلوث الفعال مع تقليل تلف السطح9. تعتبر مكشطات التيتانيوم والبلاستيك ، التي تسبب أضرارا أقل للسطح من الأطراف الفولاذية ، فعالة في إزالة التلوث من الأغشيةالحيوية 15. كما تقلل أطراف القشارة بالموجات فوق الصوتية المصنوعة من بولي إيثر إيثر كيتون (نظرة خاطفة) من الحمل البكتيري مع الحد الأدنى من تلف السطح10. يجب أن تأخذ طرق إزالة التلوث في الاعتبار الخشونة العالية لأسطح الزرع وتهدف إلى إزالة الأغشية الحيوية البكتيرية دون التسبب في تلف كبير للسطح. على الرغم من إجراء أبحاث سريرية واسعة النطاق في المختبر وفي الجسم الحي ، إلا أنه لا يوجد حتى الآن إجماع وبروتوكول معياري ذهبي لعلاج التهاب ما حول الزرع حتى الآن. يتطلب الانتشار المتزايد للأمراض المحيطة بالزرع بسبب العديد من زراعة الأسنان نهجا قائما على الأدلة ويمكن التنبؤ به لعلاج الأسطح الملوثة. تهدف هذه الدراسة إلى تقييم فعالية طرق إزالة التلوث المختلفة - أنظمة جلخ الهواء (AA) ، وأطراف الموجات فوق الصوتية PEEK ، وكشطف التيتانيوم - على إزالة التلوث من سطح الغرسة وتقييم تأثيرها على خشونة سطح الغرسة عن طريق تحليل SEM.
Access restricted. Please log in or start a trial to view this content.
Protocol
تمت الموافقة على بروتوكول الدراسة من قبل اللجنة الأخلاقية (TBAEK-363) في جامعة أكدينيز ، أنطاليا ، تركيا. تم دعم هذه الدراسة من قبل صندوق أبحاث جامعة أكدنيز (رقم المشروع: TDH-2024-6676). استخدمت الدراسة زراعة أسنان على شكل لولبي (PrimeTaper EV Implant) بأبعاد 4.2 مم × 11 مم ، وتتميز بتصميم خيط دقيق بقياس 1.7 مم على الياقة. تحضير السطح باستخدام السفع الرملي والنقش الحمضي بحمض الهيدروفلوريك المخفف لتحقيق سطح OsseoSpeed المحدد جيدا.
1. إعداد نماذج التهاب ما حول الزرع التجريبية
ملاحظة: ثلاث طرق معالجة ميكانيكية لإزالة التلوث (كاشطة الهواء (AA) ، بولي إيثركيتون (نظرة خاطفة) بالموجات فوق الصوتية ، وكشطات التيتانيوم. جدول المواد) في نوعين مختلفين من عيوب التهاب الزرع، تم تحليل 11 (الفئة 1A و Class 1B). وهكذا ، كانت هناك ست مجموعات تجريبية (الشكل 1). تم استخدام ما مجموعه 62 غرسة ، بما في ذلك غرسة تحكم إيجابية وواحدة سلبية. تم تعديل تصميم الدراسة المختبرية هذا ، الذي تم تطويره في البداية بواسطة Sharhmann et al.16 ، من قبل العديد من الباحثين12،13،14،15،16،17،18 في الأدبيات (الشكل 2). بافتراض وجود اختلاف بنسبة 10٪ في فعالية إزالة الأغشية الحيوية بين المجموعات ، تم تحديد حجم العينة على أنه 60 (10 لكل مجموعة) لست مجموعات ذات قوة G * ، وحجم تأثير 0.50 ، وخطأ من النوع الأول بنسبة 5٪ ، و 80٪ قوة.
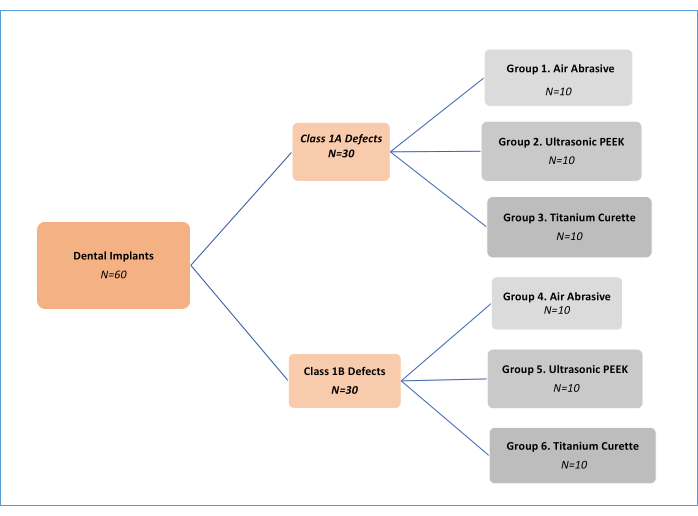
الشكل 1: مخطط انسيابي للمجموعات التجريبية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بإزالة الضرس الأول من نموذج شبح الفك السفلي التعليمي. يتم تثبيت الأسنان البلاستيكية على هذا النموذج الوهمي بمسامير. قم بفك السن الضرس الأول وإزالة الخيط من التجويف. املأ المقبس عن طريق صب مادة السيليكون الناعمة لتغطية المقبس لإنشاء حافة سنخية مسطحة.
ملاحظة: تم إنشاء محاكاة لغرسة موضوعة في منطقة غير مألوفة. - امسح النموذج المعد ضوئيا في ماسح ضوئي مختبري لإنشاء تصميم رقمي.
- قم بإنشاء عيوب عظام 3D من الفئة 1A والفئة 1B11 رقميا. افتح برنامج Exocad. قم بتحميل ملف النموذج الممسوح ضوئيا. ثم انقر فوق تصميم وحدد وضع الخبير. قم بإزالة المناطق غير المنتظمة باستخدام خيار تحرير الشبكة. ثم انقر بزر الماوس الأيمن وحدد حفظ المسح الضوئي كملف في المجلد ذي الصلة على الكمبيوتر.
- حدد خيار Tools > Add / Remove Mesh ، وحدد Wax Scanning> Upload File ، وحدد الملف المحفوظ للتو في المجلد. بعد ذلك ، انقر فوق وضع المعالج على اليمين.
- في نموذج STL الجديد الناتج ، قم بإنشاء محاكاة عيب في تجويف السن. للقيام بذلك ، انقر فوق إضافة / إزالة على الجانب الأيسر. حدد حجم الفرشاة ذات الشكل البيضاوي. بعد ذلك ، قم بإنشاء العيب في النموذج باستخدام shift والنقر بزر الماوس الأيسر في نفس الوقت. اضبط طول العيب على أنه 5 مم والعرض 4.2 مم (يتوافق مع قطر الغرسة) على السطح الشدقي للغرسة لعيوب الفئة 1A و 5-5-5 مم لعيوب الفئة 1B.
- لتضييق العرض الأفقي للعيب ، حدد الشرفات بالنقر فوق التشريح على الجانب الأيسر وتضييق العرض الدهليزي للعيب إلى الداخل. ثم انقر بزر الماوس الأيمن واحفظ المشهد كملف.
- لإنشاء نموذج نهائي ، أعد تشغيل البرنامج وأعد تحميل المجلد المحفوظ. ثم حدد خيار وضع المعالج ومحاذاة النموذج على اليمين. حدد نوع الطراز كنموذج Digital Waxup على اليسار. انقر فوق التالي عدة مرات حتى تصل إلى قسم تصميم النموذج على اليسار. حدد خيار الطراز الكامل وانقر فوق التالي مرتين. بمجرد اكتمال ملف النموذج ، افتحه باستخدام Explorer ، وسيكون جاهزا للطباعة.
- إعادة توجيه ملفات STL الخاصة بالنموذج المصمم إلى الطابعة ثلاثية الأبعاد. اطبع النماذج الرقمية التي تم إنشاؤها باستخدام راتنج نموذجي.
- اشطف النماذج التجريبية بنسبة 96٪ من الإيثانول لمدة 5-10 دقائق. بعد عملية التنظيف ، ضع النماذج في جهاز المعالجة الباعث للضوء وقم بمعالجتها بالضوء لمدة 5 دقائق عند إعداد الجرعة وفقا لتعليمات الشركة المصنعة.
ملاحظة: استخدم نموذجا من الراتنج ذو قوة شد وثني وانضغاطية عالية مناسبة لحفر الزرع. قم بتنظيف النموذج المطبوع بمحلول يحتوي على الكحول وفقا لتعليمات الشركة المصنعة وتأكد من معالجته بالضوء بشكل كاف.
2. تلطيخ الغرسات
- اغمر غرسات الاختبار في حبر أحمر لزج مقاوم للماء. تأكد من تغطية جميع أجزاء سطح الغرسة بالكامل وبشكل متجانس بالحبر لمدة 15 ثانية. قم بإزالة الغرسات من الحاوية المعقمة باستخدام مقابض السائق أو أعمدة الانطباع دون ملامسة اليد.
ملاحظة: سيحاكي هذا التلوين بديلا للأغشية الحيوية مرئيا بصريا للتحليل الفوتوغرافي. - جفف الغرسات الملطخة بالهواء باستخدام حقنة هوائية لوحدة الأسنان من أجل تشتت الحبر بشكل متساو. جفف الغرسات الملطخة لمدة 24 ساعة في درجة حرارة الغرفة. جفف الغرسات بمعزل عن المقابض ، دون ملامسة اليد.
3. وضع الغرسات الملطخة
- اضبط إعدادات موزع الأسنان الفيزيائي على النحو التالي: 800 دورة في الدقيقة ، 40 نيوتن عزم دوران بدون ري ملحي.
- قم بإنشاء تجويف الزرع باستخدام تدريبات الزرع الجراحية على النماذج التجريبية لوضع الغرسات بطول 11 مم وعرض 4.2 مم. قم بإعداد نفس مقبس الزرع للموديلات التي تحتوي على كلا النوعين من العيوب (طرازات العيوب من الفئة 1A و 1B).
- استخدم تدريبات الزرع بالتتابع وفقا لتعليمات الشركة المصنعة لتحقيق الاستقرار الأساسي. نظف الحطام المتبقي بعد الحفر بحقنة هواء وماء ، ثم ضع الغرسات. قم بتثبيت نماذج التهاب ما حول الزرع التجريبية على منصة العمل باستخدام مشبك لتجنب الحركة الدقيقة للغرسات ولمنع التشققات الصغيرة على النماذج.
- أدخل الغرسات بمقبض حامل في المقابس. اترك 5 مم من المنطقة المكشوفة على سطح الخد. تأكد من غمر الغرسات على نفس المستوى على قمة العظام اللغوية للنموذج. تجنب لمس سطح الغرسة الملطخ.
4. تطهير الغرسات
- ابدأ في تطهير الغرسات في مجموعات دون إزالتها من نماذج العيوب التجريبية 1A و 1B.
- نظام جلخ الهواء: اضبط الجهاز بكامل طاقته مع الري بالماء بمسحوق إريثريتول 14 ميكرومتر. أمسك طرف الجهاز على بعد 2-3 مم من سطح الغرسة وقم بتطبيق المسحوق بالتساوي على عيب التهاب ما حول الزرع المكشوف. حدد وقت العمل إلى دقيقتين لعيوب 1A و 3 دقائق لعيوب 1B.
- طرف بالموجات فوق الصوتية Polyetheretherketone (نظرة خاطفة): اضبط الجهاز على 8 طاقة (80٪) مع أقصى ري مائي. امسك قبضة PEEK بطريقة مناسبة للاستخدام بالموجات فوق الصوتية. قم بإزالة التلوث على سطح الغرسة بحركات خطية ومتوازية. ضع طرف PEEK بين الخيوط بقدر ما يسمح تصميمه. حدد وقت العمل إلى دقيقتين لعيوب 1A و 3 دقائق لعيوب 1B.
- مكشطات التيتانيوم: ضع جهات اتصال متتالية بضغط ثابت عند 60 درجة -90 درجة على سطح الغرسة بقوة تقريبية 0.75 نيوتن على سطح الغرسة المكشوف 5 مم لمدة دقيقتين لعيوب 1A و 3 دقائق لعيوب 1B.
- بعد إزالة التلوث ، قم بإزالة الغرسة باستخدام قطعة السائق دون ملامسة اليد. إذا أصبحت النماذج مشوهة بعد إزالة التلوث ، فانتقل إلى النماذج الاحتياطية. قم بتثبيت نماذج التهاب ما حول الزرع التجريبية على منصة العمل باستخدام مشبك.
ملاحظة: يجب معايرة جميع الطرق وتطبيقها بواسطة باحث واحد.
5. التصوير الفوتوغرافي
- قم بإزالة الغرسات من النموذج باستخدام قطعة تشغيل متوافقة للزرع. جفف الغرسات بالهواء لمدة 20 ثانية لإزالة أي جزيئات / بقايا مفككة على السطح.
- ضع الغرسات على نماذج تصوير أكريليك مصممة خصيصا لتصوير مناظر مسطحة ، ومناظر قمية بزاوية 30 درجة ، ومناظر إكليلية بزاوية 30 درجة لتقييم الأجزاء القمية والإكليلية من الخيوط على سطح الغرسة.
- ضع الكاميرا على حامل ثلاثي القوائم وقم بتوحيد إعدادات الكاميرا (المسافة 15 سم ، ISO 160 ، فتحة العدسة f / 16 ، وقت التعريض الضوئي 1/250 ثانية). تأكد من أن الغرفة مضاءة بشكل كاف. من الضروري تثبيت الكاميرا باستخدام حامل ثلاثي القوائم.
- التقط الصور الرقمية بتنسيق RAW بفلاش. احصل على ما مجموعه 90 صورة شدقية (واحدة مسطحة ، وواحدة قمية 30 درجة ، وواحدة 30 درجة إكليلية لكل سطح زرع) لعيوب الفئة 1A و 270 صورة (مسطحة ، قمية 30 درجة ، و 30 درجة إكليلية من كل سطح شدقي ، وسطي ، وبعيد لكل زرعة) لعيوب الفئة 1B. قم بإيداع جميع ملفات الصور الرقمية على قرص ثابت لمزيد من تحليل الصور.
6. تحليل الصور
- قم بإجراء جميع التحليلات على برنامج الصور الرقمية (ImageJ). قبل التحليل ، اجعل خلفية الصور سوداء باستخدام برنامج Photoshop (Photoroom) للتأكد من أن الغرسة فقط مرئية في الصورة. افتح التطبيق ثم أضف كل صورة من المعرض. قم بإزالة الخلفية من الصورة وحدد خلفية سوداء من الخيارات.
- اسحب الصورة وأفلتها على ImageJ. ارسم مربعا في الصورة لتغطية 5 مم إكليلية للزرع. ثم انقر فوق صورة > اقتصاص للتوحيد القياسي. كرر نفس العملية لكل صورة.
- قم بتحويل الصور إلى تنسيق 8 بت بالنقر فوق صورة ˃ اكتب > 8 بت واضبط العتبات بالنقر فوق صورة ˃ ضبط > عتبة لحسابات المنطقة.
- احسب مساحة سطح الغرسة بالكامل ومنطقة بقايا اللون الأحمر بالنقر فوق تحليل ˃ قياس المساحة.
- سجل منطقة البكسل التي تم الحصول عليها في ملف جدول بيانات. قم بإنشاء ملف جدول بيانات منفصل لتسجيل بيانات الصورة الأولية.
- من أجل الحصول على النسبة المئوية لبقايا اللون الأحمر ، اضرب المساحة المعروضة باللون الأحمر في 100 واقسمها على إجمالي مساحة سطح الغرسة.
7. تحليل التسويق عبر محرك البحث
- قم بتخزين جميع الغرسات في صناديقها المعقمة حتى يوم التحليل.
- قبل تحليل SEM ، اختر عينة تمثيلية واحدة بشكل عشوائي من كل مجموعة علاجية. بالإضافة إلى العينات المختارة من كل مجموعة ، أضف غرسة معقمة واحدة ، وفقط الغرسة مغطاة بالكامل بالحبر. وبالتالي ، قم بإعداد ما مجموعه ثماني عينات من الزرع لتحليل SEM.
- رش غاز النيتروجين باستخدام مسدس غاز لمدة 20 ثانية لإزالة أي مسحوق دقيق على سطح الغرسة قبل تحليل SEM.
ملاحظة: لم يتم تطبيق طلاء ذهبي إضافي بسبب التكنولوجيا المتقدمة للجهاز. - قم بتركيب كل غرسة على بذرة SEM بأقراص لاصقة كربونية موصلة بطريقة تسمح بتحليل السطح المسطح الشدقي دون إزالة التلوث اليدوي. رتبها بالترتيب حسب الرقم لتجنب ارتباك المجموعات.
- حدد منطقة من الغرسات الموضوعة في الجهاز والتقط صورا بتكبيرات مختلفة. كرر نفس الإجراء لمناطق مختلفة من أسطح الزرع (متوسطة أو بعيدة). استخدم التكبير 100x و 1000x و 5000x للصور باستخدام جهاز SEM يعمل بسرعة 10-30 كيلو فولت بمتوسط مسافة عمل 12 مم.
ملاحظة: تم اختيار الميكروستراند الثاني من منطقة الياقة والماكبرراند الثاني من الجسم لكل غرسة لضمان التوحيد القياسي أثناء تحليل SEM. بالنسبة لبعض الصور ، يوصى بإجراء تحليل العناصر (EDS) أثناء التصوير للمقارنة.

الشكل 2: مخطط انسيابي للدراسة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
8. التحليل الإحصائي
- عبر عن المتغيرات الفئوية كأرقام ونسب مئوية والمتغيرات المستمرة كمتوسط وانحراف معياري. تأكد من طبيعية التوزيع للمتغيرات المستمرة باستخدام اختبار Shapiro-Wilk.
- لمقارنة المتغيرات المستمرة بين مجموعات العيوب ، استخدم اختبار t الخاص بالطالب. للمقارنة بين أكثر من مجموعتين ، استخدم اختبار ANOVA أحادي الاتجاه أو اختبار Kruskal Wallis اعتمادا على ما إذا كانت الفرضيات الإحصائية قد تم تحقيقها أم لا.
- بالنسبة للبيانات الموزعة بشكل طبيعي ، فيما يتعلق بتجانس التباينات ، استخدم اختبارات Tukey لمقارنات متعددة للمجموعات. بالنسبة للبيانات الموزعة بشكل غير طبيعي ، استخدم اختبار Mann-Whitney U المعدل من Bonferroni للمقارنات المتعددة للمجموعات. تم إجراء جميع التحليلات الإحصائية باستخدام IBM SPSS 20. تم اعتبار المستوى الإحصائي للدلالة لجميع الاختبارات 0.05.
Access restricted. Please log in or start a trial to view this content.
النتائج
كشف البروتوكول التجريبي الموصوف هنا لتحليل إزالة التلوث من أسطح الزرع عن اختلافات كبيرة بين إجراءات العلاج المختلفة. بالإضافة إلى ذلك ، أظهر بروتوكول SEM بعد العلاج أيضا تغييرات كبيرة على أسطح الزرع بدرجات متفاوتة بين مجموعات الدراسة.
مقارنات على مست?...
Access restricted. Please log in or start a trial to view this content.
Discussion
لطالما كانت منهجية تحليل السطح في المختبر لزراعة الأسنان المصابة بمرض ما حول الزرع صعبة بسبب الطبيعة الالتهابية والبكتيرية للآليات المسببة للأمراض التي تحدث على الأسطح الخشنة للزرع. تشمل العديد من المخاوف اختيار مادة العينة ، ومحاكاة الأغشية الحيوية على السطح ، و...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم الغرسات المستخدمة في الدراسة من قبل Dentsply Sirona.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
References
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779(2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295(2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved