Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Efectos de los métodos mecánicos utilizados en el tratamiento de la periimplantitis sobre la descontaminación y rugosidad de la superficie del implante
En este artículo
Resumen
El presente protocolo describe un modelo experimental basado en la tinción de tinta que puede ser utilizado para la descontaminación de la superficie del implante in vitro y la investigación de la rugosidad para contribuir a la toma de decisiones clínicas.
Resumen
Se han propuesto varios métodos mecánicos para descontaminar las superficies de los implantes dentales con diverso éxito. Este estudio in vitro evaluó la eficiencia de descontaminación de un sistema de abrasión por aire (AA) con polvo de eritritol, una punta ultrasónica de poliéter-éter-cetona (PEEK) y curetas de titanio (TIT) y sus efectos en la topografía de la superficie del implante mediante microscopía electrónica de barrido (SEM). Un total de 60 implantes se teñieron con tinta roja permanente y se colocaron en defectos de periimplantitis de Clase 1A y Clase 1B impresos en 3D, formando seis grupos (n = 10 por grupo) según el tipo de defecto y el protocolo de tratamiento. Además, se utilizó un implante de control positivo y otro negativo. Se aplicó polvo de eritritol, puntas ultrasónicas de PEEK y curetas de titanio durante 2 minutos en los defectos de clase 1A y 3 minutos en los defectos de clase 1B. Las áreas residuales de tinta roja se cuantificaron con software digital y los cambios en la superficie del implante se analizaron mediante SEM y EDS. Ninguno de los métodos logró una descontaminación completa. Sin embargo, el polvo de eritritol fue significativamente el más efectivo, dejando una tasa de tinta residual del 24% ± 6% (p < 0,001). Las puntas ultrasónicas de PEEK dieron como resultado un 41% ± un 4% de tinta residual, mientras que las curetas de titanio dejaron un 55% ± un 3%. Se observaron diferencias significativas entre todos los métodos. No se encontraron diferencias significativas en la eficacia de la descontaminación entre los defectos de Clase 1A y Clase 1B. El análisis SEM mostró un daño superficial mínimo con polvo de eritritol y puntas de PEEK, mientras que las curetas de titanio causaron daños de moderados a graves. Basándose tanto en la eficiencia de la descontaminación como en la conservación de la superficie, el polvo de eritritol y las puntas de PEEK son opciones seguras y eficaces para el tratamiento de la periimplantitis, mientras que las curetas de titanio son menos eficaces y causan daños considerables en la superficie. Estos hallazgos pueden ayudar a los médicos en la planificación del tratamiento de la periimplantitis.
Introducción
El tratamiento con implantes dentales es el protocolo más común y preferido para reemplazar los dientes perdidos en todo el mundo. Los estudios de seguimiento a largo plazo han demostrado que el uso de restauraciones implantosoportadas en el tratamiento del edentulismo completo o parcial proporciona resultados predecibles y altas tasas de éxito en términos de supervivencia. Sin embargo, pueden surgir diversas complicaciones que afectan a los tejidos duros y blandos tras la colocación quirúrgica y la restauración de los implantes1. En 2017, el Taller Mundial sobre la Clasificación de Enfermedades y Condiciones Periodontales y Periimplantarias introdujo definiciones y diagnósticos diferenciales para las enfermedades que afectan a los tejidos periimplantarios2. De acuerdo con esta definición, la periimplantitis es una condición patológica irreversible caracterizada por signos clínicos de inflamación, incluyendo sangrado al sondaje y/o supuración, aumento de la profundidad de sondaje y/o recesión del margen mucoso en la mucosa periimplantaria y pérdida radiográfica del hueso de soporte2. La etiología de las enfermedades periimplantarias es multifactorial, y algunos individuos son más susceptibles a esta condición que otros. Las predisposiciones específicas de las personas pueden aumentar el riesgo de desarrollo de enfermedad periimplantaria, lo que puede conducir a la pérdida del implante. Otros factores que influyen en la etiología de las enfermedades periimplantarias son los relacionados con el paciente (tabaquismo, enfermedades sistémicas, antecedentes de enfermedad periodontal, higiene bucal); el estado de la mucosa queratinizada, la cantidad y calidad del hueso y los tejidos blandos en el sitio del implante; fuerzas sobre el implante y los tejidos circundantes; complicaciones encontradas durante la colocación del implante; y la experiencia y habilidad del médico que realiza tratamientos quirúrgicos y protésicos2. Además, recientemente se ha introducido un nuevo concepto de evaluación de riesgos y tratamiento, la Herramienta de Evaluación del Riesgo de Enfermedades de Implantes (IDRA)3. Esta herramienta se desarrolló como un diagrama funcional que consta de ocho parámetros, cada uno con una asociación documentada con la periimplantitis. Los vectores del octágono son la historia de periodontitis, el porcentaje de sitios de implantes y dientes con sangrado al sondaje (BoP), el número de dientes/implantes con profundidades de bolsa de sondaje ≥ 5 mm, la tasa de pérdida ósea periodontal (radiografías en relación con la edad del paciente), la susceptibilidad a la periodontitis, la frecuencia de la terapia periodontal de soporte (SPT) y el diseño de la prótesis.
Revisiones sistemáticas recientes han demostrado que la prevalencia de periimplantitis es del 19,53% a nivel de paciente y del 12,53% a nivel de implante3. Con respecto a los aproximadamente más de 5 millones de implantes que se colocan cada año en todo el mundo, con un tamaño de mercado de más de 4 mil millones de dólares, la periimplantitis representa un problema de salud importante para la población. Si no se trata, la periimplantitis provoca la pérdida del implante afectado y de la prótesis implantosoportada, lo que provoca una gran angustia tanto para el dentista como para el paciente.
El tratamiento de las enfermedades periimplantarias se puede dividir en abordajes quirúrgicos y no quirúrgicos. Aunque existe una expectativa razonable para el éxito de los criterios de valoración en el tratamiento de la periodontitis4, la evidencia comparable para el tratamiento de la periimplantitis sigue siendo escasa. Por lo tanto, la justificación para un enfoque escalonado y un tratamiento no quirúrgico de la periimplantitis es intentar el control de la biopelícula y la inflamación con enfoques relativamente simples antes de aumentar la invasividad del tratamiento y realizar el paso quirúrgico cuando se logre un mejor control de la biopelícula y los factores de riesgo. Esto incluye instrucciones y motivación para la OH, control de factores de riesgo, control de factores de retención de biofilm y limpieza/retirada/modificación de la prótesis, incluida la evaluación de los componentes de la prótesis, la instrumentación supramarginal y submarginal y el tratamiento periodontal concomitante cuando sea necesario. Por lo tanto, la terapia no quirúrgica siempre debe ser el primer paso5. En el caso de la periimplantitis temprana, la reducción de los factores de riesgo y el tratamiento no quirúrgico pueden ser suficientes, pero la eliminación completa de la biopelícula en las bolsas profundas después de la pérdida ósea suele ser un desafío. Durante la fase de reevaluación después del tratamiento no quirúrgico, la persistencia de la profundidad de las bolsas (≥ 6 mm) y el sangrado al sondaje (BoP) indican una posible progresión de la periimplantitis. Si estos signos están presentes, se recomiendan intervenciones quirúrgicas6. El tratamiento quirúrgico de la periimplantitis incluye (i) desbridamiento con colgajo abierto, (ii) cirugía con colgajo resectivo, (iii) el tratamiento de los defectos óseos periimplantarios mediante enfoques reconstructivos, (iv) métodos adicionales para la descontaminación de la superficie del implante y (v) el uso adyuvante de antibióticos locales/sistémicos7.
El principal factor etiológico de la periimplantitis es el biofilm patógeno colonizado por la superficie del implante6. La eliminación de esta biopelícula es el principio fundamental y el objetivo de todos los protocolos de tratamiento, que involucran métodos de descontaminación mecánicos, químicos y láser7.
El desbridamiento mecánico emplea curetas de plástico, carbono y titanio, dispositivos ultrasónicos con puntas de plástico y metal, cepillos de titanio y sistemas de aire abrasivo (AA) con varios polvos. Aunque la eliminación completa de la biopelícula es difícil de lograr, estas terapias proporcionan beneficios clínicos. Diversas intervenciones clínicas, incluyendo protocolos de desbridamiento mecánico con o sin antisépticos8, antibióticos9, así como cirugía resectiva y regenerativa10, han sido utilizadas con diversos grados de éxito clínico. Sin embargo, también inducen cambios en las propiedades químicas y físicas de la superficie del implante, lo que posiblemente complique la formación de hueso nuevo y la reosteointegración.
Entre los métodos mecánicos, los procedimientos de AA que utilizan diferentes composiciones de polvo han demostrado la mejor eficacia de limpieza 11,12,13. Sin embargo, la presencia de partículas residuales puede alterar la topografía de la superficie y reducir la biocompatibilidad14. La glicina, seguida del bicarbonato de sodio, es el polvo más utilizado en los sistemas AA8. Recientemente, las partículas abrasivas de aire más pequeñas, como el eritritol (14 μm), han ganado interés para una descontaminación eficaz con un daño superficial reducido9. Las curetas de titanio y plástico, que causan menos daño superficial que las puntas de acero, son efectivas en la descontaminación de biopelículas15. Las puntas raspadoras ultrasónicas hechas de poli-éter-éter-cetona (PEEK) también reducen la carga bacteriana con un daño mínimo en la superficie10. Los métodos de descontaminación deben tener en cuenta la alta rugosidad de las superficies de los implantes y tratar de eliminar la biopelícula bacteriana sin causar daños significativos en la superficie. Aunque se han realizado extensas investigaciones in vitro, in vivo y clínicas, hasta la fecha todavía no existe un consenso y un protocolo de referencia para el tratamiento de la periimplantitis. La creciente prevalencia de enfermedades periimplantarias debidas a numerosos implantes dentales requiere un enfoque predecible y basado en evidencia para tratar las superficies contaminadas. Este estudio tiene como objetivo evaluar la efectividad de diferentes métodos de descontaminación -sistemas abrasivos de aire (AA), puntas ultrasónicas de PEEK y curetas de titanio- en la descontaminación de la superficie del implante y evaluar su impacto en la rugosidad de la superficie del implante mediante análisis SEM.
Access restricted. Please log in or start a trial to view this content.
Protocolo
El protocolo del estudio fue aprobado por el comité de ética (TBAEK-363) de la Universidad de Akdeniz, Antalya, Turquía. Este estudio contó con el apoyo del Fondo de Investigación de la Universidad de Akdeniz (Número de proyecto: TDH-2024-6676). El estudio utilizó un implante dental en forma de tornillo (PrimeTaper EV Implant) con unas dimensiones de 4,2 mm x 11 mm, con un diseño de micro-rosca de 1,7 mm en el cuello. Preparación de la superficie con arenado y grabado ácido con ácido fluorhídrico diluido para lograr la superficie OsseoSpeed bien definida.
1. Preparación de modelos experimentales de periimplantitis
NOTA: Tres métodos de tratamiento mecánico de descontaminación (abrasivo de aire (AA), polieteretercetona (PEEK) ultrasónico y curetas de titanio; Tabla de Materiales) en dos tipos diferentes de defectos de periimplantitis11 (Clase 1A y Clase 1B). Así, se desarrollaron seis grupos experimentales (Figura 1). Se utilizaron un total de 62 implantes, incluyendo un implante de control positivo y otro negativo. Este diseño de estudio in vitro, desarrollado inicialmente por Sharhmann et al.16, ha sido modificado por diversos investigadores 12,13,14,15,16,17,18 en la literatura (Figura 2). Suponiendo una diferencia del 10% en la eficacia de la eliminación de biopelículas entre los grupos, el tamaño de la muestra se determinó como 60 (10 para cada grupo) para seis grupos con G*power, un tamaño del efecto de 0,50, un error de tipo I del 5% y una potencia del 80%.
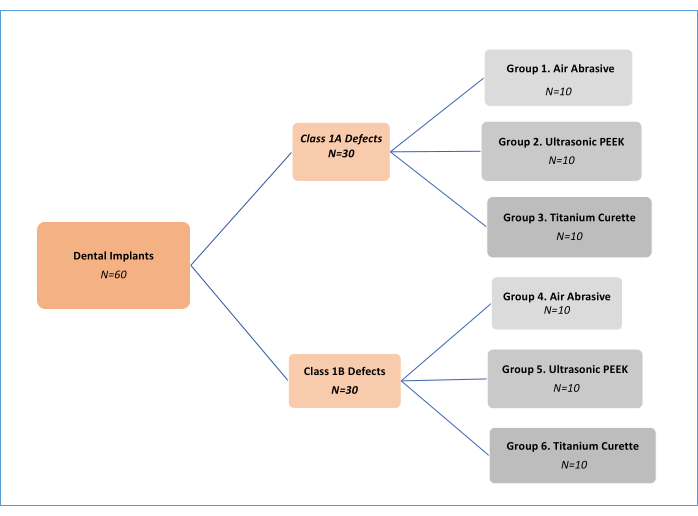
Figura 1: Diagrama de flujo de los grupos experimentales. Haga clic aquí para ver una versión más grande de esta figura.
- Extraiga un primer molar del modelo de maniquí mandibular educativo. Los dientes de plástico se fijan a este modelo fantasma con tornillos. Desenrosque el primer molar y retire la rosca del encaje. Llene el alveolo moldeando el material de silicona suave para cubrir el alveolo y crear una cresta alveolar plana.
NOTA: Se ha creado una simulación de un implante colocado en una zona edéntula. - Escanee el modelo preparado en un escáner de laboratorio para crear un diseño digital.
- Cree digitalmente defectos óseos de periimplantitis de Clase 1A y Clase1B 11 en 3D. Abra el programa de software Exocad. Cargue el archivo de modelo escaneado. A continuación, haga clic en Diseño y seleccione Modo experto. Elimine las áreas irregulares con la opción Editar malla. A continuación, haga clic con el botón derecho del ratón y seleccione Guardar escaneo como archivo en la carpeta relacionada del ordenador.
- Seleccione Herramientas > opción Agregar o quitar malla , seleccione Escaneo de cera> Cargar archivo y seleccione el archivo que acaba de guardar en la carpeta. Después de eso, haga clic en Modo asistente a la derecha.
- En el nuevo modelo STL resultante, cree una simulación de defectos en el alveolo del diente. Para hacer esto, haga clic en Agregar/Eliminar en el lado izquierdo. Seleccione Tamaño de pincel de forma ovalada. Luego, cree el defecto en el modelo usando shift y clic izquierdo al mismo tiempo. Ajuste la longitud del defecto a 5 mm y la anchura a 4,2 mm (correspondiente al diámetro del implante) en la superficie bucal del implante para los defectos de clase 1A y 5-5-5 mm para los defectos de clase 1B.
- Para reducir el ancho horizontal del defecto, seleccione las cúspides haciendo clic en Anatomía en el lado izquierdo y estrechando el ancho vestibular del defecto hacia adentro. A continuación, haga clic con el botón derecho y guarde la escena como un archivo.
- Para crear un modelo final, reinicie el programa y vuelva a cargar la carpeta guardada. A continuación, seleccione la opción Modo de asistente y alineación de modelo a la derecha. Seleccione el tipo de modelo como Modelo de encerado digital a la izquierda. Haga clic en Siguiente varias veces hasta llegar a la sección de diseño del modelo a la izquierda. Seleccione la opción Modelo completo y haga clic en Siguiente dos veces. Una vez que el archivo del modelo esté completo, ábralo con el Explorador y estará listo para imprimir.
- Reenvíe los archivos STL del modelo diseñado a la impresora 3D. Imprima los modelos digitales creados utilizando una resina para modelos.
- Enjuague los modelos experimentales en etanol al 96% durante 5-10 min. Después del proceso de limpieza, coloque los modelos en el dispositivo de curado emisor de luz y cure con luz durante 5 minutos en el ajuste de dosis de acuerdo con las instrucciones del fabricante.
NOTA: Utilice un modelo de resina con alta resistencia a la tracción, flexión y compresión que sea adecuado para la perforación de implantes. Limpie el modelo impreso con soluciones a base de alcohol de acuerdo con las instrucciones del fabricante y asegúrese de que esté adecuadamente fotopolimerizado.
2. Tinción de implantes
- Sumerja los implantes de prueba en tinta roja viscosa resistente al agua. Asegúrese de que todas las partes de la superficie del implante estén completa y homogéneamente cubiertas de tinta durante 15 s. Retire los implantes del recipiente estéril utilizando piezas de mano de controlador o postes de impresión sin contacto con la mano.
NOTA: Esta tinción simulará un sustituto de biopelícula ópticamente visible para el análisis fotográfico. - Seque al aire los implantes manchados con una jeringa de aire de la unidad dental para tener una dispersión uniforme de la tinta. Seque los implantes manchados durante 24 horas a temperatura ambiente. Seque los implantes de forma aislada con las piezas de mano, sin contacto con las manos.
3. Colocación de implantes teñidos
- Ajuste la configuración de un dispensador de fisioterapia dental de la siguiente manera: 800 rpm, 40 N de par sin irrigación salina.
- Cree el encaje del implante con las fresas de implantes quirúrgicos en los modelos experimentales para colocar los implantes de 11 mm de largo y 4,2 mm de ancho. Prepare el mismo encaje del implante para modelos con ambos tipos de defectos (modelos con defectos de clase 1A y 1B).
- Utilice las fresas de implante secuencialmente de acuerdo con las instrucciones del fabricante para lograr la estabilidad primaria. Limpie los residuos restantes después de perforar con una jeringa de aire y agua, luego coloque los implantes. Estabilice los modelos experimentales de periimplantitis en la plataforma de trabajo con una pinza para evitar el micromovimiento de los implantes y para evitar microfisuras en los modelos.
- Inserte los implantes con una pieza de mano portadora en los encajes. Deje 5 mm de área expuesta en la superficie bucal. Asegúrese de que los implantes estén sumergidos al mismo nivel en la cresta ósea lingual del modelo. Evite tocar la superficie manchada del implante.
4. Descontaminación de implantes
- Comience a descontaminar los implantes en grupos sin eliminarlos de los modelos experimentales de defectos 1A y 1B.
- Sistema abrasivo de aire: Ajuste el dispositivo a máxima potencia con riego de agua con polvo de eritritol de 14 μm. Sostenga la punta del dispositivo a 2-3 mm de la superficie del implante y aplique el polvo de manera uniforme sobre el defecto de periimplantitis expuesto. Limite el tiempo de trabajo a 2 min para defectos 1A y 3 min para defectos 1B.
- Punta ultrasónica de polieteretercetona (PEEK): Ajuste el dispositivo a 8 de potencia (80%) con la máxima irrigación de agua. Sujete la pieza de mano de PEEK de forma adecuada para su uso por ultrasonidos. Realizar la descontaminación de la superficie del implante con movimientos lineales y paralelos. Aplique la punta de PEEK entre las roscas tanto como su diseño lo permita. Limite el tiempo de trabajo a 2 min para defectos 1A y 3 min para defectos 1B.
- Curetas de titanio: Aplique contactos consecutivos con presión constante a 60°-90° sobre la superficie del implante con una fuerza aproximada de 0,75 N sobre la superficie expuesta del implante de 5 mm durante 2 min para defectos 1A y 3 min para defectos 1B.
- Después de la descontaminación, retire el implante utilizando la pieza atornilladora sin contacto con la mano. Si los modelos se deforman después de la descontaminación, proceda a los modelos de copia de seguridad. Estabilice los modelos experimentales de periimplantitis en la plataforma de trabajo con una pinza.
NOTA: Todos los métodos deben ser calibrados y aplicados por un solo investigador.
5. Imágenes fotográficas
- Retire los implantes del modelo con una pieza de destornillador de implante compatible. Seque los implantes al aire durante 20 segundos para eliminar cualquier partícula/remanente suelto en la superficie.
- Coloque los implantes en modelos fotográficos acrílicos diseñados a medida para tomar vistas planas, vistas apicales de 30° y vistas coronales de 30° para evaluar las partes apical y coronal de las roscas en la superficie del implante.
- Coloque la cámara en un trípode y estandarice la configuración de la cámara (distancia 15 cm, ISO 160, apertura f/16, tiempo de exposición 1/250 s). Asegúrese de que la habitación esté adecuadamente iluminada. Es necesario estabilizar la cámara con un trípode.
- Toma las fotos digitales en formato RAW con flash. Obtenga un total de 90 fotos bucales (una plana, una apical de 30° y una coronal de 30° para cada superficie del implante) para defectos de Clase 1A y 270 fotos (planas, apicales de 30° y 30° coronales de cada superficie bucal, mesial y distal para cada implante) para defectos de Clase 1B. Deposite todos los archivos de fotos digitales en un disco duro para su posterior análisis de imágenes.
6. Análisis de imágenes
- Realice todos los análisis en el software de imagen digital (ImageJ). Antes del análisis, haga que el fondo de las fotografías sea negro con un programa de Photoshop (Photoroom) para asegurarse de que solo el implante sea visible en la imagen. Abra la aplicación y luego agregue cada imagen de la galería. Elimine el fondo de la imagen y seleccione Fondo negro de las opciones.
- Arrastre y suelte la imagen en ImageJ. Dibuje un cuadrado en la imagen para cubrir 5 mm de la corona del implante. A continuación, haga clic en Imagen > Recortar para la estandarización. Repite el mismo proceso para cada imagen.
- Convierta las imágenes a formato de 8 bits haciendo clic en Imagen ˃ Escriba ˃ 8 bits y ajuste los umbrales haciendo clic en Imagen ˃ Ajustar ˃ Umbral para los cálculos de área.
- Calcule el área total de la superficie del implante y el área de residuos de color rojo haciendo clic en Analizar ˃ Medir ˃ Área.
- Registre el área de píxeles obtenida en un archivo de hoja de cálculo. Cree un archivo de hoja de cálculo independiente para registrar los datos de imagen sin procesar.
- Para obtener el porcentaje de restos de color rojo, multiplique el área roja por 100 y divídala por el área total de la superficie del implante.
7. Análisis SEM
- Guarde todos los implantes en sus cajas estériles hasta el día del análisis.
- Antes del análisis SEM, seleccione aleatoriamente una muestra representativa de cada grupo de tratamiento. Además de las muestras seleccionadas de cada grupo, agregue un implante estéril y solo el implante esté completamente cubierto con tinta. Por lo tanto, prepare un total de ocho muestras de implantes para el análisis SEM.
- Pulverizar gas nitrógeno con una pistola de gas durante 20 s para eliminar el micropolvo de la superficie del implante antes del análisis SEM.
NOTA: No se aplicó un recubrimiento de oro adicional debido a la tecnología avanzada del dispositivo. - Monte cada implante en muñones SEM con discos adhesivos de carbono conductores de una manera que permita el análisis de la superficie plana bucal sin descontaminación manual. Colóquelos en orden por número para evitar confusiones de los grupos.
- Seleccione un área de los implantes colocados en el instrumento y capture imágenes con diferentes aumentos. Repita el mismo procedimiento para diferentes regiones de las superficies del implante (mesial o distal). Utilice aumentos de 100x, 1000x y 5000x para imágenes con un dispositivo SEM que funcione a 10-30 kV con una distancia de trabajo promedio de 12 mm.
NOTA: La segunda microhebra del área del cuello y la segunda macrohebra del cuerpo se seleccionaron para cada implante para garantizar la estandarización durante el análisis SEM. Para algunas imágenes, se recomienda realizar un análisis elemental (EDS) durante la obtención de imágenes para la comparación.

Figura 2: Diagrama de flujo del estudio. Haga clic aquí para ver una versión más grande de esta figura.
8. Análisis estadístico
- Expresa las variables categóricas como números y porcentajes y las variables continuas como media y desviación estándar. Confirmar la normalidad de la distribución para variables continuas con la prueba de Shapiro-Wilk.
- Para la comparación de variables continuas entre grupos de defectos, utilice la prueba t de Student. Para la comparación de más de dos grupos, utilice el ANOVA de un factor o la prueba de Kruskal Wallis dependiendo de si las hipótesis estadísticas se cumplieron o no.
- Para datos distribuidos normalmente, con respecto a la homogeneidad de las varianzas, utilice las pruebas de Tukey para comparaciones múltiples de grupos. Para datos distribuidos de forma no normal, utilice la prueba U de Mann-Whitney ajustada por Bonferroni para comparaciones múltiples de grupos. Todos los análisis estadísticos se realizaron con el programa IBM SPSS 20. El nivel estadístico de significación de todas las pruebas se consideró de 0,05.
Access restricted. Please log in or start a trial to view this content.
Resultados
El protocolo experimental descrito aquí para analizar la descontaminación de las superficies de los implantes reveló diferencias significativas entre los distintos procedimientos de tratamiento. Además, el protocolo SEM post-tratamiento también mostró cambios significativos en las superficies de los implantes con diversos grados entre los grupos de estudio.
Comparaciones a nivel de implante (medias totales del implante) después de la descontamin...
Access restricted. Please log in or start a trial to view this content.
Discusión
La metodología de análisis de la superficie in vitro de los implantes dentales afectados por la enfermedad periimplantaria siempre ha sido un reto debido a la naturaleza inflamatoria y bacteriana de los mecanismos patogénicos que se producen en las superficies rugosas del implante. Varias preocupaciones incluyen la elección del material de la muestra, la imitación de la biopelícula en la superficie, la elección del tipo de defecto de periimplantitis, la representación de...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los implantes utilizados en el estudio fueron soportados por Dentsply Sirona.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
Referencias
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779(2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295(2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados