Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Влияние механических методов лечения периимплантита на обеззараживание и шероховатость поверхности имплантата
В этой статье
Резюме
Настоящий протокол описывает экспериментальную модель, основанную на окрашивании чернилами, которая может быть использована для обеззараживания поверхности имплантата in vitro и исследования шероховатости для внесения вклада в принятие клинических решений.
Аннотация
Для обеззараживания поверхностей зубных имплантатов с переменным успехом были предложены различные механические методы. В этом исследовании in vitro оценивалась эффективность обеззараживания системы воздушной абразии (АА) с порошком эритритола, ультразвуковым наконечником из полиэфир-эфир-кетона (ПЭЭК) и титановыми кюретками (TIT) и их влияние на топографию поверхности имплантата с помощью сканирующей электронной микроскопии (СЭМ). В общей сложности 60 имплантатов были окрашены перманентными красными чернилами и помещены в напечатанные на 3D-принтере дефекты периимплантита класса 1А и класса 1В, сформировав шесть групп (n=10 в группе) в зависимости от типа дефекта и протокола лечения. Кроме того, был использован один положительный и один отрицательный контрольный имплантат. Порошок эритритола, ультразвуковые наконечники PEEK и титановые кюретки наносили в течение 2 минут при дефектах класса 1А и 3 минуты при дефектах класса 1В. Остаточные участки красных чернил были количественно определены с помощью цифрового программного обеспечения, а изменения поверхности имплантата были проанализированы с помощью SEM и EDS. Ни один из методов не позволил добиться полной дезактивации. Тем не менее, порошок эритритола был значительно наиболее эффективным, оставляя остаточную долю чернил 24% ± 6% (p < 0,001). Ультразвуковые наконечники PEEK оставляли 41% ± 4% остаточных чернил, в то время как титановые кюретки оставляли 55% ± 3%. Среди всех методов наблюдались значимые различия. Существенной разницы в эффективности обеззараживания между дефектами класса 1А и класса 1В не обнаружено. Анализ СЭМ показал минимальное повреждение поверхности порошком эритритола и наконечниками PEEK, в то время как титановые кюретки вызывали повреждения средней и тяжелой степени. Основываясь как на эффективности обеззараживания, так и на сохранении поверхности, порошок эритритола и наконечники PEEK являются безопасными и эффективными вариантами лечения периимплантита, в то время как титановые кюретки менее эффективны и вызывают значительные повреждения поверхности. Эти результаты могут помочь клиницистам в планировании лечения периимплантита.
Введение
Лечение зубными имплантатами является наиболее распространенным и предпочтительным методом замены отсутствующих зубов во всем мире. Долгосрочные последующие исследования показали, что использование реставраций с опорой на имплантаты в лечении полной или частичной адентии обеспечивает предсказуемые результаты и высокие показатели успеха с точки зрения выживаемости. Однако после хирургической установки и восстановления имплантатов могут возникнуть различные осложнения, затрагивающие твердые и мягкие ткани1. В 2017 году на Всемирном семинаре по классификации заболеваний и состояний пародонта и периимплантатов были представлены определения и дифференциальная диагностика заболеваний, поражающих периимплантные ткани2. Согласно этому определению, периимплантит является необратимым патологическим состоянием, характеризующимся клиническими признаками воспаления, включая кровотечение при зондировании и/или нагноении, увеличение глубины зондирования и/или рецессию края слизистой оболочки в слизистой оболочке периимплантата, а также рентгенологическую потерю опорной кости2. Этиология периимплантных заболеваний является многофакторной, и некоторые люди более подвержены этому состоянию, чем другие. Специфическая предрасположенность людей может увеличить риск развития периимплантатного заболевания, что может привести к потере имплантата. Другими факторами, которые играют роль в этиологии периимплантных заболеваний, являются факторы, связанные с пациентом (курение, системные заболевания, пародонтоз в анамнезе, гигиена полости рта); состояние ороговевшей слизистой, количество и качество костных и мягких тканей в месте установки имплантата; воздействия на имплантат и окружающие ткани; осложнения, возникшие при установке имплантатов; а также опыт и мастерство врача, выполняющего хирургические и ортопедические процедуры2. Кроме того, недавно была представлена новая концепция оценки и лечения рисков, Инструмент оценки риска имплантационных заболеваний (IDRA)3. Этот инструмент был разработан в виде функциональной диаграммы, состоящей из восьми параметров, каждый из которых имеет документально подтвержденную связь с периимплантитом. Векторами октагона являются периодонтит в анамнезе, процент участков имплантатов и зубов с кровотечением при зондировании (BoP), количество зубов/имплантатов с глубиной зондирующих карманов ≥ 5 мм, скорость потери костной ткани пародонта (рентгенограммы в зависимости от возраста пациента), восприимчивость к пародонтиту, частота поддерживающей пародонтальной терапии (SPT) и конструкция протеза.
Последние систематические обзоры показали, что распространенность периимплантита составляет 19,53% на уровне пациента и 12,53% на уровне имплантата3. Учитывая, что ежегодно во всем мире устанавливается более 5 миллионов имплантатов, а объем рынка составляет более 4 миллиардов долларов США, периимплантит представляет собой серьезную проблему для здоровья населения. Если периимплантит не лечить, он приводит к потере пораженного имплантата и протеза с опорой на имплантат, что вызывает большие страдания как у стоматолога, так и у пациента.
Лечение периимплантных заболеваний можно разделить на безоперационный и хирургический подходы. Несмотря на разумные основания ожидать успеха конечных точек в лечении пародонтита4, сопоставимые доказательства в отношении лечения периимплантита все еще скудны. Таким образом, обоснование поэтапного подхода и нехирургической терапии периимплантита заключается в том, чтобы попытаться контролировать биопленку и воспаление с помощью относительно простых подходов до увеличения инвазивности лечения и выполнить хирургический этап, когда достигнут лучший контроль биопленки и факторов риска. Это включает в себя инструкции и мотивацию по ОН, контроль факторов риска, контроль факторов, удерживающих биопленку, и очистку/удаление/модификацию протеза, включая оценку компонентов протеза, надмаргинальных и субмаргинальных инструментов, а также сопутствующее пародонтологическое лечение, когда это необходимо. Таким образом, безоперационная терапия всегда должна быть первым шагом5. При раннем периимплантите может быть достаточно снижения факторов риска и нехирургического лечения, но полное удаление биопленки из глубоких карманов после потери костной массы часто является сложной задачей. На этапе повторной оценки после нехирургического лечения персистирующая глубина кармана (≥ 6 мм) и кровотечение при зондировании (BoP) указывают на потенциальное прогрессирование периимплантита. При наличии этих признаков рекомендуются хирургические вмешательства6. Хирургическая терапия периимплантита включает в себя: (i) обработку открытым лоскутом, (ii) резективную хирургию лоскутом, (iii) лечение костных дефектов периимплантата с использованием реконструктивных подходов, (iv) дополнительные методы обеззараживания поверхности имплантата и (v) дополнительное использование местных/системныхантибиотиков.
Основным этиологическим фактором периимплантита является патогенная биопленка, колонизированная на поверхности имплантата6. Удаление этой биопленки является основным принципом и целью всех протоколов лечения, которые включают в себя механические, химические и лазерные методы обеззараживания7.
При механической обработке используются кюретки из пластика, углерода и титана, ультразвуковые аппараты с пластиковыми и металлическими наконечниками, титановые щетки, воздушно-абразивные (АА) системы с различными порошками. Несмотря на то, что полного уничтожения биопленки достичь сложно, эти методы лечения обеспечивают клинические преимущества. Различные клинические вмешательства, включая протоколы механической обработки с антисептиками или безних8, антибиотики9, а также резектационную и регенеративнуюхирургию10, применялись с разной степенью клинического успеха. Тем не менее, они также вызывают изменения в химических и физических свойствах поверхности имплантата, что может усложнить формирование новой кости и повторную остеоинтеграцию.
Среди механических методов наилучшую эффективность очистки показали процедуры АА с использованием различных порошковых составов 11,12,13. Однако присутствие остаточных частиц может изменить рельеф поверхности и снизить биосовместимость14. Глицин, за которым следует бикарбонат натрия, является наиболее часто используемым порошком в системах АА8. В последнее время более мелкие аэроабразивные частицы, такие как эритрит (14 мкм), стали вызывать интерес благодаря эффективному обеззараживанию с меньшим повреждением поверхности9. Титановые и пластиковые кюретки, которые наносят меньший ущерб поверхности, чем стальные наконечники, эффективны для обеззараживания биопленки15. Ультразвуковые наконечники для удаления зубного камня, изготовленные из полиэфир-эфир-кетона (PEEK), также снижают бактериальную нагрузку с минимальным повреждением поверхности10. Методы обеззараживания должны учитывать высокую шероховатость поверхностей имплантатов и направлены на удаление бактериальной биопленки без причинения значительного повреждения поверхности. Несмотря на то, что были проведены обширные исследования in vitro, in vivo и клинические исследования, на сегодняшний день до сих пор нет консенсуса и золотого стандарта протокола лечения периимплантита. Растущая распространенность периимплантных заболеваний из-за большого количества зубных имплантатов требует научно обоснованного и предсказуемого подхода к лечению загрязненных поверхностей. Целью данного исследования является оценка эффективности различных методов обеззараживания – воздушных абразивных систем (АА), ультразвуковых наконечников из ПЭЭК и обеззараживания поверхности имплантатов на титановых кюретках, а также оценка их влияния на шероховатость поверхности имплантата с помощью СЭМ-анализа.
Access restricted. Please log in or start a trial to view this content.
протокол
Протокол исследования был одобрен этическим комитетом (TBAEK-363) Университета Акдениз, Анталия, Турция. Это исследование было поддержано Исследовательским фондом Университета Акдениз (номер проекта: TDH-2024-6676). В исследовании использовался винтовой зубной имплантат (PrimeTaper EV Implant) размером 4,2 мм x 11 мм, с микрорезьбой размером 1,7 мм на воротнике. Подготовка поверхности с помощью пескоструйной обработки и кислотного травления разбавленной фтористоводородной кислотой для получения четко выраженной поверхности OsseoSpeed.
1. Подготовка экспериментальных моделей периимплантита
ПРИМЕЧАНИЕ: Три метода механической обработки обеззараживания (воздушный абразив (АА), полиэфирэфиркетон (ПЭЭК), ультразвуковые и титановые кюретки; Таблица материалов) при двух различных типах периимплантита были проанализированы дефекты11 (класс 1А и класс 1В). Таким образом, было выделено шесть экспериментальных групп (рис. 1). Всего было использовано 62 имплантата, в том числе один положительный и один отрицательный контрольный имплантат. Этот дизайн исследования in vitro, первоначально разработанный Sharhmann et al.16, был модифицирован различными исследователями 12,13,14,15,16,17,18 в литературе (Рисунок 2). Предполагая 10% разницу в эффективности удаления биопленки между группами, размер выборки был определен как 60 (10 для каждой группы) для шести групп с G*мощностью, величиной эффекта 0,50, ошибкой I типа 5% и мощностью 80%.
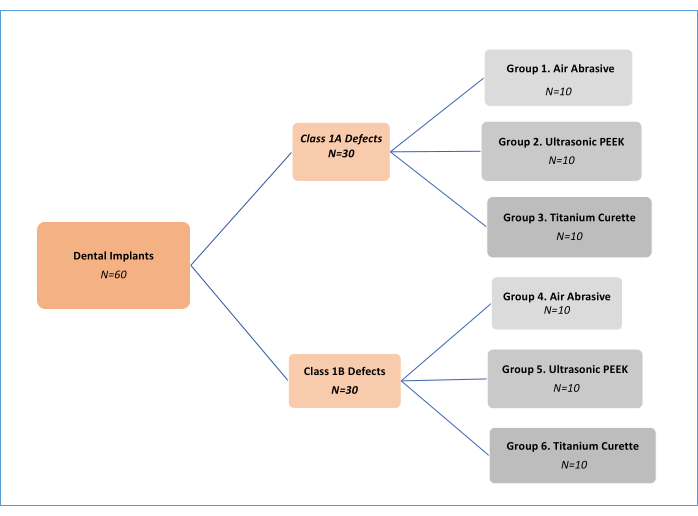
Рисунок 1: Блок-схема экспериментальных групп. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Удалите один первый моляр из образовательной фантомной модели нижней челюсти. Пластиковые зубья фиксируются на этой фантомной модели винтами. Открутите первый коренной зуб и снимите резьбу с лунки. Заполните лунку, отлив мягкий силиконовый материал, чтобы покрыть лунку, чтобы создать плоский альвеолярный гребень.
ПРИМЕЧАНИЕ: Была создана симуляция имплантата, установленного в беззубой области. - Отсканируйте подготовленную модель в лабораторном сканере для создания цифрового дизайна.
- Создавайте 3D костные дефекты периимплантита класса1A и класса 1B 11 в цифровом виде. Откройте программу Exocad. Загрузите отсканированный файл модели. Затем нажмите «Дизайн» и выберите «Экспертный режим». Удалите неровные участки с помощью опции «Редактировать сетку». Затем щелкните правой кнопкой мыши и выберите «Сохранить скан как файл» в соответствующей папке на компьютере.
- Выберите «Инструменты» > опцию «Добавить/удалить сетку », выберите «Сканирование воска> «Загрузить файл» и выберите файл, только что сохраненный в папке. После этого нажмите «Режим мастера » справа.
- В полученной новой модели STL создайте симуляцию дефекта в лунке зуба. Для этого нажмите « Добавить/Удалить » слева. Выберите Размер кисти овальной формы. После этого создайте дефект на модели, одновременно используя Shift и щелчок левой кнопкой мыши. Отрегулируйте длину дефекта как 5 мм и ширину как 4,2 мм (что соответствует диаметру имплантата) на щечной поверхности имплантата для дефектов класса 1А и 5-5-5 мм для дефектов класса 1В.
- Чтобы сузить горизонтальную ширину дефекта, выберите бугорки , нажав на «Анатомия » слева и сузив вестибулярную ширину дефекта внутрь. Затем щелкните правой кнопкой мыши и сохраните сцену в виде файла.
- Чтобы создать окончательную модель, перезапустите программу и перезагрузите сохраненную папку. Затем выберите опцию «Режим мастера » и « Выравнивание модели » справа. Выберите тип модели как Digital Waxup Model слева. Нажмите кнопку «Далее» несколько раз, пока не дойдете до раздела дизайна модели слева. Выберите опцию «Полная модель» и нажмите «Далее » два раза. Когда файл модели будет готов, откройте его с помощью Проводника, и он будет готов к печати.
- Передайте STL-файлы спроектированной модели на 3D-принтер. Распечатайте созданные цифровые модели с помощью модельной смолы.
- Промойте опытные модели в 96% этаноле в течение 5-10 минут. После процесса очистки поместите модели в светоизлучающее устройство отверждения и отверждайте светом в течение 5 минут при установленной дозе в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: Используйте модель из смолы с высокой прочностью на растяжение, изгиб и сжатие, которая подходит для сверления имплантатов. Очистите напечатанную модель растворами на спиртовой основе в соответствии с инструкциями производителя и убедитесь, что она достаточно отверждается.
2. Окрашивание имплантатов
- Погрузите тестовые имплантаты в вязкие водостойкие красные чернила. Убедитесь, что все участки поверхности имплантата полностью и равномерно покрыты чернилами в течение 15 секунд. Извлеките имплантаты из стерильного контейнера с помощью наконечников водителя или оттискных штифтов без контакта с руками.
ПРИМЕЧАНИЕ: Это окрашивание будет имитировать оптически видимый суррогат биопленки для фотографического анализа. - Высушите окрашенные имплантаты на воздухе с помощью воздушного шприца стоматологической установки, чтобы получить равномерное рассеивание чернил. Высушите окрашенные имплантаты в течение 24 часов при комнатной температуре. Сушите имплантаты изолированно с помощью наконечников, без контакта с руками.
3. Установка окрашенных имплантатов
- Отрегулируйте настройки стоматологического физиодозатора следующим образом: 800 об/мин, крутящий момент 40 Н без орошения солевым раствором.
- Создание лунки имплантата с помощью хирургических сверл для имплантатов на экспериментальных моделях для установки имплантатов длиной 11 мм и шириной 4,2 мм. Подготовьте одну и ту же лунку имплантата для моделей с обоими типами дефектов (модели с дефектами класса 1А и 1В).
- Используйте сверла для имплантатов последовательно в соответствии с инструкциями производителя для достижения первичной стабильности. Очистите оставшийся мусор после сверления с помощью воздушно-водяного шприца, затем установите имплантаты. Стабилизируйте экспериментальные модели периимплантита на рабочей площадке с помощью зажима, чтобы избежать микросмещения имплантатов и предотвратить появление микротрещин на моделях.
- Вставьте имплантаты с помощью несущего наконечника в лунки. Оставьте на щечной поверхности 5 мм открытого участка. Убедитесь, что имплантаты погружены в воду на одном уровне на язычном костном гребне модели. Избегайте прикосновения к испачканной поверхности имплантата.
4. Обеззараживание имплантатов
- Начинайте обеззараживать имплантаты группами без их удаления с экспериментальных моделей дефектов 1А и 1В.
- Система воздушного абразива: Установите устройство на полную мощность с водяным орошением порошком эритритола 14 мкм. Удерживайте наконечник устройства на расстоянии 2-3 мм от поверхности имплантата и равномерно нанесите порошок на обнаженный дефект периимплантита. Ограничьте время работы до 2 минут для дефектов 1А и 3 минут для дефектов 1В.
- Ультразвуковой наконечник из полиэфирэфиркетона (PEEK): установите устройство на мощность 8 (80%) с максимальным водяным орошением. Держите наконечник PEEK способом, подходящим для использования под ультразвуком. Проводите обеззараживание поверхности имплантата линейными и параллельными движениями. Нанесите наконечник PEEK между нитями настолько, насколько позволяет его конструкция. Ограничьте время работы до 2 минут для дефектов 1А и 3 минут для дефектов 1В.
- Титановые кюретки: Прикладывайте последовательные контакты с постоянным давлением под углом 60°-90° к поверхности имплантата с усилием около 0,75 Н на открытой поверхности имплантата диаметром 5 мм в течение 2 минут для дефектов 1А и 3 минут для дефектов 1В.
- После обеззараживания извлеките имплантат с помощью драйвера без контакта с рукой. Если модели деформируются после дезактивации, переходите к резервным моделям. Стабилизируйте экспериментальные модели периимплантита на рабочей площадке с помощью зажима.
ПРИМЕЧАНИЕ: Все методы должны быть откалиброваны и применены одним исследователем.
5. Фотографическая визуализация
- Извлеките имплантаты из модели с помощью совместимой части имплантатоводителя. Высушите имплантаты на воздухе в течение 20 секунд, чтобы удалить любые разрыхлившиеся частицы/остатки на поверхности.
- Установите имплантаты на специально разработанные акриловые фотографические модели, чтобы снять плоские виды, апикальные виды на 30° и корональные виды на 30°, чтобы оценить апикальную и корональную части резьбы на поверхности имплантата.
- Установите камеру на штатив и стандартизируйте настройки камеры (расстояние 15 см, ISO 160, диафрагма f/16, время экспозиции 1/250 с). Убедитесь, что помещение достаточно освещено. Необходимо стабилизировать камеру штативом.
- Делайте цифровые фотографии в формате RAW со вспышкой. Получите в общей сложности 90 буккальных фотографий (одну плоскую, одну 30° апикальную и одну 30° корональной для каждой поверхности имплантата) для дефектов класса 1A и 270 фотографий (плоскую, 30° апикальную и 30° корональную с каждой щечной, мезиальной и дистальной поверхности для каждого имплантата) для дефектов класса 1B. Поместите все цифровые фотофайлы на жесткий диск для дальнейшего анализа изображений.
6. Анализ изображений
- Выполняйте весь анализ в программном обеспечении для обработки цифровых изображений (ImageJ). Перед анализом сделайте фон фотографий черным с помощью программы Photoshop (Photoroom), чтобы убедиться, что на изображении виден только имплантат. Откройте приложение и добавьте каждое изображение из галереи. Удалите фон с изображения и выберите «Черный фон » из предложенных вариантов.
- Перетащите изображение на ImageJ. Нарисуйте квадрат на изображении, чтобы покрыть 5 мм коронально к имплантату. Затем нажмите «Изображение» > «Обрезать » для стандартизации. Повторите тот же процесс для каждого изображения.
- Преобразуйте изображения в 8-битный формат, нажав Изображение ˃ Тип ˃ 8-бит , и настройте пороговые значения, нажав Изображение ˃ Настроить ˃ Порог для вычисления площади.
- Рассчитайте всю площадь поверхности имплантата и остаточную площадь красного цвета, нажав кнопку «Анализ» («Измерить») («Измерить площадь»).
- Запишите полученную площадь в пикселях в файл таблицы. Создайте отдельный файл электронной таблицы для записи необработанных данных изображения.
- Чтобы получить процентное содержание остатков красного цвета, умножьте отображаемую красным область на 100 и разделите на общую площадь поверхности имплантата.
7. Анализ SEM
- Храните все имплантаты в стерильных коробках до дня анализа.
- Перед анализом СЭМ случайным образом выберите одну репрезентативную выборку из каждой группы лечения. В дополнение к образцам, отобранным из каждой группы, добавьте по одному стерильному имплантату и только имплантат, полностью покрытый чернилами. Таким образом, подготовьте в общей сложности восемь образцов имплантатов для анализа СЭМ.
- Распылите газообразный азот с помощью газового пистолета в течение 20 с, чтобы удалить любой микропорошок с поверхности имплантата перед анализом СЭМ.
ПРИМЕЧАНИЕ: Дополнительное золотое покрытие не было нанесено благодаря передовым технологиям устройства. - Установите каждый имплантат на заглушки SEM с проводящими углеродными адгезивными дисками таким образом, чтобы можно было анализировать плоскую поверхность щек без ручной дезинфикации. Расположите их по номерам, чтобы избежать путаницы в группах.
- Выберите область из имплантатов, установленных в инструменте, и сделайте снимки с разным увеличением. Повторите ту же процедуру для разных областей поверхности имплантата (мезиальной или дистальной). Используйте 100-кратное, 1000-кратное и 5000-кратное увеличение для получения изображений с помощью устройства СЭМ, работающего на напряжении 10-30 кВ со средним рабочим расстоянием 12 мм.
ПРИМЕЧАНИЕ: Для каждого имплантата были выбраны вторая микроцепь из области воротника и вторая макроцепь из тела, чтобы обеспечить стандартизацию во время анализа СЭМ. Для некоторых изображений рекомендуется выполнять элементный анализ (EDS) во время визуализации для сравнения.

Рисунок 2: Блок-схема исследования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
8. Статистический анализ
- Выражайте категориальные переменные в виде чисел и процентов, а непрерывные переменные — в виде среднего и стандартного отклонения. Подтвердите нормальность распределения для непрерывных переменных с помощью теста Шапиро-Уилка.
- Для сравнения непрерывных переменных между группами дефектов используйте t-критерий Стьюдента. Для сравнения более двух групп используйте однофакторный ANOVA или тест Краскала-Уоллиса в зависимости от того, сбылись статистические гипотезы или нет.
- Для нормально распределенных данных, касающихся однородности дисперсий, используйте тесты Тьюки для множественных сравнений групп. Для ненормально распределенных данных используйте U-критерий Манна-Уитни с поправкой на Бонферрони для многократного сравнения групп. Все статистические анализы проводились с использованием IBM SPSS 20. Статистический уровень значимости для всех тестов был принят на уровне 0,05.
Access restricted. Please log in or start a trial to view this content.
Результаты
Описанный здесь экспериментальный протокол анализа обеззараживания поверхностей имплантатов выявил значительные различия между различными процедурами лечения. Кроме того, протокол СЭМ после лечения также показал значительные изменения на поверхностях имплантат?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Методология анализа поверхности in vitro зубных имплантатов, пораженных периимплантатным заболеванием, всегда была сложной из-за воспалительной и бактериальной природы патогенных механизмов, происходящих на шероховатых поверхностях имплантата. Некоторые из них ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Имплантаты, использованные в исследовании, поддерживались компанией Dentsply Sirona.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
Ссылки
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779(2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295(2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены