É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Efeitos dos métodos mecânicos usados no tratamento da peri-implantite na descontaminação e rugosidade da superfície do implante
Neste Artigo
Resumo
O presente protocolo descreve um modelo experimental baseado em coloração de tinta que pode ser usado para descontaminação in vitro da superfície do implante e pesquisa de rugosidade para contribuir com a tomada de decisão clínica.
Resumo
Vários métodos mecânicos foram propostos para descontaminar superfícies de implantes dentários com sucesso variável. Este estudo in vitro avaliou a eficiência de descontaminação de um sistema de abrasão a ar (AA) com pó de eritritol, ponta ultrassônica de poliéter-éter-cetona (PEEK) e curetas de titânio (TIT) e seus efeitos na topografia da superfície do implante usando microscopia eletrônica de varredura (MEV). Um total de 60 implantes foram corados com tinta vermelha permanente e colocados em defeitos de peri-implantite Classe 1A e Classe 1B impressos em 3D, formando seis grupos (n=10 por grupo) com base no tipo de defeito e protocolo de tratamento. Além disso, foi utilizado um implante controle positivo e um negativo. Eritritol em pó, pontas ultrassônicas PEEK e curetas de titânio foram aplicados por 2 min em defeitos de Classe 1A e 3 minutos em defeitos de Classe 1B. As áreas residuais de tinta vermelha foram quantificadas com software digital e as alterações na superfície do implante foram analisadas usando SEM e EDS. Nenhum dos métodos alcançou a descontaminação completa. No entanto, o eritritol em pó foi significativamente o mais eficaz, deixando uma taxa de tinta residual de 24% ± 6% (p < 0,001). As pontas ultrassônicas PEEK resultaram em 41% ± 4% de tinta residual, enquanto as curetas de titânio deixaram 55% ± 3%. Diferenças significativas foram observadas entre todos os métodos. Nenhuma diferença significativa na eficácia da descontaminação foi encontrada entre os defeitos de Classe 1A e Classe 1B. A análise de MEV mostrou danos superficiais mínimos com pó de eritritol e pontas de PEEK, enquanto as curetas de titânio causaram danos moderados a graves. Com base na eficiência da descontaminação e na preservação da superfície, o pó de eritritol e as pontas de PEEK são opções seguras e eficazes para o tratamento da peri-implantite, enquanto as curetas de titânio são menos eficazes e causam danos consideráveis à superfície. Esses achados podem ajudar os médicos no planejamento do tratamento da peri-implantite.
Introdução
O tratamento com implantes dentários é o protocolo mais comum e preferido para a substituição de dentes perdidos em todo o mundo. Estudos de acompanhamento a longo prazo mostraram que o uso de restaurações implantossuportadas no tratamento do edentulismo completo ou parcial fornece resultados previsíveis e altas taxas de sucesso em termos de sobrevida. No entanto, várias complicações que afetam os tecidos duros e moles podem surgir após a colocação cirúrgica e restauração dos implantes1. Em 2017, o Workshop Mundial sobre a Classificação de Doenças e Condições Periodontais e Peri-implantares introduziu definições e diagnósticos diferenciais para doenças que afetam os tecidos peri-implantares2. De acordo com essa definição, a peri-implantite é uma condição patológica irreversível caracterizada por sinais clínicos de inflamação, incluindo sangramento à sondagem e/ou supuração, aumento da profundidade de sondagem e/ou recessão da margem mucosa na mucosa peri-implantar e perda radiográfica do osso de suporte2. A etiologia das doenças peri-implantares é multifatorial, e alguns indivíduos são mais suscetíveis a essa condição do que outros. Predisposições específicas dos indivíduos podem aumentar o risco de desenvolvimento de doença peri-implantar, o que pode levar à perda do implante. Outros fatores que desempenham um papel na etiologia das doenças peri-implantares são fatores relacionados ao paciente (tabagismo, doenças sistêmicas, história de doença periodontal, higiene bucal); a condição da mucosa queratinizada, quantidade e qualidade do osso e tecidos moles no local do implante; forças sobre o implante e os tecidos circundantes; complicações encontradas durante a colocação do implante; e a experiência e habilidade do médico que realiza tratamentos cirúrgicos e protéticos2. Além disso, um novo conceito de avaliação de risco e tratamento foi introduzido recentemente, a Ferramenta de Avaliação de Risco de Doença de Implante (IDRA)3. Essa ferramenta foi desenvolvida como um diagrama funcional composto por oito parâmetros, cada um com uma associação documentada com peri-implantite. Os vetores do octógono são a história de periodontite, porcentagem de implantes e locais dentários com sangramento à sondagem (BoP), número de dentes/implantes com profundidades de bolsa de sondagem ≥ 5 mm, taxa de perda óssea periodontal (radiografias em relação à idade do paciente), suscetibilidade à periodontite, frequência de terapia periodontal de suporte (SPT) e desenho da prótese.
Revisões sistemáticas recentes mostraram que a prevalência de peri-implantite é de 19,53% no nível do paciente e 12,53% no nível do implante3. Em relação a aproximadamente mais de 5 milhões de implantes colocados a cada ano em todo o mundo, com um tamanho de mercado de mais de 4 bilhões de dólares, a peri-implantite representa um grande problema de saúde para a população. Se não for tratada, a peri-implantite resulta na perda do implante afetado e da prótese implanto-suportada, causando um grande sofrimento tanto para o dentista quanto para o paciente.
O tratamento das doenças peri-implantares pode ser dividido em abordagens não cirúrgicas e cirúrgicas. Embora haja uma expectativa razoável para o sucesso dos desfechos no tratamento da periodontite4, evidências comparáveis para o tratamento da peri-implantite ainda são escassas. Portanto, a justificativa para uma abordagem em estágios e terapia não cirúrgica da peri-implantite é tentar o controle do biofilme e da inflamação com abordagens relativamente simples antes de aumentar a invasividade do tratamento e realizar a etapa cirúrgica quando um melhor controle do biofilme e dos fatores de risco for alcançado. Isso inclui instruções e motivação de OH, controle de fatores de risco, controle de fatores de retenção de biofilme e limpeza/remoção/modificação da prótese, incluindo avaliação dos componentes da prótese, instrumentação supramarginal e submarginal e tratamento periodontal concomitante quando necessário. Assim, a terapia não cirúrgica deve ser sempre o primeiro passo5. Para peri-implantite precoce, a redução dos fatores de risco e o tratamento não cirúrgico podem ser suficientes, mas a remoção completa do biofilme em bolsas profundas após a perda óssea costuma ser um desafio. Durante a fase de reavaliação após o tratamento não cirúrgico, profundidades persistentes da bolsa (≥ 6 mm) e sangramento à sondagem (BoP) indicam potencial progressão da peri-implantite. Se esses sinais estiverem presentes, intervenções cirúrgicas são recomendadas6. A terapia cirúrgica da peri-implantite inclui (i) desbridamento de retalho aberto, (ii) cirurgia de retalho ressectivo, (iii) o manejo de defeitos ósseos peri-implantares usando abordagens reconstrutivas, (iv) métodos adicionais para descontaminação da superfície do implante e (v) uso adjuvante de antibióticos locais/sistêmicos7.
O principal fator etiológico da peri-implantite é o biofilme patogênico colonizado na superfície do implante6. A remoção desse biofilme é o principal princípio e objetivo de todos os protocolos de tratamento, que envolvem métodos mecânicos, químicos e de descontaminação a laser7.
O desbridamento mecânico emprega curetas de plástico, carbono e titânio, dispositivos ultrassônicos com pontas de plástico e metal, escovas de titânio e sistemas abrasivos ao ar (AA) com vários pós. Embora a eliminação completa do biofilme seja difícil de alcançar, essas terapias fornecem benefícios clínicos. Várias intervenções clínicas, incluindo protocolos de desbridamento mecânico com ou sem antissépticos8, antibióticos9, bem como cirurgia ressectiva e regenerativa10, têm sido utilizadas com graus variados de sucesso clínico. No entanto, eles também induzem alterações nas propriedades químicas e físicas da superfície do implante, possivelmente complicando a formação de novo osso e a re-osseointegração.
Dentre os métodos mecânicos, os procedimentos de AA utilizando diferentes composições de pó têm mostrado a melhor eficácia de limpeza 11,12,13. No entanto, a presença de partículas residuais pode alterar a topografia da superfície e reduzir a biocompatibilidade14. A glicina, seguida pelo bicarbonato de sódio, é o pó mais utilizado nos sistemas AA8. Recentemente, partículas abrasivas menores do ar, como o eritritol (14 μm), ganharam interesse pela descontaminação eficaz com danos superficiais reduzidos9. As curetas de titânio e plástico, que causam menos danos superficiais do que as pontas de aço, são eficazes na descontaminação do biofilme15. As pontas ultrassônicas do raspador feitas de poli-éter-éter-cetona (PEEK) também reduzem a carga bacteriana com danos mínimos à superfície10. Os métodos de descontaminação devem considerar a alta rugosidade das superfícies dos implantes e ter como objetivo remover o biofilme bacteriano sem causar danos significativos à superfície. Embora extensas pesquisas in vitro, in vivo e clínicas tenham sido realizadas, ainda não há consenso e um protocolo padrão-ouro para o tratamento da peri-implantite até o momento. A crescente prevalência de doenças peri-implantares devido a numerosos implantes dentários requer uma abordagem previsível e baseada em evidências para o tratamento de superfícies contaminadas. Este estudo tem como objetivo avaliar a eficácia de diferentes métodos de descontaminação - sistemas abrasivos ao ar (AA), pontas ultrassônicas PEEK e curetas de titânio - na descontaminação da superfície do implante e avaliar seu impacto na rugosidade da superfície do implante por meio da análise de MEV.
Protocolo
O protocolo do estudo foi aprovado pelo comitê de ética (TBAEK-363) da Universidade de Akdeniz, Antalya, Turquia. Este estudo foi apoiado pelo Fundo de Pesquisa da Universidade Akdeniz (número do projeto: TDH-2024-6676). O estudo utilizou um implante dentário em forma de parafuso (PrimeTaper EV Implant) com dimensões de 4,2 mm x 11 mm, apresentando um design de micro-rosca medindo 1,7 mm no colar. Preparação da superfície com jateamento e condicionamento ácido com ácido fluorídrico diluído para obter a superfície OsseoSpeed bem definida.
1. Preparação de modelos experimentais de peri-implantite
NOTA: Três métodos de tratamento mecânico de descontaminação (abrasivo ao ar (AA), polieteretercetona (PEEK) ultrassônico e curetas de titânio; Tabela de Materiais) em dois diferentes tipos de defeitos de peri-implantite,foram analisados 11 (Classe 1A e Classe 1B). Assim, foram realizados seis grupos experimentais (Figura 1). Foram utilizados 62 implantes, incluindo um controle positivo e um negativo. Este desenho de estudo in vitro, inicialmente desenvolvido por Sharhmann et al.16, foi modificado por vários pesquisadores 12,13,14,15,16,17,18 na literatura (Figura 2). Assumindo uma diferença de 10% na eficácia de remoção de biofilme entre os grupos, o tamanho da amostra foi determinado como 60 (10 para cada grupo) para seis grupos com G*power, um tamanho de efeito de 0,50, um erro tipo I de 5% e 80% de poder.
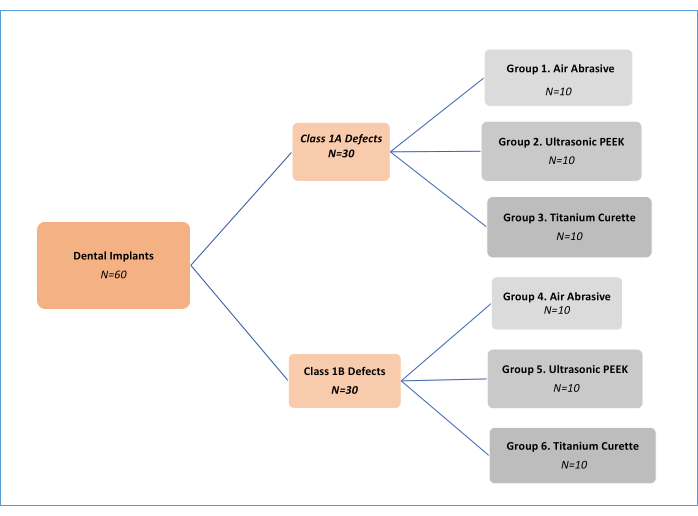
Figura 1: Fluxograma dos grupos experimentais. Clique aqui para ver uma versão maior desta figura.
- Remova um primeiro molar do modelo de simulador mandibular educacional. Os dentes de plástico são fixados a este modelo fantasma com parafusos. Desaparafuse o primeiro dente molar e remova a rosca do encaixe. Encha o soquete moldando o material de silicone macio para cobrir o soquete para criar uma crista alveolar plana.
NOTA: Foi criada uma simulação de um implante colocado em uma área edêntula. - Digitalize o modelo preparado em um scanner de laboratório para criar um design digital.
- Crie defeitos ósseos 3D Classe 1A e Classe1B 11 peri-implantite digitalmente. Abra o programa de software Exocad. Carregue o arquivo de modelo digitalizado. Em seguida, clique em Design e selecione Modo Especialista. Remova áreas irregulares com a opção Editar malha. Em seguida, clique com o botão direito do mouse e selecione Salvar digitalização como um arquivo na pasta relacionada no computador.
- Selecione Ferramentas > opção Adicionar/Remover Malha , selecione Digitalização de Cera> Carregar Arquivo e selecione o arquivo que acabou de ser salvo na pasta. Depois disso, clique em Modo Assistente à direita.
- No novo modelo STL resultante, crie uma simulação de defeito no alvéolo dentário. Para fazer isso, clique em Adicionar/Remover no lado esquerdo. Selecione o tamanho do pincel de forma oval. Depois, crie o defeito no modelo usando shift e clique com o botão esquerdo ao mesmo tempo. Ajuste o comprimento do defeito como 5 mm e a largura como 4,2 mm (correspondendo ao diâmetro do implante) na superfície vestibular do implante para os defeitos de Classe 1A e 5-5-5 mm para os defeitos de Classe 1B.
- Para estreitar a largura horizontal do defeito, selecione as Cúspides clicando em Anatomia no lado esquerdo e estreitando a largura vestibular do defeito para dentro. Em seguida, clique com o botão direito do mouse e salve a cena como um arquivo.
- Para criar um modelo final, reinicie o programa e recarregue a pasta salva. Em seguida, selecione a opção Modo do assistente e alinhamento do modelo à direita. Selecione o tipo de modelo como Modelo de enceramento digital à esquerda. Clique em Avançar várias vezes até chegar à seção de design do modelo à esquerda. Selecione a opção Modelo completo e clique em Avançar duas vezes. Quando o arquivo de modelo estiver concluído, abra-o com o Explorer e ele estará pronto para imprimir.
- Encaminhe os arquivos STL do modelo projetado para a impressora 3D. Imprima os modelos digitais criados usando uma resina de modelo.
- Enxágue os modelos experimentais em etanol a 96% por 5-10 min. Após o processo de limpeza, coloque os modelos no dispositivo de fotopolimerização emissor de luz e catalise com luz durante 5 min na dose de acordo com as instruções do fabricante.
NOTA: Use um modelo de resina com alta resistência à tração, flexão e compressão que seja adequado para perfuração de implantes. Limpe o modelo impresso com soluções à base de álcool de acordo com as instruções do fabricante e certifique-se de que esteja adequadamente fotopolimerizado.
2. Coloração de implantes
- Mergulhe os implantes de teste em tinta vermelha viscosa e resistente à água. Certifique-se de que todas as partes da superfície do implante estejam completa e homogeneamente cobertas com tinta por 15 s. Remova os implantes do recipiente estéril usando peças de mão ou postes de impressão sem contato com as mãos.
NOTA: Esta coloração simulará um substituto de biofilme opticamente visível para a análise fotográfica. - Seque ao ar os implantes manchados com uma seringa de ar da unidade odontológica para obter uma dispersão uniforme da tinta. Seque os implantes manchados por mais 24 h em temperatura ambiente. Seque os implantes isoladamente com as peças de mão, sem contato com as mãos.
3. Colocação de implantes manchados
- Ajuste as configurações de um dispensador de fisioterapia odontológica da seguinte forma: 800 rpm, torque de 40 N sem irrigação salina.
- Crie o encaixe do implante com as brocas cirúrgicas sobre implantes nos modelos experimentais para colocar os implantes de 11 mm de comprimento e 4,2 mm de largura. Prepare o mesmo encaixe de implante para modelos com ambos os tipos de defeitos (modelos de defeitos Classe 1A e 1B).
- Use as brocas de implante sequencialmente de acordo com as instruções do fabricante para obter estabilidade primária. Limpe os detritos restantes após a perfuração com uma seringa ar-água e coloque os implantes. Estabilize os modelos experimentais de peri-implantite na plataforma de trabalho com uma pinça para evitar o micromovimento dos implantes e evitar microfissuras nos modelos.
- Insira os implantes com uma peça de mão transportadora nos alvéolos. Deixe 5 mm de área exposta na superfície vestibular. Certifique-se de que os implantes estejam submersos no mesmo nível na crista óssea lingual do modelo. Evite tocar na superfície manchada do implante.
4. Descontaminação de implantes
- Comece a descontaminar os implantes em grupos sem removê-los dos modelos experimentais de defeitos 1A e 1B.
- Sistema abrasivo de ar: Coloque o dispositivo na potência máxima com irrigação por água com pó de eritritol de 14 μm. Segure a ponta do dispositivo a 2-3 mm da superfície do implante e aplique o pó uniformemente no defeito de peri-implantite exposto. Limite o tempo de trabalho a 2 min para defeitos 1A e 3 min para defeitos 1B.
- Ponta ultrassônica de polieteretercetona (PEEK): Defina o dispositivo em 8 potências (80%) com irrigação máxima com água. Segure a peça de mão PEEK de maneira adequada para uso ultrassônico. Realize a descontaminação na superfície do implante com movimentos lineares e paralelos. Aplique a ponta PEEK entre as roscas o quanto seu design permitir. Limite o tempo de trabalho a 2 min para defeitos 1A e 3 min para defeitos 1B.
- Curetas de titânio: Aplique contatos consecutivos com pressão constante a 60°-90° na superfície do implante com uma força aproximada de 0,75 N na superfície exposta do implante de 5 mm por 2 min para defeitos 1A e 3 min para defeitos 1B.
- Após a descontaminação, remova o implante usando a peça de acionamento sem contato com as mãos. Se os modelos ficarem deformados após a descontaminação, prossiga para os modelos de backup. Estabilize os modelos experimentais de peri-implantite na plataforma de trabalho com uma pinça.
NOTA: Todos os métodos devem ser calibrados e aplicados por um único pesquisador.
5. Imagem fotográfica
- Remova os implantes do modelo com uma peça de acionamento de implante compatível. Seque os implantes ao ar por 20 s para remover quaisquer partículas/restos soltos na superfície.
- Coloque os implantes em modelos fotográficos de acrílico personalizados para fotografar vistas planas, vistas apicais de 30° e vistas coronais de 30° para avaliar as partes apicais e coronais das roscas na superfície do implante.
- Coloque a câmera em um tripé e padronize as configurações da câmera (distância 15 cm, ISO 160, abertura f/16, tempo de exposição 1/250 seg.). Certifique-se de que a sala esteja adequadamente iluminada. É necessário estabilizar a câmera com um tripé.
- Tire as fotos digitais em formato RAW com flash. Obtenha um total de 90 fotos vestibulares (uma plana, uma apical de 30° e uma de 30° coronal para cada superfície do implante) para defeitos de Classe 1A e 270 fotos (plana, 30° apical e 30° coronal de cada superfície vestibular, mesial e distal para cada implante) para defeitos de Classe 1B. Deposite todos os arquivos de fotos digitais em um disco rígido para análise posterior da imagem.
6. Análise de imagem
- Realize todas as análises em software de imagem digital (ImageJ). Antes da análise, deixe o fundo das fotografias preto usando um programa Photoshop (Photoroom) para garantir que apenas o implante seja visível na imagem. Abra o aplicativo e adicione cada imagem da galeria. Remova o fundo da imagem e selecione Fundo preto nas opções.
- Arraste e solte a imagem no ImageJ. Desenhe um quadrado na imagem para cobrir 5 mm coronal ao implante. Em seguida, clique em Recorte de imagem > para padronização. Repita o mesmo processo para cada imagem.
- Converta as imagens para o formato de 8 bits clicando em Imagem > Tipo > 8 bits e ajuste os limites clicando em Imagem > Ajustar > Limite para cálculos de área.
- Calcule toda a área da superfície do implante e a área de resíduo de cor vermelha clicando em Analisar > Medir > Área.
- Registre a área de pixels obtida em um arquivo de planilha. Crie um arquivo de planilha separado para registrar os dados brutos da imagem.
- Para obter a porcentagem de remanescentes de cor vermelha, multiplique a área exibida em vermelho por 100 e divida pela área total da superfície do implante.
7. Análise de MEV
- Armazene todos os implantes em suas caixas estéreis até o dia da análise.
- Antes da análise de MEV, selecione aleatoriamente uma amostra representativa de cada grupo de tratamento. Além das amostras selecionadas de cada grupo, adicione um implante estéril e apenas o implante completamente coberto com tinta. Assim, prepare um total de oito amostras de implantes para análise de MEV.
- Pulverize gás nitrogênio usando uma pistola de gás por 20 s para remover qualquer micropó da superfície do implante antes da análise de MEV.
NOTA: Nenhum revestimento de ouro adicional foi aplicado devido à tecnologia avançada do dispositivo. - Monte cada implante em pontas de MEV com discos adesivos de carbono condutores de forma a permitir a análise da superfície plana vestibular sem descontaminação manual. Organize-os em ordem por número para evitar confusão dos grupos.
- Selecione uma área dos implantes colocados no instrumento e capture imagens em diferentes ampliações. Repita o mesmo procedimento para diferentes regiões das superfícies do implante (mesial ou distal). Use ampliação de 100x, 1000x e 5000x para imagens usando um dispositivo SEM operando a 10-30 kV com uma distância média de trabalho de 12 mm.
NOTA: A segunda microfita da área do colar e a segunda macrofita do corpo foram selecionadas para cada implante para garantir a padronização durante a análise de MEV. Para algumas imagens, recomenda-se realizar análise elementar (EDS) durante a imagem para comparação.

Figura 2: Fluxograma do estudo. Clique aqui para ver uma versão maior desta figura.
8. Análise estatística
- Expresse variáveis categóricas como números e porcentagens e variáveis contínuas como média e desvio padrão. Confirme a normalidade da distribuição para variáveis contínuas com o teste de Shapiro-Wilk.
- Para comparação de variáveis contínuas entre grupos de defeitos, use o teste t de Student. Para comparação de mais de dois grupos, use ANOVA de uma via ou teste de Kruskal Wallis, dependendo se as hipóteses estatísticas foram cumpridas ou não.
- Para dados com distribuição normal, em relação à homogeneidade das variâncias, utilizar os testes de Tukey para comparações múltiplas de grupos. Para dados com distribuição não normal, use o teste U de Mann-Whitney ajustado por Bonferroni para comparações múltiplas de grupos. Todas as análises estatísticas foram realizadas usando o IBM SPSS 20. O nível de significância estatística para todos os testes foi considerado de 0,05.
Resultados
O protocolo experimental aqui descrito para análise da descontaminação das superfícies dos implantes revelou diferenças significativas entre os vários procedimentos de tratamento. Além disso, o protocolo de MEV pós-tratamento também mostrou alterações significativas nas superfícies dos implantes com graus variados entre os grupos de estudo.
Comparações no nível do implante (médias totais do implante) após a descontaminação
Discussão
A metodologia de análise de superfície in vitro de implantes dentários afetados por doença peri-implantar sempre foi desafiadora devido à natureza inflamatória e bacteriana dos mecanismos patogênicos que ocorrem nas superfícies rugosas do implante. Várias preocupações incluem a escolha do material da amostra, imitação do biofilme na superfície, escolha do tipo de defeito peri-implantite, representação das condições clínicas durante os procedimentos in vitro, v...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Os implantes utilizados no estudo foram suportados pela Dentsply Sirona.
Materiais
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
Referências
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779 (2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295 (2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados