È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Effetti dei metodi meccanici utilizzati nel trattamento della perimplantite sulla decontaminazione e rugosità della superficie dell'impianto
In questo articolo
Riepilogo
Il presente protocollo descrive un modello sperimentale basato sulla colorazione con inchiostro che può essere utilizzato per la decontaminazione della superficie implantare in vitro e la ricerca sulla rugosità per contribuire al processo decisionale clinico.
Abstract
Sono stati proposti vari metodi meccanici per decontaminare le superfici degli impianti dentali con successo variabile. Questo studio in vitro ha valutato l'efficienza di decontaminazione di un sistema di abrasione dell'aria (AA) con polvere di eritritolo, una punta a ultrasuoni in polietere-etere-chetone (PEEK) e curette in titanio (TIT) e i loro effetti sulla topografia della superficie dell'impianto utilizzando la microscopia elettronica a scansione (SEM). Un totale di 60 impianti sono stati colorati con inchiostro rosso permanente e inseriti in difetti di perimplantite di Classe 1A e Classe 1B stampati in 3D, formando sei gruppi (n=10 per gruppo) in base al tipo di difetto e al protocollo di trattamento. Inoltre, è stato utilizzato un impianto di controllo positivo e uno negativo. La polvere di eritritolo, le punte a ultrasuoni in PEEK e le curette in titanio sono state applicate per 2 minuti nei difetti di Classe 1A e 3 minuti nei difetti di Classe 1B. Le aree residue dell'inchiostro rosso sono state quantificate con un software digitale e le modifiche della superficie dell'impianto sono state analizzate utilizzando SEM e EDS. Nessuno dei metodi ha raggiunto la completa decontaminazione. Tuttavia, la polvere di eritritolo era significativamente la più efficace, lasciando un tasso di inchiostro residuo del 24% ± del 6% (p < 0,001). Le punte a ultrasuoni in PEEK hanno prodotto il 41% ± il 4% di inchiostro residuo, mentre le curette in titanio hanno lasciato il 55% ± il 3%. Sono state osservate differenze significative tra tutti i metodi. Non è stata riscontrata alcuna differenza significativa nell'efficacia della decontaminazione tra i difetti di Classe 1A e Classe 1B. L'analisi SEM ha mostrato danni superficiali minimi con polvere di eritritolo e punte in PEEK, mentre le curette in titanio hanno causato danni da moderati a gravi. Sulla base dell'efficienza della decontaminazione e della conservazione della superficie, la polvere di eritritolo e le punte in PEEK sono opzioni sicure ed efficaci per il trattamento della perimplantite, mentre le curette in titanio sono meno efficaci e causano notevoli danni alla superficie. Questi risultati possono aiutare i medici nella pianificazione del trattamento della perimplantite.
Introduzione
Il trattamento implantare dentale è il protocollo più comune e preferito per la sostituzione dei denti mancanti in tutto il mondo. Studi di follow-up a lungo termine hanno dimostrato che l'uso di restauri supportati da impianti nel trattamento dell'edentulia completa o parziale fornisce risultati prevedibili e alti tassi di successo in termini di sopravvivenza. Tuttavia, in seguito al posizionamento chirurgico e al restauro degli impianti possono insorgere varie complicanze che interessano i tessuti duri e molli1. Nel 2017, il World Workshop on the Classification of Parodontale and Disease-Implant and Conditions ha introdotto definizioni e diagnosi differenziali per le malattie che colpiscono i tessuti perimplantari2. Secondo questa definizione, la perimplantite è una condizione patologica irreversibile caratterizzata da segni clinici di infiammazione, tra cui sanguinamento al sondaggio e/o suppurazione, aumento della profondità di sondaggio e/o recessione del margine mucoso nella mucosa perimplantare e perdita radiografica dell'osso di supporto2. L'eziologia delle malattie perimplantari è multifattoriale e alcuni individui sono più suscettibili a questa condizione rispetto ad altri. Le predisposizioni specifiche degli individui possono aumentare il rischio di sviluppo della malattia perimplantare, che può portare alla perdita dell'impianto. Altri fattori che giocano un ruolo nell'eziologia delle malattie perimplantari sono i fattori correlati al paziente (fumo, malattie sistemiche, anamnesi della malattia parodontale, igiene orale); lo stato della mucosa cheratinizzata, la quantità e la qualità dell'osso e dei tessuti molli nel sito implantare; forze sull'impianto e sui tessuti circostanti; complicazioni riscontrate durante l'inserimento dell'impianto; e l'esperienza e l'abilità del medico che esegue trattamenti chirurgici e protesici2. Inoltre, è stato recentemente introdotto un nuovo concetto di valutazione e trattamento del rischio, lo strumento di valutazione del rischio di malattia da impianto (IDRA)3. Questo strumento è stato sviluppato come un diagramma funzionale composto da otto parametri, ciascuno con un'associazione documentata con la perimplantite. I vettori dell'ottagono sono la storia della parodontite, la percentuale di siti implantari e dentali con sanguinamento al sondaggio (BoP), il numero di denti/impianti con profondità della tasca di sondaggio ≥ 5 mm, il tasso di perdita ossea parodontale (radiografie in relazione all'età del paziente), la suscettibilità alla parodontite, la frequenza della terapia parodontale di supporto (SPT) e la progettazione della protesi.
Recenti revisioni sistematiche hanno dimostrato che la prevalenza della perimplantite è del 19,53% a livello di paziente e del 12,53% a livello di impianto3. Con circa 5 milioni di protesi posizionate ogni anno in tutto il mondo, con una dimensione di mercato di oltre 4 miliardi di dollari, la perimplantite rappresenta un grave problema di salute per la popolazione. Se non trattata, la perimplantite provoca la perdita dell'impianto interessato e della protesi supportata dall'impianto, causando un grande disagio sia per il dentista che per il paziente.
Il trattamento delle malattie perimplantari può essere suddiviso in approcci non chirurgici e chirurgici. Sebbene vi sia una ragionevole aspettativa per il successo degli endpoint nel trattamento della parodontite4, le prove comparabili per il trattamento della perimplantite sono ancora scarse. Pertanto, il razionale per un approccio graduale e la terapia non chirurgica della perimplantite è quello di tentare il controllo del biofilm e dell'infiammazione con approcci relativamente semplici prima di aumentare l'invasività del trattamento e di eseguire la fase chirurgica quando si ottiene un migliore controllo del biofilm e dei fattori di rischio. Ciò include le istruzioni e la motivazione OH, il controllo dei fattori di rischio, il controllo dei fattori di ritenzione del biofilm e la pulizia/rimozione/modifica della protesi, compresa la valutazione dei componenti della protesi, della strumentazione sopramarginale e sub-marginale e il trattamento parodontale concomitante quando necessario. Pertanto, la terapia non chirurgica dovrebbe sempre essere il primo passo5. Per la perimplantite precoce, la riduzione dei fattori di rischio e il trattamento non chirurgico possono essere sufficienti, ma la rimozione completa del biofilm nelle tasche profonde dopo la perdita ossea è spesso impegnativa. Durante la fase di rivalutazione dopo il trattamento non chirurgico, le profondità persistenti delle tasche (≥ 6 mm) e il sanguinamento al sondaggio (BoP) indicano una potenziale progressione della perimplantite. Se questi segni sono presenti, si raccomandano interventi chirurgici6. La terapia chirurgica della perimplantite comprende (i) lo sbrigliamento del lembo aperto, (ii) la chirurgia resettiva del lembo, (iii) la gestione dei difetti ossei perimplantari utilizzando approcci ricostruttivi, (iv) metodi aggiuntivi per la decontaminazione della superficie implantare e (v) l'uso aggiuntivo di antibiotici locali/sistemici7.
Il principale fattore eziologico della perimplantite è il biofilm patogeno colonizzato sulla superficie dell'impianto6. La rimozione di questo biofilm è il principio principale e l'obiettivo di tutti i protocolli di trattamento, che prevedono metodi di decontaminazione meccanica, chimica e laser7.
Lo sbrigliamento meccanico impiega curette in plastica, carbonio e titanio, dispositivi a ultrasuoni con punte in plastica e metallo, spazzole in titanio e sistemi abrasivi ad aria (AA) con varie polveri. Sebbene l'eliminazione completa del biofilm sia difficile da ottenere, queste terapie forniscono benefici clinici. Vari interventi clinici, tra cui protocolli di sbrigliamento meccanico con o senza antisettici8, antibiotici9, nonché chirurgia resettiva e rigenerativa10, sono stati utilizzati con vari gradi di successo clinico. Tuttavia, inducono anche cambiamenti nelle proprietà chimiche e fisiche della superficie dell'impianto, complicando eventualmente la formazione di nuovo osso e la reosteointegrazione.
Tra i metodi meccanici, le procedure AA che utilizzano diverse composizioni di polvere hanno dimostrato la migliore efficacia di pulizia 11,12,13. Tuttavia, la presenza di particelle residue può alterare la topografia della superficie e ridurre la biocompatibilità14. La glicina, seguita dal bicarbonato di sodio, è la polvere più utilizzata nei sistemi AA8. Recentemente, particelle più piccole abrasive per l'aria come l'eritritolo (14 μm) hanno guadagnato interesse per una decontaminazione efficace con danni superficiali ridotti9. Le curette in titanio e plastica, che causano meno danni superficiali rispetto alle punte in acciaio, sono efficaci nella decontaminazione del biofilm15. Le punte degli ablatori a ultrasuoni in polietere-etere-chetone (PEEK) riducono anche la carica batterica con danni superficiali minimi10. I metodi di decontaminazione devono considerare l'elevata rugosità delle superfici dell'impianto e mirare a rimuovere il biofilm batterico senza causare danni superficiali significativi. Sebbene siano state condotte ricerche approfondite in vitro, in vivo e cliniche, ad oggi non esiste ancora un consenso e un protocollo gold standard per il trattamento della perimplantite. La crescente prevalenza di malattie perimplantari dovute a numerosi impianti dentali richiede un approccio prevedibile e basato sull'evidenza per il trattamento delle superfici contaminate. Questo studio mira a valutare l'efficacia di diversi metodi di decontaminazione - sistemi abrasivi ad aria (AA), punte a ultrasuoni in PEEK e curette in titanio - sulla decontaminazione della superficie dell'impianto e a valutare il loro impatto sulla rugosità della superficie dell'impianto mediante analisi SEM.
Protocollo
Il protocollo di studio è stato approvato dal comitato etico (TBAEK-363) dell'Università di Akdeniz, Antalya, Turchia. Questo studio è stato sostenuto dal Fondo di ricerca dell'Università di Akdeniz (numero di progetto: TDH-2024-6676). Lo studio ha utilizzato un impianto dentale a forma di vite (PrimeTaper EV Implant) con dimensioni di 4,2 mm x 11 mm, caratterizzato da un design a micro-filettatura che misura 1,7 mm sul colletto. Preparazione della superficie con sabbiatura e mordenzatura acida con acido fluoridrico diluito per ottenere la superficie OsseoSpeed ben definita.
1. Preparazione di modelli sperimentali di perimplantite
NOTA: Tre metodi di trattamento meccanico di decontaminazione (abrasivo ad aria (AA), polietereterchetone (PEEK) a ultrasuoni e curette in titanio; Tabella dei materiali) in due diversi tipi di difetto di perimplantite sono stati analizzati11 (Classe 1A e Classe 1B). Pertanto, c'erano sei gruppi sperimentali (Figura 1). Sono stati utilizzati un totale di 62 impianti, di cui uno di controllo positivo e uno negativo. Questo disegno di studio in vitro, inizialmente sviluppato da Sharhmann et al.16, è stato modificato da vari ricercatori 12,13,14,15,16,17,18 in letteratura (Figura 2). Supponendo una differenza del 10% nell'efficacia della rimozione del biofilm tra i gruppi, la dimensione del campione è stata determinata come 60 (10 per ciascun gruppo) per sei gruppi con potenza G*, una dimensione dell'effetto di 0,50, un errore di tipo I del 5% e una potenza dell'80%.
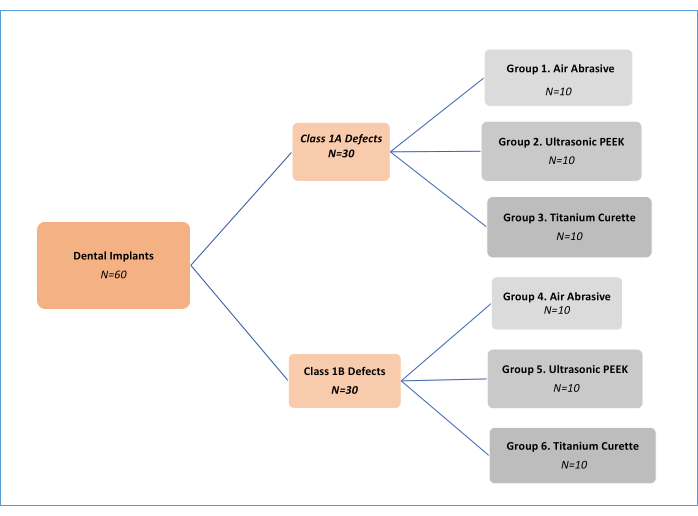
Figura 1: Diagramma di flusso dei gruppi sperimentali. Clicca qui per visualizzare una versione più grande di questa figura.
- Rimuovere un primo molare dal modello di fantoccio mandibolare educativo. I denti in plastica sono fissati a questo modello fantasma con viti. Svitare il primo dente molare e rimuovere la filettatura dall'incavo. Riempi l'alveolo modellando il materiale in silicone morbido per coprire l'alveolo e creare una cresta alveolare piatta.
NOTA: E' stata realizzata una simulazione di un impianto inserito in un'area edentula. - Scansiona il modello preparato in uno scanner da laboratorio per creare un progetto digitale.
- Crea digitalmente difetti ossei per perimplantite 3D di Classe 1A e Classe 1B11 . Apri il programma software Exocad. Caricare il file del modello scansionato. Quindi fai clic su Progettazione e seleziona Modalità esperto. Rimuovi le aree irregolari con l'opzione Modifica mesh. Quindi fare clic con il pulsante destro del mouse e selezionare Salva scansione come file nella cartella correlata sul computer.
- Seleziona Strumenti >opzione Aggiungi/Rimuovi mesh , seleziona Scansione cera> Carica file e seleziona il file appena salvato nella cartella. Successivamente, fai clic su Modalità guidata a destra.
- Nel nuovo modello STL risultante, creare una simulazione di difetto nell'alveolo del dente. Per fare ciò, fai clic su Aggiungi/Rimuovi sul lato sinistro. Seleziona la dimensione del pennello di forma ovale. Successivamente, crea il difetto sul modello utilizzando contemporaneamente Maiusc e clic sinistro. Regolare la lunghezza del difetto a 5 mm e la larghezza a 4,2 mm (corrispondente al diametro dell'impianto) sulla superficie vestibolare dell'impianto per i difetti di Classe 1A e 5-5-5 mm per i difetti di Classe 1B.
- Per restringere la larghezza orizzontale del difetto, selezionare le cuspidi facendo clic su Anatomia sul lato sinistro e restringendo la larghezza vestibolare del difetto verso l'interno. Quindi, fai clic con il pulsante destro del mouse e salva la scena come file.
- Per creare un modello finale, riavviare il programma e ricaricare la cartella salvata. Quindi selezionare l'opzione Modalità guidata e allineamento del modello a destra. Seleziona il tipo di modello come Digital Waxup Model a sinistra. Fare clic su Avanti più volte fino a raggiungere la sezione di progettazione del modello a sinistra. Seleziona l'opzione Modello completo e fai clic su Avanti due volte. Una volta completato il file del modello, aprilo con Esplora risorse ed è pronto per la stampa.
- Inoltra i file STL del modello progettato alla stampante 3D. Stampa i modelli digitali creati utilizzando una resina per modelli.
- Sciacquare i modelli sperimentali in etanolo al 96% per 5-10 minuti. Dopo il processo di pulizia, inserire i modelli nel dispositivo di polimerizzazione a emissione di luce e polimerizzare con la luce per 5 minuti alla dose impostata secondo le istruzioni del produttore.
NOTA: Utilizzare un modello in resina con elevata resistenza alla trazione, alla flessione e alla compressione adatto per la perforazione di impianti. Pulire il modello stampato con soluzioni a base di alcol secondo le istruzioni del produttore e assicurarsi che sia adeguatamente fotopolimerizzato.
2. Colorazione degli impianti
- Immergere gli impianti di prova in inchiostro rosso viscoso e resistente all'acqua. Assicurarsi che tutte le parti della superficie dell'impianto siano completamente e uniformemente ricoperte di inchiostro per 15 s. Rimuovere le protesi dal contenitore sterile utilizzando manipoli driver o perni d'impronta senza contatto con le mani.
NOTA: Questa colorazione simulerà un surrogato di biofilm otticamente visibile per l'analisi fotografica. - Asciugare all'aria gli impianti colorati con una siringa ad aria per riunito in modo da avere una dispersione uniforme dell'inchiostro. Asciugare ulteriormente le protesi colorate per 24 ore a temperatura ambiente. Asciugare gli impianti in isolamento con i manipoli, senza contatto con le mani.
3. Posizionamento di protesi colorate
- Regolare le impostazioni di un dispenser di fisioterapia dentale come segue: 800 giri/min, coppia 40 N senza irrigazione salina.
- Creare l'alveolo dell'impianto con le frese per impianti chirurgici sui modelli sperimentali per posizionare gli impianti di 11 mm di lunghezza e 4,2 mm di larghezza. Preparare lo stesso alveolo implantare per i modelli con entrambi i tipi di difetti (modelli con difetti di Classe 1A e 1B).
- Utilizzare le frese per impianti in sequenza secondo le istruzioni del produttore per ottenere la stabilità primaria. Pulire i detriti rimanenti dopo la perforazione con una siringa aria-acqua, quindi posizionare gli impianti. Stabilizzare i modelli sperimentali di perimplantite sulla piattaforma di lavoro con un morsetto per evitare il micromovimento degli impianti e per prevenire microcrepe sui modelli.
- Inserire gli impianti con un manipolo portante negli alveoli. Lasciare 5 mm di area esposta sulla superficie buccale. Assicurarsi che gli impianti siano immersi allo stesso livello sulla cresta ossea linguale del modello. Evitare di toccare la superficie dell'impianto macchiata.
4. Decontaminazione degli impianti
- Iniziare a decontaminare gli impianti in gruppi senza rimuoverli dai modelli sperimentali di difetto 1A e 1B.
- Sistema abrasivo ad aria: Impostare il dispositivo alla massima potenza con irrigazione ad acqua con polvere di eritritolo da 14 μm. Tenere la punta del dispositivo a 2-3 mm dalla superficie dell'impianto e applicare la polvere in modo uniforme sul difetto di perimplantite esposto. Limitare il tempo di lavorazione a 2 minuti per difetti 1A e 3 minuti per difetti 1B.
- Punta a ultrasuoni in polietereterchetone (PEEK): Impostare il dispositivo a 8 potenze (80%) con la massima irrigazione dell'acqua. Tenere il manipolo in PEEK in modo adatto all'uso a ultrasuoni. Eseguire la decontaminazione sulla superficie dell'impianto con movimenti lineari e paralleli. Applicare la punta in PEEK tra le filettature quanto consentito dal suo design. Limitare il tempo di lavorazione a 2 minuti per difetti 1A e 3 minuti per difetti 1B.
- Curette in titanio: applicare contatti consecutivi con una pressione costante a 60°-90° sulla superficie dell'impianto con una forza di circa 0,75 N sulla superficie dell'impianto esposta di 5 mm per 2 minuti per difetti 1A e 3 minuti per difetti 1B.
- Dopo la decontaminazione, rimuovere l'impianto utilizzando il pezzo di trascinamento senza contatto con le mani. Se i modelli si deformano dopo la decontaminazione, procedere ai modelli di backup. Stabilizzare i modelli sperimentali di perimplantite sulla piattaforma di lavoro con un morsetto.
NOTA: Tutti i metodi devono essere calibrati e applicati da un singolo ricercatore.
5. Imaging fotografico
- Rimuovere gli impianti dal modello con un pezzo di trascinamento dell'impianto compatibile. Asciugare gli impianti all'aria per 20 secondi per rimuovere eventuali particelle/residui allentati sulla superficie.
- Posiziona gli impianti su modelli fotografici acrilici progettati su misura per scattare viste piatte, viste apicali a 30° e viste coronali a 30° per valutare le parti apicali e coronali delle filettature sulla superficie dell'impianto.
- Posiziona la fotocamera su un treppiede e standardizza le impostazioni della fotocamera (distanza 15 cm, ISO 160, apertura f/16, tempo di esposizione 1/250 s). Assicurarsi che la stanza sia adeguatamente illuminata. È necessario stabilizzare la fotocamera con un treppiede.
- Scatta le foto digitali in formato RAW con un flash. Ottenere un totale di 90 foto buccali (una piatta, una apicale a 30° e una coronale a 30° per ciascuna superficie dell'impianto) per i difetti di Classe 1A e 270 foto (piatte, apicali a 30° e coronali a 30° da ciascuna superficie buccale, mesiale e distale per ciascun impianto) per i difetti di Classe 1B. Deposita tutti i file di foto digitali su un disco rigido per un'ulteriore analisi delle immagini.
6. Analisi delle immagini
- Eseguire tutte le analisi sul software di immagine digitale (ImageJ). Prima dell'analisi, rendere nero lo sfondo delle fotografie utilizzando un programma Photoshop (Photoroom) per assicurarsi che nell'immagine sia visibile solo l'impianto. Apri l'applicazione, quindi aggiungi ogni immagine dalla galleria. Rimuovi lo sfondo dall'immagine e seleziona Sfondo nero dalle opzioni.
- Trascina e rilascia l'immagine su ImageJ. Disegna un quadrato nell'immagine per coprire 5 mm coronale all'impianto. Quindi fare clic su Immagine > Ritaglia per standardizzazione. Ripeti lo stesso processo per ogni immagine.
- Convertire le immagini in formato a 8 bit facendo clic su Immagine ˃ Digitare ˃ 8 bit e regolare le soglie facendo clic su Immagine ˃ Regola ˃ Soglia per i calcoli dell'area.
- Calcola l'intera superficie dell'impianto e l'area del residuo di colore rosso facendo clic su Analizza ˃ Misura ˃ Area.
- Registra l'area dei pixel ottenuta in un file di foglio di calcolo. Crea un file di foglio di calcolo separato per registrare i dati dell'immagine non elaborata.
- Per ottenere la percentuale di residui di colore rosso, moltiplicare l'area visualizzata in rosso per 100 e dividere per l'area totale della superficie dell'impianto.
7. Analisi SEM
- Conservare tutte le protesi nelle loro scatole sterili fino al giorno dell'analisi.
- Prima dell'analisi SEM, selezionare casualmente un campione rappresentativo da ciascun gruppo di trattamento. Oltre ai campioni selezionati da ogni gruppo, aggiungere un impianto sterile e solo l'impianto completamente ricoperto di inchiostro. Pertanto, preparare un totale di otto campioni di impianto per l'analisi SEM.
- Spruzzare azoto gassoso con una pistola a gas per 20 s al fine di rimuovere eventuali micro-polveri sulla superficie dell'impianto prima dell'analisi SEM.
NOTA: Non è stato applicato alcun rivestimento d'oro aggiuntivo a causa della tecnologia avanzata del dispositivo. - Montare ogni impianto su tronchetti SEM con dischi adesivi conduttivi in carbonio in modo da consentire l'analisi della superficie piana buccale senza decontaminazione manuale. Disponili in ordine di numero per evitare confusione tra i gruppi.
- Seleziona un'area tra gli impianti posizionati nello strumento e acquisisci immagini con diversi ingrandimenti. Ripetere la stessa procedura per diverse regioni delle superfici dell'impianto (mesiale o distale). Utilizzare l'ingrandimento 100x, 1000x e 5000x per le immagini che utilizzano un dispositivo SEM funzionante a 10-30 kV con una distanza di lavoro media di 12 mm.
NOTA: Per ogni impianto sono stati selezionati il secondo microfilamento dall'area del colletto e il secondo macrofilamento dal corpo per garantire la standardizzazione durante l'analisi SEM. Per alcune immagini, si consiglia di eseguire l'analisi elementare (EDS) durante l'imaging per il confronto.

Figura 2: Diagramma di flusso dello studio. Clicca qui per visualizzare una versione più grande di questa figura.
8. Analisi statistica
- Esprimi le variabili categoriali come numeri e percentuali e le variabili continue come media e deviazione standard. Confermare la normalità della distribuzione per variabili continue con il test di Shapiro-Wilk.
- Per il confronto di variabili continue tra gruppi di difetti, utilizzare il test t di Student. Per il confronto di più di due gruppi, utilizzare l'ANOVA unidirezionale o il test di Kruskal Wallis a seconda che le ipotesi statistiche siano state soddisfatte o meno.
- Per i dati normalmente distribuiti, riguardanti l'omogeneità delle varianze, utilizzare i test di Tukey per confronti multipli di gruppi. Per dati distribuiti in modo non normale, utilizzare il test U di Mann-Whitney aggiustato per Bonferroni per confronti multipli di gruppi. Tutte le analisi statistiche sono state effettuate utilizzando IBM SPSS 20. Il livello statistico di significatività per tutti i test è stato considerato pari a 0,05.
Risultati
Il protocollo sperimentale qui descritto per l'analisi della decontaminazione delle superfici implantari ha rivelato differenze significative tra le varie procedure di trattamento. Inoltre, il protocollo SEM post-trattamento ha mostrato cambiamenti significativi sulle superfici implantari con gradi variabili tra i gruppi di studio.
Confronti a livello di impianto (media totale dell'impianto) dopo la decontaminazione
I confronti a livello di...
Discussione
La metodologia dell'analisi in vitro della superficie degli impianti dentali affetti da malattia perimplantare è sempre stata impegnativa a causa della natura infiammatoria e batterica dei meccanismi patogenetici che si verificano sulle superfici ruvide dell'impianto. Diverse preoccupazioni includono la scelta del materiale del campione, l'imitazione del biofilm sulla superficie, la scelta del tipo di difetto di perimplantite, la rappresentazione delle condizioni cliniche duran...
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Gli impianti utilizzati nello studio sono stati supportati da Dentsply Sirona.
Materiali
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
Riferimenti
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779 (2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295 (2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon