このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
インプラント周囲炎治療における機械的方法がインプラント表面の除染と粗さに及ぼす影響
要約
本プロトコルは、 in vitro インプラント表面の除染および粗さ研究に使用でき、臨床上の意思決定に貢献できるインク染色に基づく実験モデルを示しています。
要約
歯科インプラントの表面を除染するために、さまざまな機械的方法が提案されており、さまざまな成功を収めています。この in vitro 研究では、エリスリトール粉末、ポリエーテルエーテルケトン(PEEK)超音波チップ、チタンキュレット(TIT)を使用したエアアブレーション(AA)システムの除染効率と、走査型電子顕微鏡(SEM)を使用してインプラント表面トポグラフィーへの影響を評価しました。合計 60 本のインプラントを永久的な赤色インクで染色し、3D プリントされたクラス 1A およびクラス 1B のインプラント周囲炎の欠陥に埋入し、欠陥の種類と治療プロトコルに基づいて 6 つのグループ (グループあたり n=10) を形成しました。さらに、1 つのポジティブ コントロール インプラントと 1 つのネガティブ コントロール インプラントが使用されました。エリスリトール粉末、PEEK超音波チップ、およびチタンキュレットを、クラス1Aの欠陥で2分間、クラス1Bの欠陥で3分間適用しました。残留赤インク領域をデジタルソフトウェアで定量化し、インプラント表面の変化をSEMとEDSを用いて解析しました。いずれの方法でも完全な除染は達成されませんでした。しかし、エリスリトール粉末は有意に最も効果的であり、残留インク率は24%±6%(p < 0.001)でした。PEEK超音波チップは41%±4%のインク残量をもたらしましたが、チタンキュレットは55%±3%を残しました。すべての方法で有意差が観察されました。クラス1Aとクラス1Bの欠陥の間で除染効果に有意差は認められませんでした。SEM分析では、エリスリトール粉末とPEEKチップで表面の損傷が最小限に抑えられましたが、チタン製のキュレットは中程度から重度の損傷を引き起こしました。除染効率と表面保存の両方に基づいて、エリスリトール粉末とPEEKチップはインプラント周囲炎の治療に安全で効果的な選択肢ですが、チタン製のキュレットは効果が低く、表面にかなりの損傷を与えます。これらの知見は、臨床医がインプラント周囲炎の治療計画を立てるのに役立つ可能性があります。
概要
歯科インプラント治療は、世界中で欠損した歯を交換するための最も一般的で好ましいプロトコルです。長期の追跡研究により、完全または部分的な無歯顎症の治療にインプラント支持修復物を使用すると、予測可能な結果と生存率の高い成功率が得られることが示されています。しかし、硬組織と軟組織に影響を与えるさまざまな合併症が、インプラントの外科的埋入および修復後に発生する可能性があります1。2017年、歯周およびインプラント周囲の疾患と状態の分類に関する世界ワークショップは、インプラント周囲組織に影響を与える疾患の定義と鑑別診断を導入しました2。この定義によれば、インプラント周囲炎は、プローブおよび/または化膿による出血、プローブ深度の増加、および/またはインプラント周囲粘膜の粘膜縁の後退、および支持骨のX線写真による喪失を含む、炎症の臨床徴候を特徴とする不可逆的な病理学的状態です2。インプラント周囲疾患の病因は多因子性であり、一部の個人は他の個人よりもこの状態にかかりやすいです。個人の特定の素因は、インプラント周囲疾患の発症リスクを高める可能性があり、インプラントの喪失につながる可能性があります。インプラント周囲疾患の病因に関与する他の要因は、患者関連の要因(喫煙、全身性疾患、歯周病歴、口腔衛生)です。角質化した粘膜の状態、インプラント部位の骨および軟組織の量と質。インプラントおよび周囲の組織に力がかかる。インプラント埋入中に遭遇した合併症。外科的および補綴的治療を行う医師の経験と技術2.さらに、新しいリスク評価と治療の概念であるインプラント疾患リスク評価ツール(IDRA)3が最近導入されました。このツールは、8 つのパラメーターで構成される機能図として開発され、それぞれにインプラント周囲炎との関連が文書化されています。八角形のベクトルは、歯周炎の病歴、プローブで出血したインプラントおよび歯の部位の割合 (BoP)、プローブ ポケットの深さが 5 mm ≥歯/インプラントの数、歯周骨量減少率 (患者の年齢に対する X 線写真)、歯周炎に対する感受性、支持的歯周治療 (SPT) の頻度、およびプロテーゼの設計です。
最近の系統的レビューでは、インプラント周囲炎の有病率は患者レベルで19.53%、インプラントレベル3で12.53%であることが示されています。世界中で毎年約500万本以上のインプラントが埋入され、市場規模は40億米ドルを超えていることから、インプラント周囲炎は人口にとって大きな健康問題となっています。インプラント周囲炎を治療せずに放置すると、影響を受けたインプラントとインプラント支持補綴物が失われ、歯科医と患者の両方に大きな苦痛を引き起こします。
インプラント周囲疾患の治療は、非外科的アプローチと外科的アプローチに分けることができます。歯周炎4の治療におけるエンドポイントの成功には合理的な期待がありますが、インプラント周囲炎の治療に関する同等のエビデンスはまだ不足しています。したがって、インプラント周囲炎の段階的アプローチと非外科的治療の理論的根拠は、治療の侵襲性を高める前に比較的単純なアプローチでバイオフィルムと炎症の制御を試み、より良いバイオフィルムと危険因子の制御が達成されたときに外科的ステップを実行することです。これには、OHの指示と動機付け、リスク因子の制御、バイオフィルム保持因子の制御、およびプロテーゼの洗浄/取り外し/変更(プロテーゼコンポーネントの評価、辺縁上および辺縁下器具、および必要に応じて付随する歯周治療を含む)が含まれます。したがって、非外科的治療は常に最初のステップであるべきです5。早期のインプラント周囲炎の場合、危険因子の軽減と非外科的治療で十分かもしれませんが、骨量減少後の深いポケットでの完全なバイオフィルム除去はしばしば困難です。非外科的治療後の再評価段階では、持続的なポケットの深さ (≥ 6 mm) とプローブ時の出血 (BoP) は、インプラント周囲炎の進行の可能性を示しています。これらの徴候が見られる場合は、外科的介入が推奨される6。インプラント周囲炎の外科的治療には、(i)開腹弁創面切除術、(ii)切除皮弁手術、(iii)再建的アプローチを使用したインプラント周囲骨欠損の管理、(iv)インプラント表面除染のための追加の方法、および(v)局所/全身抗生物質の補助使用が含まれます7。
インプラント周囲炎の主な病因は、インプラント表面にコロニー形成された病原性バイオフィルムです6。このバイオフィルムを除去することは、機械的、化学的、およびレーザーによる除染方法を含むすべての治療プロトコルの主要な原則と目標です7。
機械的なデブリードマンは、プラスチック、カーボン、チタンのキュレット、プラスチックと金属の先端を持つ超音波装置、チタンブラシ、およびさまざまな粉末を含む空気研磨剤(AA)システムを採用しています。バイオフィルムを完全に除去することは困難ですが、これらの治療法は臨床的な利点を提供します。消毒薬8、抗生物質9、切除手術および再生手術10の有無にかかわらず、機械的創面切除プロトコルを含むさまざまな臨床的介入が使用されており、さまざまな程度の臨床的成功が見られます。しかし、それらはまた、インプラント表面の化学的および物理的特性の変化を誘発し、新しい骨の形成と再オッセオインテグレーションを複雑にする可能性があります。
機械的方法の中で、異なる粉末組成物を用いたAA処置は、最高の洗浄効果を示している11,12,13。しかし、残留粒子の存在は、表面のトポグラフィーを変化させ、生体適合性を低下させる可能性がある14。グリシン、続いて重炭酸ナトリウムは、AAシステム8で最も使用されている粉末です。最近、エリスリトール(14μm)のような小さな空気研磨粒子が、表面損傷を減らした効果的な除染に関心を集めています9。チタンやプラスチックのキュレットは、スチール製のチップよりも表面の損傷が少ないため、バイオフィルムの除染に効果的です15。ポリエーテルエーテルケトン(PEEK)製の超音波スケーラーチップも、表面の損傷を最小限に抑えて細菌の負荷を軽減します10。除染法では、インプラント表面の高い粗さを考慮し、表面に大きな損傷を与えることなく細菌のバイオフィルムを除去することを目指す必要があります。広範な in vitro、in vivo、および臨床研究が行われてきましたが、これまでのインプラント周囲炎治療のコンセンサスとゴールド スタンダード プロトコルはまだありません。多数の歯科インプラントによるインプラント周囲疾患の有病率の増加により、汚染された表面を治療するための証拠に基づいた予測可能なアプローチが必要です。この研究は、さまざまな除染方法(空気研磨剤(AA)システム、PEEK超音波チップ、チタンキュレット)のインプラント表面除染の有効性を評価し、SEM分析によってインプラント表面粗さへの影響を評価することを目的としています。
プロトコル
研究プロトコルは、トルコのアンタルヤにあるアクデニズ大学の倫理委員会 (TBAEK-363) によって承認されました。本研究は、アクデニズ大学研究基金(プロジェクト番号:TDH-2024-6676)の支援を受けて行われました。この研究では、4.2 mm x 11 mmの寸法のネジ型歯科インプラント(PrimeTaper EV Implant)を利用し、カラーに1.7 mmのマイクロスレッドデザインを特徴としています。サンドブラストによる表面処理と希釈フッ化水素酸による酸エッチングにより、明確に定義されたOsseoSpeed表面を実現します。
1. 実験的インプラント周囲炎モデルの準備
注:3つの除染機械的処理方法(空気研磨剤(AA)、ポリエーテルエーテルケトン(PEEK)超音波、およびチタンキュレット。 資料表)2つの異なるインプラント周囲炎の欠陥タイプ11 (クラス1Aおよびクラス1B)が分析されました。したがって、6つの実験グループがありました(図1)。合計62のインプラントが使用され、そのうち1つはポジティブコントロールインプラント、1つはネガティブコントロールインプラントでした。この in vitro 研究デザインは、最初にSharhmannらによって開発されました16、さまざまな研究者によって変更されています12、13、14、15、16、17、18 文献(図2)。グループ間でバイオフィルム除去効果に 10% の差があると仮定すると、G*パワー、効果サイズ 0.50、タイプ I エラーが 5%、検出力が 80% の 6 つのグループについて、サンプル サイズは 60 (各グループごとに 10) と決定されました。
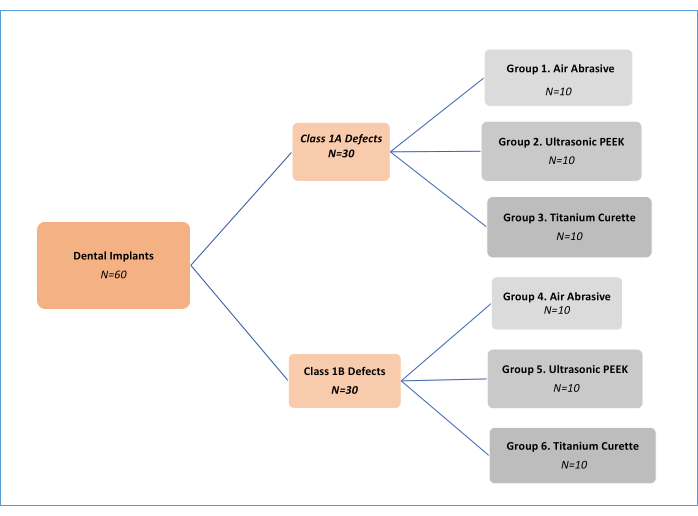
図1:実験グループのフローチャート。 この図の拡大版を表示するには、ここをクリックしてください。
- 教育用下顎ファントムモデルから1つの第一大臼歯を取り外します。プラスチック製の歯は、このファントムモデルにネジで固定されています。最初の大臼歯を緩め、ソケットからねじ山を取り外します。柔らかいシリコン素材を成形してソケットを覆い、平らな歯槽骨隆起を作成してソケットを埋めます。
注:無歯顎領域に埋入されたインプラントのシミュレーションが作成されています。 - 準備したモデルをラボスキャナーでスキャンして、デジタルデザインを作成します。
- 3Dクラス1Aおよびクラス1B11 のインプラント周囲骨欠損をデジタルで作成します。Exocadソフトウェアプログラムを開きます。スキャンしたモデルファイルをアップロードします。次に、「 デザイン 」をクリックし、「 エキスパートモード」を選択します。不規則な領域は、Edit Meshオプションで削除します。次に、右クリックして、[ スキャンをファイルとして保存 ]をコンピューター上の関連フォルダーに選択します。
- [ツール]>[メッシュの追加/削除]オプションを選択し、[ワックススキャン]>[ファイルのアップロード]を選択して、フォルダに保存したファイルを選択します。その後、右側のウィザードモードをクリックします。
- 結果の新しい STL モデルで、歯のソケットに欠陥シミュレーションを作成します。これを行うには、左側の [追加/削除 ]をクリックします。 楕円形のブラシサイズを選択します。その後、Shiftキーと左クリックを同時に使用して、モデルに欠陥を作成します。インプラントの頬面上の欠陥の長さを5 mm、幅を4.2 mm(インプラントの直径に対応)に調整します。クラス1Aの欠陥は、欠陥の場合は5-5-5 mmです。
- 欠損の水平幅を狭くするには、左側の[解剖学]をクリックし、欠損の前庭幅を内側に狭めてカスプを選択します。次に、右クリックしてシーンをファイルとして保存します。
- 最終モデルを作成するには、プログラムを再起動し、保存したフォルダを再読み込みします。次に、右側の ウィザードモード と モデルアライメント オプションを選択します。モデルタイプとして左の デジタルワックスアップモデル を選択します。「次へ」を数回クリックして、左側のモデル設計セクションに移動します。「フルモデル」オプションを選択し、「 次へ 」を 2 回クリックします。モデルファイルが完成したら、エクスプローラーで開くと、印刷の準備が整います。
- 設計したモデルのSTLファイルを3Dプリンターに転送します。作成したデジタルモデルをモデルレジンでプリントします。
- 実験モデルを96%エタノールで5〜10分間すすぎます。洗浄プロセス後、モデルを発光硬化装置に置き、製造元の指示に従って用量設定で5分間光で硬化させます。
注:インプラントの穴あけに適した、引張強度、曲げ強度、圧縮強度の高い樹脂モデルを使用してください。製造元の指示に従って、印刷したモデルをアルコールベースの溶液で洗浄し、適切に光硬化していることを確認します。
2. インプラントの染色
- テストインプラントを粘性のある耐水性の赤いインクに浸します。インプラント表面のすべての部分がインクで15秒間完全かつ均質に覆われていることを確認します。ドライバーハンドピースまたは印象ポストを使用して、手が触れないように滅菌容器からインプラントを取り出します。
注:この染色は、写真分析のために光学的に見えるバイオフィルムの代用をシミュレートします。 - 汚れたインプラントをデンタルユニットのエアシリンジで風乾し、インクが均一に分散するようにします。染色したインプラントをさらに室温で24時間乾燥させます。インプラントをハンドピースで分離して、手を触れずに乾燥させます。
3. 染色インプラントの埋入
- 歯科理学療法ディスペンサーの設定を次のように調整します:800 rpm、40 Nのトルク、生理食塩水灌漑なし。
- 実験モデルに外科用インプラントドリルを使用してインプラントソケットを作成し、長さ11 mm、幅4.2 mmのインプラントを配置します。両方のタイプの欠陥があるモデル(クラス1Aおよび1Bの欠陥モデル)に同じインプラントソケットを準備します。
- インプラントドリルは、製造元の指示に従って順番に使用し、一次安定性を達成します。穴を開けた後、空気水シリンジで残りの破片を清掃し、インプラントを埋め込みます。インプラントの微小な動きを避け、モデルの微小亀裂を防ぐために、クランプを使用して作業プラットフォーム上の実験的なインプラント周囲炎モデルを安定させます。
- キャリアハンドピース付きのインプラントをソケットに挿入します。頬面に5mmの露出領域を残します。インプラントがモデルの舌骨稜の同じレベルで沈んでいることを確認します。汚れたインプラント表面に触れないでください。
4. インプラントの除染
- インプラントを実験的な 1A および 1B 欠陥モデルから削除せずに、グループでインプラントの除染を開始します。
- 空気研磨システム:14μmのエリスリトール粉末を使用した水灌漑でデバイスをフルパワーに設定します。デバイスの先端をインプラント表面から2〜3 mmのところに保持し、露出したインプラント周囲炎の欠陥に粉末を均等に塗布します。作業時間を1Aの欠陥の場合は2分、1Bの欠陥の場合は3分に制限します。
- ポリエーテルエーテルケトン(PEEK)超音波チップ:デバイスを8電力(80%)に設定し、最大水灌漑を行います。PEEKハンドピースは、超音波使用に適した方法で保持します。インプラント表面の除染を直線的および平行な動きで行います。PEEKチップは、そのデザインが許す限りスレッドの間に適用します。作業時間を1Aの欠陥の場合は2分、1Bの欠陥の場合は3分に制限します。
- チタンキュレット:5mmの露出したインプラント表面に約0.75Nの力で、60°〜90°の一定の圧力でインプラント表面に連続して接触させ、1A欠陥の場合は2分間、1B欠陥の場合は3分間塗布します。
- 除染後、ドライバーピースを使用して、手が触れないようにインプラントを取り外してください。除染後にモデルが変形した場合は、バックアップモデルに進んでください。実験的なインプラント周囲炎モデルを作業プラットフォーム上でクランプで安定させます。
注:すべての方法は、1人の研究者が校正および適用する必要があります。
5. 写真撮影
- 互換性のあるインプラントドライバーピースを使用して、モデルからインプラントを取り外します。インプラントを20秒間風乾して、表面の緩んだ粒子/残りを取り除きます。
- インプラントをカスタムデザインのアクリル写真モデルに装着して、フラットビュー、30°アピカルビュー、30°コロナビューを撮影し、インプラント表面の糸のアピカル部分とコロナル部分を評価します。
- カメラを三脚に置き、カメラの設定を標準化します(距離15 cm、ISO 160、絞りf / 16、露出時間1/250秒)。部屋が十分に照らされていることを確認してください。三脚でカメラを安定させる必要があります。
- フラッシュでRAW形式のデジタル写真を撮ります。Class1A欠損については合計90枚の頬側写真(インプラント表面ごとに平坦な写真1枚、インプラント表面ごとに30°の頂端部1枚、30°冠状片1枚)を、Class 1Bの欠損部については270枚の写真(インプラントごとに各頬面、近心面、遠位面から平坦な写真、30°の頂端部、30°の冠状片)を取得します。すべてのデジタル写真ファイルをハードディスクに保存して、さらに画像分析を行います。
6. 画像解析
- すべての解析をデジタル画像ソフトウェア(ImageJ)で行います。分析の前に、Photoshopプログラム(Photoroom)を使用して写真の背景を黒にし、インプラントのみが画像に表示されるようにします。アプリケーションを開き、ギャラリーから各画像を追加します。画像から背景を削除し、オプションから 黒の背景 を選択します。
- ImageJに画像をドラッグ&ドロップします。インプラントまで5mmの冠状動脈を覆うように、画像に正方形を描きます。次に 、「画像」>「切り抜き 」をクリックして標準化します。各画像に対して同じプロセスを繰り返します。
- 画像 ˃ タイプ ˃ 8ビット をクリックして画像を 8 ビット形式に変換し、画像 ˃ 調整 ˃ 面積計算のしきい値をクリックしてしきい値を調整します。
- インプラントの表面積全体と赤色の残留物領域を計算するには、 Analyze(分析)˃ Measure(測定)˃ Area(面積)をクリックしてください。
- 取得したピクセル領域をスプレッドシートファイルに記録します。未加工の画像データを記録するために、別のスプレッドシートファイルを作成します。
- 赤色の残骸の割合を求めるには、赤色の残骸の領域に100を掛け、インプラントの総表面積で割ります。
7. SEM分析
- すべてのインプラントは、分析の日まで滅菌ボックスに保管してください。
- SEM分析の前に、各処理群から代表サンプルを1つランダムに選択します。各グループから選択したサンプルに加えて、滅菌インプラントを1つ追加し、インプラントのみをインクで完全に覆います。したがって、SEM分析用に合計8つのインプラントサンプルを準備します。
- SEM分析の前に、注入表面のマイクロパウダーを除去するために、ガスガンを使用して窒素ガスを20秒間噴霧します。
注:デバイスの高度な技術により、追加の金コーティングは適用されませんでした。 - 導電性カーボン接着ディスクを使用して、各インプラントをSEMスタブに取り付け、手で除染することなく頬側の平坦な表面を分析できるようにします。グループの混乱を避けるために、番号順に並べてください。
- 装置に留置されたインプラントから領域を選択し、異なる倍率で画像を撮影します。インプラント表面の異なる領域(近心または遠位)に対して同じ手順を繰り返します。100倍、1000倍、5000倍の倍率で、平均作動距離12 mmの10-30 kVで動作するSEMデバイスを使用して画像を作成します。
注:襟部からの2本目のマイクロストランドとボディからの2本目のマクロストランドは、SEM分析中の標準化を確実にするために、各インプラントに対して選択されました。一部の画像では、比較のためにイメージング中に元素分析(EDS)を実行することをお勧めします。

図2:調査のフローチャート。 この図の拡大版を表示するには、ここをクリックしてください。
8. 統計分析
- カテゴリ変数を数値とパーセンテージで表し、連続変数を平均と標準偏差で表します。連続変数の分布の正規性をShapiro-Wilk検定で確認します。
- 欠陥グループ間の連続変数を比較するには、スチューデントのt検定を使用します。2つ以上のグループの比較には、統計的仮説が満たされたかどうかに応じて、一元配置分散分析またはクラスカルウォリス検定を使用します。
- 正規分布データの場合、分散の均一性に関して、グループの多重比較にテューキー検定を使用します。非正規分布データの場合、ボンフェローニ調整マンホイットニーU検定を使用して、グループの多重比較を行います。すべての統計分析は、IBM SPSS 20を使用して実行されました。すべての検定の統計的有意水準は0.05であると考えられました。
結果
ここで説明するインプラント表面の除染を分析するための実験プロトコルでは、さまざまな治療手順間で大きな違いが明らかになりました。さらに、治療後のSEMプロトコルでは、研究グループ間で程度の差こそあれ、インプラント表面に有意な変化が見られました。
除染後のインプラントレベルの比較(総インプラント平均)
イン?...
ディスカッション
インプラント周囲疾患に罹患した歯科インプラントのin vitro表面分析の方法論は、インプラントの粗い表面で発生する病原性メカニズムの炎症性と細菌性のために、常に困難でした。いくつかの懸念事項には、サンプル材料の選択、表面のバイオフィルムの模倣、インプラント周囲炎の欠陥タイプの選択、in vitro手順中の臨床状態の表現、除染手順のバリエー?...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究で使用されたインプラントは、デンツプライシロナによってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
参考文献
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779 (2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295 (2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved