Method Article
التصوير ثلاثي الأبعاد للأنسجة الحاملة للورم باستخدام التبييض التكراري يمتد إلى نهج تعدد الإرسال
In This Article
Summary
توضح هذه المقالة بروتوكولا للتألق المناعي متعدد الإرسال المحسن لتوصيف البنية ثلاثية الأبعاد للنقائل الصفاقية.
Abstract
يعد عدم التجانس المكاني للبيئة المكروية للورم (TME) محددا حاسما للاستجابة العلاجية ، خاصة بالنسبة لعوامل الأورام المناعية ، حيث يعتمد النجاح على توزيع مجموعات سكانية فرعية محددة من الخلايا المناعية. على مدى العقد الماضي ، تم إدخال العديد من التقنيات المتطورة لتحقيق دقة مفصلة ل TME باستخدام أقسام ثنائية الأبعاد إما من الأنسجة الثابتة بالفورمالين أو الأنسجة المدمجة في البارافين (FFPE) أو المجمدة الثابتة. في حين أن هذه الأقسام الرقيقة أسهل في شرائها وتحليلها ، إلا أنها تفتقر إلى البنية ثلاثية الأبعاد اللازمة لتوصيف الورم بشكل موثوق وشامل. لمعالجة هذا القيد ، تم تطوير تقنية تركيب الأنسجة وتصويرها لتمكين التحليل ثلاثي الأبعاد لآفات الورم في حالتها الأصلية في الجسم الحي . يحدد هذا البروتوكول شراء أنسجة الورم البشري ، وتركيب العينات على منصات مطبوعة حسب الطلب ، وإجراءات تلطيخ عينات ما بعد التثبيت. تم تكييف تقنية التألق المناعي متعدد الإرسال ، IBEX (التبييض التكراري يمتد تعدد الإرسال) ، لتوصيف TME ثلاثي الأبعاد مع ما يصل إلى 15 علامة للخلايا السرطانية والمناعية واللحمية باستخدام الأجسام المضادة المتاحة تجاريا. تم تحقيق أعماق تصوير تصل إلى 100 ميكرومتر باستخدام مجهر ليزر متحد البؤر مقلوب بالضوء الأبيض مع محول تصوير مطبوع حسب الطلب وأطباق زجاجية تجارية لضمان التوجيه الأمثل للأنسجة. يسلط هذا البروتوكول الضوء على إمكانات طريقة IBEX لتوسيع دراسات التألق المناعي متعدد الإرسال ، مما يوفر فهما أكثر شمولا لتكوين TME.
Introduction
الأورام الصلبة متغيرة للغاية ، مع تركيبة معقدة من أنواع الخلايا (الخبيثة وغير الخبيثة) ، وبروتينات المصفوفة خارج الخلية ، والعوامل القابلة للذوبان1،2. في النهاية ، تحدد هذه البيئة المكروية المعقدة للغاية وغير المتجانسة للورم (TME) القابلية للإصابة بعلاجات مثل العلاج المناعي3،4. على هذا النحو ، تم تطبيق تقنيات مثل التألق المناعي عالي الإرسال5،6 والنسخ المكانية7 لتوصيف تعقيد TME في أقسام طبقة الخلية السميكة (~ 4 ميكرومتر).
على عكس مناهج تشتت الخلايا مثل تسلسل الخلية المفردة وقياس التدفقالخلوي 8،9،10 ، تحافظ هذه التقنيات على العلاقات المكانية للمساهمة بمعلومات مهمة حول الحديث المتبادل الخلوي ويمكن استخدامها لتحديد المؤشرات الحيوية المحتملة للتنبؤ باستجابة العلاج11،12،13. ومع ذلك ، فإن آفات الورم هي بطبيعتها هياكل ثلاثية الأبعاد (3D) ، والأساليب ثنائية الأبعاد مثل تلك المذكورة أعلاه لا تلتقط بشكل كاف المشهد الخلوي المعقد. تم تقدير أهمية علم الأحياء ثلاثي الأبعاد في هذا المجال ، كما يتضح من الاستخدام الواسع للثقافات العضوية السرطانية المشتقة من المريض14. ومع ذلك ، لا تحتفظ العضيات بالتعقيد الخلوي للأصل في الجسم الحي TME ، مما يحد من قابلية التطبيق للاستخدام مع الأدوية المعدلة للمناعة أو لتوصيف مجموعات خلايا TME المتنوعة.
على الرغم من أنه قد يكون من الممكن إجراء تحليلات على أقسام 2D تسلسلية و "خياطة" الصور معا حسابيا لعرض ثلاثي الأبعاد ، إلا أن هذه التقنية باهظة التكلفة وصعبة لإنجازها بدقة عالية15. لتوصيف الأنسجة ثلاثية الأبعاد بشكل فعال من حيث التكلفة (على سبيل المثال ، الأورام) بطريقة قابلة للتكرار ، تم تطوير طريقة فريدة للتحضير وتلوين / تحليل التألق المناعي متعدد الإرسال وإثباتها باستخدام آفات الورم البريتوني من مريض مصاب بسرطان الصفاق الأولي.
استنادا إلى تكييف تقنية IBEX الراسخة (التبييض التكراري يمتد تعدد الإرسال)16،17 ، يوضح هذا البروتوكول تفاصيل الطباعة ثلاثية الأبعاد لحامل الأنسجة ومحول التصوير ، وشراء الأنسجة البريتونية ، والتركيب ، ودورات متعددة من التلوين بعلامات مختلفة من نوع الورم والخلية ، والتصوير ثلاثي الأبعاد متحد البؤر عالي الدقة.
Protocol
أجريت الدراسة بموافقة مجلس مراجعة المؤسسات الصحية التابع للمعاهد الوطنية بموجب البروتوكول NCT01915225. تم الحصول على الأنسجة البشرية بموافقة خطية مستنيرة في وقت تنظير البطن التشخيصي. كانت جميع الأنسجة حاملة للورم ، على النحو الذي يحدده الفحص المرئي وتم تأكيده من خلال الفحص النسيجي المرضي النهائي. تفاصيل جميع الكواشف والمعدات المستخدمة مدرجة في جدول المواد. يتم توفير توضيح تخطيطي لسير العمل بأكمله في الشكل 1.
1. منصات الطباعة ، محول التصوير ، ولوحة الحضانة
- إجراءات التقطيع / الطباعة ثلاثية الأبعاد / المعالجة اللاحقة للمنصة وأجزاء الألواح ذات 9 آبار (الموضحة في الشكل 2A-C)
- التقطيع: افتح برنامج التقطيع واستورد ملفات التصميم في . صيغة المحكمة الخاصة بلبنان (الملف التكميلي 1 والملف التكميلي 2). قم بتوجيه النماذج للحصول على الطباعة المثلى وإضافة الدعامات. حدد الطابعة الطبية ، وحدد الراتنج الشفاف ، وارتفاع الطبقة 50 ميكرومتر. تحقق من إمكانية الطباعة وأرسل المهمة إلى الطابعة.
- الطباعة ثلاثية الأبعاد: تأكد من أن الطابعة جاهزة (خرطوشة الراتنج والخزان والمنصة الصحيحة في مكانها). على شاشة اللمس الخاصة بالطابعة، حدد المهمة التي تم تحميلها من برنامج مقسم طريقة العرض لبدء الطباعة. بمجرد اكتمال الطباعة ، استخدم أداة الإزالة لفصل الجزء المطبوع عن النظام الأساسي.
- المعالجة اللاحقة: اشطف الجزء الموجود في وحدة الغسيل المملوء بكحول الأيزوبروبيل بنسبة 99٪ (IPA) لمدة 15 دقيقة. قم بإزالة الأجزاء من وحدة الغسيل وانقعها في IPA الطازج لمدة 5 دقائق.
- بعد معالجة الجزء لمدة 60 دقيقة عند 60 درجة مئوية. قم بإزالة الدعامات باستخدام قواطع التدفق. قم برمل أي علامات دعم باستخدام ورق صنفرة ناعم إذا لزم الأمر.
- إجراءات التقطيع / الطباعة ثلاثية الأبعاد / المعالجة اللاحقة لأداة ضبط الارتفاع والغطاء الخارجي (الموضحة في الشكل 2A-C)
- التقطيع: افتح برنامج الطباعة واستورد ملفات التصميم في . تنسيق المحكمة الخاصة بلبنان (الملف التكميلي 3 والملف التكميلي 4). توجيه النماذج وتعيين المواد. حدد وضع الطباعة المطلوب (المزج العالي، السرعة العالية)، واضبط إعدادات الطراز على الانتهاء من غير لامع. تحقق من إمكانية الطباعة وأرسل المهمة إلى الطابعة.
- الطباعة ثلاثية الأبعاد: تأكد من تحميل المواد الصحيحة للطابعة وتنظيف درج التصميم. على واجهة شاشة الطابعة، حدد المهمة التي تم تحميلها لبدء الطباعة. بمجرد اكتمال الطباعة ، استخدم أداة الكاشطة لإزالة الجزء المطبوع برفق من درج البناء.
- المعالجة اللاحقة: ضع القطع المطبوعة في منظف بنفث الماء أو نظام تنظيف التحريك لإزالة مادة الدعم. قم بإجراء أي إزالة يدوية للدعم ، إذا لزم الأمر ، باستخدام أدوات مثل الملقط أو الكماشة.
- القطع بالليزر لمنزلق المنصة (كما هو موضح في الشكل 2 أ ، ج)
- إعداد التصميم: استيراد *. ملف تصميم DWG في برنامج المتجهات (ملف تكميلي 5). اضبط ألوان الخط على اللون الأحمر (RGB) للقطع المتجه. أرسل المهمة إلى قاطع الليزر.
- إعداد آلة القطع بالليزر: افتح برنامج القطع بالليزر واستورد ملف التصميم. حدد نوع المادة واضبط إعدادات الطاقة والسرعة والدقة للأكريليك بسمك 1/32 بوصة. ضع المادة على سرير الليزر ، وتأكد من محاذاة الليزر بشكل صحيح ، وركز الليزر.
- القطع بالليزر: ابدأ عملية القطع بالليزر وراقب للتأكد من قطع المادة بشكل صحيح.
2. تركيب الأنسجة على المنصات المطبوعة
- تحضير وسط الحصاد وطاولة الإعداد
- استكمل 100 مل من DMEM (منخفض الجلوكوز) مع Anti-Anti وضعه في حاضنة 37 درجة مئوية لحين الحاجة (وسط الحصاد).
- قم بإعداد "طاولة تحضيرية" في غرفة العمليات مع العناصر التالية: منصات مطبوعة ثلاثية الأبعاد معقمة ، عبوة من 2-0 أربطة خيوط حريرية ، لوحة تسخين ، كوب عينة مع وسط حصاد 50 مل ، صفيحة استزراع 15 سم تحتوي على 30 مل من وسط الحصاد الدافئ مسبقا ولوحة 24 بئر مع 4 آبار تحتوي كل منها على 1.5 مل من وسط الحصاد (ضع كلها على لوحة التسخين) ، 1 زوج من الملقط و 1 زوج من المقصات الجراحية.
- استئصال الأنسجة وتركيبها
ملاحظة: يتم الحصول على الأنسجة من غرفة العمليات. يتم تحديد مناطق الصفاق ذات بؤر الورم التي يقل سمكها وقطرها عن 0.5 مم عند الفحص البصري (الشكل 2 د). وتجدر الإشارة إلى أن ~ 2 سم2 من الأنسجة (الصفاق) مطلوبة لإعداد منصة واحدة.- افصل بعناية الصفاق الحامل للورم عن جدار البطن الأساسي والعضلات واللفافة (يقوم بها الجراح). انقل صفائح المناديل الناتجة إلى كوب عينة يحتوي على وسط حصاد دافئ وضعها على لوح تسخين (طاولة تحضيرية).
- قم بتركيب المنديل على منصات في صفيحة مقاس 15 سم تحتوي على وسط الحصاد. ثني الأنسجة الحاملة للورم بعناية (الجانب الظهاري المتوسط متجها لأعلى) على جانب الفتحة الصغيرة من المنصة وثبتها في مكانها بخياطة حريرية 2-0. ضع منصة الأنسجة المحضرة عكسيا (مغمورة) في صفيحة مكونة من 24 بئرا تحتوي على وسط حصاد (الشكل 2E-G).
ملاحظة: قم بتركيب الأنسجة التي تم تعليمها بما يكفي لمنع الطيات على سطح المنصة ، ولكن لا تولد توترا لأن هذا سيؤدي إلى تغييرات ميكانيكية وحيوية وفسيولوجية غير مرغوب فيها.
3. إجراء التثبيت / التلوين / التبييض
ملاحظة: التغييرات من البروتوكول الأصلي المصممة خصيصا لتدفق الكثافة الأقصائية الوظيفية الرقيقة 4 ميكرومتر أو الأقسام المجمدة الثابتة موضحة في الشكل 3. يقدم الجدول 1 قائمة بالأجسام المضادة (مع التخفيفات) المستخدمة في جولات IBEX 1-6.
- تثبيت
- قم بإعداد 40 مل من المخزن المؤقت للتثبيت عن طريق إضافة 10 مل من مخزون التثبيت إلى أنبوب مخروطي سعة 50 مل يحتوي على 30 مل من البارد 1x PBS.
- باستخدام زوج من الملقط ، انقل الأنسجة المثبتة على المنصات إلى مخزن التثبيت واحتضانها لمدة 24 ساعة عند 4 درجات مئوية.
- صب المثبت واستبدله ب 40 مل من 1x PBS البارد واحتضانه لمدة 10 دقائق عند 4 درجات مئوية.
- تلطيخ
- أضف 1 مل من المخزن المؤقت للحجب (1٪ BSA ، 0.3٪ Triton-X-100 ، 1٪ Fc Block في 1x PBS مفلتر بمرشح حقنة 0.22 ميكرومتر) إلى كل بئر وأدخل منصات الأنسجة. قم بحظر لمدة ساعتين على الأقل في درجة حرارة الغرفة على كرسي هزاز مضبوطة على سرعة منخفضة (30 دورة في الدقيقة).
ملاحظة: تأكد من محاذاة الشق على المنصة والبستان في البئر. هذه الخطوة ليست حساسة للوقت ويمكن القيام بها بين عشية وضحاها عند 4 درجات مئوية. - قم بإعداد 0.8 مل من محلول الأجسام المضادة / الصبغة في أنبوب الطرد المركزي الدقيق وجهاز الطرد المركزي عند 10,000 × جم لمدة 5 دقائق في درجة حرارة الغرفة. انقل 0.75 مل إلى بئر نظيف من لوحة الحضانة المكونة من 9 آبار وأدخل منصة مغسولة.
- لف اللوحة بورق الألمنيوم واحتضانها لمدة ساعتين على الأقل في درجة حرارة الغرفة على هزاز مضبوطة على سرعة منخفضة (30 دورة في الدقيقة).
- اغسل المنصة في أنبوب مخروطي سعة 50 مل مع 40 مل من 1x PBS لمدة 10 دقائق عند 4 درجات مئوية. النظام الأساسي جاهز الآن لإدخاله في محول التصوير.
- أضف 1 مل من المخزن المؤقت للحجب (1٪ BSA ، 0.3٪ Triton-X-100 ، 1٪ Fc Block في 1x PBS مفلتر بمرشح حقنة 0.22 ميكرومتر) إلى كل بئر وأدخل منصات الأنسجة. قم بحظر لمدة ساعتين على الأقل في درجة حرارة الغرفة على كرسي هزاز مضبوطة على سرعة منخفضة (30 دورة في الدقيقة).
- تبيض
- بعد كل جولة من التلوين والتصوير ، قم بتبييض الفلوروفورات باستخدام عامل تقليل الإستر بوروهيدريد الليثيوم (LiBH4). سيؤدي هذا العلاج إلى القضاء على إشارات التألق من Alexa Fluor (AF) 488 و AF647 و AF750 ولكن ليس من AF594 والصبغة النووية Hoechst.
تنبيه: بوروهيدريد الليثيوم شديد التفاعل مع الماء. يتم إطلاق غازات الهيدروجين القابلة للاشتعال عند ملامستها للماء. يجب التخلص من بوروهيدريد الليثيوم المستهلك والمستهلكات الملوثة ببوروهيدريد الليثيوم كنفايات خطرة. - تحضير 5 مل من محلول LiBH4 1.5 مجم / مل في الماء المقطر (في غطاء كيميائي) واحتضانه لمدة 30 دقيقة في درجة حرارة الغرفة.
ملاحظة: سيفقد محلول LiBH4 فعاليته في الاختزال / التبييض عند تحضيره قبل >4 ساعات من الاستخدام. - انقل 1 مل من محلول LiBH4 إلى بئر نظيف من لوحة الحضانة المكونة من 9 آبار وأدخل المنصة المغسولة لمدة 60 دقيقة في درجة حرارة الغرفة.
- اغسل المنصة لفترة وجيزة في 20 مل من 1x PBS في أنبوب مخروطي الشكل وتحقق من إشارة التألق المتبقية باستخدام أعلى إعداد ليزر لتعويض Z في جولة التصوير السابقة قبل المتابعة إلى جولات تلطيخ لاحقة.
- كرر حجب العينة لمدة ساعتين في درجة حرارة الغرفة قبل الانتقال إلى خطوة حضانة الجسم المضاد التالية.
- بعد كل جولة من التلوين والتصوير ، قم بتبييض الفلوروفورات باستخدام عامل تقليل الإستر بوروهيدريد الليثيوم (LiBH4). سيؤدي هذا العلاج إلى القضاء على إشارات التألق من Alexa Fluor (AF) 488 و AF647 و AF750 ولكن ليس من AF594 والصبغة النووية Hoechst.
4. إجراء التصوير
- تجميع محولات / منصات التصوير
- أضف 0.1 مل من 1x PBS إلى منتصف القاع الزجاجي لطبق تصوير مقاس 3.5 سم واتركه جانبا. قم بربط حلقة ضبط الارتفاع بشكل غير محكم في اتجاه عقارب الساعة في الغطاء الخارجي وقم بتركيب المنصة في الحامل البلاستيكي الداخلي (محاذاة الشق والبستان). قم بتأمين النظام الأساسي باستخدام شريط التمرير.
- ضع محول التصوير المجمع على الطبق السفلي الزجاجي وقم بخفض حلقة ضبط الارتفاع بعناية حتى تلامس الأنسجة المخزن المؤقت. تجنب تدوير المنصة في قاع الزجاج.
- بمجرد الوصول إلى المسافة المثلى من الزجاج ، أضف 0.2 مل من 1x PBS على الأنسجة (الآن الجانب السفلي لأعلى) لتجنب جفاف الأنسجة أثناء التصوير.
- التصوير متحد البؤر
- قم بتشغيل جميع مكونات المجهر متحد البؤر المقلوب ، بما في ذلك الكمبيوتر والمجهر والليزر ومصدر ضوء LED لاستخدام العدسة. ابدأ برنامج الحصول على الصور .
- حدد الهدف المناسب (على سبيل المثال ، 20x أو 40x) وأضف وسيط الغمر المناسب. على سبيل المثال ، يتم استخدام هدف مائي 20x في هذه الدراسة. يضاف ~ 200 ميكرولتر من الماء إلى الهدف لتجنب الجفاف أثناء الحصول على الصور الطويلة.
- ضع طبق التصوير المجمع في حامل العينة على مرحلة المجهر وتأكد من أن العينة آمنة (لا تتحرك).
ملاحظة: عند وضع العينة المجمعة على مرحلة المجهر ، لاحظ موضع الشق واستخدم نفس الموضع للدورات التكرارية لتسهيل محاذاة الصورة. من المهم الحفاظ على محول التصوير في إعداد الارتفاع الأمثل للجولات المتتالية. - قم بتوسيط العينة باستخدام عنصر تحكم XY ورفع الهدف إلى زجاج الغطاء. بالنظر من خلال العدسة واستخدام إشارة Hoechst كمرجع ، حرك الهدف للحصول على تركيز دقيق على الأنسجة.
- حدد خطوط الليزر المناسبة أو اضبط WLL على أطياف الإثارة والانبعاث للفلوروفورات المستخدمة في تلطيخ عينة الأنسجة. تخلص من التداخل بين القنوات عن طريق ضبط الإعدادات وإضافة تسلسلات إذا كانت الفلوروفورات لها أطياف إثارة مماثلة.
- اختر معلمات الحصول على الصور التالية: سرعة المسح الضوئي 600 هرتز ودقة XY 1024 × 1024 ومتوسطات 3 أسطر والمسح الضوئي ثنائي الاتجاه .
- اختر معلمات Z-stack التالية: (1) استخدم حجم الخطوة Z المحسن للهدف المستخدم، (2) حدد بداية المكدس ونهايته، (3) اضبط معلمات تعويض Z لتحقيق سطوع متساو في جميع أنحاء المكدس، و (4) احصل على مكدس اختبار مكون من 1 بلاط بمتوسط واحد.
- حدد المنطقة المراد تصويرها واحصل على مكدس تجانب Z عالي الدقة.
النتائج
الصفاق عبارة عن بنية غشائية يقل سمكها عن 1 مم تبطن سطح جدار البطن وهي متجاورة مع أسطح أعضاء البطن. يتكون من البصت المتوسط السطحي والنسيج الضام الأساسي الذي تتخلله الخلايا الدهنية والخلايا الليمفاوية والضامة والخلايا الليفية ، وكذلك الأوعية الدموية واللمفاوية. غالبا ما تنبع الأورام الخبيثة البريتونية من نقائل الورم البطني (على سبيل المثال، سرطان المبيض أو سرطان المعدة)18 أو، في كثير من الأحيان، يمكن أن تكون أورام أولية في الصفاق (على سبيل المثال، ورم الظهارة المتوسطة)19. غالبا ما تكون آفات الورم الصغيرة (<1 سم) معقدة للغاية ولكنها قابلة للتوصيف ثلاثي الأبعاد باستخدام التقنية الموضحة. يتم استخدام إسقاط أقصى لخمسة أقسام متحد البؤر لعرض العينة بأكملها المثبتة على منصة (الشكل 4 ، في الزاوية اليسرى العليا). تم استخدام ثلاثة أجسام مضادة مترافقة أولية (AF488-CD44 و AF594-CD45 و AF647-Podoplanin) جنبا إلى جنب مع الصبغة النووية Hoechst في الجولة الأولى من IBEX (IBEX1 ، الشكل 4). تظهر آفات الورم من خلال الهياكل الشبيهة بالوردة الإيجابية المزدوجة ل CD44 و Podoplanin وتظهر ترتيبا للنوى المميزة لورم الظهارة المتوسطة الحليمي.
تم تحديد الخلايا السرطانية باستخدام مورفولوجيا الخلايا واثنين من الأجسام المضادة لأن كلا من مضاد بودوبلانين ومضاد CD44 يتعرفان على الخلايا غير السرطانية ، كما يتضح من اكتشاف الأوعية اللمفاوية عن طريق مضاد بودوبلانين وارتباط الجسم المضاد CD44 بمجموعات فرعية من الخلايا المناعية. ثم يتم التقاط مناطق الاهتمام الأصغر (ROIs) باستخدام تنسيق مسح ضوئي للبلاط بدقة أعلى بأحجام Z-step محسنة لتقديم إسقاطات ثلاثية الأبعاد (الشكل 5 أ). تم أخذ المنصات من خلال إجراءات التلوين التكرارية ، وتم تصوير نفس عائد الاستثمار في دورات IBEX 1-6. يتم تجميع الصور التمثيلية للورم (الصندوق الأصفر) وواجهات الهيكل اللمفاوي الثلاثي للورم (TLS) (الصندوق الأزرق) في الشكل 5B-M.
يشير وجود TLS وكثافة الخلايا الإيجابية CD3 إلى تسلل كبير للخلايا المناعية20 وربما الاستجابة للأدوية المعدلةللمناعة 21. وتجدر الإشارة إلى أن TLS والجزء الأكبر من آفات الورم موجودان في أعماق Z مختلفة من الأنسجة ، كما هو موضح في مقارنة إسقاطات المكدس للأقسام البصرية المختلفة في الشكل 6 ، مما يسلط الضوء على فوائد التصوير ثلاثي الأبعاد والبيولوجيا المفقودة المحتملة عند تطبيق التصوير ثنائي الأبعاد على الهياكل ثلاثية الأبعاد. يصبح الطابع ثلاثي الأبعاد لهذه الآفات أكثر وضوحا في ملفات الفيلم (الفيلم 1-12) ، والتي تصور عروض الحجم للآفات الفردية في الشكل 5.
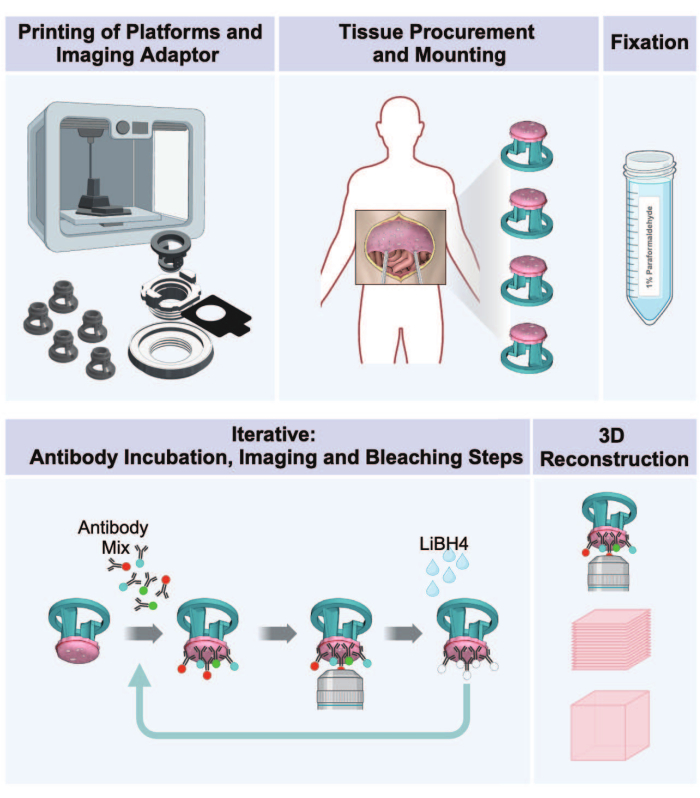
الشكل 1: سير العمل من الطباعة ثلاثية الأبعاد إلى التصوير ثلاثي الأبعاد للأورام الصفاقية. يتكون البروتوكول من سلسلة من خمس خطوات لإعداد صور ثلاثية الأبعاد متعددة الإرسال من الأنسجة البريتونية الحاملة للورم. (1) طباعة منصات استقبال الأنسجة وأجزاء محول التصوير ولوحة الحضانة. (2) شراء الأنسجة وإجراءات التركيب. (3) التثبيت مع بارافورمالدهايد. (4) دورات تلطيخ وتصوير IBEX. (5) إعادة بناء ثلاثية الأبعاد باستخدام برامج التصوير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مكونات الأجهزة مع واجهة الأنسجة للتصوير ثلاثي الأبعاد. (أ) رسم تخطيطي لتجميع المنصة داخل محول التصوير. (ب) لوحة حضانة مكونة من 9 آبار. (ج) صور فوتوغرافية لمكونات محول الصور مع التجميع. (د) الصفاق الحامل لورم الظهارة المتوسطة كما لوحظ أثناء تنظير البطن التشخيصي. (ه) تركيب الأنسجة على المنصة. (إف ، ز) الصفاق الحامل للورم مثبت على المنصات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
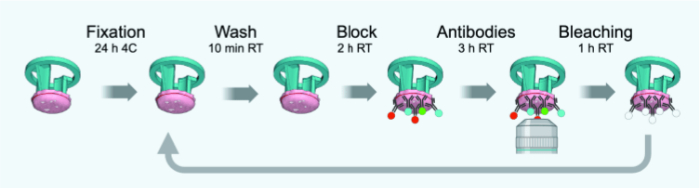
الشكل 3: الرسم التخطيطي للجدول الزمني لدورات IBEX. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
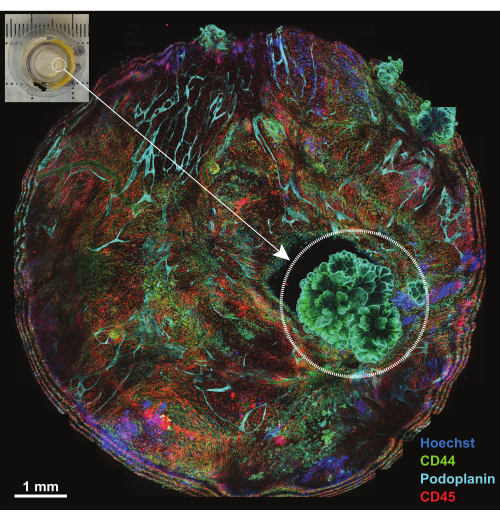
الشكل 4: نظرة عامة على المنصة بعد الحضانة باستخدام لوحة IBEX1. الحد الأقصى للإسقاط للمنصة بأكملها بعد الحضانة باستخدام لوحة IBEX1 (Hoechst و AF488-CD44 و AF594-CD45 و AF647-Podoplanin). تسلط الدائرة المتقطعة الضوء على الورم. داخلي: صورة للبريتونيوم الحامل للورم مثبتة على منصة التصوير. شريط المقياس: 1 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
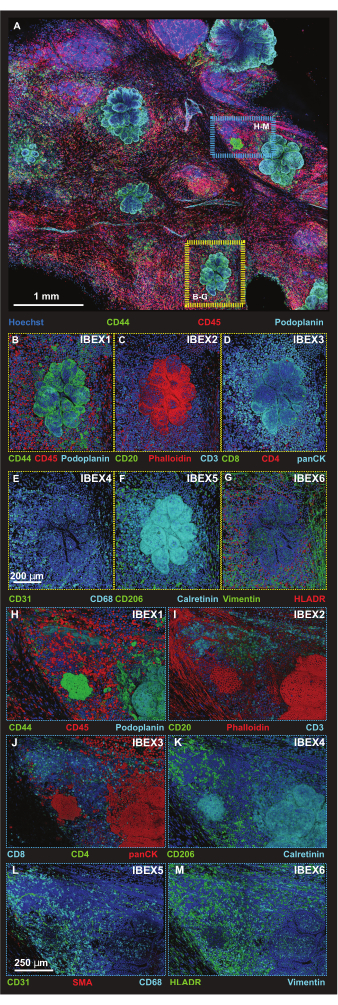
الشكل 5: صور التألق المناعي عالية الدقة لمناطق منصة محددة. (أ) الحد الأقصى للإسقاط لصورة مكدس Z المدمجة المكونة من 56 بلاطة التي تم الحصول عليها بعد الحضانة باستخدام لوحة IBEX1 (Hoechst وAF488-CD44 وAF594-CD45 وAF647-Podoplanin). المستطيل الأصفر: آفة الورم الموضحة في اللوحات (B-G). المستطيل الأزرق: واجهة البنية اللمفاوية للورم الثلاثي الموضحة في (H-M). (ب - ز) آفة ورم فردية واحدة مع لوحة IBEX 1-6 في تجسيد الحجم. (ب) IBEX1 ، أخضر: CD44 ، أحمر: CD45 ، سماوي: بودوبلانين. (ج) IBEX2 ، أخضر: CD20 ، أحمر: F-actin ، سماوي: CD3. (د) IBEX3 ، أخضر: CD8 ، أحمر: CD4 ، سماوي: panCK. (ه) IBEX4 ، أخضر: CD31 ، سماوي: CD68. (F) IBEX5 ، أخضر: CD206 ، سماوي: Calretinin. (ز) IBEX6 ، أخضر: Vimentin ، أحمر: HLADR. (H-M) واجهة هيكل ليمفاوية فردية للورم مع لوحة IBEX 1-6 في عرض الحجم. (ح) IBEX1 ، أخضر: CD44 ، أحمر: CD45 ، سماوي: بودوبلانين. (I) IBEX2 ، أخضر: CD20 ، أحمر: F-actin ، سماوي: CD3. (ي) IBEX3 ، أخضر: CD4 ، أحمر: panCK ، سماوي: CD8. (K) IBEX4 ، أخضر: CD31 ، أحمر: SMA ، سماوي: CD68. (L) IBEX5 ، أخضر: CD206 ، سماوي: كالريتينين. (م) IBEX6 ، أخضر: HLADR ، سماوي: Vimentin. جميع اللوحات ، أزرق: Hoechst. قضبان المقياس: (أ ، 1 مم) ؛ (ب إم ، 250 ميكرومتر). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
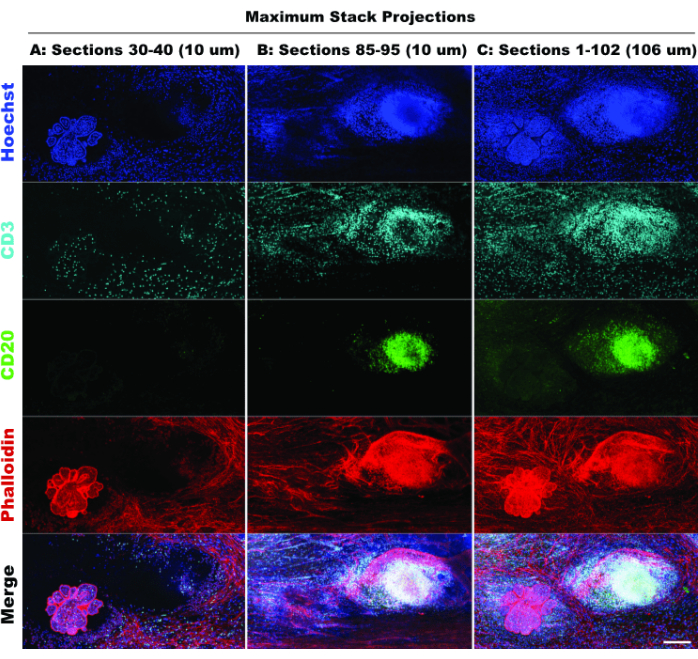
الشكل 6: محاكاة التصوير ثنائي الأبعاد. تؤكد مقارنة الإسقاطات المحدودة (10 أقسام بصرية) والمكدس الكامل (102 قسما بصريا) فقدان سياق الأنسجة في المحاكاة ثنائية الأبعاد. (أ) الإسقاط الأقصى للأقسام 30-40 (10 ميكرومتر). (ب) الإسقاط الأقصى للأقسام 85-95 (10 ميكرومتر). (ج) الإسقاط الأقصى للأقسام 1-102 (~ 100 ميكرومتر). جميع اللوحات ، IBEX2 (Hoechst ، AF488-CD20 ، AF647-CD3 ، AF790-phalloidin). شريط المقياس: 200 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: الأجسام المضادة المستخدمة لألواح IBEX الفردية. الرجاء النقر هنا لتنزيل هذا الجدول.
الفيلم 1: عرض حجم متحرك للآفة الفردية باستخدام لوحة IBEX 1 (أزرق: Hoechst ، أخضر: CD44 ، أحمر: CD45 ، سماوي: Podoplanin). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 2: عرض حجم متحرك للآفة الفردية باستخدام لوحة IBEX 2 (أزرق: Hoechst، أخضر: CD20، أحمر: F-actin، سماوي: CD3). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 3: عرض حجم متحرك للآفة الفردية باستخدام لوحة IBEX 3 (الأزرق: Hoechst ، الأخضر: CD8 ، الأحمر: CD4 ، السماوي: panCK). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 4: عرض حجم متحرك للآفة الفردية باستخدام لوحة IBEX 4 (أزرق: Hoechst ، أخضر: CD31 ، سماوي: CD68). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 5: عرض حجم متحرك للآفة الفردية باستخدام لوحة IBEX 5 (أزرق: Hoechst، أخضر: CD206، سماوي: Calretinin). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 6: عرض حجم متحرك للآفة الفردية باستخدام لوحة IBEX 6 (الأزرق: Hoechst، الأخضر: Vimentin، الأحمر: HLADR). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 7: عرض حجم متحرك لواجهة الآفة اللمفاوية الثلاثية مع لوحة IBEX 1 (الأزرق: Hoechst ، الأخضر: CD44 ، الأحمر: CD45 ، السماوي: Podoplanin). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 8: عرض حجم متحرك لواجهة الآفة اللمفاوية الثلاثية مع لوحة IBEX 2 (الأزرق: Hoechst ، الأخضر: CD20 ، الأحمر: F-actin ، السماوي: CD3). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 9: عرض حجم متحرك لواجهة الهيكل اللمفاوي الثلاثي والآفة مع لوحة IBEX 3 (الأزرق: Hoechst ، الأخضر: CD8 ، الأحمر: CD4 ، السماوي: panCK). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 10: عرض حجم متحرك لواجهة الآفة اللمفاوية الثلاثية مع لوحة IBEX 4 (الأزرق: Hoechst ، الأخضر: CD31 ، الأحمر: SMA ، سماوي: CD68). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 11: عرض حجم متحرك لواجهة الآفة اللمفاوية الثلاثية مع لوحة IBEX 5 (الأزرق: Hoechst ، الأخضر: CD206 ، السماوي: Calretinin). الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم 12: عرض حجم متحرك لواجهة البنية اللمفاوية الثلاثية والآفة مع لوحة IBEX 6 (الأزرق: Hoechst ، الأخضر: Vimentin ، الأحمر: HLADR). الرجاء النقر هنا لتنزيل هذا الفيلم.
ملف تكميلي 1: طباعة ملف للوحة الحضانة. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 2: طباعة ملف للمنصات الفردية البالغ عددها 36. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 3: طباعة ملف لحلقة ضبط الارتفاع. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 4: طباعة ملف للغطاء الخارجي. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 5: ملف القطع بالليزر لشريط التمرير. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تقتصر تقنيات تعدد الإرسال الحالية للتصوير الفلوري على الأقسام الرقيقة ولا توفر سياقا ثلاثي الأبعاد. تصف الدراسة الحالية بروتوكولا لتطبيق طريقة التصوير IBEX16،17 على الأورام السليمة المثبتة على منصات مصممة خصيصا. تم اختيار آفات الورم البريتوني لتسليط الضوء على هذه التقنية حيث أن المرضى عادة ما يعانون من رواسب ورمية متعددة ذات حجم مثالي يتم أخذها جنبا إلى جنب مع الصفاق الطبيعي المحيط كجزء من جراحة الاختزال الخلوي القياسية التي يتم إجراؤها في معظم مراكز الإحالة من الدرجة الثالثة في جميع أنحاء العالم22،23. ومع ذلك ، فإن البروتوكول قابل للتطبيق على النقائل المتني وأورام نموذج الفئران على حد سواء باستخدام شرائح الورم كما تم وصفه سابقا24،25. علاوة على ذلك ، يمكن تعديل قطر حلقة التثبيت على المنصات وفقا للاحتياجات التجريبية / الأنسجة ، على الرغم من أن المساحات الأكبر عرضة لترهل الأنسجة وأوقات التصوير الممتدة. بغض النظر عن مصدر الأنسجة وحجمها ، يجب الحفاظ على الحد الأدنى من الوقت بين الشراء والحفظ لضمان الجودة المثلى26. يضمن إعداد طاولة الإعداد في غرفة العمليات المعالجة الفورية عند مشاركة المرضى. يجب ملاحظة الوقت من شراء الأنسجة إلى تثبيت الأنسجة لضمان إمكانية المقارنة بين التجارب.
يتم أخذ عينات الأنسجة من خلال بروتوكول IBEX حيث يتم إجراء حوامل كاملة ، أي التثبيت والتصوير بالإضافة إلى خطوات التبييض ، باستخدام الأنسجة السليمة الملصقة على المنصة. يضمن هذا الحفاظ على العينة من خلال دورات التلوين / التصوير / التبييض التكرارية ، نظرا لعدم وجود واجهة شبه دائمة للقسم الزجاجي ولا حاجة لوضع / إزالة زجاج الغطاء بشكل متكرر من الأنسجة ، وكلاهما يمكن أن يؤدي إلى فقدان الأنسجة. لتوفير الكواشف ، تضمن اللوحة ذات 9 الآبار المصممة خصيصا ملاءمة مثالية للمنصة بأقل قدر من "الحجم الميت". جميع الأجسام المضادة المستخدمة في التلوين هي أجسام مضادة مترافقة أولية ، وجميع مترافقات الفلوروفور المستخدمة (باستثناء صبغة Hoechst) هي أصباغ Alexa Fluor ، والتي تم اختيارها لسمعها الممتاز27. تم تصميم لوحات الأجسام المضادة الأخرى للفلوروفورات وفقا للبيانات المودعة من مجتمع التصوير IBEX ، وهو مستودع عالمي مفتوح يجمع مجموعات البيانات والبروتوكولات والتعليقات من مجموعة دولية من العلماء باستخدام IBEX (https://ibeximagingcommunity.github.io/ibex_imaging_knowledge_base/). تم اختيار تسلسل لوحات الأجسام المضادة بعناية. بشكل عام ، تم وضع أهداف منخفضة الوفرة في دورات سابقة. دورة IBEX 1 (CD45 و CD44 و Podoplanin) هي استثناء حيث تم استخدام هذه العلامات الثلاث لتحديد آفات الورم في جولة التلوين الأولية.
لوحات الأجسام المضادة صغيرة نسبيا لتقليل الحديث المتبادل للقناة في إعدادات كثافة الليزر العالية ، وهو أمر ضروري لتصوير الأنسجة بشكل أعمق باستخدام مجهر متحد البؤر. تم تضمين مترافقات AF750 حيثما أمكن ذلك لتوسيع اللوحة من 2 إلى 3 أجسام مضادة. وتجدر الإشارة إلى أنه لا يوجد العديد من المترافقات AF750 المتاحة تجاريا ، وحقيقة أن هدف هذه القناة يجب أن يكون وفيرا للغاية يحد من استخدام هذا الفلوروفور. مثال على ذلك هو الجسم المضاد المضاد لضمور العضلات الشوكي المترافق AF750 الذي تم استخدامه في هذا البروتوكول. على الرغم من أن هذا استنساخ يعمل بشكل موثوق مع AF488 أو AF594 ، إلا أن شدة الإشارة لهذا الجسم المضاد المقترن ب AF750 أقل بكثير ، مما يجعل من الصعب إنشاء مكدسات Z عالية الجودة.
تعتبر حضانات الأجسام المضادة لمدة 3 ساعات في درجة حرارة الغرفة قصيرة مقارنة بالبروتوكول الأصلي وتعكس على الأرجح انخفاض كثافة الخلايا في عينات الأنسجة الصفاقية. في المقابل ، كانت خطوة التبييض مع 1.5 مجم / مل بوروهيدريد الليثيوم لمدة 60 دقيقة أكثر صرامة. تم تحديد هذه المعلمات تجريبيا ويمكن أن تختلف باختلاف الأنسجة والأجسام المضادة المستخدمة. وتجدر الإشارة إلى أنه بسبب الحضانة في محلول التبييض التفاعلي ، يمكن أن تكون فقاعات الهواء الصغيرة محاصرة في الأنسجة. كلما أصبح هذا واضحا أثناء خطوة التصوير من الإجراء ، تم تفريغ العينات عن طريق تعريض المنصة في لوحة الحضانة المكونة من 9 آبار للتفريغ باستخدام علبة شفط. لا يمكن إجراء تسجيلات عينات ITK البسيطة ، التي غالبا ما يتم تطبيقها في دراسات IBEX ، بسبب إدخال البيانات الهائلة إلى برنامج تحليل الصور. ومع ذلك ، يمكن التعرف بسهولة على مجموعات الخلايا المتطابقة من خلال مقارنة مجموعات البيانات الفردية. بشكل عام ، تم توقيت الدورات التكرارية بحيث يمكن إكمال دورة واحدة في يوم واحد ، حيث يستغرق التصوير معظم الدورة بأكملها (~ 8 ساعات).
هذه التقنية لها قيود تستحق الذكر. والوقت المطلوب للبروتوكول يجعل من غير المرجح أن تعتمد هذه الطريقة على نطاق واسع بل في ظروف مختارة. نتصور أن هذا البروتوكول يستخدم بشكل أفضل لتوصيف التغيرات في البيئة المكروية المناعية للورم قبل العلاج وبعده (على سبيل المثال ، الأجسام المضادة ثنائية النوع للعلاج المناعي للسرطان) أو للتنبؤ بنتائج العلاج العامة. على الرغم من أن هذا البروتوكول يقدم توصيفا ثلاثي الأبعاد ، إلا أنه من غير المعروف مقدار المنطقة التي يجب استجوابها لوصف الورم بشكل فعال ، بما في ذلك مجموعات الخلايا المعقدة28. قد يكون الوصول إلى الأنسجة البشرية الطازجة أمرا صعبا أيضا في بعض المراكز ، لكننا نتصور أن هذا البروتوكول ينطبق على النماذج الحيوانية أيضا29.
تتنوع تطبيقات هذا البروتوكول ، من الأبحاث الأساسية التي تحلل تركيبة TME عبر أورام صلبة متعددة إلى خزعات ما قبل / بعد الأنسجة للمرضى المسجلين في التجارب السريرية. على الرغم من أن البيانات التي يمكن الحصول عليها من قسم الأنسجة السميكة لطبقة خلية واحدة هائلة ، إلا أنه يمكن التغاضي عن البيولوجيا ثلاثية الأبعاد بسهولة. نرى التصوير ثلاثي الأبعاد كعامل مساعد لتقنيات البيولوجيا المكانية الأخرى ، ومن المحتمل أن يساعد في اختيار أقسام ثنائية الأبعاد للتحليلات اللاحقة. بالإضافة إلى ذلك ، هناك بروتوكول لدمج مكون التصوير المباشر على مدار عدة ساعات باستخدام تركيب الأنسجة الموصوفة وإعداد التصوير مستمر بنشاط.
Disclosures
اي.
Acknowledgements
تم دعم هذا البحث من قبل برنامج البحوث الداخلية التابع للمعاهد الوطنية للصحة والمعهد الوطني للسرطان (NCI). تم دعم هذا البحث أيضا جزئيا من قبل CAT-I ، وهو تعاون بحثي بين NIAID و NCI ، بقيادة رونالد جيرمان. نود أن نعرب عن امتناننا لأندريا رادتكي على جهودها الحماسية والتعاونية. استفادت خبرتها بشكل كبير من هذه الدراسة.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor Plus 750 Phalloidin | Invitrogen | A30105 | F-actin dye |
| Alexa Fluor 488 anti-human CD206 (MMR) Antibody | BioLegend | 321114 | antibody |
| Alexa Fluor 488 anti-human CD31 Antibody | BioLegend | 303110 | antibody |
| Alexa Fluor 488 anti-human CD4 Antibody | BioLegend | 300519 | antibody |
| Alexa Fluor 488 anti-human HLA-DR Antibody | BioLegend | 307656 | antibody |
| Alexa Fluor 488 anti-mouse/human CD44 Antibody | BioLegend | 103016 | antibody |
| Alexa Fluor 594 anti-human CD45 Antibody | BioLegend | 304060 | antibody |
| Alexa Fluor 647 Anti-Calretinin antibody [EP1798] | Abcam | ab214244 | antibody |
| Alexa Fluor 647 anti-human CD3 Antibody | BioLegend | 300416 | antibody |
| Alexa Fluor 647 anti-human CD8 Antibody | BioLegend | 344726 | antibody |
| Alexa Fluor 647 anti-human Podoplanin Antibody | BioLegend | 337007 | antibody |
| Alexa Fluor 647 anti-Vimentin Antibody | BioLegend | 677807 | antibody |
| Alexa Fluor 647 CD68 Antibody (KP1) | Santa Cruz | sc-20060AF647 | antibody |
| Alexa Fluor 750 Cytokeratin, pan Antibody (AE-1/AE-3) | Novus | NBP2-33200AF750 | antibody |
| Alexa Fluor 750 Human alpha-Smooth Muscle Actin Antibody | R&D | IC1420S | antibody |
| Alexa Fluor 488 CD20 Monoclonal Antibody (L26) eBioscience | Thermo Fisher | 53-0202-82 | antibody |
| Antibiotic-Antimycotic | Gibco | 15240096 | supplement harvest medium |
| BioMed Clear Resin (Form 3) | FormLabs | RS-F2-BMCL-01 | resin used for platform + incubation plate |
| BSA | Sigma | A7906-500g | blocking solution component |
| Cast acrylic 1/32" thick | material used for cutting slider | ||
| CleanStation DT3 | Stratasys | DT3 | post processing for height adjuster & outer lid |
| Container, Specimen | McKesson | 870203 | transfer of tissue from perating table to prep table |
| CorelDraw | CorelDRAW | Software to prepare the vector-based design file for laser cutting | |
| Cytofix | BD Bioscience | 554655 | fixative |
| Dish 15 cm | Falcon | 353025 | dish used during mounting |
| Dish 35 mm No. 1.5 Coverslip 14 mm Glass Diameter Uncoated | Matek | P35G-1.5-14-C | imaging dish |
| DMEM (no glucose) | Gibco | 11966025 | harvest medium |
| Fc Block | BD Bioscience | 564220 | blocking solution component |
| Form 3B+ | Formlabs | Form 3B+ | printer used for platform + incubation plate |
| Form Cure | Formlabs | FH-CU-01 | post processing for platform + incubation plate |
| Form Wash | Formlabs | FH-WA-01 | post processing for platform + incubation plate |
| GrabCAD Print | GrabCAD | GrabCAD Print | Software to prepare models for Stratasys printers |
| Hoechst 33342 10 mg/mL | Biotium | 40046 | nuclear dye |
| J826 Prime 3D Printer | Stratasys | J826 | printer used for height adjuster & outer lid |
| LAS X | Leica | LAS X | Confocal software |
| Laser cutting system | Universal Laser Systems | ULS PLS6.150D | CO2 Laser cutting used for slider |
| Lithium Borohydride | STREM Chemicals | 93-0397 | bleaching chemical |
| PBS, pH 7.4 | Gibco | 10010023 | base Buffer for washing, blocking, staining |
| PreForm | FormLabs | PreForm | Software to prepare models for Formlab printers |
| Silk sutures 2-0 | Ethicon | A305.O35 | affix tissue to platform |
| Stellaris 8 WLL confocal microscope | Leica | STELLARIS 8 | Confocal Imaging |
| Syringe filter | filter ab solution | ||
| Triton X-100 | American Bio | AB02025-00100 | permeabelizing reagent, blocking solution component |
| Vero ContactClear | Stratasys | CTT610, 4 KG | resin used for height adjuster & outer lid |
| Warming Tray | Spring USA | ST-1220 | keep media and tissue warm |
| Water, distilled | Gibco | 15230-170 | diluent for LiBH4 |
References
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Li, Z., Li, J., Bai, X., Huang, X., Wang, Q. Tumor microenvironment as a complex milieu driving cancer progression: A mini-review. Clin Transl Oncol. , (2024).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nat Rev Clin Oncol. 14 (12), 717-734 (2017).
- Roma-Rodrigues, C., Mendes, R., Baptista, P. V., Fernandes, A. R. Targeting tumor microenvironment for cancer therapy. Int J Mol Sci. 20 (4), 840 (2019).
- Sheng, W., et al. Multiplex immunofluorescence: A powerful tool in cancer immunotherapy. Int J Mol Sci. 24 (4), 3086 (2023).
- Bollhagen, A., Bodenmiller, B. Highly multiplexed tissue imaging in precision oncology and translational cancer research. Cancer Discov. 14 (11), 2071-2088 (2024).
- Jin, Y., et al. Advances in spatial transcriptomics and its applications in cancer research. Mol Cancer. 23 (1), 129 (2024).
- Kashyap, A., et al. Quantification of tumor heterogeneity: From data acquisition to metric generation. Trends Biotechnol. 40 (6), 647-676 (2022).
- Chang, Q., Hedley, D. Emerging applications of flow cytometry in solid tumor biology. Methods. 57 (3), 359-367 (2012).
- Zhang, L., et al. Single-cell analyses inform mechanisms of myeloid-targeted therapies in colon cancer. Cell. 181 (2), 442-459.e29 (2020).
- Wang, X. Q., et al. Spatial predictors of immunotherapy response in triple-negative breast cancer. Nature. 621 (7980), 868-876 (2023).
- Maestri, E., et al. Spatial proximity of tumor-immune interactions predicts patient outcome in hepatocellular carcinoma. Hepatology. 79 (4), 768-779 (2024).
- Wang, Q., et al. Role of tumor microenvironment in cancer progression and therapeutic strategy. Cancer Med. 12 (10), 11149-11165 (2023).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Lin, J. R., et al. Multiplexed 3d atlas of state transitions and immune interaction in colorectal cancer. Cell. 186 (2), 363-381.e19 (2023).
- Radtke, A. J., et al. Ibex: An iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- Radtke, A. J., et al. Ibex: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proc Natl Acad Sci U S A. 117 (52), 33455-33465 (2020).
- Van Baal, J. O., et al. The histophysiology and pathophysiology of the peritoneum. Tissue Cell. 49 (1), 95-105 (2017).
- Bridda, A., Padoan, I., Mencarelli, R., Frego, M. Peritoneal mesothelioma: A review. MedGenMed. 9 (2), 32 (2007).
- Demuytere, J., Ernst, S., Van Ovost, J., Cosyns, S., Ceelen, W. The tumor immune microenvironment in peritoneal carcinomatosis. Int Rev Cell Mol Biol. 371, 63-95 (2022).
- Wang, Q., et al. Heterogeneity of tertiary lymphoid structures predicts the response to neoadjuvant therapy and immune microenvironment characteristics in triple-negative breast cancer. Br J Cancer. , (2024).
- Kepenekian, V., et al. Peritoneal mesothelioma: Systematic review of hyperthermic intraperitoneal chemotherapy (HIPEC) protocol outcomes. Indian J Surg Oncol. 14 (Suppl 1), 39-59 (2023).
- Mcquade, C., Renton, M., Chouhan, A., Macdermott, R., O'brien, C. Review of imaging peritoneal disease and treatment. Can Assoc Radiol J. , (2024).
- Kenerson, H. L., et al. Tumor slice culture as a biologic surrogate of human cancer. Ann Transl Med. 8 (4), 114 (2020).
- Arrizabalaga, L., et al. Tumor slice culture system for ex vivo immunotherapy studies. Methods Cell Biol. 189, 55-69 (2024).
- Neumeister, V. M., et al. Quantitative assessment of effect of preanalytic cold ischemic time on protein expression in breast cancer tissues. J Natl Cancer Inst. 104 (23), 1815-1824 (2012).
- Panchuk-Voloshina, N., et al. Alexa dyes: A series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47 (9), 1179-1188 (1999).
- Rajaram, S., et al. Sampling strategies to capture single-cell heterogeneity. Nat Methods. 14 (10), 967-970 (2017).
- Bella, A., et al. Mouse models of peritoneal carcinomatosis to develop clinical applications. Cancers (Basel). 13 (5), 963 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved