Method Article
Iterative Bleaching Extends Multiplexity 접근법을 사용한 종양 함유 조직의 3차원 이미징
요약
이 논문에서는 복막 전이의 3차원 구조를 특성화하기 위해 최적화된 다중 면역형광 프로토콜에 대해 설명합니다.
초록
종양 미세환경(TME)의 공간적 이질성은 치료 반응의 중요한 결정 요인이며, 특히 면역 종양학 제제의 경우 성공 여부가 특정 면역 세포 하위 집단의 분포에 달려 있습니다. 지난 10년 동안 포르말린 고정, 파라핀 포매(FFPE) 또는 고정 동결 조직의 2차원 절편을 사용하여 TME의 상세한 해상도를 달성하기 위해 여러 정교한 기술이 도입되었습니다. 이러한 얇은 절편은 조달 및 분석이 더 쉽지만 종양을 안정적이고 포괄적으로 특성화하는 데 필요한 3차원 아키텍처가 부족합니다. 이러한 한계를 해결하기 위해 조직 장착 및 이미징 기술이 개발되어 원래 생체 내 상태의 종양 병변을 3차원으로 분석할 수 있습니다. 이 프로토콜은 인간 종양 조직의 조달, 맞춤형 인쇄 플랫폼에 샘플 장착, 고정 후 샘플에 대한 염색 절차를 간략하게 설명합니다. 다중화 면역형광 기술인 IBEX(Iterative Bleaching Extends Multiplexity)는 상업적으로 이용 가능한 항체를 사용하여 종양, 면역 및 기질 세포에 대한 최대 15개의 마커로 3차원 TME를 특성화하도록 조정되었습니다. 최적의 조직 방향을 보장하기 위해 맞춤형 인쇄 이미징 어댑터와 상업용 유리 바닥 접시가 있는 도립 백색광 레이저 컨포칼 현미경을 사용하여 최대 100μm의 이미징 깊이를 달성했습니다. 이 프로토콜은 다중화 면역형광 연구를 확장할 수 있는 IBEX 방법의 잠재력을 강조하여 TME 구성에 대한 보다 포괄적인 이해를 제공합니다.
서문
고형 종양은 세포 유형(악성 및 비악성), 세포외 기질 단백질 및 용해성 인자의 복잡한 구성으로 인해 매우 다양하다 1,2. 궁극적으로, 이 매우 복잡하고 이질적인 종양 미세환경(TME)은 면역요법과 같은 치료에 대한 감수성을 결정합니다 3,4. 이와 같이, 고도로 다중화된 면역형광 5,6 및 공간 전사체학7과 같은 기술이 적용되어 세포층 두께(~4μM) 절편에서 TME의 복잡성을 특성화했습니다.
단일 세포 염기서열 분석 및 유세포 분석 8,9,10과 같은 세포 분산 접근법과 달리, 이러한 기술은 공간 관계를 보존하여 세포 누화에 대한 중요한 정보를 제공하고 치료 반응 예측을 위한 잠재적인 바이오마커를 식별하는 데 사용할 수 있습니다 11,12,13. 그러나 종양 병변은 본질적으로 3차원(3D) 구조이며, 위에서 언급한 것과 같은 2D 접근 방식은 복잡한 세포 지형을 적절하게 포착하지 못합니다. 3D 생물학의 중요성은 환자 유래 종양 오가노이드 배양의 광범위한 활용으로 입증된 바와 같이 이 분야에서 높이 평가되어 왔습니다14. 그러나 오가노이드는 원래 in vivo TME의 세포 복잡성을 유지하지 못하기 때문에 면역조절 약물에 사용하거나 다양한 TME 세포 집단의 특성화에 대한 적용 가능성이 제한됩니다.
직렬 2D 단면에 대한 분석을 수행하고 3D 렌더링을 위해 이미지를 계산적으로 "연결"하는 것이 가능할 수 있지만 이 기술은 비용이 많이 들고 높은 충실도15로 수행하기가 어렵습니다. 재현 가능한 방식으로 3D 조직(예: 종양)을 비용 효율적으로 특성화하기 위해 원발성 복막암 환자의 복막 종양 병변을 사용하여 준비 및 다중 면역 형광 염색/분석을 위한 고유한 방법을 개발하고 시연했습니다.
잘 정립된 IBEX 기술(Iterative Bleaching Extends Multiplexity)16,17의 적응을 기반으로 하는 이 프로토콜은 조직 홀더 및 이미징 어댑터의 3D 프린팅, 복막 조직 조달 및 장착, 다양한 종양 및 세포 유형 마커를 사용한 다중 염색 주기, 고해상도 컨포칼 3D 이미징에 대해 자세히 설명합니다.
프로토콜
이 연구는 프로토콜 NCT01915225에 따라 국립보건원(National Institutes of Health Institutional Review Board)의 승인을 받아 수행되었습니다. 인체 조직은 진단용 복강경 검사 시 서면 동의서를 가지고 획득했습니다. 모든 조직은 육안 검사에 의해 결정되고 최종 조직병리학적 검사를 통해 확인된 바와 같이 종양이 있었습니다. 사용된 모든 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다. 전체 워크플로우에 대한 개략도는 그림 1에 나와 있습니다.
1. 인쇄 플랫폼, 이미징 어댑터 및 인큐베이션 플레이트
- 플랫폼 및 9웰 플레이트 부품에 대한 슬라이싱/3D 프린팅/후처리 절차(그림 2A-C에 요약됨)
- 슬라이싱: 슬라이싱 소프트웨어를 열고 디자인 파일을 로 가져옵니다. STL 형식(보충 파일 1 및 보충 파일 2). 최적의 인쇄를 위해 모델의 방향을 지정하고 지지대를 추가합니다. 의료용 프린터를 선택하고 투명 레진과 50μm 레이어 높이를 선택합니다. 인쇄 가능성을 확인하고 작업을 프린터로 보냅니다.
- 3D 프린팅: 프린터가 준비되었는지 확인합니다(올바른 수지 카트리지, 탱크 및 플랫폼이 제자리에 있음). 프린터의 터치스크린에서 슬라이서 소프트웨어에서 업로드된 작업을 선택하여 인쇄를 시작합니다. 인쇄가 완료되면 제거 도구를 사용하여 플랫폼에서 인쇄된 부품을 분리합니다.
- 후처리: 99% 이소프로필 알코올(IPA)로 채워진 세척 장치에서 부품을 15분 동안 헹굽니다. 세척 장치에서 부품을 제거하고 새 IPA에 5분 동안 담그십시오.
- 60 ° C에서 60 분 동안 부품을 사후 경화합니다. 플러시 커터를 사용하여 지지대를 제거합니다. 필요한 경우 미세한 사포를 사용하여 지지 표시를 사포로 닦습니다.
- 슬라이싱/3D 프린팅/높이 조절기 및 외부 덮개에 대한 후처리 절차(그림 2A-C에 요약됨)
- 슬라이싱: 인쇄 소프트웨어를 열고 에서 디자인 파일을 가져옵니다. STL 형식(보충 파일 3 및 보충 파일 4). 모형의 방향을 지정하고 재료를 지정합니다. 원하는 인쇄 모드(High mix, high speed)를 선택하고 모델 설정을 무광으로 마무리하도록 설정합니다. 인쇄 가능성을 확인하고 작업을 프린터로 보냅니다.
- 3D 프린팅: 프린터에 올바른 재료가 로드되어 있고 빌드 트레이가 깨끗한지 확인합니다. 프린터의 모니터 인터페이스에서 업로드된 작업을 선택하여 인쇄를 시작합니다. 인쇄가 완료되면 스크레이퍼 도구를 사용하여 빌드 트레이에서 인쇄된 부품을 부드럽게 제거합니다.
- 후처리: 인쇄된 조각을 워터젯 클리너 또는 교반 세척 시스템에 넣어 지지 재료를 제거합니다. 필요한 경우 핀셋 또는 플라이어와 같은 도구를 사용하여 수동 서포트 제거를 수행합니다.
- 플랫폼 슬라이더의 레이저 절단( 그림 2A, C 참조)
- 설계 준비: *를 가져옵니다. DWG 디자인 파일(보충 파일 5)을 사용합니다. 벡터 절단을 위해 선 색상을 빨간색(RGB)으로 설정합니다. 레이저 절단기로 작업을 보냅니다.
- 레이저 절단기 설정: 레이저 절단기 소프트웨어를 열고 설계 파일을 가져옵니다. 재료 유형을 선택하고 1/32" 두께의 아크릴에 대한 출력, 속도 및 해상도 설정을 조정합니다. 레이저 베드에 재료를 놓고 올바르게 정렬되었는지 확인하고 레이저의 초점을 맞춥니다.
- 레이저 절단: 레이저 절단 프로세스를 시작하고 재료가 올바르게 절단되고 있는지 모니터링합니다.
2. 인쇄된 플랫폼에 조직 장착
- 수확 배지 및 준비 테이블 준비
- 100mL의 DMEM(저포도당)에 Anti-Anti를 보충하고 필요할 때까지 37°C 인큐베이터(수확 배지)에 넣습니다.
- 고압증기멸균 3D 프린팅 플랫폼, 2-0 실크 봉합사 타이 팩, 가열판, 50mL의 예열 수확 배지가 들어 있는 샘플 컵, 30mL의 예열된 수확 배지가 들어 있는 15cm 배양 플레이트, 1.5mL의 수확 배지가 들어 있는 4개의 웰이 있는 24웰 플레이트(모두 가열판에 놓음)로 수술실에 "준비 테이블"을 설치합니다. 집게 1쌍과 수술용 가위 1쌍.
- 조직 절제 및 장착
참고: 조직은 수술실에서 얻습니다. 두께와 직경이 0.5mm 미만인 종양의 병소가 있는 복막 영역은 육안 검사에서 확인됩니다(그림 2D). 참고로, 하나의 플랫폼을 준비하기 위해 ~ 2cm2 의 조직 (복막)이 필요합니다.- 종양이 있는 복막을 밑에 있는 복벽, 근육 조직 및 근막에서 조심스럽게 분리합니다(외과 의사가 수행). 생성된 티슈 시트를 따뜻한 수확 배지가 들어 있는 샘플 컵으로 옮기고 가열판(준비 테이블)에 놓습니다.
- 수확 배지가 들어 있는 15cm 플레이트의 플랫폼에 조직을 장착합니다. 종양이 있는 조직(중피 쪽이 위를 향함)을 플랫폼의 작은 구멍쪽 위에 조심스럽게 드리우고 2-0 실크 봉합사로 제자리에 고정합니다. 준비된 조직 플랫폼을 수확 배지가 들어 있는 24웰 플레이트에 반대로(침수) 놓습니다(그림 2E-G).
알림: 플랫폼 표면의 주름을 방지할 수 있을 만큼 충분히 가르친 조직을 장착하되 원치 않는 생체역학적, 생리학적 변화를 유발할 수 있으므로 장력을 발생시키지 마십시오.
3. 정착/염색/표백 절차
참고: 4μm 얇은 FFPE 또는 고정 동결 절편에 맞게 조정된 원래 프로토콜의 변경 사항은 그림 3에 요약되어 있습니다. 표 1 은 IBEX 라운드 1-6에 사용되는 항체(희석 포함) 목록을 제공합니다.
- 고정
- 30mL의 차가운 1x PBS가 들어 있는 50mL 원뿔형 튜브에 10mL의 고정성 스톡을 추가하여 40mL의 고정 완충액을 준비합니다.
- 한 쌍의 겸자를 사용하여 플랫폼에 장착된 조직을 고정 완충액으로 옮기고 4°C에서 24시간 동안 배양합니다.
- 정착액을 디캔팅하고 40mL의 차가운 1x PBS로 교체하고 4°C에서 10분 동안 배양합니다.
- 얼룩
- 각 웰에 1mL의 차단 완충액(0.22μm 주사기 필터로 필터링된 1x PBS의 1% BSA, 0.3% Triton-X-100, 1% Fc 블록)을 추가하고 조직 플랫폼을 삽입합니다. 저속(30rpm)으로 설정된 로커에서 실온에서 최소 2시간 동안 차단합니다.
알림: 플랫폼의 노치와 우물의 홈이 정렬되어 있는지 확인하십시오. 이 단계는 시간에 민감하지 않으며 4°C에서 밤새 수행할 수 있습니다. - 마이크로 원심분리 튜브에 0.8mL의 항체/염료 용액을 준비하고 실온에서 5분 동안 10,000 x g 의 원심분리를 준비합니다. 0.75mL를 9-well incubation plate의 깨끗한 well로 옮기고 세척된 플랫폼을 삽입합니다.
- 플레이트를 알루미늄 호일로 감싸고 저속(30rpm)으로 설정된 로커에서 실온에서 최소 2시간 동안 배양합니다.
- 40 °C에서 10분 동안 40 mL의 1x PBS가 있는 50 mL 코니컬 튜브로 플랫폼을 세척합니다. 이제 플랫폼을 이미징 어댑터에 삽입할 준비가 되었습니다.
- 각 웰에 1mL의 차단 완충액(0.22μm 주사기 필터로 필터링된 1x PBS의 1% BSA, 0.3% Triton-X-100, 1% Fc 블록)을 추가하고 조직 플랫폼을 삽입합니다. 저속(30rpm)으로 설정된 로커에서 실온에서 최소 2시간 동안 차단합니다.
- 표백
- 각 염색 및 이미징 라운드에 이어 에스테르 환원제인 리튬 붕소화물(LiBH4)을 사용하여 형광단을 표백합니다. 이 처리는 Alexa Fluor (AF)488, AF647 및 AF750의 형광 신호를 제거하지만 AF594 및 핵 염료 Hoechst에서는 제거하지 않습니다.
주의 : 수소화붕소는 물과 매우 민감합니다. 가연성 수소 가스는 물과 접촉하면 방출됩니다. 사용한 리튬 수소화 붕소 및 리튬 수소화 붕소로 오염된 일회용품은 유해 폐기물로 처리해야 합니다. - 증류수(화학 후드)에 1.5mg/mL LiBH4 용액 5mL를 준비하고 실온에서 30분 동안 배양합니다.
알림: LiBH4 용액은 사용 >4시간 전에 준비하면 감소/표백 효과를 잃게 됩니다. - 1mL의 LiBH4 용액을 9-well incubation plate의 깨끗한 well에 옮기고 세척된 플랫폼을 실온에서 60분 동안 삽입합니다.
- 원뿔형 튜브에 20mL의 1x PBS로 플랫폼을 잠시 세척하고 후속 염색을 진행하기 전에 이전 이미징 라운드에서 Z 보정에 대해 가장 높은 레이저 설정을 사용하여 남아 있는 형광 신호를 확인합니다.
- 다음 항체 배양 단계로 진행하기 전에 실온에서 2시간 동안 샘플 차단을 반복합니다.
- 각 염색 및 이미징 라운드에 이어 에스테르 환원제인 리튬 붕소화물(LiBH4)을 사용하여 형광단을 표백합니다. 이 처리는 Alexa Fluor (AF)488, AF647 및 AF750의 형광 신호를 제거하지만 AF594 및 핵 염료 Hoechst에서는 제거하지 않습니다.
4. 이미징 절차
- 이미징 어댑터/플랫폼 조립
- 3.5cm 이미징 접시의 유리 바닥 중앙에 0.1mL의 1x PBS를 추가하고 따로 보관합니다. 높이 조정 링을 시계 방향으로 느슨하게 외부 덮개에 나사로 고정하고 내부 플라스틱 홀더(노치-그로브 정렬)에 플랫폼을 장착합니다. 슬라이더로 플랫폼을 고정합니다.
- 조립된 이미징 어댑터를 유리 바닥 접시에 놓고 티슈가 버퍼에 닿을 때까지 높이 조절 링을 조심스럽게 내립니다. 유리 바닥에서 플랫폼을 회전하지 마십시오.
- 유리에서 최적의 거리에 도달하면 이미징 중 조직 탈수를 방지하기 위해 조직(이제 바닥이 위로)에 0.2mL의 1x PBS를 추가합니다.
- 컨포칼 이미징
- 접안렌즈 사용을 위해 컴퓨터, 현미경, 레이저 및 LED 광원을 포함한 도립 컨포칼 현미경의 모든 구성 요소를 켭니다. 이미지 획득 소프트웨어를 시작합니다.
- 적절한 대물렌즈(예: 20x 또는 40x)를 선택하고 적절한 이멀젼 매체를 추가합니다. 예를 들어, 이 연구에서는 20배 물 목표가 사용됩니다. ~200μL의 물을 대물렌즈에 첨가하여 장시간 이미지 획득 중에 건조를 방지합니다.
- 조립된 이미징 접시를 현미경의 샘플 홀더에 놓습니다.tage 그리고 표본이 고정되었는지 확인합니다(움직이지 않음).
알림: 조립된 샘플을 현미경 s에 놓을 때tage, 노치 위치를 기록하고 반복 주기에 동일한 위치를 사용하여 이미지 정렬을 용이하게 합니다. 연속 라운드를 위해 이미징 어댑터를 최적의 높이 설정으로 유지하는 것이 중요합니다. - XY 컨트롤을 사용하여 표본을 중앙에 놓고 대물렌즈를 커버 유리까지 가져옵니다. 접안렌즈를 통해 보고 Hoechst 신호를 기준으로 사용하여 대물렌즈를 움직여 조직에 대한 미세한 초점을 얻습니다.
- 적절한 레이저 라인을 선택하거나 조직 샘플을 염색하는 데 사용되는 형광단의 여기 및 방출 스펙트럼에 맞게 WLL을 조정합니다. 설정을 조정하여 채널 간의 중복을 제거하고 형광단이 유사한 excitation 스펙트럼을 갖는 경우 시퀀스를 추가합니다.
- 스캔 속도 600Hz, XY 해상도 1024 x 1024, 3줄 평균 및 양방향 스캔과 같은 이미지 획득 매개변수를 선택합니다.
- (1) 사용 중인 목표에 최적화된 Z-스텝 크기를 사용하고, (2) 스택의 시작과 끝을 정의하고, (3) 스택 전체에서 동일한 밝기를 달성하도록 Z-보상 매개 변수를 조정하고, (4) 평균이 하나인 1-타일 테스트 스택을 획득합니다.
- 이미징할 영역을 정의하고 고해상도 tile-Z 스택을 획득합니다.
결과
복막은 두께가 1mm 미만인 막질 구조로 복벽 표면을 감싸고 복부 장기 표면과 인접합니다. 그것은 표면 중피와 그 밑에 있는 결합 조직으로 구성되어 있으며, 지방 세포, 림프구, 대식세포, 섬유아세포, 혈액 및 림프관이 산재해 있습니다. 복막 악성 종양은 복부 종양 전이(예: 난소암 또는 위암)에서 비롯되는 경우가 가장 많으며18 또는 드물게 복막의 원발성 종양(예: 중피종)일 수 있습니다19. 이러한 종종 작은(<1cm) 종양 병변은 매우 복잡하지만 설명된 기술을 사용하여 3D 특성화에 적용할 수 있습니다. 플랫폼에 장착된 전체 샘플을 보기 위해 5개의 컨포칼 섹션의 최대 투영이 사용됩니다(그림 4, 왼쪽 상단 모서리에 삽입). 3개의 1차 접합 항체(AF488-CD44, AF594-CD45 및 AF647-Podoplanin)와 핵 염료 Hoechst를 IBEX의 첫 번째 라운드에 사용했습니다(IBEX1, 그림 4). 종양 병변은 CD44 및 Podoplanin에 대해 이중 양성인 장미와 같은 구조에 의해 분명해지고 유두 중피종의 특징적인 핵 배열을 보여줍니다.
항-포도플라닌(anti-Podoplanin)과 항-CD44(anti-CD44)는 모두 비종양세포를 인식하기 때문에 세포 형태학과 두 개의 항체를 사용하여 종양 세포를 식별했으며, 이는 항-포도플라닌(anti-Podoplanin)을 통한 림프관 검출 및 CD44 항체가 면역 세포의 하위 집합에 결합하는 것으로 입증되었습니다. 그런 다음 3D 프로젝션을 렌더링하기 위해 최적화된 Z-step 크기에서 더 높은 해상도의 타일 스캔 형식을 사용하여 더 작은 관심 영역(ROI)을 캡처합니다(그림 5A). 플랫폼은 반복적인 염색 절차를 통해 취해졌으며 IBEX 주기 1-6에서 동일한 ROI가 이미지화되었습니다. 종양(노란색 상자) 및 종양-3차 림프 구조(TLS) 인터페이스(파란색 상자)에 대한 대표 이미지는 그림 5B-M에 정리되어 있습니다.
TLS의 존재와 CD3 양성 세포의 밀도는 상당한 면역 세포 침투20 및 면역 조절 약물에 대한 반응 가능성을 나타냅니다21. 참고로, 그림 6에서 서로 다른 광학 절편의 스택 투영을 비교하는 것에서 알 수 있듯이 TLS와 대부분의 종양 병변은 조직의 서로 다른 Z 깊이에 존재하며, 2D 이미징이 3D 구조에 적용될 때 3D 이미징의 이점과 잠재적인 생물학 누락을 강조합니다. 이러한 병변의 3D 특성은 그림 5의 개별 병변의 볼륨 렌더링을 묘사하는 동영상 파일(영화 1-12)에서 더 분명해집니다.
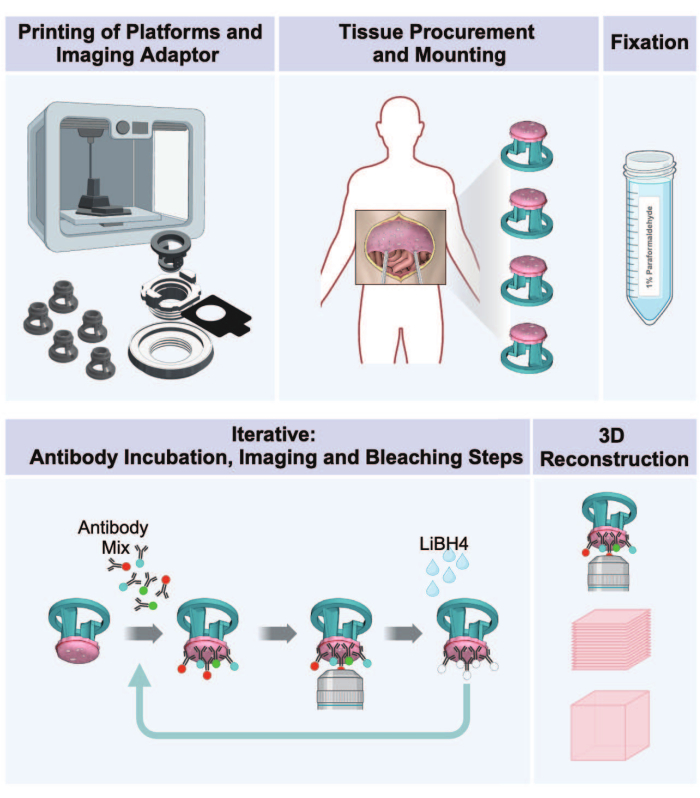
그림 1: 3D 프린팅에서 복막 종양의 3D 이미징까지의 작업 흐름. 이 프로토콜은 종양이 있는 복막 조직에서 3D 다중화 이미지를 준비하기 위한 5단계 시퀀스로 구성됩니다. (1) 조직 수용 플랫폼, 이미징 어댑터 부품 및 배양 플레이트의 인쇄. (2) 조직 조달 및 장착 절차. (3) 파라포름알데히드로 고정. (4) IBEX 염색 및 이미징 주기. (5) 이미징 소프트웨어를 사용한 3D 재구성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 3D 이미징을 위한 조직 인터페이스가 있는 하드웨어 구성 요소. (A) 이미징 어댑터 내 플랫폼 어셈블리의 개략도. (B) 9웰 배양 플레이트. (C) 조립품이 있는 이미지 어댑터 구성 요소의 사진. (D) 진단용 복강경 검사에서 관찰된 중피종 함유 복막. (E) 플랫폼에 조직 장착. (여,지) 플랫폼에 장착된 종양이 있는 복막. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
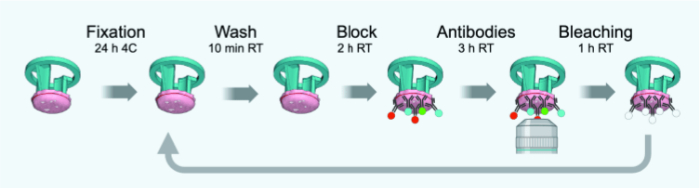
그림 3: IBEX 사이클의 타임라인 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
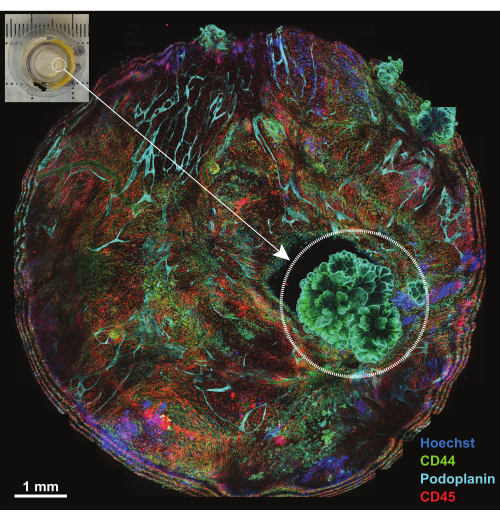
그림 4: IBEX1 패널을 사용한 배양 후 플랫폼 개요. IBEX1 패널(Hoechst, AF488-CD44, AF594-CD45 및 AF647-Podoplanin)로 배양 후 전체 플랫폼의 최대 투영. 파선 원은 종양을 강조 표시합니다. 삽입 사진: 이미징 플랫폼에 장착된 종양 보유 복막 사진. 눈금 막대: 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
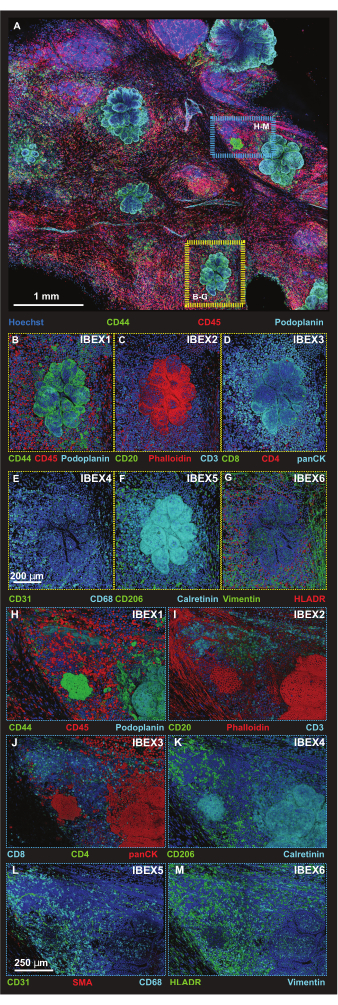
그림 5: 선택한 플랫폼 영역의 고해상도 면역형광 이미지. (A) IBEX1 패널(Hoechst, AF488-CD44, AF594-CD45 및 AF647-Podoplanin)로 배양 후 획득한 병합된 56타일 Z-스택 이미지의 최대 투영. 노란색 직사각형: 패널에 표시된 종양 병변(B-G). 파란색 직사각형: (H-M)에 표시된 종양-삼차 림프 구조 인터페이스. (B-G) 볼륨 렌더링에서 IBEX 패널 1-6을 사용한 개별 종양 병변 1개. (B) IBEX1, 녹색: CD44, 빨간색: CD45, 시안: 포도플라닌. (C) IBEX2, 녹색 : CD20, 빨간색 : F- 액틴, 시안 : CD3. (D) IBEX3, 녹색: CD8, 빨간색: CD4, 시안: panCK. (E) IBEX4, 녹색: CD31, 시안: CD68. (F) IBEX5, 녹색: CD206, 시안: 칼레티닌. (G) IBEX6, 녹색: 비멘틴, 빨간색: HLADR. (음) 하나의 개별 종양-삼차 림프 구조가 볼륨 렌더링에서 IBEX 패널 1-6과 인터페이스합니다. (H) IBEX1, 녹색: CD44, 빨간색: CD45, 시안: 포도플라닌. (I) IBEX2, 녹색: CD20, 빨간색: F-액틴, 시안: CD3. (J) IBEX3, 녹색: CD4, 빨간색: panCK, 시안: CD8. (K) IBEX4, 녹색: CD31, 빨간색: SMA, 시안: CD68. (L) IBEX5, 녹색: CD206, 시안: 칼레티닌. (M) IBEX6, 녹색: HLADR, 시안: 비멘틴. 모든 패널, 파란색: Hoechst. 스케일 바 : (A, 1mm); (B-M, 250 μm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
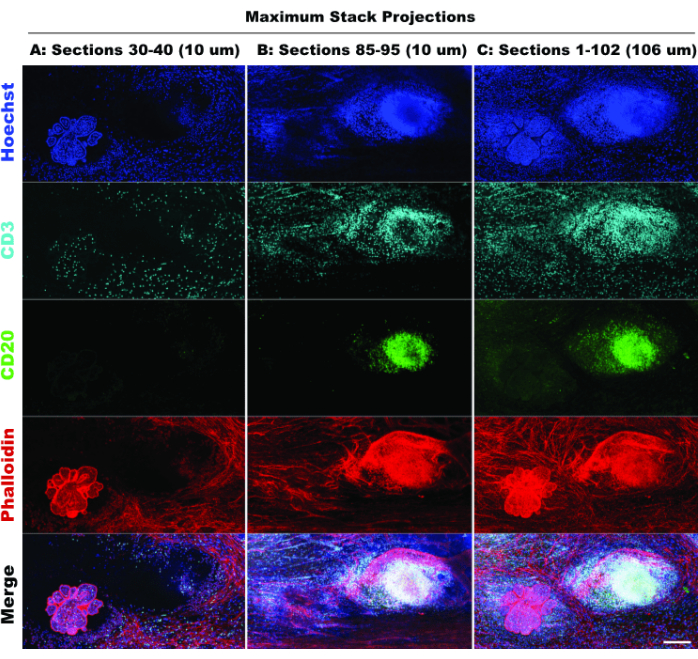
그림 6: 시뮬레이션된 2D 이미징. 제한적(10개의 광학 섹션) 및 전체 스택(102개의 광학 섹션) 프로젝션을 비교하면 2D 시뮬레이션에서 조직 컨텍스트의 손실을 확인할 수 있습니다. (A) 섹션 30-40 (10 μm)의 최대 돌출부. (B) 섹션 85-95(10μm)의 최대 투영. (C) 섹션 1-102(~100μm)의 최대 투영. 모든 패널, IBEX2 (Hoechst, AF488-CD20, AF647-CD3, AF790-phalloidin). 눈금 막대 : 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 개별 IBEX 패널에 사용된 항체. 이 표를 다운로드하려면 여기를 클릭하십시오.
동영상 1: IBEX 패널 1(파란색: Hoechst, 녹색: CD44, 빨간색: CD45, 청록색: Podoplanin)을 사용한 개별 병변의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 2: IBEX 패널 2(파란색: Hoechst, 녹색: CD20, 빨간색: F-actin, 청록색: CD3)를 사용한 개별 병변의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 3: IBEX 패널 3(파란색: Hoechst, 녹색: CD8, 빨간색: CD4, 청록색: panCK)을 사용한 개별 병변의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 4: IBEX 패널 4(파란색: Hoechst, 녹색: CD31, 청록색: CD68)를 사용한 개별 병변의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 5: IBEX 패널 5(파란색: Hoechst, 녹색: CD206, 청록색: 칼레티닌)를 사용한 개별 병변의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 6: IBEX 패널 6(파란색: Hoechst, 녹색: Vimentin, 빨간색: HLADR)을 사용한 개별 병변의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 7: IBEX 패널 1(파란색: Hoechst, 녹색: CD44, 빨간색: CD45, 청록색: Podoplanin)을 사용한 3차 림프 구조-병변 인터페이스의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 8: IBEX 패널 2(파란색: Hoechst, 녹색: CD20, 빨간색: F-actin, 청록색: CD3)를 사용한 3차 림프 구조-병변 인터페이스의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 9: IBEX 패널 3을 사용한 3차 림프 구조-병변 인터페이스의 애니메이션 볼륨 렌더링 (파란색: Hoechst, 녹색: CD8, 빨간색: CD4, 청록색: panCK). 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 10: IBEX 패널 4(파란색: Hoechst, 녹색: CD31, 빨간색: SMA, 청록색: CD68)를 사용한 3차 림프 구조-병변 인터페이스의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 11: IBEX 패널 5(파란색: Hoechst, 녹색: CD206, 청록색: 칼레티닌)를 사용한 3차 림프 구조-병변 인터페이스의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 12: IBEX 패널 6(파란색: Hoechst, 녹색: Vimentin, 빨간색: HLADR)을 사용한 3차 림프 구조-병변 인터페이스의 애니메이션 볼륨 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 인큐베이션 플레이트용 인쇄 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: 36개의 개별 플랫폼에 대한 인쇄 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: 높이 조정 링에 대한 파일을 인쇄합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 4: 외부 뚜껑에 대한 파일을 인쇄합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 5: 슬라이더용 레이저 컷 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
형광 이미징을 위한 현재의 멀티플렉스 기술은 얇은 절편으로 제한되며 3D 컨텍스트를 제공하지 않습니다. 본 연구는 맞춤형으로 설계된 플랫폼에 장착된 온전한 종양에 IBEX 이미징 방법16,17을 적용하는 프로토콜을 설명합니다. 복막 종양 병변은 전 세계 대부분의 3차 위탁 센터에서 수행되는 표준 세포 축소 수술의 일환으로 주변 정상 복막과 함께 채취되는 여러 개의 이상적인 크기의 종양 침전물을 일반적으로 가지고 있는 환자로서 이 기술을 강조하기 위해 선택되었습니다22,23. 그럼에도 불구하고 이 프로토콜은 이전에 기술된 바와 같이 종양 절편을 사용하여 실질 전이 및 마우스 모델 종양 모두에 적용할 수 있습니다24,25. 또한, 플랫폼의 마운팅 링의 직경은 실험적/조직 요구 사항에 맞게 조정할 수 있지만, 더 넓은 영역은 조직이 처지고 이미징 시간이 길어지기 쉽습니다. 조직의 공급원과 크기에 관계없이, 최적의 품질을 보장하기 위해 조달과 보존 사이의 시간을 최소한으로 유지해야 한다26. 수술실에 준비 테이블을 설치하면 환자가 참여했을 때 신속한 처리가 보장됩니다. 실험 간의 비교를 보장하기 위해 조직 조달에서 고정까지의 시간을 기록해야 합니다.
조직 샘플은 IBEX 프로토콜을 통해 채취되며, 플랫폼에 온전한 조직을 부착한 상태에서 전체 마운트, 즉 고정 및 이미징, 표백 단계가 수행됩니다. 이를 통해 반영구적인 단면 유리 계면이 없고 조직에서 커버 유리를 반복적으로 배치/제거할 필요가 없기 때문에 반복적인 염색/이미징/표백 주기를 통해 샘플 보존이 보장되며, 두 가지 모두 조직 손실로 이어질 수 있습니다. 시약 비용을 절약하기 위해 맞춤형으로 설계된 9웰 플레이트는 최소한의 "데드 볼륨"으로 플랫폼의 최적 장착을 보장합니다. 염색에 사용되는 모든 항체는 1차 접합 항체이며, 사용된 모든 형광단 접합체(Hoechst 염료 제외)는 Alexa Fluor 염료이며, 이는 우수한 밝기로 인해 선택되었습니다27. 다른 형광단 항체 패널은 IBEX(https://ibeximagingcommunity.github.io/ibex_imaging_knowledge_base/)를 사용하는 국제 과학자 그룹의 데이터 세트, 프로토콜 및 피드백을 수집하는 개방형 글로벌 저장소인 IBEX 이미징 커뮤니티에서 기탁된 데이터에 따라 설계되었습니다. 항체 패널의 순서는 신중하게 선택되었습니다. 일반적으로 존재비가 낮은 표적은 더 이른 주기에 배치되었습니다. IBEX 주기 1(CD45, CD44 및 Podoplanin)은 초기 염색 라운드에서 종양 병변을 식별하는 데 이 세 가지 마커가 사용되었기 때문에 예외입니다.
항체 패널은 높은 레이저 강도 설정에서 채널 누화를 줄이기 위해 비교적 작으며, 이는 컨포칼 현미경을 사용하여 조직을 더 깊이 이미지화하는 데 필요합니다. 패널을 2개에서 3개의 항체로 확장하기 위해 가능한 모든 곳에 AF750 접합체가 포함되었습니다. 주목할 점은 상업적으로 이용 가능한 AF750 콘주게이트가 많지 않으며 이 채널의 타겟이 매우 풍부해야 한다는 사실로 인해 이 형광단의 사용이 제한된다는 것입니다. 이 프로토콜에 사용된 AF750 접합 항-SMA 항체를 예로 들 수 있습니다. 이 클론은 AF488 또는 AF594에 안정적으로 접합되어 작동하는 클론이지만, AF750과 접합된 이 항체의 신호 강도가 현저히 낮아 고품질 Z-스택을 생성하기가 어렵습니다.
실온에서 3시간의 항체 배양은 원래 프로토콜에 비해 짧으며 복막 조직 샘플의 낮은 세포 밀도를 반영할 가능성이 가장 높습니다. 대조적으로, 1.5mg/mL 리튬 수소화물을 60분 동안 사용한 표백 단계는 더 엄격했습니다. 이러한 매개변수는 경험적으로 결정되었으며 사용되는 조직 및 항체에 따라 달라질 수 있습니다. 주목할 점은 반응성 표백 용액의 배양으로 인해 작은 기포가 조직에 갇힐 수 있다는 것입니다. 절차의 이미징 단계에서 이것이 분명해질 때마다 흡입 캐니스터를 사용하여 9웰 배양 플레이트의 플랫폼을 진공 청소기에 노출시켜 샘플을 탈기했습니다. IBEX 연구에 자주 적용되는 간단한 ITK 샘플 정합은 이미지 분석 소프트웨어에 대한 압도적인 데이터 입력으로 인해 수행할 수 없었습니다. 그럼에도 불구하고 동일한 세포 집단은 개별 데이터 세트를 비교하여 쉽게 식별할 수 있습니다. 전반적으로, 반복 주기는 한 주기가 하루에 완료될 수 있도록 시간이 지정되었으며, 이미징은 전체 주기의 대부분(~ 8시간)을 차지했습니다.
이 기술에는 언급할 가치가 있는 제한 사항이 있습니다. 프로토콜의 시간 요구 사항으로 인해 이 방법이 광범위하게 채택될 가능성은 낮고 오히려 특정 상황에서 채택될 가능성이 높습니다. 우리는 이 프로토콜이 치료 전후 종양 면역 미세환경의 변화(예: 암 면역 요법을 위한 이중특이성 항체)를 특성화하거나 일반적인 치료 결과를 예측하는 데 가장 잘 활용될 것으로 생각합니다. 이 프로토콜은 3D 특성화를 제공하지만, 복잡한 세포 집단을 포함하여 종양을 효과적으로 설명하기 위해 얼마나 많은 면적을 조사해야 하는지는 알려져 있지 않습니다28. 특정 센터에서는 신선한 인체 조직에 대한 접근이 어려울 수도 있지만, 우리는 이 프로토콜이 동물 모델에도 적용될 수 있을 것으로 예상한다29.
이 프로토콜의 응용 분야는 여러 고형 종양에 걸쳐 TME 구성을 분석하는 기초 연구부터 임상 시험에 등록된 환자에 대한 전/후 조직 생검에 이르기까지 다양합니다. 단일 세포층 두께의 조직 절편에서 얻을 수 있는 데이터는 방대하지만 3D 생물학은 쉽게 간과될 수 있습니다. 우리는 3D 이미징을 다른 공간 생물학 기술의 보조 도구로 보고 있으며, 후속 분석을 위한 2D 섹션 선택에 도움이 될 것으로 보고 있습니다. 또한, 설명된 조직 장착 및 이미징 설정을 사용하여 여러 시간에 걸쳐 라이브 이미징 구성 요소를 통합하는 프로토콜이 활발히 진행 중입니다.
공개
없음.
감사의 말
이 연구는 미국 국립보건원(National Institutes of Health)과 미국 국립암연구소(National Cancer Institute, NCI)의 교내 연구 프로그램(Intramural Research Program)의 지원을 받았습니다. 이 연구는 또한 로널드 저메인(Ronald Germain)이 이끄는 NIAID와 NCI의 연구 협력인 CAT-I의 일부 지원을 받았습니다. 우리는 Andrea Radtke의 열정적이고 협력적인 노력에 감사를 표하고 싶습니다. 그녀의 전문 지식은 이 연구에 큰 도움이 되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Alexa Fluor Plus 750 Phalloidin | Invitrogen | A30105 | F-actin dye |
| Alexa Fluor 488 anti-human CD206 (MMR) Antibody | BioLegend | 321114 | antibody |
| Alexa Fluor 488 anti-human CD31 Antibody | BioLegend | 303110 | antibody |
| Alexa Fluor 488 anti-human CD4 Antibody | BioLegend | 300519 | antibody |
| Alexa Fluor 488 anti-human HLA-DR Antibody | BioLegend | 307656 | antibody |
| Alexa Fluor 488 anti-mouse/human CD44 Antibody | BioLegend | 103016 | antibody |
| Alexa Fluor 594 anti-human CD45 Antibody | BioLegend | 304060 | antibody |
| Alexa Fluor 647 Anti-Calretinin antibody [EP1798] | Abcam | ab214244 | antibody |
| Alexa Fluor 647 anti-human CD3 Antibody | BioLegend | 300416 | antibody |
| Alexa Fluor 647 anti-human CD8 Antibody | BioLegend | 344726 | antibody |
| Alexa Fluor 647 anti-human Podoplanin Antibody | BioLegend | 337007 | antibody |
| Alexa Fluor 647 anti-Vimentin Antibody | BioLegend | 677807 | antibody |
| Alexa Fluor 647 CD68 Antibody (KP1) | Santa Cruz | sc-20060AF647 | antibody |
| Alexa Fluor 750 Cytokeratin, pan Antibody (AE-1/AE-3) | Novus | NBP2-33200AF750 | antibody |
| Alexa Fluor 750 Human alpha-Smooth Muscle Actin Antibody | R&D | IC1420S | antibody |
| Alexa Fluor 488 CD20 Monoclonal Antibody (L26) eBioscience | Thermo Fisher | 53-0202-82 | antibody |
| Antibiotic-Antimycotic | Gibco | 15240096 | supplement harvest medium |
| BioMed Clear Resin (Form 3) | FormLabs | RS-F2-BMCL-01 | resin used for platform + incubation plate |
| BSA | Sigma | A7906-500g | blocking solution component |
| Cast acrylic 1/32" thick | material used for cutting slider | ||
| CleanStation DT3 | Stratasys | DT3 | post processing for height adjuster & outer lid |
| Container, Specimen | McKesson | 870203 | transfer of tissue from perating table to prep table |
| CorelDraw | CorelDRAW | Software to prepare the vector-based design file for laser cutting | |
| Cytofix | BD Bioscience | 554655 | fixative |
| Dish 15 cm | Falcon | 353025 | dish used during mounting |
| Dish 35 mm No. 1.5 Coverslip 14 mm Glass Diameter Uncoated | Matek | P35G-1.5-14-C | imaging dish |
| DMEM (no glucose) | Gibco | 11966025 | harvest medium |
| Fc Block | BD Bioscience | 564220 | blocking solution component |
| Form 3B+ | Formlabs | Form 3B+ | printer used for platform + incubation plate |
| Form Cure | Formlabs | FH-CU-01 | post processing for platform + incubation plate |
| Form Wash | Formlabs | FH-WA-01 | post processing for platform + incubation plate |
| GrabCAD Print | GrabCAD | GrabCAD Print | Software to prepare models for Stratasys printers |
| Hoechst 33342 10 mg/mL | Biotium | 40046 | nuclear dye |
| J826 Prime 3D Printer | Stratasys | J826 | printer used for height adjuster & outer lid |
| LAS X | Leica | LAS X | Confocal software |
| Laser cutting system | Universal Laser Systems | ULS PLS6.150D | CO2 Laser cutting used for slider |
| Lithium Borohydride | STREM Chemicals | 93-0397 | bleaching chemical |
| PBS, pH 7.4 | Gibco | 10010023 | base Buffer for washing, blocking, staining |
| PreForm | FormLabs | PreForm | Software to prepare models for Formlab printers |
| Silk sutures 2-0 | Ethicon | A305.O35 | affix tissue to platform |
| Stellaris 8 WLL confocal microscope | Leica | STELLARIS 8 | Confocal Imaging |
| Syringe filter | filter ab solution | ||
| Triton X-100 | American Bio | AB02025-00100 | permeabelizing reagent, blocking solution component |
| Vero ContactClear | Stratasys | CTT610, 4 KG | resin used for height adjuster & outer lid |
| Warming Tray | Spring USA | ST-1220 | keep media and tissue warm |
| Water, distilled | Gibco | 15230-170 | diluent for LiBH4 |
참고문헌
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Li, Z., Li, J., Bai, X., Huang, X., Wang, Q. Tumor microenvironment as a complex milieu driving cancer progression: A mini-review. Clin Transl Oncol. , (2024).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nat Rev Clin Oncol. 14 (12), 717-734 (2017).
- Roma-Rodrigues, C., Mendes, R., Baptista, P. V., Fernandes, A. R. Targeting tumor microenvironment for cancer therapy. Int J Mol Sci. 20 (4), 840 (2019).
- Sheng, W., et al. Multiplex immunofluorescence: A powerful tool in cancer immunotherapy. Int J Mol Sci. 24 (4), 3086 (2023).
- Bollhagen, A., Bodenmiller, B. Highly multiplexed tissue imaging in precision oncology and translational cancer research. Cancer Discov. 14 (11), 2071-2088 (2024).
- Jin, Y., et al. Advances in spatial transcriptomics and its applications in cancer research. Mol Cancer. 23 (1), 129 (2024).
- Kashyap, A., et al. Quantification of tumor heterogeneity: From data acquisition to metric generation. Trends Biotechnol. 40 (6), 647-676 (2022).
- Chang, Q., Hedley, D. Emerging applications of flow cytometry in solid tumor biology. Methods. 57 (3), 359-367 (2012).
- Zhang, L., et al. Single-cell analyses inform mechanisms of myeloid-targeted therapies in colon cancer. Cell. 181 (2), 442-459.e29 (2020).
- Wang, X. Q., et al. Spatial predictors of immunotherapy response in triple-negative breast cancer. Nature. 621 (7980), 868-876 (2023).
- Maestri, E., et al. Spatial proximity of tumor-immune interactions predicts patient outcome in hepatocellular carcinoma. Hepatology. 79 (4), 768-779 (2024).
- Wang, Q., et al. Role of tumor microenvironment in cancer progression and therapeutic strategy. Cancer Med. 12 (10), 11149-11165 (2023).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Lin, J. R., et al. Multiplexed 3d atlas of state transitions and immune interaction in colorectal cancer. Cell. 186 (2), 363-381.e19 (2023).
- Radtke, A. J., et al. Ibex: An iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- Radtke, A. J., et al. Ibex: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proc Natl Acad Sci U S A. 117 (52), 33455-33465 (2020).
- Van Baal, J. O., et al. The histophysiology and pathophysiology of the peritoneum. Tissue Cell. 49 (1), 95-105 (2017).
- Bridda, A., Padoan, I., Mencarelli, R., Frego, M. Peritoneal mesothelioma: A review. MedGenMed. 9 (2), 32 (2007).
- Demuytere, J., Ernst, S., Van Ovost, J., Cosyns, S., Ceelen, W. The tumor immune microenvironment in peritoneal carcinomatosis. Int Rev Cell Mol Biol. 371, 63-95 (2022).
- Wang, Q., et al. Heterogeneity of tertiary lymphoid structures predicts the response to neoadjuvant therapy and immune microenvironment characteristics in triple-negative breast cancer. Br J Cancer. , (2024).
- Kepenekian, V., et al. Peritoneal mesothelioma: Systematic review of hyperthermic intraperitoneal chemotherapy (HIPEC) protocol outcomes. Indian J Surg Oncol. 14 (Suppl 1), 39-59 (2023).
- Mcquade, C., Renton, M., Chouhan, A., Macdermott, R., O'brien, C. Review of imaging peritoneal disease and treatment. Can Assoc Radiol J. , (2024).
- Kenerson, H. L., et al. Tumor slice culture as a biologic surrogate of human cancer. Ann Transl Med. 8 (4), 114 (2020).
- Arrizabalaga, L., et al. Tumor slice culture system for ex vivo immunotherapy studies. Methods Cell Biol. 189, 55-69 (2024).
- Neumeister, V. M., et al. Quantitative assessment of effect of preanalytic cold ischemic time on protein expression in breast cancer tissues. J Natl Cancer Inst. 104 (23), 1815-1824 (2012).
- Panchuk-Voloshina, N., et al. Alexa dyes: A series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47 (9), 1179-1188 (1999).
- Rajaram, S., et al. Sampling strategies to capture single-cell heterogeneity. Nat Methods. 14 (10), 967-970 (2017).
- Bella, A., et al. Mouse models of peritoneal carcinomatosis to develop clinical applications. Cancers (Basel). 13 (5), 963 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유