Method Article
使用迭代漂白对荷瘤组织进行三维成像扩展了多重方法
摘要
本文介绍了一种多重免疫荧光方案,该方案经过优化以表征腹膜转移的三维结构。
摘要
肿瘤微环境 (TME) 的空间异质性是治疗反应的关键决定因素,特别是对于免疫肿瘤药物,其中成功取决于特定免疫细胞亚群的分布。在过去的十年中,已经引入了多种复杂的技术,以使用福尔马林固定、石蜡包埋 (FFPE) 或固定冷冻组织的二维切片来实现 TME 的详细分辨率。虽然这些薄片更容易获得和分析,但它们缺乏可靠和全面表征肿瘤所需的三维结构。为了解决这一限制,开发了一种组织镶嵌和成像技术,以便能够对天然 体内 状态下的肿瘤病变进行三维分析。该方案概述了人类肿瘤组织的采购、样品在定制打印平台上的安装以及固定后样品的染色程序。多重免疫荧光技术 IBEX (Iterative Bleaching Extends Multiplexity) 适用于使用市售抗体表征具有多达 15 个肿瘤、免疫和基质细胞标志物的三维 TME。使用倒置白光激光共聚焦显微镜、定制打印成像适配器和商用玻璃底培养皿,确保最佳组织定向,可实现高达 100 μm 的成像深度。该方案强调了 IBEX 方法扩展多重免疫荧光研究的潜力,从而更全面地了解 TME 组成。
引言
实体瘤变化很大,细胞类型(恶性和非恶性)、细胞外基质蛋白和可溶性因子的组成错综复杂 1,2。最终,这种高度复杂、异质性的肿瘤微环境 (TME) 决定了对免疫疗法等治疗的敏感性 3,4。因此,已应用高度多重免疫荧光 5,6 和空间转录组学7 等技术来表征细胞层厚 (~4 μM) 切片中 TME 的复杂性。
与单细胞测序和流式细胞术等细胞分散方法 8,9,10 相反,这些技术保留了空间关系,以提供有关细胞串扰的关键信息,并可用于识别预测治疗反应的潜在生物标志物 11,12,13.然而,肿瘤病变本质上是三维 (3D) 结构,如上所述的 2D 方法并不能充分捕捉复杂的细胞景观。3D 生物学的重要性在该领域得到了认可,患者来源的肿瘤类器官培养物的广泛利用证明了这一点14。然而,类器官不保留原始体内 TME 的细胞复杂性,这限制了与免疫调节药物一起使用或表征不同 TME 细胞群的适用性。
尽管可以对连续的 2D 截面进行分析,并通过计算将图像“拼接”在一起以进行 3D 渲染,但这种技术成本高昂且难以以高保真度完成15。为了以可重复的方式经济高效地表征 3D 组织(例如肿瘤),开发了一种独特的制备和多重免疫荧光染色/分析方法,并使用原发性腹膜癌患者的腹膜肿瘤病灶进行了验证。
基于对成熟的 IBEX 技术(迭代漂白扩展多路性)16,17 的改编,该协议详细介绍了组织支架和成像适配器的 3D 打印、腹膜组织的采购和安装、使用各种肿瘤和细胞类型标记物的多个染色周期,以及高分辨率共聚焦 3D 成像。
研究方案
该研究是根据方案 NCT01915225 获得美国国立卫生研究院机构审查委员会的批准进行的。在诊断性腹腔镜检查时获得书面知情同意书即可获得人体组织。所有组织均携带肿瘤,通过肉眼检查确定并通过最终组织病理学检查确认。材料 表中列出了所有使用的试剂和设备的详细信息。 图 1 提供了整个工作流程的示意图。
1. 打印平台、成像适配器和孵育板
- 平台和 9 孔板部件的切片/3D 打印/后处理程序(如图 2A-C 中概述)
- 切片:打开 切片软件 ,将设计文件导入 。STL 格式(补充文件 1 和 补充文件 2)。确定模型的方向以实现最佳打印并添加支撑。选择医疗级打印机,选择 透明树脂和 50 μm 层高。检查适打印性并将作业发送到打印机。
- 3D 打印:检查打印机是否已准备就绪(正确的树脂盒、树脂槽和平台就位)。在打印机的触摸屏上,从切片软件中选择 上传的作业 以开始打印。打印完成后,使用拆卸工具将打印部件从平台上拆下。
- 后处理:在装满 99% 异丙醇 (IPA) 的清洗装置中冲洗部件 15 分钟。从清洗装置中取出部件,并在新鲜的 IPA 中浸泡 5 分钟。
- 在 60 °C 下对部件进行 60 分钟后固化。 使用平口剪去除支撑。如有必要,使用细砂纸打磨任何支撑痕迹。
- 高度调节器和外盖的切片/3D 打印/后处理程序(如图 2A-C 所示)
- 切片:打开 打印软件 ,将设计文件导入 。STL 格式(补充文件 3 和 补充文件 4)。定向模型并指定材质。选择所需的打印模式(High mix、High Speed),并将要完成的模型设置设置为 哑光。检查适打印性并将作业发送到打印机。
- 3D 打印:确保打印机加载了正确的材料,并且构建托盘干净。在打印机的监视器界面上,选择上传的 作业 以开始打印。打印完成后,使用刮刀工具轻轻地从构建托盘中取出打印部件。
- 后处理:将打印件放入水射流清洁器或搅拌清洁系统中,以去除支撑材料。如有必要,使用镊子或钳子等工具手动移除支撑。
- 平台滑块的激光切割(如图 2A、C 所示)
- 准备设计:导入 *.矢量软件中的 DWG 设计 文件(补充文件 5)。将线条颜色设置为红色 (RGB) 以进行矢量切割。将作业发送到激光切割机。
- 设置激光切割机:打开激光切割机软件并导入设计文件。选择材质类型并调整 1/32 英寸厚亚克力的功率、速度和分辨率设置。将材料放在激光床上,确保其正确对准,然后聚焦激光。
- 激光切割:启动激光切割过程并监控以确保材料被正确切割。
2. 打印平台上的纸巾镶嵌
- 收获培养基和制备台的制备
- 用抗抗药补充 100 mL DMEM(低葡萄糖),并置于 37 °C 培养箱中,直至需要(收获培养基)。
- 在手术室中设置一个“准备台”,其中包含以下物品:高压灭菌的 3D 打印平台、一包 2-0 条丝线扎带、加热板、装有 50 mL 预热收获培养基的样品杯、含有 30 mL 预热收获培养基的 15 cm 培养板和一个带有 4 个孔的 24 孔板,每个孔含有 1.5 mL 收获培养基(全部放在加热板上), 1 对镊子和 1 对手术剪。
- 组织切除和镶嵌
注意:组织是从手术室获得的。通过目视检查确定具有厚度和直径小于 0.5 毫米的肿瘤病灶的腹膜区域(图 2D)。值得注意的是,准备一个平台需要 ~ 2 cm2 的组织(腹膜)。- 小心地将荷瘤腹膜与下面的腹壁肌肉组织和筋膜分开(由外科医生进行)。将所得纸巾片转移到装有温收获培养基的样品杯中,并放在加热板(准备台)上。
- 将组织安装在含有收获培养基的 15 cm 板中的平台上。小心地将荷瘤组织(间皮侧朝上)覆盖在平台的小孔侧,并用 2-0 丝缝合线将其固定到位。将制备的组织平台反向(浸没)在含有收获培养基的 24 孔板中(图 2E-G)。
注意:安装组织以防止平台表面出现褶皱,但不会产生张力,因为这会引起不必要的生物力学和生理变化。
3. 固定/染色/漂白程序
注意: 图 3 概述了针对 4 μm 薄 FFPE 或固定冷冻切片的原始方案的变化。 表 1 提供了用于 IBEX 第 1-6 轮的抗体(含稀释液)列表。
- 固定
- 通过将 10 mL 固定剂原液添加到含有 30 mL 冷 1x PBS 的 50 mL 锥形管中,制备 40 mL 固定缓冲液。
- 使用一对镊子,将固定在平台上的组织转移到固定缓冲液中,并在 4 °C 下孵育 24 小时。
- 倒出固定剂,用 40 mL 冷的 1x PBS 替换,并在 4 °C 下孵育 10 分钟。
- 染色
- 向每个孔中加入 1 mL 封闭缓冲液(1% BSA、0.3% Triton-X-100、1% Fc 封闭剂,溶于 1x PBS 中,用 0.22 μm 注射器过滤器过滤)并插入组织平台。在室温下在设置为低速 (30 rpm) 的摇杆上封闭至少 2 小时。
注意: 确保平台上的槽口和井中的凹槽对齐。此步骤对时间不敏感,可以在 4 °C 下过夜完成。 - 在微量离心管中制备 0.8 mL 抗体/染料溶液,并在室温下以 10,000 x g 离心 5 分钟。将 0.75 mL 转移至 9 孔孵育板的干净孔中,并插入洗涤过的平台。
- 将板包裹在铝箔中,并在室温下在设置为低速 (30 rpm) 的摇杆上孵育至少 2 小时。
- 在 4 °C 下,在 50 mL 锥形管中加入 40 mL 1x PBS 洗涤平台 10 分钟。 该平台现在可以插入成像适配器中。
- 向每个孔中加入 1 mL 封闭缓冲液(1% BSA、0.3% Triton-X-100、1% Fc 封闭剂,溶于 1x PBS 中,用 0.22 μm 注射器过滤器过滤)并插入组织平台。在室温下在设置为低速 (30 rpm) 的摇杆上封闭至少 2 小时。
- 漂白
- 在每轮染色和成像之后,使用酯还原剂硼氢化锂 (LiBH4) 漂白荧光团。这种处理将消除来自 Alexa Fluor (AF)488、AF647 和 AF750 的荧光信号,但不会消除来自 AF594 和核染料 Hoechst 的荧光信号。
注意:硼氢化锂与水极易反应。与水接触放出易燃氢气;被硼氢化锂污染的废硼氢化锂和一次性用品需要作为危险废物处理。 - 在蒸馏水(在化学罩中)中制备 5 mL 1.5 mg/mL LiBH4 溶液,并在室温下孵育 30 分钟。
注意:LiBH4 溶液在使用前 >4 小时制备时将失去其还原/漂白效果。 - 将 1 mL 的 LiBH4 溶液转移到 9 孔孵育板的干净孔中,并在室温下插入洗涤过的平台 60 分钟。
- 在锥形管中用 20 mL 的 1x PBS 短暂洗涤平台,并在进行后续轮染色之前,使用前一轮成像中用于 Z 补偿的最高激光设置检查剩余的荧光信号。
- 在进行下一个抗体孵育步骤之前,在室温下重复封闭样品 2 小时。
- 在每轮染色和成像之后,使用酯还原剂硼氢化锂 (LiBH4) 漂白荧光团。这种处理将消除来自 Alexa Fluor (AF)488、AF647 和 AF750 的荧光信号,但不会消除来自 AF594 和核染料 Hoechst 的荧光信号。
4. 成像程序
- 组装成像适配器/平台
- 将 0.1 mL 的 1x PBS 添加到 3.5 cm 成像皿的玻璃底部中心并放在一边。将高度调节环顺时针松散地拧入外盖,然后将平台安装在内部塑料支架中(缺口-凹槽对齐)。用滑块固定平台。
- 将组装好的成像适配器放在玻璃底培养皿上,小心地降低高度调节环,直到组织接触到缓冲液。避免在玻璃底部旋转平台。
- 一旦达到与玻璃的最佳距离,将 0.2 mL 的 1x PBS 添加到组织上(现在底部朝上)以避免成像过程中组织脱水。
- 共聚焦成像
- 打开倒置共聚焦显微镜的所有组件,包括计算机、显微镜、激光器和用于目镜的 LED 光源。启动 图像采集 软件。
- 选择合适的物镜(例如, 20 倍 或 40 倍)并添加适当的浸入介质。例如,本研究中使用了 20 倍的水物镜;向物镜中加入 ~200 μL 水,以避免在长时间图像采集过程中干燥。
- 将组装好的成像皿放入显微镜载物台上的样品架中,并确保样品牢固(不移动)。
注意:将组装好的样品放在显微镜载物台上时,请注意缺口位置,并使用相同的位置进行迭代循环,以便于图像对齐。对于连续轮次,将成像适配器保持在最佳高度设置非常重要。 - 使用 X-Y 控制将样品居中,并将物镜升高到盖玻片上。通过目镜观察并使用 Hoechst 信号作为参考,移动物镜以获得对组织的精细聚焦。
- 选择合适的激光线或根据用于对组织样品进行染色的荧光团的激发和发射光谱调整 WLL。通过调整设置来消除通道之间的重叠,如果荧光基团具有相似的激发光谱,则添加序列。
- 选择以下图像采集参数:扫描速度 600 Hz、XY 分辨率 1024 x 1024、 3 线 平均值和 双向 扫描。
- 选择以下 Z 堆栈参数:(1) 使用针对所用目标优化的 Z 步长,(2) 定义堆栈的开始和结束,(3) 调整 Z 补偿参数以在整个堆栈中实现相等的亮度,以及 (4) 获取具有一个平均值的 1 个图块测试堆栈。
- 定义要成像的区域并获取高分辨率的 tile-Z 堆栈。
结果
腹膜是厚度小于 1 毫米的膜结构,排列在腹壁表面,与腹部器官表面相连。它由表面间皮和下面的结缔组织组成,散布着脂肪细胞、淋巴细胞、巨噬细胞和成纤维细胞,以及血液和淋巴管。腹膜恶性肿瘤最常源于腹部肿瘤转移(例如卵巢癌或胃癌)18 ,或者较少见的是腹膜原发性肿瘤(例如间皮瘤)19。这些通常很小 (<1 cm) 的肿瘤病灶非常复杂,但适合使用概述的技术进行 3D 表征。五个共聚焦切片的最大投影用于查看安装在平台上的整个样品(图 4,左上角插图)。三种一抗偶联抗体(AF488-CD44、AF594-CD45 和 AF647-Podoplanin)与核染料 Hoechst 一起用于第一轮 IBEX(IBEX1, 图 4)。CD44 和 Podoplanin 双阳性的玫瑰花结状结构使肿瘤病变变得明显,并显示状间皮瘤特征的细胞核排列。
由于抗鬼臼素和抗 CD44 都识别非肿瘤细胞,因此使用细胞形态学和两种抗体鉴定肿瘤细胞,通过抗鬼臼素检测淋巴管以及 CD44 抗体与免疫细胞亚群的结合证明了这一点。然后使用更高分辨率的平铺扫描格式以优化的 Z 步长捕获较小的感兴趣区域 (ROI),以渲染 3D 投影(图 5A)。通过迭代染色程序对平台进行检测,并在 IBEX 第 1-6 周期中对相同的 ROI 进行成像。肿瘤(黄框)和肿瘤三级淋巴结构 (TLS) 界面(蓝框)的代表性图像组装在图 5B-M 中。
TLS 的存在和 CD3 阳性细胞的密度表明免疫细胞浸润显著20 ,并且可能对免疫调节药物有反应21。值得注意的是,TLS 和大部分肿瘤病灶存在于组织的不同 Z 深度,如图 6 中比较不同光学切片的堆栈投影所示,突出了 3D 成像的好处以及将 2D 成像应用于 3D 结构时可能遗漏的生物学。这些病变的 3D 特征在电影文件(电影 1-12)中变得更加明显,它描绘了图 5 中各个病变的体积渲染。
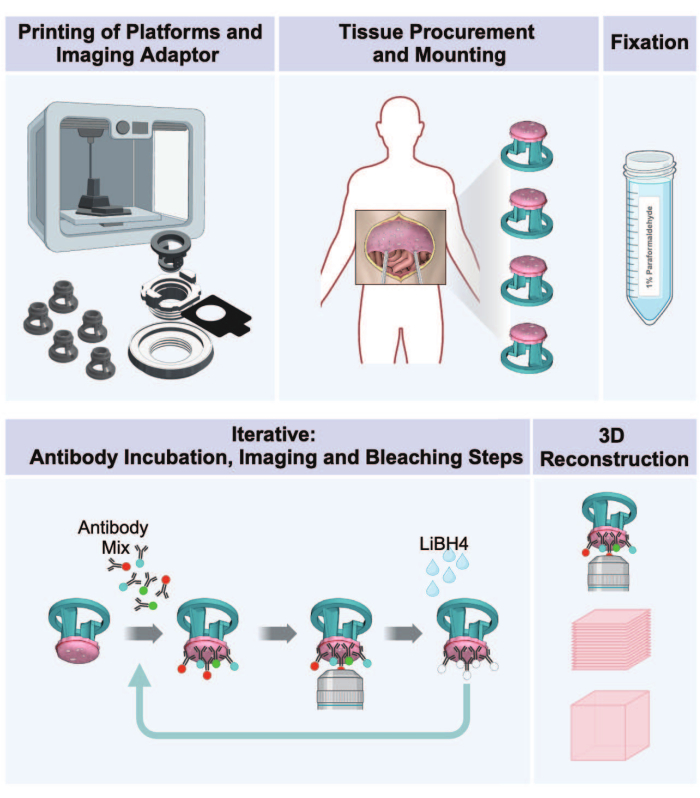
图 1:腹膜肿瘤从 3D 打印到 3D 成像的工作流程。 该方案包括一系列五个步骤,用于从荷瘤腹膜组织制备 3D 多路复用图像。(1) 组织接收平台、成像适配器部件和孵育板的打印。(2) 生活用纸采购和安装程序。(3) 用多聚甲醛固定。(4) IBEX 染色和成像周期。(5) 使用成像软件进行 3D 重建。 请单击此处查看此图的较大版本。

图 2:用于 3D 成像的带有组织接口的硬件组件。 (A) 成像适配器内平台组件的示意图。(B) 9 孔培养板。(C) 带组件的图像适配器组件的照片。(D) 诊断性腹腔镜检查期间观察到的携带间皮瘤的腹膜。(E) 将组织固定在平台上。(F,G)安装在平台上的荷瘤腹膜。 请单击此处查看此图的较大版本。
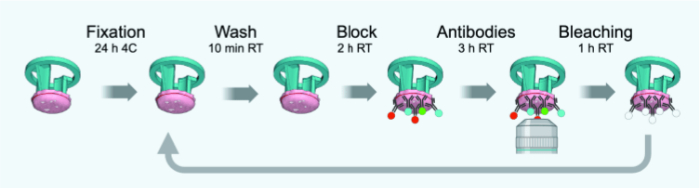
图 3:IBEX 周期的时间线示意图。 请单击此处查看此图的较大版本。
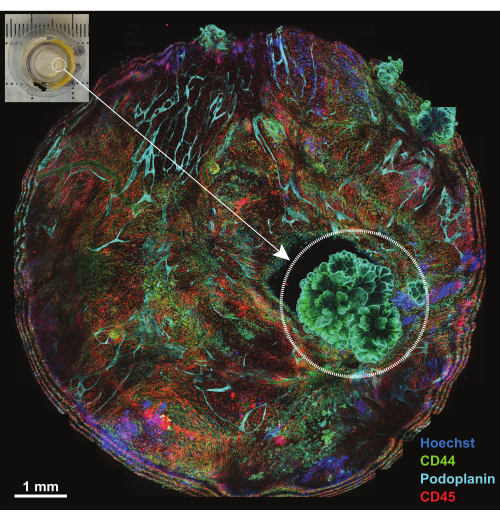
图 4:使用 IBEX1 panel 孵育后的平台概述。 与 IBEX1 面板 (Hoechst、AF488-CD44、AF594-CD45 和 AF647-Podoplanin) 孵育后整个平台的最大投影。虚线圆圈突出显示肿瘤。插图:安装在成像平台上的荷瘤腹膜的照片。比例尺:1 毫米。 请单击此处查看此图的较大版本。
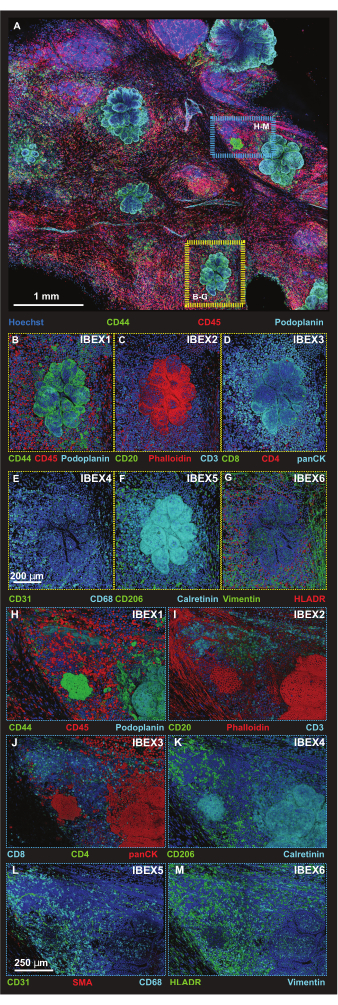
图 5:选定平台区域的高分辨率免疫荧光图像。 (A) 与 IBEX1 面板(Hoechst、AF488-CD44、AF594-CD45 和 AF647-Podoplanin)孵育后获得的合并 56 个图块 Z 堆栈图像的最大投影。黄色矩形:图中所示的肿瘤病灶 (BG)。蓝色矩形:肿瘤-三级淋巴结构界面,如 (HM) 所示。(B-G)一个单独的肿瘤病灶,IBEX 面板 1-6 的体积渲染。(B) IBEX1,绿色:CD44,红色:CD45,青色:Podoplanin。(C) IBEX2,绿色:CD20,红色:F-肌动蛋白,青色:CD3。(D) IBEX3,绿色:CD8,红色:CD4,青色:panCK。(E) IBEX4,绿色:CD31,青色:CD68。(F) IBEX5,绿色:CD206,青色:钙调蛋白。(G) IBEX6,绿色:Vimentin,红色:HLADR。(H-M)一个单独的肿瘤-三级淋巴结构界面,体积渲染中为 IBEX 面板 1-6。(H) IBEX1,绿色:CD44,红色:CD45,青色:Podoplanin。(I) IBEX2,绿色:CD20,红色:F-肌动蛋白,青色:CD3。(J) IBEX3,绿色:CD4,红色:panCK,青色:CD8。(K) IBEX4,绿色:CD31,红色:SMA,青色:CD68。(L) IBEX5,绿色:CD206,青色:钙调蛋白。(M) IBEX6,绿色:HLADR,青色:波形蛋白。所有面板,蓝色:Hoechst。比例尺:(A,1 毫米);(BM,250 微米)。请单击此处查看此图的较大版本。
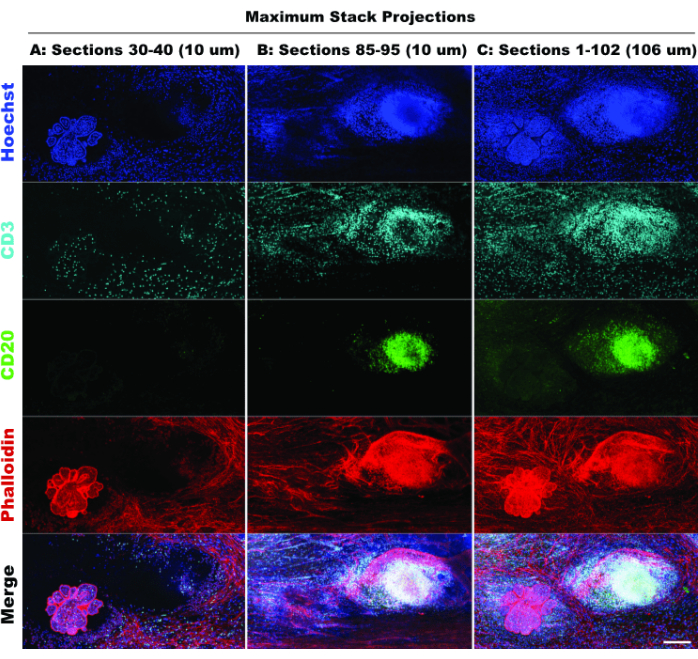
图 6:模拟 2D 成像。 有限(10 个光学切片)和全栈(102 个光学切片)投影的比较证实了 2D 模拟中组织环境的损失。(A) 截面 30-40 (10 μm) 的最大投影。(B) 截面 85-95 (10 μm) 的最大投影。(C) 切片 1-102 的最大投影 (~100 μm)。所有面板,IBEX2(Hoechst,AF488-CD20,AF647-CD3,AF790-鬼笔环肽)。比例尺:200 μm。 请点击此处查看此图的较大版本。
表 1:用于单个 IBEX 检测组合的抗体。请点击此处下载此表格。
电影 1:使用 IBEX 面板 1 (蓝色:Hoechst,绿色:CD44,红色:CD45,青色:Podoplanin)对单个病灶进行动画体积渲染。 请点击这里下载此电影。
电影 2:使用 IBEX 面板 2 (蓝色:Hoechst,绿色:CD20,红色:F-肌动蛋白,青色:CD3)对单个病灶进行动画体积渲染。 请点击这里下载此电影。
电影 3:使用 IBEX 面板 3 (蓝色:Hoechst,绿色:CD8,红色:CD4,青色:panCK)对单个病灶进行动画体积渲染。 请点击这里下载此电影。
影片 4:使用 IBEX 面板 4 (蓝色:Hoechst,绿色:CD31,青色:CD68)对单个病灶进行动画体积渲染。 请点击这里下载此电影。
影片 5:使用 IBEX 面板 5 (蓝色:Hoechst,绿色:CD206,青色:钙调蛋白)对单个病灶进行动画体积渲染。 请点击这里下载此电影。
电影 6:使用 IBEX 面板 6 (蓝色:Hoechst,绿色:Vimentin,红色:HLADR)对单个病灶进行动画体积渲染。 请点击这里下载此电影。
电影 7:使用 IBEX 面板 1(蓝色:Hoechst,绿色:CD44,红色:CD45,青色:Podoplanin)对三级淋巴结构-病变界面进行动画体积渲染。请点击这里下载此电影。
电影 8:使用 IBEX 面板 2(蓝色:Hoechst,绿色:CD20,红色:F-肌动蛋白,青色:CD3)对三级淋巴结构-病变界面进行动画体积渲染。请点击这里下载此电影。
电影 9:使用 IBEX 面板 3(蓝色:Hoechst,绿色:CD8,红色:CD4,青色:panCK)对三级淋巴结构-病变界面进行动画体积渲染。请点击这里下载此电影。
影片 10:使用 IBEX 面板 4(蓝色:Hoechst,绿色:CD31,红色:SMA,青色:CD68)对三级淋巴结构-病变界面进行动画体积渲染。请点击这里下载此电影。
电影 11:使用 IBEX 面板 5(蓝色:Hoechst,绿色:CD206,青色:钙调蛋白)对三级淋巴结构-病变界面进行动画体积渲染。请点击这里下载此电影。
电影 12:使用 IBEX 面板 6(蓝色:Hoechst,绿色:Vimentin,红色:HLADR)对三级淋巴结构-病变界面进行动画体积渲染。请点击这里下载此电影。
补充文件 1:打印孵化板的文件。请点击此处下载此文件。
补充文件 2:36 个独立平台的打印文件。请点击此处下载此文件。
补充文件 3:高度调节环的打印文件。请点击此处下载此文件。
补充文件 4:打印外盖文件。请点击此处下载此文件。
补充文件 5:滑块的激光切割文件。请点击此处下载此文件。
讨论
目前用于荧光成像的多重技术仅限于薄片,不提供 3D 背景。本研究描述了一种将 IBEX 成像方法16,17 应用于安装在定制设计平台上的完整肿瘤的方案。选择腹膜肿瘤病灶是为了突出该技术,因为患者通常表现为多个大小理想的肿瘤沉积物,这些沉积物与周围的正常腹膜一起被取出,作为全球大多数三级转诊中心进行的标准细胞减灭术的一部分22,23。尽管如此,该方案适用于实质转移和小鼠模型肿瘤,使用如前所述的肿瘤切片24,25。此外,平台上安装环的直径可以根据实验/组织需求进行调整,尽管较大的区域容易导致组织下垂和成像时间延长。无论组织来源和大小如何,采购和保存之间的时间都必须保持在最短,以确保最佳质量26。在手术室中设置准备台可确保在涉及患者时及时处理。应注意从采购到固定组织的时间,以确保实验之间的可比性。
通过 IBEX 方案采集组织样本,因为将完整组织固定在平台上进行整体安装,即固定和成像以及漂白步骤。这保证了通过迭代染色/成像/漂白循环保存样品,因为没有半永久性切片玻璃界面,也无需从组织中重复放置/移除盖玻片,这两者都会导致组织损失。为了节省试剂,定制设计的 9 孔板可确保以最小的“死体积”实现平台的最佳拟合。所有用于染色的抗体都是一抗偶联抗体,所有使用的荧光团偶联物(Hoechst 染料除外)都是 Alexa Fluor 染料,因其出色的亮度而被选中27。其他荧光基团抗体检测组合是根据 IBEX 成像社区存放的数据设计的,IBEX 成像社区是一个开放的全球存储库,收集数据集、实验步骤和来自 IBEX (https://ibeximagingcommunity.github.io/ibex_imaging_knowledge_base/) 的国际科学家小组的反馈。抗体检测组合的顺序经过精心选择。一般来说,丰度低的靶标被放置在较早的周期中。IBEX 第 1 周期 (CD45、CD44 和 Podoplanin) 是一个例外,因为这三个标志物用于在初始染色轮次中识别肿瘤病变。
抗体检测组合相对较小,以减少高激光强度设置下的通道串扰,这对于使用共聚焦显微镜对组织进行更深的成像是必要的。尽可能包括 AF750 偶联物,以将面板从 2 种抗体扩展到 3 种抗体。值得注意的是,市售的 AF750 偶联物并不多,而且该通道的靶标应该高度丰富这一事实限制了该荧光团的使用。一个例子是该方案中使用的 AF750 偶联的抗 SMA 抗体。虽然这是一个与 AF488 或 AF594 偶联可靠工作的克隆,但这种与 AF750 偶联的抗体的信号强度明显较低,这使得难以生成高质量的 Z 堆栈。
与原始方案相比,在室温下孵育 3 小时的抗体孵育时间短,并且很可能反映了腹膜组织样品中较低的细胞密度。相比之下,用 1.5 mg/mL 硼氢化锂漂白 60 分钟的漂白步骤更为严格。这些参数是根据经验确定的,并且可能因所使用的组织和抗体而异。值得注意的是,由于在反应漂白溶液中孵育,小气泡可能会滞留在组织中。在程序的成像步骤中,只要这一点变得明显,就会使用抽吸罐将 9 孔培养板中的平台暴露在真空中对样品进行脱气。由于图像分析软件的数据输入量很大,因此无法进行简单的 ITK 样品配准,通常用于 IBEX 研究。尽管如此,通过比较单个数据集很容易识别相同的细胞群。总体而言,迭代周期的计时使得一个周期可以在一天内完成,成像占据了整个周期的大部分时间 (~ 8 h)。
该技术确实存在值得一提的局限性。协议的时间要求使得这种方法不太可能被广泛采用,而是在特定情况下采用。我们设想该方案最好用于表征治疗前后肿瘤免疫微环境的变化(例如,用于癌症免疫治疗的双特异性抗体)或预测一般治疗结果。尽管该协议提供了 3D 表征,但尚不清楚必须询问多少区域才能有效描述肿瘤,包括其复杂的细胞群28。在某些中心也可能难以获得新鲜的人体组织,但我们认为该协议也适用于动物模型29。
该方案的应用多种多样,从分析多个实体瘤的 TME 组成的基础研究到参加临床试验的患者的组织活检前/后。尽管从单个细胞层厚组织切片中获得的数据非常庞大,但 3D 生物学很容易被忽视。我们将 3D 成像视为其他空间生物学技术的辅助手段,可能有助于为后续分析选择 2D 切片。此外,使用所述组织封片和成像设置在数小时内整合实时成像组件的方案正在积极进行中。
披露声明
没有。
致谢
这项研究得到了美国国立卫生研究院和美国国家癌症研究所 (NCI) 校内研究计划的支持。这项研究也得到了 CAT-I 的部分支持,CAT-I 是 NIAID 和 NCI 之间的研究合作,由 Ronald Germain 领导。我们要感谢 Andrea Radtke 的热情和协作努力。她的专业知识使这项研究受益匪浅。
材料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor Plus 750 Phalloidin | Invitrogen | A30105 | F-actin dye |
| Alexa Fluor 488 anti-human CD206 (MMR) Antibody | BioLegend | 321114 | antibody |
| Alexa Fluor 488 anti-human CD31 Antibody | BioLegend | 303110 | antibody |
| Alexa Fluor 488 anti-human CD4 Antibody | BioLegend | 300519 | antibody |
| Alexa Fluor 488 anti-human HLA-DR Antibody | BioLegend | 307656 | antibody |
| Alexa Fluor 488 anti-mouse/human CD44 Antibody | BioLegend | 103016 | antibody |
| Alexa Fluor 594 anti-human CD45 Antibody | BioLegend | 304060 | antibody |
| Alexa Fluor 647 Anti-Calretinin antibody [EP1798] | Abcam | ab214244 | antibody |
| Alexa Fluor 647 anti-human CD3 Antibody | BioLegend | 300416 | antibody |
| Alexa Fluor 647 anti-human CD8 Antibody | BioLegend | 344726 | antibody |
| Alexa Fluor 647 anti-human Podoplanin Antibody | BioLegend | 337007 | antibody |
| Alexa Fluor 647 anti-Vimentin Antibody | BioLegend | 677807 | antibody |
| Alexa Fluor 647 CD68 Antibody (KP1) | Santa Cruz | sc-20060AF647 | antibody |
| Alexa Fluor 750 Cytokeratin, pan Antibody (AE-1/AE-3) | Novus | NBP2-33200AF750 | antibody |
| Alexa Fluor 750 Human alpha-Smooth Muscle Actin Antibody | R&D | IC1420S | antibody |
| Alexa Fluor 488 CD20 Monoclonal Antibody (L26) eBioscience | Thermo Fisher | 53-0202-82 | antibody |
| Antibiotic-Antimycotic | Gibco | 15240096 | supplement harvest medium |
| BioMed Clear Resin (Form 3) | FormLabs | RS-F2-BMCL-01 | resin used for platform + incubation plate |
| BSA | Sigma | A7906-500g | blocking solution component |
| Cast acrylic 1/32" thick | material used for cutting slider | ||
| CleanStation DT3 | Stratasys | DT3 | post processing for height adjuster & outer lid |
| Container, Specimen | McKesson | 870203 | transfer of tissue from perating table to prep table |
| CorelDraw | CorelDRAW | Software to prepare the vector-based design file for laser cutting | |
| Cytofix | BD Bioscience | 554655 | fixative |
| Dish 15 cm | Falcon | 353025 | dish used during mounting |
| Dish 35 mm No. 1.5 Coverslip 14 mm Glass Diameter Uncoated | Matek | P35G-1.5-14-C | imaging dish |
| DMEM (no glucose) | Gibco | 11966025 | harvest medium |
| Fc Block | BD Bioscience | 564220 | blocking solution component |
| Form 3B+ | Formlabs | Form 3B+ | printer used for platform + incubation plate |
| Form Cure | Formlabs | FH-CU-01 | post processing for platform + incubation plate |
| Form Wash | Formlabs | FH-WA-01 | post processing for platform + incubation plate |
| GrabCAD Print | GrabCAD | GrabCAD Print | Software to prepare models for Stratasys printers |
| Hoechst 33342 10 mg/mL | Biotium | 40046 | nuclear dye |
| J826 Prime 3D Printer | Stratasys | J826 | printer used for height adjuster & outer lid |
| LAS X | Leica | LAS X | Confocal software |
| Laser cutting system | Universal Laser Systems | ULS PLS6.150D | CO2 Laser cutting used for slider |
| Lithium Borohydride | STREM Chemicals | 93-0397 | bleaching chemical |
| PBS, pH 7.4 | Gibco | 10010023 | base Buffer for washing, blocking, staining |
| PreForm | FormLabs | PreForm | Software to prepare models for Formlab printers |
| Silk sutures 2-0 | Ethicon | A305.O35 | affix tissue to platform |
| Stellaris 8 WLL confocal microscope | Leica | STELLARIS 8 | Confocal Imaging |
| Syringe filter | filter ab solution | ||
| Triton X-100 | American Bio | AB02025-00100 | permeabelizing reagent, blocking solution component |
| Vero ContactClear | Stratasys | CTT610, 4 KG | resin used for height adjuster & outer lid |
| Warming Tray | Spring USA | ST-1220 | keep media and tissue warm |
| Water, distilled | Gibco | 15230-170 | diluent for LiBH4 |
参考文献
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Li, Z., Li, J., Bai, X., Huang, X., Wang, Q. Tumor microenvironment as a complex milieu driving cancer progression: A mini-review. Clin Transl Oncol. , (2024).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nat Rev Clin Oncol. 14 (12), 717-734 (2017).
- Roma-Rodrigues, C., Mendes, R., Baptista, P. V., Fernandes, A. R. Targeting tumor microenvironment for cancer therapy. Int J Mol Sci. 20 (4), 840 (2019).
- Sheng, W., et al. Multiplex immunofluorescence: A powerful tool in cancer immunotherapy. Int J Mol Sci. 24 (4), 3086 (2023).
- Bollhagen, A., Bodenmiller, B. Highly multiplexed tissue imaging in precision oncology and translational cancer research. Cancer Discov. 14 (11), 2071-2088 (2024).
- Jin, Y., et al. Advances in spatial transcriptomics and its applications in cancer research. Mol Cancer. 23 (1), 129 (2024).
- Kashyap, A., et al. Quantification of tumor heterogeneity: From data acquisition to metric generation. Trends Biotechnol. 40 (6), 647-676 (2022).
- Chang, Q., Hedley, D. Emerging applications of flow cytometry in solid tumor biology. Methods. 57 (3), 359-367 (2012).
- Zhang, L., et al. Single-cell analyses inform mechanisms of myeloid-targeted therapies in colon cancer. Cell. 181 (2), 442-459.e29 (2020).
- Wang, X. Q., et al. Spatial predictors of immunotherapy response in triple-negative breast cancer. Nature. 621 (7980), 868-876 (2023).
- Maestri, E., et al. Spatial proximity of tumor-immune interactions predicts patient outcome in hepatocellular carcinoma. Hepatology. 79 (4), 768-779 (2024).
- Wang, Q., et al. Role of tumor microenvironment in cancer progression and therapeutic strategy. Cancer Med. 12 (10), 11149-11165 (2023).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Lin, J. R., et al. Multiplexed 3d atlas of state transitions and immune interaction in colorectal cancer. Cell. 186 (2), 363-381.e19 (2023).
- Radtke, A. J., et al. Ibex: An iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- Radtke, A. J., et al. Ibex: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proc Natl Acad Sci U S A. 117 (52), 33455-33465 (2020).
- Van Baal, J. O., et al. The histophysiology and pathophysiology of the peritoneum. Tissue Cell. 49 (1), 95-105 (2017).
- Bridda, A., Padoan, I., Mencarelli, R., Frego, M. Peritoneal mesothelioma: A review. MedGenMed. 9 (2), 32 (2007).
- Demuytere, J., Ernst, S., Van Ovost, J., Cosyns, S., Ceelen, W. The tumor immune microenvironment in peritoneal carcinomatosis. Int Rev Cell Mol Biol. 371, 63-95 (2022).
- Wang, Q., et al. Heterogeneity of tertiary lymphoid structures predicts the response to neoadjuvant therapy and immune microenvironment characteristics in triple-negative breast cancer. Br J Cancer. , (2024).
- Kepenekian, V., et al. Peritoneal mesothelioma: Systematic review of hyperthermic intraperitoneal chemotherapy (HIPEC) protocol outcomes. Indian J Surg Oncol. 14 (Suppl 1), 39-59 (2023).
- Mcquade, C., Renton, M., Chouhan, A., Macdermott, R., O'brien, C. Review of imaging peritoneal disease and treatment. Can Assoc Radiol J. , (2024).
- Kenerson, H. L., et al. Tumor slice culture as a biologic surrogate of human cancer. Ann Transl Med. 8 (4), 114 (2020).
- Arrizabalaga, L., et al. Tumor slice culture system for ex vivo immunotherapy studies. Methods Cell Biol. 189, 55-69 (2024).
- Neumeister, V. M., et al. Quantitative assessment of effect of preanalytic cold ischemic time on protein expression in breast cancer tissues. J Natl Cancer Inst. 104 (23), 1815-1824 (2012).
- Panchuk-Voloshina, N., et al. Alexa dyes: A series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47 (9), 1179-1188 (1999).
- Rajaram, S., et al. Sampling strategies to capture single-cell heterogeneity. Nat Methods. 14 (10), 967-970 (2017).
- Bella, A., et al. Mouse models of peritoneal carcinomatosis to develop clinical applications. Cancers (Basel). 13 (5), 963 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。