Method Article
Трехмерная визуализация опухолевой ткани с использованием итерационного отбеливания расширяет подход мультиплексности
В этой статье
Резюме
В данной статье описан протокол мультиплексной иммунофлуоресценции, оптимизированный для характеристики трехмерной архитектуры перитонеальных метастазов.
Аннотация
Пространственная гетерогенность опухолевого микроокружения (ТМЭ) является критическим фактором, определяющим терапевтический ответ, особенно для иммуноонкологических препаратов, где успех зависит от распределения специфических субпопуляций иммунных клеток. За последнее десятилетие было внедрено множество сложных технологий для достижения детального разрешения TME с использованием двумерных срезов из фиксированных формалином, залитых парафином (FFPE) или фиксированных замороженных тканей. Несмотря на то, что эти тонкие срезы легче получить и проанализировать, им не хватает трехмерной архитектуры, необходимой для надежной и всесторонней характеристики опухоли. Чтобы устранить это ограничение, был разработан метод монтирования тканей и визуализации, позволяющий проводить трехмерный анализ опухолевых поражений в их нативном состоянии in vivo . В этом протоколе описывается заготовка опухолевой ткани человека, монтаж образцов на специально напечатанных платформах и процедуры окрашивания образцов после фиксации. Метод мультиплексной иммунофлуоресценции IBEX (Iterative Bleaching Extends Multiplexity) был адаптирован для характеристики трехмерной ТМЭ с использованием до 15 маркеров опухолевых, иммунных и стромальных клеток с использованием коммерчески доступных антител. Глубина визуализации до 100 мкм была достигнута с помощью инвертированного лазерного конфокального микроскопа белого света с специально напечатанным адаптером визуализации и коммерческими чашками со стеклянным дном для обеспечения оптимальной ориентации тканей. Этот протокол подчеркивает потенциал метода IBEX для расширения мультиплексных иммунофлуоресцентных исследований, обеспечивая более полное понимание состава TME.
Введение
Солидные опухоли очень вариабельны, со сложным составом типов клеток (злокачественные и незлокачественные), белков внеклеточного матрикса и растворимых факторов 1,2. В конечном счете, это очень сложное, гетерогенное опухолевое микроокружение (ТМЭ) определяет восприимчивость к таким методам лечения, как иммунотерапия 3,4. Таким образом, для характеристики сложности ТМЭ в срезах толщиной клеточного слоя (~4 мкМ) были применены такие технологии, как высокомультиплексная иммунофлуоресценция 5,6 и пространственная транскриптомика7.
В отличие от подходов к клеточной дисперсии, таких как секвенирование одиночных клеток и проточная цитометрия 8,9,10, эти методы сохраняют пространственные отношения для внесения критически важной информации о клеточных перекрестных помехах и могут быть использованы для идентификации потенциальных биомаркеров для прогнозирования ответа на лечение 11,12,13. Тем не менее, опухолевые поражения по своей сути являются трехмерными (3D) структурами, и двухмерные подходы, подобные упомянутым выше, не позволяют адекватно отразить сложный клеточный ландшафт. Важность 3D-биологии была оценена в этой области, о чем свидетельствует широкое использование культур опухолевых органоидов, полученных от пациентов14. Тем не менее, органоиды не сохраняют клеточную сложность оригинала in vivo TME, что ограничивает их применимость для использования с иммуномодулирующими препаратами или для характеристики разнообразных клеточных популяций TME.
Несмотря на то, что можно выполнить анализ последовательных 2D-сечений и вычислительно «сшить» изображения для 3D-рендеринга, этот метод является непомерно дорогим и сложным для выполнения с высокойточностью. Для экономически эффективной характеристики 3D-тканей (например, опухолей) воспроизводимым образом был разработан уникальный метод получения и мультиплексного иммунофлуоресцентного окрашивания/анализа, который был продемонстрирован с использованием поражений опухоли брюшины у пациента с первичным раком брюшины.
Основанный на адаптации хорошо зарекомендовавшей себя методики IBEX (Iterative Bleaching Extends Multiplexity)16,17, этот протокол детализирует 3D-печать держателя ткани и адаптера для визуализации, заготовку и монтаж перитонеальной ткани, многократные циклы окрашивания различными опухолевыми и клеточными маркерами, а также конфокальную 3D-визуализацию с высоким разрешением.
протокол
Исследование было проведено с одобрения Институционального наблюдательного совета Национальных институтов здравоохранения в соответствии с протоколом NCT01915225. Человеческая ткань была получена с письменного информированного согласия во время диагностической лапароскопии. Все ткани были опухолевыми, что было определено при видимом осмотре и подтверждено окончательным гистопатологическим исследованием. Подробная информация обо всех используемых реагентах и оборудовании приведена в Таблице материалов. Схематическая иллюстрация всего рабочего процесса представлена на рисунке 1.
1. Печатные платформы, адаптер для обработки изображений и инкубационная пластина
- Процедуры нарезки / 3D-печати / постобработки для платформы и 9-луночных деталей планшета (см. Рисунок 2A-C)
- Нарезка: Откройте программное обеспечение для нарезки и импортируйте файлы проекта в формате . Формат STL (Дополнительный файл 1 и Дополнительный файл 2). Сориентируйте модели для оптимальной печати и добавьте опоры. Выберите принтер медицинского класса, выберите прозрачную смолу и высоту слоя 50 мкм . Проверьте пригодность для печати и отправьте задание на принтер.
- 3D-печать: убедитесь, что принтер готов (правильно установите картридж со смолой, резервуар и платформу). На сенсорном экране принтера выберите загруженное задание в программном обеспечении слайсера, чтобы начать печать. После завершения печати используйте инструмент для снятия, чтобы отсоединить напечатанную деталь от платформы.
- Постобработка: Промойте деталь в моечной установке, заполненной 99% изопропиловым спиртом (IPA) в течение 15 минут. Снимите детали с моечного агрегата и замочите в свежем IPA на 5 минут.
- Отверждение детали в течение 60 минут при 60 °C. Снимите опоры с помощью резцов заподлицо. При необходимости отшлифуйте все опорные отметины мелкозернистой наждачной бумагой.
- Процедуры нарезки / 3D-печати / постобработки регулятора высоты и внешней крышки (показано на рисунке 2A-C)
- Нарезка: Откройте программу для печати и импортируйте файлы дизайна в формате . STL (Дополнительный файл 3 и Дополнительный файл 4). Ориентация моделей и назначение материалов. Выберите нужный режим печати (Высокое смешивание, Высокая скорость) и установите в настройках модели значение Матовый. Проверьте пригодность для печати и отправьте задание на принтер.
- 3D-печать: убедитесь, что в принтер загружены правильные материалы, а лоток для сборки чистый. В интерфейсе монитора принтера выберите загруженное задание , чтобы начать печать. После завершения печати с помощью скребка аккуратно извлеките напечатанную деталь из лотка для сборки.
- Постобработка: поместите напечатанные детали в водоструйный очиститель или систему очистки мешалкой, чтобы удалить материал поддержки. При необходимости выполните любое ручное снятие опоры с помощью таких инструментов, как пинцет или плоскогубцы.
- Лазерная резка платформенного слайдера (показано на рисунке 2A, C)
- Подготовка дизайна: Импортируйте файл *. Файл проекта DWG в векторном программном обеспечении (Дополнительный файл 5). Установите цвет линий на красный (RGB) для векторной резки. Отправьте задание на лазерный резак.
- Настройка лазерного резака: Откройте программное обеспечение для лазерного резака и импортируйте файл проекта. Выберите тип материала и отрегулируйте параметры мощности, скорости и разрешения для акрила толщиной 1/32 дюйма. Поместите материал на лазерную платформу, убедитесь, что она правильно выровнена, и сфокусируйте лазер.
- Лазерная резка: Запустите процесс лазерной резки и контролируйте, чтобы убедиться, что материал разрезается правильно.
2. Крепление тканей на печатных платформах
- Подготовка уборочной среды и подготовительный стол
- Добавьте 100 мл DMEM (с низким уровнем глюкозы) с Anti-Anti и поместите в инкубатор с температурой 37 °C до необходимости (среда для сбора урожая).
- Установите «подготовительный стол» в операционной со следующими предметами: автоклавные 3D-печатные платформы, упаковка 2-0 шелковых шовных завязок, нагревательная пластина, чашка для образцов с 50 мл предварительно подогретой среды для сбора урожая, 15-сантиметровая культуральная пластина, содержащая 30 мл предварительно подогретой среды для сбора урожая, и 24-луночная пластина с 4 лунками каждая, содержащая 1,5 мл среды для сбора урожая (поместите все на нагревательную пластину). 1 пара щипцов и 1 пара хирургических ножниц.
- Резекция и монтаж тканей
ПРИМЕЧАНИЕ: Ткань получают из операционной. При визуальном осмотре выявляются участки брюшины с очагами опухоли толщиной и диаметром менее 0,5 мм (рисунок 2D). Следует отметить, что для подготовки одной платформы необходимо ~ 2 см2 ткани (брюшины).- Осторожно отделите опухоленосную брюшину от нижележащей брюшной стенки, мускулатуры и фасции (выполняется хирургом). Переложите полученные листы салфетки в чашку для образцов с теплой средой для сбора урожая и поставьте на нагревательную тарелку (стол для подготовки).
- Закрепите салфетку на платформах в 15-сантиметровой пластине, содержащей среду для сбора урожая. Осторожно накиньте опухолевую ткань (мезотелиальной стороной вверх) на сторону небольшого отверстия платформы и закрепите ее на месте шелковым швом 2-0. Поместите подготовленную тканевую платформу обратно (погруженной) в 24-луночный планшет, содержащий питательную среду (рис. 2E-G).
ПРИМЕЧАНИЕ: Установите ткань достаточно для предотвращения складок на поверхности платформы, но не создавайте напряжения, так как это вызовет нежелательные биомеханические и физиологические изменения.
3. Процедура фиксации/окрашивания/отбеливания
ПРИМЕЧАНИЕ: Изменения по сравнению с исходным протоколом, адаптированным к FFPE толщиной 4 мкм или фиксированным замороженным срезам, показаны на рисунке 3. В таблице 1 приведен список антител (с разведениями), используемых для 1-6 раундов IBEX.
- Фиксация
- Приготовьте 40 мл фиксирующего буфера, добавив 10 мл фиксирующего материала в коническую пробирку объемом 50 мл, содержащую 30 мл холодного 1x PBS.
- С помощью пары щипцов перенесите ткань, установленную на платформах, в фиксирующий буфер и инкубируйте в течение 24 ч при 4 °C.
- Сцедите фиксатор и замените его 40 мл холодного 1x PBS и инкубируйте в течение 10 минут при 4 °C.
- Окрашивание
- Добавьте 1 мл блокирующего буфера (1% BSA, 0,3% Triton-X-100, 1% Fc Block в 1x PBS, отфильтрованном шприцевым фильтром 0,22 мкм) в каждую лунку и вставьте тканевые платформы. Заблокируйте не менее чем на 2 ч при комнатной температуре на коромысле, установленном на низкую скорость (30 об/мин).
ПРИМЕЧАНИЕ: Убедитесь, что вырез на платформе и паз в колодце выровнены. Этот шаг не привязан ко времени и может быть выполнен в течение ночи при температуре 4 °C. - Приготовьте 0,8 мл раствора антитела/красителя в микроцентрифужной пробирке и центрифугируйте при давлении 10 000 x g в течение 5 мин при комнатной температуре. Перелейте 0,75 мл в чистую лунку 9-луночного инкубационного планшета и вставьте промытую платформу.
- Оберните пластину алюминиевой фольгой и выдерживайте не менее 2 часов при комнатной температуре на коромысле, установленном на низкую скорость (30 оборотов в минуту).
- Промойте платформу в конической пробирке объемом 50 мл с 40 мл 1x PBS в течение 10 минут при 4 °C. Теперь платформа готова к установке в адаптер для обработки изображений.
- Добавьте 1 мл блокирующего буфера (1% BSA, 0,3% Triton-X-100, 1% Fc Block в 1x PBS, отфильтрованном шприцевым фильтром 0,22 мкм) в каждую лунку и вставьте тканевые платформы. Заблокируйте не менее чем на 2 ч при комнатной температуре на коромысле, установленном на низкую скорость (30 об/мин).
- Отбеливание
- После каждого раунда окрашивания и визуализации отбеливайте флуорофоры с помощью боргидрида лития, восстанавливающего сложный эфир (LiBH4). Эта обработка устраняет сигналы флуоресценции от Alexa Fluor (AF)488, AF647 и AF750, но не от AF594 и ядерного красителя Hoechst.
ВНИМАНИЕ: Борогидрид лития чрезвычайно реакционноспособен с водой. При контакте с водой выделяются легковоспламеняющиеся водородные газы; Отработанный борогидрид лития и одноразовые материалы, загрязненные боргидридом лития, необходимо утилизировать как опасные отходы. - Приготовьте 5 мл раствора LiBH4 1,5 мг/мл в дистиллированной воде (в химическом колпаке) и инкубируйте в течение 30 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Раствор LiBH4 теряет свою эффективность восстановления/отбеливания при приготовлении за >4 часа до использования. - Перелейте 1 мл раствора LiBH4 в чистую лунку 9-луночного инкубационного планшета и вставьте промытую платформу на 60 минут при комнатной температуре.
- Кратковременно промойте платформу в 20 мл 1x PBS в конической трубке и проверьте наличие оставшегося флуоресцентного сигнала, используя максимальную настройку лазера для компенсации Z в предыдущем раунде визуализации, прежде чем приступать к последующим раундам окрашивания.
- Повторите блокирование образца в течение 2 ч при комнатной температуре, прежде чем перейти к следующему этапу инкубации антител.
- После каждого раунда окрашивания и визуализации отбеливайте флуорофоры с помощью боргидрида лития, восстанавливающего сложный эфир (LiBH4). Эта обработка устраняет сигналы флуоресценции от Alexa Fluor (AF)488, AF647 и AF750, но не от AF594 и ядерного красителя Hoechst.
4. Процедура визуализации
- Сборка адаптеров/платформ для обработки изображений
- Добавьте 0,1 мл 1x PBS в центр стеклянного дна чашки для визуализации диаметром 3,5 см и отложите в сторону. Свободно вкрутите кольцо регулировки высоты по часовой стрелке во внешнюю крышку и установите платформу во внутренний пластиковый держатель (выравнивание по выемке-пазу). Закрепите платформу с помощью слайдера.
- Поместите собранный адаптер визуализации на стеклянную нижнюю чашку и осторожно опустите кольцо регулировки высоты, пока ткань не коснется буфера. Избегайте поворота платформы на стеклянном дне.
- Как только будет достигнуто оптимальное расстояние от стекла, добавьте 0,2 мл 1x PBS на ткань (теперь нижней стороной вверх), чтобы избежать обезвоживания тканей во время визуализации.
- Конфокальная визуализация
- Включите все компоненты инвертированного конфокального микроскопа, включая компьютер, микроскоп, лазер и светодиодный источник света для использования в окуляре. Запустите программное обеспечение для получения изображений .
- Выберите подходящий объектив (например, 20x или 40x) и добавьте подходящую среду для погружения. Например, в этом исследовании используется цель с 20-кратным увеличением воды; В объектив добавляется ~200 μL воды, чтобы избежать высыхания при получении длинных изображений.
- Поместите собранную чашку для визуализации в держатель образца на предметном столике микроскопа и убедитесь, что образец надежно закреплен (не перемещается).
ПРИМЕЧАНИЕ: При размещении собранного образца на предметном столике микроскопа обратите внимание на положение выреза и используйте одно и то же положение для итерационных циклов, чтобы облегчить совмещение изображения. Важно, чтобы адаптер визуализации находился на оптимальной высоте для последовательных раундов. - Центрируйте образец с помощью регулятора X-Y и поднесите объектив к защитному стеклу. Глядя в окуляр и используя сигнал Хёхста в качестве эталона, перемещайте объектив для получения точной фокусировки на ткани.
- Выберите подходящие лазерные линии или настройте WLL в соответствии со спектрами возбуждения и излучения флуорофоров, используемых для окрашивания образца ткани. Устраните перекрытие между каналами, регулируя настройки, и добавьте последовательности, если флуорофоры имеют схожие спектры возбуждения.
- Выберите следующие параметры получения изображения: скорость сканирования 600 Гц, разрешение XY 1024 x 1024, 3-строчные средние значения и двунаправленное сканирование.
- Выберите следующие параметры Z-стека: (1) используйте размер Z-шага, оптимизированный для используемой цели, (2) определите начало и конец стека, (3) настройте параметры Z-компенсации для достижения одинаковой яркости по всему стеку и (4) получите тестовый стек из 1 клетки с одним средним значением.
- Определите область для отображения и получите стек тайлов Z с высоким разрешением.
Результаты
Брюшина представляет собой пленчатую структуру толщиной менее 1 мм, которая выстилает поверхность брюшной стенки и прилегает к поверхностям органов брюшной полости. Он состоит из поверхностного мезотелия и нижележащей соединительной ткани, которая перемежается с жировыми клетками, лимфоцитами, макрофагами и фибробластами, а также кровеносными и лимфатическими сосудами. Злокачественные новообразования брюшины чаще всего возникают в результате метастазов опухоли брюшной полости (например, рака яичников или рака желудка)18 или, реже, могут быть первичными опухолями брюшины (например, мезотелиомой)19. Эти часто небольшие (<1 см) опухолевые поражения очень сложны, но поддаются 3D-характеристике с использованием описанной техники. Максимальная проекция в пять конфокальных сечений используется для просмотра всего образца, установленного на платформе (рис. 4, вставка в верхнем левом углу). Три первичных конъюгированных антитела (AF488-CD44, AF594-CD45 и AF647-подопланин) вместе с ядерным красителем Hoechst использовали для первого раунда IBEX (IBEX1, рис. 4). Опухолевые поражения проявляются в розетообразных структурах, которые являются дважды положительными на CD44 и подопланин и демонстрируют расположение ядер, характерное для папиллярной мезотелиомы.
Опухолевые клетки были идентифицированы с использованием клеточной морфологии и двух антител, поскольку как антиподопланин, так и анти-CD44 распознают неопухолевые клетки, о чем свидетельствует обнаружение лимфатических сосудов с помощью антиподопланина и связывание антитела CD44 с субпопуляциями иммунных клеток. Затем небольшие области интереса (ROI) захватываются с использованием формата сканирования листов в более высоком разрешении с оптимизированными размерами шага Z для рендеринга 3D-проекций (рис. 5A). Платформы были проведены через процедуры итеративного окрашивания, и те же ROI были визуализированы в циклах IBEX 1-6. Репрезентативные изображения границ раздела опухоли (желтый прямоугольник) и границы между опухолью и третичной лимфоидной структурой (TLS) (синий прямоугольник) собраны на рисунке 5B-M.
Наличие TLS и плотность CD3-положительных клеток указывают на значительную инфильтрацию иммунных клеток20 и, возможно, на реакцию на иммуномодулирующие препараты21. Следует отметить, что ТЛС и основная масса опухолевых поражений присутствуют в различных Z-глубинах ткани, как показано при сравнении стековых проекций различных оптических сечений на рисунке 6, что подчеркивает преимущества 3D-визуализации и потенциальные упущенные биологические возможности при применении 2D-визуализации к 3D-структурам. 3D-характер этих поражений становится более очевидным в файлах фильма (Фильм 1-12), которые изображают объемную визуализацию отдельных поражений на рисунке 5.
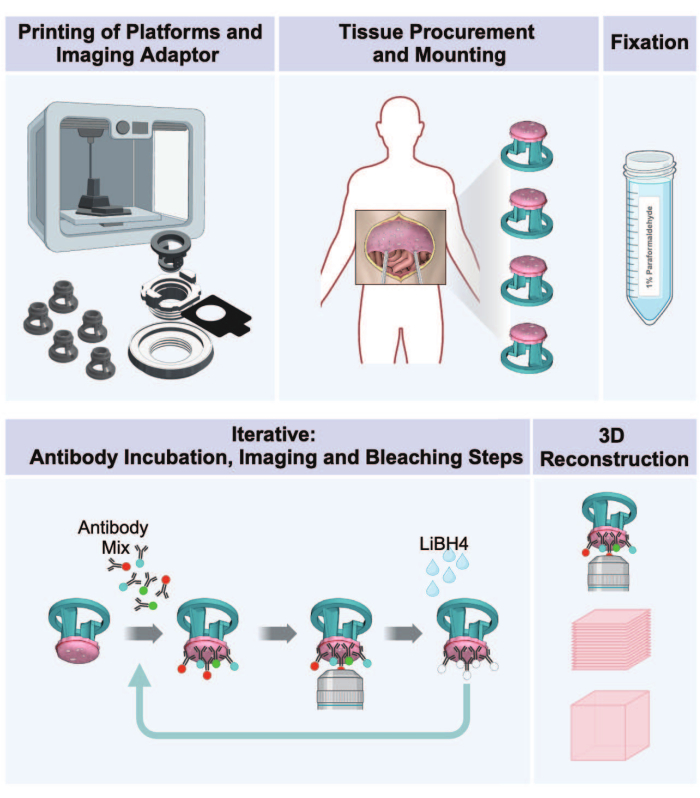
Рисунок 1: Рабочий процесс от 3D-печати до 3D-визуализации опухолей брюшины. Протокол состоит из последовательности из пяти этапов подготовки 3D-мультиплексных изображений из опухолевой перитонеальной ткани. (1) Печать платформ для приема тканей, деталей адаптера для визуализации и инкубационной пластины. (2) Процедуры заготовки и монтажа тканей. (3) Фиксация параформальдегидом. (4) Циклы окрашивания и визуализации IBEX. (5) 3D-реконструкция с использованием программного обеспечения для обработки изображений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Аппаратные компоненты с тканевым интерфейсом для 3D-визуализации. (A) Принципиальная схема сборки платформы в адаптере визуализации. (B) Инкубационная тарелка на 9 лунок. (C) Фотографии компонентов адаптера изображения в сборе. (D) Мезотелиомонесущая брюшина, наблюдаемая при диагностической лапароскопии. (E) Монтаж ткани на платформе. (Ф,Г) Опухоленосная брюшина, установленная на платформах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
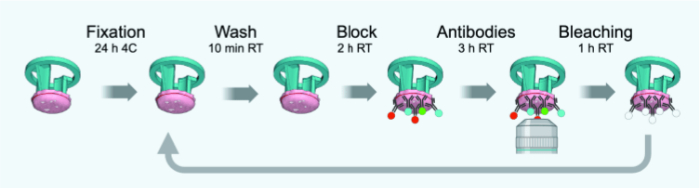
Рисунок 3: Временная схема циклов IBEX. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
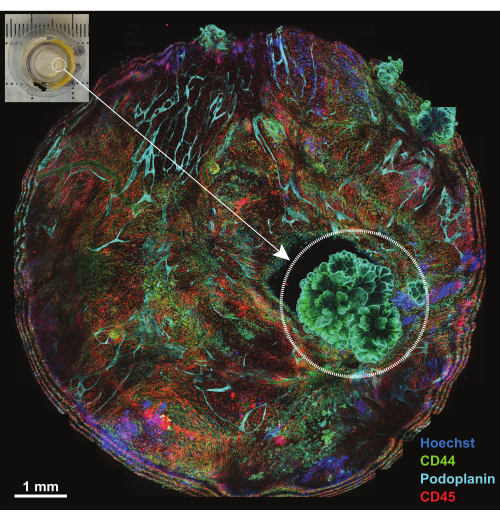
Рисунок 4: Обзор платформы после инкубации с панелью IBEX1. Максимальная проекция всей платформы после инкубации с панелью IBEX1 (Hoechst, AF488-CD44, AF594-CD45 и AF647-Podoplanin). Пунктирным кругом выделена опухоль. Вставка: Фотография опухолевой брюшины, установленной на платформе для визуализации. Масштабная линейка: 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
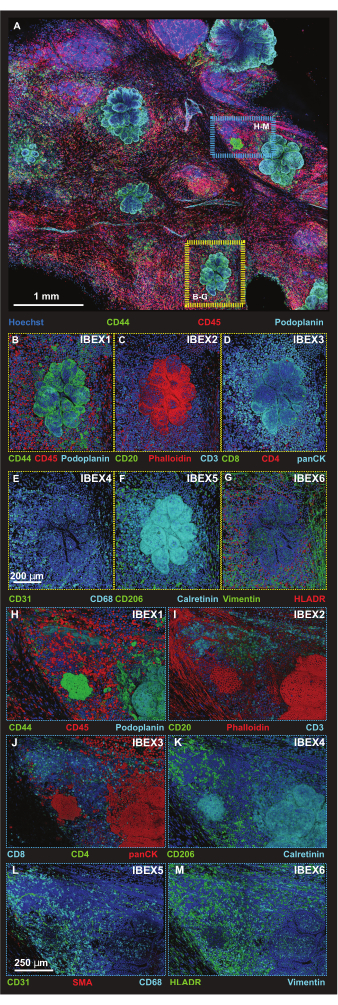
Рисунок 5: Иммунофлуоресцентные изображения с высоким разрешением выбранных областей платформы. (A) Максимальная проекция объединенного изображения Z-стека из 56 плиток, полученного после инкубации с панелью IBEX1 (Hoechst, AF488-CD44, AF594-CD45 и AF647-Podoplanin). Желтый прямоугольник: опухолевое поражение показано на панелях (B-G). Синий прямоугольник: граница между опухолью и третичной лимфоидной структурой показана на рисунке (H-M). (Б-Г) Одно индивидуальное опухолевое поражение с помощью IBEX панели 1-6 в объемном рендеринге. (B) IBEX1, зеленый: CD44, красный: CD45, голубой: Подопланин. (C) IBEX2, зеленый: CD20, красный: F-актин, голубой: CD3. (D) IBEX3, зеленый: CD8, красный: CD4, голубой: panCK. (E) IBEX4, зеленый: CD31, голубой: CD68. (F) IBEX5, зеленый: CD206, голубой: кальретинин. (G) IBEX6, зеленый: Виментин, красный: HLADR. (Х-М) Интерфейс одной индивидуальной опухолево-третичной лимфоидной структуры с панелью IBEX 1-6 в объемном рендеринге. (H) IBEX1, зеленый: CD44, красный: CD45, голубой: подопланин. (I) IBEX2, зеленый: CD20, красный: F-актин, голубой: CD3. (J) IBEX3, зеленый: CD4, красный: panCK, голубой: CD8. (K) IBEX4, зеленый: CD31, красный: SMA, голубой: CD68. (L) IBEX5, зеленый: CD206, голубой: кальретинин. (M) IBEX6, зеленый: HLADR, голубой: Vimentin. Все панели, синие: Hoechst. Масштабные линейки: (А, 1 мм); (В-М, 250 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
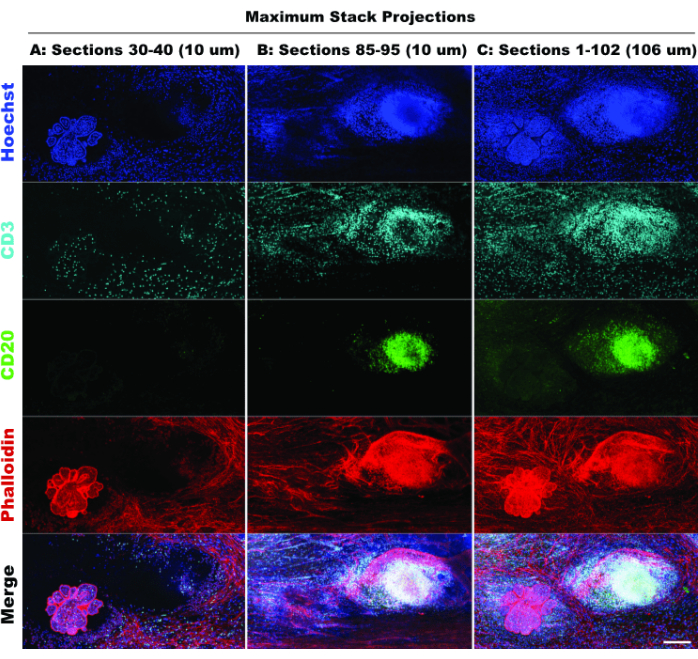
Рисунок 6: Имитация 2D-визуализации. Сравнение ограниченной (10 оптических сечений) и полной стековых (102 оптических секции) проекций подтверждает потерю тканевого контекста в 2D-моделировании. (A) Максимальная проекция секций 30-40 (10 мкм). (B) Максимальная проекция секций 85-95 (10 мкм). (C) Максимальная проекция секций 1-102 (~100 мкм). Все панели, IBEX2 (Hoechst, AF488-CD20, AF647-CD3, AF790-фаллоидин). Масштабная линейка: 200 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Антитела, используемые для отдельных панелей IBEX. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Видео 1: Анимированный объемный рендеринг отдельного поражения с помощью панели IBEX 1 (синий: Hoechst, зеленый: CD44, красный: CD45, голубой: Подопланин). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 2: Анимированный объемный рендеринг отдельного поражения с помощью панели IBEX 2 (синий: Hoechst, зеленый: CD20, красный: F-актин, голубой: CD3). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 3: Анимированный объемный рендеринг отдельного поражения с помощью панели IBEX 3 (синий: Hoechst, зеленый: CD8, красный: CD4, голубой: panCK). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 4: Анимированный объемный рендеринг отдельного поражения с помощью панели IBEX 4 (синий: Hoechst, зеленый: CD31, голубой: CD68). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 5: Анимированный объемный рендеринг отдельного поражения с помощью панели IBEX 5 (синий: Hoechst, зеленый: CD206, голубой: кальретинин). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 6: Анимированный объемный рендеринг отдельного поражения с помощью панели IBEX 6 (синий: Hoechst, зеленый: Vimentin, красный: HLADR). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 7: Анимированный объемный рендеринг границы раздела третичной лимфоидной структуры и поражения с панелью IBEX 1 (синий: Hoechst, зеленый: CD44, красный: CD45, голубой: Podoplanin). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 8: Анимированный объемный рендеринг третичной лимфоидной структуры-поражения с помощью панели IBEX 2 (синий: Hoechst, зеленый: CD20, красный: F-актин, голубой: CD3). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 9: Анимированный объемный рендеринг третичной лимфоидной структуры-поражения с помощью панели IBEX 3 (синий: Hoechst, зеленый: CD8, красный: CD4, голубой: panCK). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 10: Анимированный объемный рендеринг третичной лимфоидной структуры-поражения с помощью панели IBEX 4 (синий: Hoechst, зеленый: CD31, красный: SMA, голубой: CD68). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 11: Анимированный объемный рендеринг третичной лимфоидной структуры-поражения с помощью панели IBEX 5 (синий: Hoechst, зеленый: CD206, голубой: кальретинин). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 12: Анимированный объемный рендеринг третичной лимфоидной структуры-поражения с помощью панели IBEX 6 (синий: Hoechst, зеленый: Vimentin, красный: HLADR). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Дополнительный файл 1: Распечатайте файл для инкубационной пластины. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Распечатайте файл для 36 отдельных платформ. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: Распечатайте файл для кольца регулировки высоты. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 4: Распечатайте файл для внешней крышки. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 5: Лазерная резка файла для слайдера. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Современные мультиплексные методы флуоресцентной визуализации ограничены тонкими срезами и не обеспечивают 3D-контекст. В настоящем исследовании описан протокол применения метода визуализации IBEX16,17 к интактным опухолям, установленным на специально разработанных платформах. Опухолевые поражения брюшины были выбраны для того, чтобы подчеркнуть эту технику, поскольку у пациентов обычно обнаруживаются множественные опухолевые отложения идеального размера, которые берутся вместе с окружающей нормальной брюшиной в рамках стандартной циторедукционной хирургии, проводимой в большинстве третичных специализированных центров по всему миру22,23. Тем не менее, протокол применим как к паренхиматозным метастазам, так и к мышиным моделям опухолей с использованием срезов опухоли, как было описано ранее24,25. Кроме того, диаметр монтажного кольца на платформах может быть отрегулирован в соответствии с экспериментальными/тканевыми потребностями, хотя большие площади подвержены провисанию тканей и увеличению времени визуализации. Независимо от источника и размера ткани, для обеспеченияоптимального качества необходимо свести к минимуму время между заготовкой и консервацией. Установка подготовительного стола в операционной гарантирует оперативную обработку пациентов. Следует учитывать время от заготовки до фиксации ткани для обеспечения сопоставимости между экспериментами.
Образцы тканей отбираются по протоколу IBEX в виде целых креплений, т.е. этапы фиксации и визуализации, а также отбеливания выполняются с прикреплением неповрежденной ткани к платформе. Это гарантирует сохранность образца в течение циклов итеративного окрашивания/визуализации/отбеливания, поскольку отсутствует полупостоянная граница раздела со стеклом и нет необходимости многократного размещения/удаления покровного стекла из ткани, что может привести к потере ткани. Для экономии на реагентах специально разработанный 9-луночный планшет гарантирует оптимальную посадку платформы с минимальным «мертвым объемом». Все антитела, используемые для окрашивания, являются первичными конъюгированными антителами, а все используемые конъюгаты флуорофоров (за исключением красителя Хёхста) являются красителями Alexa Fluor, которые были выбраны из-за их превосходной яркости27. Панели антител для других флуорофоров были разработаны в соответствии с данными, полученными от сообщества визуализации IBEX, открытого глобального репозитория, собирающего наборы данных, протоколы и отзывы международной группы ученых с использованием IBEX (https://ibeximagingcommunity.github.io/ibex_imaging_knowledge_base/). Последовательность панелей антител была тщательно подобрана. В целом, цели с низкой численностью были помещены в более ранние циклы. Цикл 1 IBEX (CD45, CD44 и подопланин) является исключением, поскольку эти три маркера использовались для идентификации опухолевых поражений в начальном раунде окрашивания.
Панели антител сравнительно малы для уменьшения перекрестных помех каналов при высоких настройках интенсивности лазера, что необходимо для более глубокого изображения ткани с помощью конфокального микроскопа. Конъюгаты AF750 были включены везде, где это было возможно, чтобы расширить панель с 2 до 3 антител. Следует отметить, что коммерчески доступно не так много конъюгатов AF750, и тот факт, что мишень для этого канала должна быть в большом количестве, ограничивает использование этого флуорофора. В качестве примера можно привести конъюгированное антитело AF750 против СМА, которое использовалось в этом протоколе. Несмотря на то, что это клон, который надежно работает в конъюгированном с AF488 или AF594 антителе, интенсивность сигнала для этого антитела, конъюгированного с AF750, значительно ниже, что затрудняет генерацию высококачественных Z-стеков.
Инкубация антител продолжительностью 3 ч при комнатной температуре коротка по сравнению с исходным протоколом и, скорее всего, отражает более низкую плотность клеток в образцах перитонеальной ткани. Напротив, стадия отбеливания борогидридом лития в дозе 1,5 мг/мл в течение 60 мин была более строгой. Эти параметры были определены опытным путем и могут варьироваться в зависимости от используемых тканей и антител. Следует отметить, что из-за инкубации в реактивном отбеливающем растворе мелкие пузырьки воздуха могут задерживаться в тканях. Всякий раз, когда это становилось очевидным на этапе визуализации процедуры, образцы дегазировали путем вакуумирования платформы в 9-луночной инкубационной пластине с помощью всасывающего канистры. Простая регистрация образцов ITK, часто применяемая в исследованиях IBEX, не могла быть выполнена из-за чрезмерного ввода данных в программное обеспечение для анализа изображений. Тем не менее, идентичные популяции клеток легко идентифицировать путем сравнения отдельных наборов данных. В целом, итерационные циклы были рассчитаны таким образом, чтобы один цикл мог быть завершен за один день, при этом визуализация занимала большую часть всего цикла (~ 8 часов).
У этого метода есть ограничения, о которых стоит упомянуть. Требование по времени, предусмотренное протоколом, делает маловероятным широкое применение этого метода, а скорее в отдельных обстоятельствах. Мы предполагаем, что этот протокол лучше всего использовать для характеристики изменений в иммунном микроокружении опухоли до и после лечения (например, биспецифические антитела для иммунотерапии рака) или для прогнозирования общих результатов лечения. Несмотря на то, что этот протокол предлагает 3D-характеристику, неизвестно, какая площадь должна быть исследована для эффективного описания опухоли, включая ее сложные клеточные популяции. Доступ к свежим человеческим тканям также может быть затруднен в некоторых центрах, но мы предполагаем, что этот протокол применим и к животным моделям.
Применение этого протокола разнообразно: от фундаментальных исследований, анализирующих состав TME при множественных солидных опухолях, до биопсии тканей до и после биопсии тканей у пациентов, участвующих в клинических испытаниях. Несмотря на то, что данные, получаемые из одного слоя ткани толщиной в один клеточный слой, огромны, 3D-биологию можно легко упустить из виду. Мы рассматриваем 3D-визуализацию как дополнение к другим методам пространственной биологии, что, вероятно, помогает в выборе 2D-срезов для последующего анализа. Кроме того, активно разрабатывается протокол для включения компонента визуализации в реальном времени в течение нескольких часов с использованием описанного монтажа ткани и настройки визуализации.
Раскрытие информации
Никакой.
Благодарности
Это исследование было поддержано Программой внутренних исследований Национальных институтов здравоохранения и Национальным институтом рака (NCI). Это исследование также было частично поддержано CAT-I, исследовательским сотрудничеством между NIAID и NCI, возглавляемым Рональдом Жерменом. Мы хотели бы выразить нашу благодарность Андреа Радтке за ее энтузиазм и совместную работу. Ее опыт очень помог этому исследованию.
Материалы
| Name | Company | Catalog Number | Comments |
| Alexa Fluor Plus 750 Phalloidin | Invitrogen | A30105 | F-actin dye |
| Alexa Fluor 488 anti-human CD206 (MMR) Antibody | BioLegend | 321114 | antibody |
| Alexa Fluor 488 anti-human CD31 Antibody | BioLegend | 303110 | antibody |
| Alexa Fluor 488 anti-human CD4 Antibody | BioLegend | 300519 | antibody |
| Alexa Fluor 488 anti-human HLA-DR Antibody | BioLegend | 307656 | antibody |
| Alexa Fluor 488 anti-mouse/human CD44 Antibody | BioLegend | 103016 | antibody |
| Alexa Fluor 594 anti-human CD45 Antibody | BioLegend | 304060 | antibody |
| Alexa Fluor 647 Anti-Calretinin antibody [EP1798] | Abcam | ab214244 | antibody |
| Alexa Fluor 647 anti-human CD3 Antibody | BioLegend | 300416 | antibody |
| Alexa Fluor 647 anti-human CD8 Antibody | BioLegend | 344726 | antibody |
| Alexa Fluor 647 anti-human Podoplanin Antibody | BioLegend | 337007 | antibody |
| Alexa Fluor 647 anti-Vimentin Antibody | BioLegend | 677807 | antibody |
| Alexa Fluor 647 CD68 Antibody (KP1) | Santa Cruz | sc-20060AF647 | antibody |
| Alexa Fluor 750 Cytokeratin, pan Antibody (AE-1/AE-3) | Novus | NBP2-33200AF750 | antibody |
| Alexa Fluor 750 Human alpha-Smooth Muscle Actin Antibody | R&D | IC1420S | antibody |
| Alexa Fluor 488 CD20 Monoclonal Antibody (L26) eBioscience | Thermo Fisher | 53-0202-82 | antibody |
| Antibiotic-Antimycotic | Gibco | 15240096 | supplement harvest medium |
| BioMed Clear Resin (Form 3) | FormLabs | RS-F2-BMCL-01 | resin used for platform + incubation plate |
| BSA | Sigma | A7906-500g | blocking solution component |
| Cast acrylic 1/32" thick | material used for cutting slider | ||
| CleanStation DT3 | Stratasys | DT3 | post processing for height adjuster & outer lid |
| Container, Specimen | McKesson | 870203 | transfer of tissue from perating table to prep table |
| CorelDraw | CorelDRAW | Software to prepare the vector-based design file for laser cutting | |
| Cytofix | BD Bioscience | 554655 | fixative |
| Dish 15 cm | Falcon | 353025 | dish used during mounting |
| Dish 35 mm No. 1.5 Coverslip 14 mm Glass Diameter Uncoated | Matek | P35G-1.5-14-C | imaging dish |
| DMEM (no glucose) | Gibco | 11966025 | harvest medium |
| Fc Block | BD Bioscience | 564220 | blocking solution component |
| Form 3B+ | Formlabs | Form 3B+ | printer used for platform + incubation plate |
| Form Cure | Formlabs | FH-CU-01 | post processing for platform + incubation plate |
| Form Wash | Formlabs | FH-WA-01 | post processing for platform + incubation plate |
| GrabCAD Print | GrabCAD | GrabCAD Print | Software to prepare models for Stratasys printers |
| Hoechst 33342 10 mg/mL | Biotium | 40046 | nuclear dye |
| J826 Prime 3D Printer | Stratasys | J826 | printer used for height adjuster & outer lid |
| LAS X | Leica | LAS X | Confocal software |
| Laser cutting system | Universal Laser Systems | ULS PLS6.150D | CO2 Laser cutting used for slider |
| Lithium Borohydride | STREM Chemicals | 93-0397 | bleaching chemical |
| PBS, pH 7.4 | Gibco | 10010023 | base Buffer for washing, blocking, staining |
| PreForm | FormLabs | PreForm | Software to prepare models for Formlab printers |
| Silk sutures 2-0 | Ethicon | A305.O35 | affix tissue to platform |
| Stellaris 8 WLL confocal microscope | Leica | STELLARIS 8 | Confocal Imaging |
| Syringe filter | filter ab solution | ||
| Triton X-100 | American Bio | AB02025-00100 | permeabelizing reagent, blocking solution component |
| Vero ContactClear | Stratasys | CTT610, 4 KG | resin used for height adjuster & outer lid |
| Warming Tray | Spring USA | ST-1220 | keep media and tissue warm |
| Water, distilled | Gibco | 15230-170 | diluent for LiBH4 |
Ссылки
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Li, Z., Li, J., Bai, X., Huang, X., Wang, Q. Tumor microenvironment as a complex milieu driving cancer progression: A mini-review. Clin Transl Oncol. , (2024).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nat Rev Clin Oncol. 14 (12), 717-734 (2017).
- Roma-Rodrigues, C., Mendes, R., Baptista, P. V., Fernandes, A. R. Targeting tumor microenvironment for cancer therapy. Int J Mol Sci. 20 (4), 840 (2019).
- Sheng, W., et al. Multiplex immunofluorescence: A powerful tool in cancer immunotherapy. Int J Mol Sci. 24 (4), 3086 (2023).
- Bollhagen, A., Bodenmiller, B. Highly multiplexed tissue imaging in precision oncology and translational cancer research. Cancer Discov. 14 (11), 2071-2088 (2024).
- Jin, Y., et al. Advances in spatial transcriptomics and its applications in cancer research. Mol Cancer. 23 (1), 129 (2024).
- Kashyap, A., et al. Quantification of tumor heterogeneity: From data acquisition to metric generation. Trends Biotechnol. 40 (6), 647-676 (2022).
- Chang, Q., Hedley, D. Emerging applications of flow cytometry in solid tumor biology. Methods. 57 (3), 359-367 (2012).
- Zhang, L., et al. Single-cell analyses inform mechanisms of myeloid-targeted therapies in colon cancer. Cell. 181 (2), 442-459.e29 (2020).
- Wang, X. Q., et al. Spatial predictors of immunotherapy response in triple-negative breast cancer. Nature. 621 (7980), 868-876 (2023).
- Maestri, E., et al. Spatial proximity of tumor-immune interactions predicts patient outcome in hepatocellular carcinoma. Hepatology. 79 (4), 768-779 (2024).
- Wang, Q., et al. Role of tumor microenvironment in cancer progression and therapeutic strategy. Cancer Med. 12 (10), 11149-11165 (2023).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Lin, J. R., et al. Multiplexed 3d atlas of state transitions and immune interaction in colorectal cancer. Cell. 186 (2), 363-381.e19 (2023).
- Radtke, A. J., et al. Ibex: An iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- Radtke, A. J., et al. Ibex: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proc Natl Acad Sci U S A. 117 (52), 33455-33465 (2020).
- Van Baal, J. O., et al. The histophysiology and pathophysiology of the peritoneum. Tissue Cell. 49 (1), 95-105 (2017).
- Bridda, A., Padoan, I., Mencarelli, R., Frego, M. Peritoneal mesothelioma: A review. MedGenMed. 9 (2), 32 (2007).
- Demuytere, J., Ernst, S., Van Ovost, J., Cosyns, S., Ceelen, W. The tumor immune microenvironment in peritoneal carcinomatosis. Int Rev Cell Mol Biol. 371, 63-95 (2022).
- Wang, Q., et al. Heterogeneity of tertiary lymphoid structures predicts the response to neoadjuvant therapy and immune microenvironment characteristics in triple-negative breast cancer. Br J Cancer. , (2024).
- Kepenekian, V., et al. Peritoneal mesothelioma: Systematic review of hyperthermic intraperitoneal chemotherapy (HIPEC) protocol outcomes. Indian J Surg Oncol. 14 (Suppl 1), 39-59 (2023).
- Mcquade, C., Renton, M., Chouhan, A., Macdermott, R., O'brien, C. Review of imaging peritoneal disease and treatment. Can Assoc Radiol J. , (2024).
- Kenerson, H. L., et al. Tumor slice culture as a biologic surrogate of human cancer. Ann Transl Med. 8 (4), 114 (2020).
- Arrizabalaga, L., et al. Tumor slice culture system for ex vivo immunotherapy studies. Methods Cell Biol. 189, 55-69 (2024).
- Neumeister, V. M., et al. Quantitative assessment of effect of preanalytic cold ischemic time on protein expression in breast cancer tissues. J Natl Cancer Inst. 104 (23), 1815-1824 (2012).
- Panchuk-Voloshina, N., et al. Alexa dyes: A series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47 (9), 1179-1188 (1999).
- Rajaram, S., et al. Sampling strategies to capture single-cell heterogeneity. Nat Methods. 14 (10), 967-970 (2017).
- Bella, A., et al. Mouse models of peritoneal carcinomatosis to develop clinical applications. Cancers (Basel). 13 (5), 963 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены