Method Article
反復漂白法を用いた担腫瘍組織の三次元イメージングは、マルチプレキシック性アプローチを拡張します
要約
この記事では、腹膜転移の三次元構造を特徴付けるために最適化されたマルチプレックス免疫蛍光法のプロトコルについて説明します。
要約
腫瘍微小環境(TME)の空間的不均一性は、特に免疫腫瘍学の薬剤にとって、治療反応の重要な決定要因であり、成功は特定の免疫細胞亜集団の分布に依存します。過去10年間で、ホルマリン固定パラフィン包埋(FFPE)または固定凍結組織のいずれかからの2次元切片を使用してTMEの詳細な分解能を達成するために、複数の高度な技術が導入されてきました。これらの薄い切片は調達と分析が容易である一方で、腫瘍を確実かつ包括的に特徴付けるために必要な3次元構造が欠けています。この制限に対処するために、腫瘍病変のネイティブな in vivo 状態での3次元解析を可能にするために、組織マウントおよびイメージング技術が開発されました。このプロトコルは、ヒト腫瘍組織の調達、カスタムプリントされたプラットフォームへのサンプルのマウント、および固定後サンプルの染色手順について概説しています。マルチプレックス免疫蛍光法であるIBEX(反復的漂白はマルチプレックスを拡張する)は、市販の抗体を使用して、腫瘍細胞、免疫細胞、および間質細胞の最大15のマーカーで三次元TMEを特徴付けるように適合されました。倒立白色光レーザー共焦点顕微鏡とカスタムプリントイメージングアダプター、市販のガラス底皿を使用して、最大100μmのイメージング深度を達成し、最適な組織配向を確保しました。このプロトコルは、IBEX法がマルチプレックス免疫蛍光研究を拡大する可能性を強調し、TME組成のより包括的な理解を提供します。
概要
固形腫瘍は非常に多様で、細胞型(悪性および非悪性)、細胞外マトリックスタンパク質、および可溶性因子の複雑な組成があります1,2。最終的に、この非常に複雑で不均一な腫瘍微小環境(TME)が、免疫療法などの治療に対する感受性を決定します3,4。そのため、高度にマルチプレックス化された免疫蛍光5,6や空間的トランスクリプトミクス7などの技術が適用され、細胞層の厚さ(~4 μM)切片におけるTMEの複雑さを特徴付けています。
シングルセルシーケンシングやフローサイトメトリーなどの細胞分散アプローチとは対照的に、これらの技術は空間的関係を保持して細胞クロストークに関する重要な情報を提供し、治療反応の予測のための潜在的なバイオマーカーを特定するために使用できます11,12,13.しかし、腫瘍病変は本質的に3次元(3D)構造であり、上記のような2Dアプローチでは、複雑な細胞の風景を適切に捉えることはできません。3D生物学の重要性は、患者由来の腫瘍オルガノイド培養が広く利用されていることからも明らかなように、この分野で高く評価されている14。しかし、オルガノイドは元のin vivo TMEの細胞の複雑さを保持していないため、免疫調節薬との使用や多様なTME細胞集団の特性評価への適用性が制限されます。
連続した2Dセクションに対して解析を実行し、3Dレンダリングのために画像を計算的に「つなぎ合わせる」ことが可能かもしれませんが、この手法はコストがかかり、高忠実度で実現するのは困難です15。3D組織(腫瘍など)を再現性のある方法で費用対効果の高い方法で特性評価するために、原発性腹膜がん患者の腹膜腫瘍病変を用いて、調製およびマルチプレックス免疫蛍光染色/分析のための独自の方法が開発され、実証されました。
このプロトコルは、定評のあるIBEX技術(Iterative Bleaching Extends Multiplexity)16,17の適応に基づいており、組織ホルダーとイメージングアダプターの3Dプリント、腹膜組織の調達とマウント、さまざまな腫瘍および細胞型マーカーによる複数サイクルの染色、および高解像度の共焦点3Dイメージングについて詳しく説明します。
プロトコル
この研究は、プロトコルNCT01915225に基づき、国立衛生研究所の治験審査委員会の承認を得て実施されました。ヒト組織は、診断腹腔鏡検査時に書面によるインフォームドコンセントを得て取得されました。すべての組織は、目に見える検査によって決定され、最終的な病理組織学的検査を通じて確認されたように、腫瘍形成性でした。使用したすべての試薬および機器の詳細は、 材料表に記載されています。ワークフロー全体の概略図を 図 1 に示します。
1. 印刷プラットフォーム、イメージングアダプター、インキュベーションプレート
- プラットフォームおよび9ウェルプレート部品のスライス/3Dプリント/後処理手順(図2A-Cに概説)
- スライス: スライス ソフトウェア を開き、 にデザイン ファイルをインポートします。STL形式(Supplementary File 1 および Supplementary File 2)。最適な印刷のためにモデルの向きを調整し、サポートを追加します。医療グレードのプリンターを選択し、 透明な樹脂を選択し、層の高さを 50μm にします。印刷適性を確認し、ジョブをプリンターに送ってください。
- 3Dプリント:プリンタの準備ができていることを確認します(レジンカートリッジ、タンク、プラットフォームが正しい位置にあることを確認します)。プリンターのタッチスクリーンで、 アップロードしたジョブ をスライサーソフトウェアから選択して印刷を開始します。印刷が完了したら、取り外しツールを使用して、印刷されたパーツをプラットフォームから取り外します。
- 後処理:99%イソプロピルアルコール(IPA)を充填した洗浄ユニットで部品を15分間すすぎます。ウォッシュユニットから部品を取り外し、新しいIPAに5分間浸します。
- 部品を60°Cで60分間後硬化させます。 フラッシュカッターを使用してサポートを取り外します。必要に応じて、細かいグリットのサンドペーパーを使用してサポートマークを研磨します。
- 高さ調整器と外蓋のスライス/3Dプリント/後処理手順(図2A-Cに概説)
- スライス: 印刷ソフトウェア を開き、デザインをインポートします files.STL形式(Supplementary File 3 、 Supplementary File 4)。モデルの向きを調整し、材料を割り当てます。目的の印刷モード(ハイミックス、ハイスピード)を選択し、仕上げるモデル設定を マットに設定します。印刷適性を確認し、ジョブをプリンターに送ってください。
- 3Dプリント:プリンターに正しい材料がロードされ、ビルドトレイが汚れていないことを確認します。プリンターのモニターインターフェースで、 アップロードしたジョブ を選択して印刷を開始します。プリントが完了したら、スクレーパーツールを使用して、プリントしたパーツをビルドトレイからそっと取り外します。
- 後処理:印刷したピースをウォータージェットクリーナーまたは攪拌洗浄システムに入れて、サポート材料を取り除きます。必要に応じて、ピンセットやペンチなどのツールを使用して、手動でサポートを取り外してください。
- プラットフォームスライダーのレーザー切断( 図2A、Cに表示)
- デザインの準備: *をインポートします。ベクトルソフトウェアのDWGデザイン ファイル(補足ファイル5)。線の色を赤(RGB)に設定してベクトルカットします。ジョブをレーザーカッターに送信します。
- レーザーカッターのセットアップ:レーザーカッターソフトウェアを開き、デザインをインポートします file.素材の種類を選択し、1/32インチ厚のアクリルの電力、速度、解像度の設定を調整します。材料をレーザーベッドに置き、適切に位置合わせされていることを確認し、レーザーの焦点を合わせます。
- レーザー切断:レーザー切断プロセスを開始し、材料が正しく切断されていることを確認するために監視します。
2. 印刷されたプラットフォームへのティッシュの取り付け
- 収穫培地と準備テーブルの準備
- 100 mLのDMEM(低グルコース)にAnti-Antiを添加し、必要になるまで37°Cのインキュベーターに置きます(収穫培地)。
- 手術室に次のアイテムを備えた「準備テーブル」を設置します:オートクレーブ滅菌された3Dプリントプラットフォーム、2-0シルク縫合タイのパック、加熱プレート、50 mLの予熱された収穫培地が入ったサンプルカップ、30 mLの予熱された収穫培地が入った15 cm培養プレート、および1.5 mLの収穫培地が入った4つのウェルが入った24ウェルプレート(すべて加熱プレートに置きます)。 1対の鉗子と1対の外科用鋏。
- 組織切除とマウント
注:ティッシュは手術室から採取されます。腫瘍の病巣が厚さと直径が0.5mm未満の腹膜の領域は、目視検査で特定されます(図2D)。なお、1つのプラットフォームを調製するには、~2cm2 の組織(腹膜)が必要です。- 腫瘍担在腹膜を、下にある腹壁の筋肉組織および筋膜から慎重に分離します(外科医が行います)。得られたティッシュシートを温かい収穫培地が入ったサンプルカップに移し、加熱プレート(準備テーブル)に置きます。
- ティッシュを収穫培地が入った15cmプレートのプラットフォームに取り付けます。腫瘍担存組織(中皮側が上を向いている側)をプラットフォームの小さなオリフィス側に慎重にドレープし、2-0シルク縫合糸で所定の位置に固定します。調製した組織プラットホームを、ハーベスト培地を含む24ウェルプレートに逆(水没)します(図2E-G)。
注:プラットフォーム表面の折り目を防ぐのに十分なように教えられた組織を取り付けますが、これは望ましくない生体力学的および生理学的変化を誘発するため、張力を発生させないでください。
3. 固定/染色/漂白の手順
注:4 μmの薄FFPEまたは固定凍結切片に合わせた元のプロトコルからの変更点を 図3に示します。 表1 に、IBEXラウンド1-6に使用した抗体(希釈剤を含む)のリストを示します。
- 固定
- 30 mLの冷製1x PBSを含む50 mLのコニカルチューブに10 mLの固定ストックを加えて、40 mLの固定バッファーを調製します。
- 一対の鉗子を使用して、プラットフォームに取り付けた組織を固定緩衝液に移し、4°Cで24時間インキュベートします。
- 固定液をデカンタンジュし、40 mLの冷たくした1x PBSと交換し、4°Cで10分間インキュベートします。
- 染色
- 1 mLのブロッキングバッファー(1% BSA、0.3% Triton-X-100、1% Fc Block in 1x PBS、0.22 μm syringe filterでろ過)を各ウェルに加え、組織プラットフォームを挿入します。低速(30 rpm)に設定されたロッカーで室温で少なくとも2時間ブロックします。
注意: プラットフォームのノッチとウェルのグローブが揃っていることを確認します。このステップは時間に敏感ではなく、4°Cで一晩実行できます。 - 0.8 mLの抗体/色素溶液を微量遠心チューブに調製し、10,000 x g で室温で5分間遠心分離します。0.75 mLを9ウェルインキュベーションプレートの清浄なウェルに移し、洗浄したプラットホームを挿入します。
- プレートをアルミホイルで包み、低速(30 rpm)に設定したロッカーで室温で少なくとも2時間インキュベートします。
- プラットホームを50 mLのコニカルチューブに入れ、40 mLの1x PBSを4°Cで10分間洗浄します。 これで、プラットフォームをイメージングアダプターに挿入する準備が整いました。
- 1 mLのブロッキングバッファー(1% BSA、0.3% Triton-X-100、1% Fc Block in 1x PBS、0.22 μm syringe filterでろ過)を各ウェルに加え、組織プラットフォームを挿入します。低速(30 rpm)に設定されたロッカーで室温で少なくとも2時間ブロックします。
- 漂白
- 染色とイメージングの各ラウンドの後、エステル還元剤の水素化ホウ素リチウム(LiBH4)を使用して蛍光色素を漂白します。この処理により、Alexa Fluor (AF)488、AF647、および AF750 からの蛍光シグナルは除去されますが、AF594 と核色素 Hoechst からの蛍光シグナルは除去されません。
注意:水素化ホウ素リチウムは水と非常に反応性があります。可燃性水素ガスは、水と接触すると放出されます。使用済みの水素化ホウ素リチウムおよび水素化ホウ素リチウムで汚染された使い捨て品は、有害廃棄物として処分する必要があります。 - 蒸留水(ケミカルフード内)に5 mLの1.5 mg/mL LiBH4 溶液を調製し、室温で30分間インキュベートします。
注:LiBH4 溶液は、使用の>4時間前に調製すると、還元/漂白効果が失われます。 - 1 mLのLiBH4 溶液を9ウェルインキュベーションプレートの清浄なウェルに移し、洗浄したプラットホームを室温で60分間挿入します。
- コニカルチューブ内の20 mLの1x PBSでプラットフォームを短時間洗浄し、前のイメージングラウンドでZ補正の最も高いレーザー設定を使用して残りの蛍光シグナルを確認してから、次の染色ラウンドに進みます。
- サンプルのブロッキングを室温で2時間繰り返してから、次の抗体インキュベーションステップに進みます。
- 染色とイメージングの各ラウンドの後、エステル還元剤の水素化ホウ素リチウム(LiBH4)を使用して蛍光色素を漂白します。この処理により、Alexa Fluor (AF)488、AF647、および AF750 からの蛍光シグナルは除去されますが、AF594 と核色素 Hoechst からの蛍光シグナルは除去されません。
4. イメージング手順
- イメージングアダプター/プラットフォームの組み立て
- 3.5 cmのイメージングディッシュのガラス底の中央に0.1 mLの1x PBSを加え、取っておきます。高さ調整リングを時計回りに外蓋にゆるくねじ込み、プラットフォームを内側のプラスチックホルダーに取り付けます(ノッチグローブの位置合わせ)。スライダーでプラットフォームを固定します。
- 組み立てたイメージングアダプターをガラス底の皿に置き、ティッシュがバッファーに触れるまで高さ調整リングを慎重に下げます。ガラス底でプラットフォームを回転させないでください。
- ガラスから最適な距離に達したら、イメージング中の組織の脱水を避けるために、0.2 mLの1x PBSを組織(現在は下面を上にして)に加えます。
- 共焦点イメージング
- コンピューター、顕微鏡、レーザー、接眼レンズ用のLED光源など、倒立共焦点顕微鏡のすべてのコンポーネントの電源を入れます。 画像取得 ソフトウェアを起動します。
- 適切な対物レンズ( 20倍 や 40倍など)を選択し、適切な液浸媒体を追加します。たとえば、この研究では20倍の水対物レンズが使用されています。~200 μL の水が対物レンズに加えられ、長時間の画像取得で乾燥するのを防ぎます。
- 組み立てたイメージングディッシュを顕微鏡ステージのサンプルホルダーに入れ、試料が固定されている(動かない)ことを確認します。
注:組み立てたサンプルを顕微鏡ステージに置くときは、ノッチの位置に注意し、反復サイクルに同じ位置を使用して、画像の位置合わせを容易にします。連続したラウンドでは、イメージングアダプターを最適な高さ設定に保つことが重要です。 - X-Yコントロールを使用して試験片を中央に配置し、対物レンズをカバーガラスに近づけます。接眼レンズを覗き込み、Hoechst信号を基準として使用して、対物レンズを動かして組織に細かく焦点を合わせます。
- 適切なレーザーラインを選択するか、組織サンプルの染色に使用した蛍光色素の励起スペクトルと発光スペクトルに合わせてWLLを調整します。設定を調整してチャンネル間のオーバーラップを排除し、蛍光色素分子が同様の励起スペクトルを持つ場合は配列を追加します。
- 画像取得パラメータとして、スキャン速度 600Hz、XY解像度 1024×1024、 3ライン 平均、 双方向 スキャンを選択します。
- 次のZスタックパラメータを選択します:(1)使用する目的に最適化されたZステップサイズを使用する、(2)スタックの開始と終了を定義する、(3)スタック全体で等しい輝度を達成するためのZ補正パラメータの調整、および(4)1つの平均で1タイルのテストスタックを取得する。
- 画像化する領域を定義し、高解像度のタイルZスタックを取得します。
結果
腹膜は、腹壁の表面を覆う厚さ1mm未満の膜状構造で、腹部臓器の表面と隣接しています。これは、脂肪細胞、リンパ球、マクロファージ、線維芽細胞、血管、リンパ管が点在する表面の中皮とその下にある結合組織で構成されています。腹膜悪性腫瘍は、ほとんどの場合、腹部腫瘍転移(例えば、卵巣がんまたは胃がん)18 に起因し、または頻度は低いが、腹膜の原発腫瘍(例えば、中皮腫)19に起因します。これらのしばしば小さな(< cm)腫瘍病変は非常に複雑ですが、概説された手法を使用した3D特性評価に適しています。最大5つの共焦点セクションを投影して、プラットフォームに取り付けられたサンプル全体を表示します(図4、左上隅の挿入図)。3つの一次標識抗体(AF488-CD44、AF594-CD45、およびAF647-ポドプラニン)と核色素HoechstをIBEXの1回戦(IBEX1、 図4)に使用しました。腫瘍病変は、CD44とポドプラニンに対して二重陽性であり、乳頭状中皮腫に特徴的な核の配置を示すロゼット様構造によって明らかになります。
抗ポドプラニンと抗CD44の両方が非腫瘍細胞を認識するため、腫瘍細胞は細胞形態と2つの抗体を用いて同定されました。これは、抗ポドプラニンを介したリンパ管の検出と、CD44抗体の免疫細胞のサブセットへの結合によって証明されています。次に、3D投影のレンダリングに最適化されたZステップサイズで、高解像度のタイルスキャン形式を使用して、より小さな関心領域(ROI)をキャプチャします(図5A)。プラットホームを反復染色手順で採取し、同じROIをIBEXサイクル1〜6で画像化しました。腫瘍(黄色のボックス)と腫瘍-三次リンパ構造(TLS)インターフェース(青いボックス)の代表的な画像を図5B-Mにまとめました。
TLSの存在とCD3陽性細胞の密度は、免疫細胞の有意な浸潤20と、おそらく免疫調節薬21に対する応答性を示している。注目すべきは、図6の異なる光学セクションのスタック投影の比較で示されているように、TLSと腫瘍病変の大部分は組織の異なるZ深さに存在し、3Dイメージングの利点と、2Dイメージングを3D構造に適用した場合の潜在的な生物学の見逃しを強調しています。これらの病変の 3D 特性は、図 5 の個々の病変のボリューム レンダリングを描いたムービー ファイル (ムービー 1-12) でより明確になります。
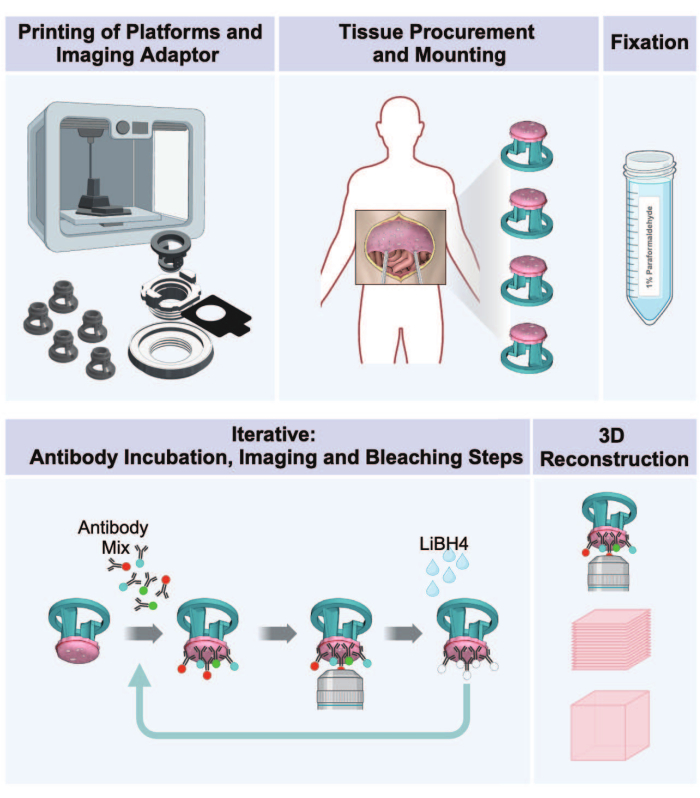
図1:腹膜腫瘍の3Dプリンティングから3Dイメージングまでのワークフロー。 このプロトコルは、腫瘍担存腹膜組織から 3D マルチプレックス画像を調製するための一連の 5 つのステップで構成されています。(1)ティッシュレシーブプラットフォーム、イメージングアダプター部品、インキュベーションプレートの印刷(2)ティッシュの調達と取り付け手順。(3)パラホルムアルデヒドによる固定。(4)IBEX染色およびイメージングサイクル。(5)イメージングソフトウェアによる3D再構成。 この図の拡大版を表示するには、ここをクリックしてください。

図2:3Dイメージング用の組織インターフェースを備えたハードウェアコンポーネント。 (A)イメージングアダプター内のプラットフォームアセンブリの概略図。(B)9ウェルインキュベーションプレート。(C)イメージアダプター部品の組み立て時の写真。(D)診断腹腔鏡検査中に観察された中皮腫を含む腹膜。(E)プラットフォームへのティッシュの取り付け。(F,G)プラットフォームに取り付けられた腫瘍担存腹膜。 この図の拡大版を表示するには、ここをクリックしてください。
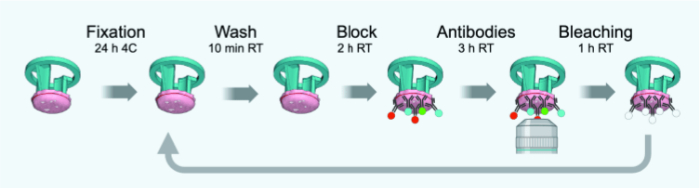
図3:IBEXサイクルのタイムライン概略図。 この図の拡大版を表示するには、ここをクリックしてください。
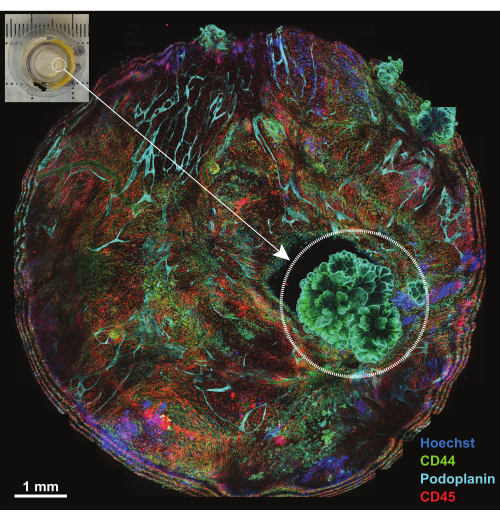
図4:IBEX1パネルを使用したインキュベーション後のプラットフォームの概要。 IBEX1パネル(Hoechst、AF488-CD44、AF594-CD45、AF647-Podoplanin)とのインキュベーション後のプラットフォーム全体の最大投影。破線の円は腫瘍を強調しています。挿入図:イメージングプラットフォームに取り付けられた腫瘍形成腹膜の写真。スケールバー:1 mm。 この図の拡大版を表示するには、ここをクリックしてください。
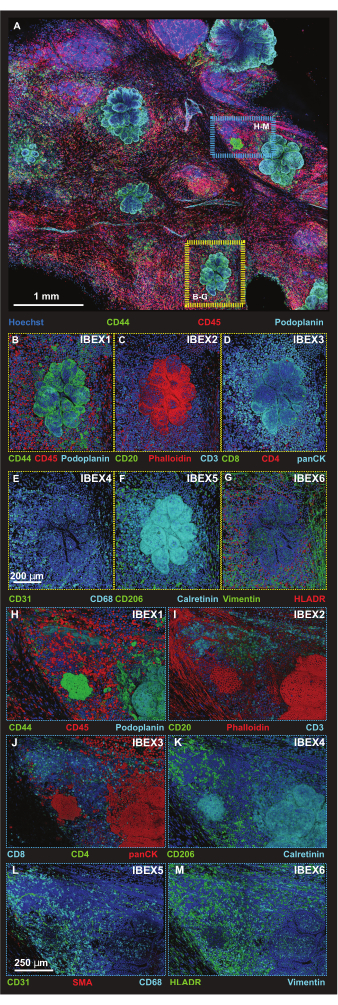
図5:選択したプラットフォーム領域の高解像度免疫蛍光画像。 (A)IBEX1パネル(Hoechst、AF488-CD44、AF594-CD45、AF647-Podoplanin)とのインキュベーション後に取得された56タイルのZスタック画像の最大投影。黄色の長方形:パネル(B-G)に示されている腫瘍病変。青色の長方形:(H-M)に示す腫瘍-三次リンパ系リンパ管構造界面。(B-G)ボリュームレンダリングの IBEX パネル 1-6 を使用した 1 つの個々の腫瘍病変。(B)IBEX1、緑:CD44、赤:CD45、シアン:ポドプラニン。(C)IBEX2、緑:CD20、赤:F-アクチン、シアン:CD3。(D)IBEX3、緑:CD8、赤:CD4、シアン:panCK。(E)IBEX4、グリーン:CD31、シアン:CD68。(F)IBEX5、緑:CD206、シアン:カルレチニン。(G)IBEX6、緑:ビメンチン、赤:HLADR。(H-M)ボリュームレンダリングのIBEXパネル1-6との1つの個々の腫瘍-三次リンパ系リンパ系構造界面。(H)IBEX1、緑:CD44、赤:CD45、シアン:ポドプラニン。(I)IBEX2、緑:CD20、赤:F-アクチン、シアン:CD3。(J)IBEX3、緑:CD4、赤:パンCK、シアン:CD8。(K)IBEX4、緑:CD31、赤:SMA、シアン:CD68。(L)IBEX5、緑:CD206、シアン:カルレチニン。(M)IBEX6、グリーン:HLADR、シアン:ビメンチン。すべてのパネル、青:Hoechst。スケールバー:(A、1 mm);(B-M、250μm)。この図の拡大版を表示するには、ここをクリックしてください。
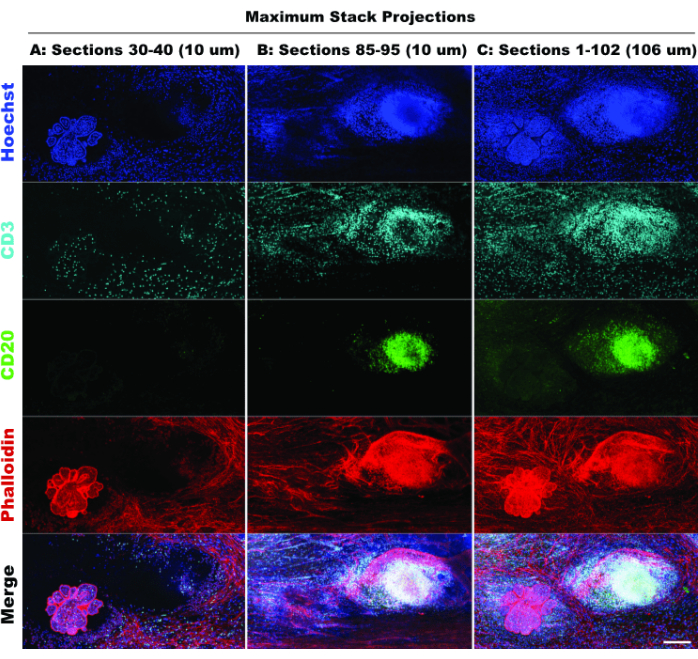
図6:シミュレートされた2Dイメージング。 リミテッド(10個の光学切片)とフルスタック(102個の光学切片)の投影を比較すると、2Dシミュレーションにおける組織コンテキストの喪失が確認されています。(A)セクション30〜40(10μm)の最大投影。(B)セクション85〜95の最大投影(10μm)。(C)セクション1〜102の最大投影(~100μm)。すべてのパネル、IBEX2(Hoechst、AF488-CD20、AF647-CD3、AF790-phalloidin)。スケールバー:200μmこの 図の拡大版を表示するには、ここをクリックしてください。
表1:各IBEXパネルに使用した抗体。この表をダウンロードするには、ここをクリックしてください。
動画1:IBEXパネル1 (青:Hoechst、緑:CD44、赤:CD45、シアン:ポドプラニン)による個々の病変のボリュームレンダリングのアニメーション化。 この映画をダウンロードするには、ここをクリックしてください。
動画2:IBEXパネル2 (青:Hoechst、緑:CD20、赤:F-actin、シアン:CD3)による個々の病変のボリュームレンダリングのアニメーション化。 この映画をダウンロードするには、ここをクリックしてください。
動画3:IBEXパネル3 (青:Hoechst、緑:CD8、赤:CD4、シアン:panCK)による個々の病変のボリュームレンダリングのアニメーション化。 この映画をダウンロードするには、ここをクリックしてください。
動画4:IBEXパネル4( 青:Hoechst、緑:CD31、シアン:CD68)による個々の病変のボリュームレンダリングのアニメーション化。 この映画をダウンロードするには、ここをクリックしてください。
動画5:IBEXパネル5( 青:Hoechst、緑:CD206、シアン:カルレチニン)による個々の病変のアニメーションボリュームレンダリング。 この映画をダウンロードするには、ここをクリックしてください。
動画6:IBEXパネル6( 青:Hoechst、緑:Vimentin、赤:HLADR)による個々の病変のボリュームレンダリングのアニメーション。 この映画をダウンロードするには、ここをクリックしてください。
動画7:IBEXパネル1(青:Hoechst、緑:CD44、赤:CD45、シアン:ポドプラニン)による三次リンパ系構造-病変界面のボリュームレンダリングのアニメーション化。この映画をダウンロードするには、ここをクリックしてください。
動画8:IBEXパネル2(青:Hoechst、緑:CD20、赤:F-actin、シアン:CD3)による三次リンパ系構造-病変界面のボリュームレンダリングのアニメーション化。この映画をダウンロードするには、ここをクリックしてください。
動画9:IBEXパネル3による三次リンパ系構造-病変界面のボリュームレンダリングのアニメーション 化(青:Hoechst、緑:CD8、赤:CD4、シアン:panCK)。 この映画をダウンロードするには、ここをクリックしてください。
動画10:IBEXパネル4(青:Hoechst、緑:CD31、赤:SMA、シアン:CD68)による三次リンパ系構造-病変界面のボリュームレンダリングのアニメーション化。この映画をダウンロードするには、ここをクリックしてください。
動画11:IBEXパネル5(青:Hoechst、緑:CD206、シアン:カルレチニン)を用いた三次リンパ系組織-病変界面のボリュームレンダリングのアニメーション化。この映画をダウンロードするには、ここをクリックしてください。
動画12:IBEXパネル6による三次リンパ系構造-病変インターフェースのボリュームレンダリングのアニメーション 化(青:Hoechst、緑:ビメンチン、赤:HLADR)。 この映画をダウンロードするには、ここをクリックしてください。
補足ファイル1:インキュベーションプレート用のファイルを印刷します。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:36の個々のプラットフォームの印刷ファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル3:高さ調整リングの印刷ファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル4:外蓋用の印刷ファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル5:スライダーのレーザーカットファイル。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
現在の蛍光イメージングのマルチプレックス技術は、薄い切片に限定されており、3Dコンテキストを提供していません。本研究では、IBEXイメージング法16,17をカスタム設計プラットフォームにマウントされた無傷の腫瘍に適用するためのプロトコルについて説明します。腹膜腫瘍病変は、患者が一般的に複数の理想的なサイズの腫瘍沈着物を呈し、世界中のほとんどの三次紹介センターで実施される標準的な細胞減少手術の一部として周囲の正常な腹膜とともに採取されるため、この技術を強調するために選択されました22,23。それにもかかわらず、このプロトコルは、以前に記載されているように、腫瘍スライスを使用して実質転移およびマウスモデル腫瘍にも同様に適用可能である24,25。さらに、プラットフォーム上の取り付けリングの直径は、実験/組織のニーズに合わせて調整できますが、領域が大きくなると組織のたるみが発生しやすく、イメージング時間が長くなります。組織の供給源やサイズに関係なく、最適な品質を確保するためには、調達から保存までの時間を最小限に抑える必要があります26。手術室にプレップテーブルを設置することで、患者が関与した場合の迅速な処理が保証されます。調達から組織の固定までの時間に注意して、実験間の比較可能性を確保する必要があります。
組織サンプルは、IBEXプロトコルを通じて採取され、固定とイメージング、および漂白ステップは、無傷の組織をプラットフォームに貼り付けた状態で実行されます。これにより、半永久的な断面ガラスの界面がなく、組織からカバーガラスを繰り返し配置/取り外す必要がないため、反復的な染色/イメージング/漂白サイクルによるサンプルの保存が保証されます。試薬を節約するために、カスタム設計の9ウェルプレートは、最小限の「デッドボリューム」でプラットフォームの最適なフィット感を保証します。染色に使用されるすべての抗体は一次標識抗体であり、使用されるすべての蛍光色素標識(Hoechst色素を除く)は、優れた輝度で選択されたAlexa Fluor色素です27。その他の蛍光色素 抗体パネルは、IBEXを使用する国際的な科学者グループからのデータセット、プロトコル、フィードバックを収集するオープンでグローバルなリポジトリであるIBEXイメージングコミュニティから寄託されたデータに基づいて設計されました(https://ibeximagingcommunity.github.io/ibex_imaging_knowledge_base/)。抗体パネルの配列は慎重に選択されました。一般に、存在量が少ないターゲットは、以前のサイクルに配置されていました。IBEXサイクル1(CD45、CD44、およびポドプラニン)は、これらの3つのマーカーが最初の染色ラウンドで腫瘍病変を特定するために使用されたため、例外です。
抗体パネルは比較的小さいため、共焦点顕微鏡を使用して組織をより深くイメージングするために必要な高レーザー強度設定でのチャネルクロストークを低減します。AF750コンジュゲートは、パネルを2つから3つの抗体に拡大するために、可能な限り含まれました。注目すべきは、市販されているAF750コンジュゲートは多くなく、このチャネルのターゲットが非常に豊富であるはずであるという事実が、この蛍光色素の使用を制限していることです。一例は、このプロトコルで使用されたAF750標識抗SMA抗体です。AF488またはAF594に確実に結合したクローンですが、AF750と結合した抗体のシグナル強度は大幅に低く、高品質のZスタックを生成することは困難です。
室温で3時間の抗体インキュベーションは、元のプロトコールと比較して短く、腹膜組織サンプルの細胞密度が低いことを反映している可能性が最も高いです。対照的に、1.5 mg/mLの水素化ホウ素リチウムを60分間投与した漂白ステップは、より厳格でした。これらのパラメータは経験的に決定されたものであり、使用する組織や抗体によって異なる場合があります。注目すべきは、反応性漂白液中でのインキュベーションにより、小さな気泡が組織に閉じ込められる可能性があることです。この手順のイメージングステップでこれが明らかになった場合はいつでも、吸引キャニスターを使用して9ウェルインキュベーションプレートのプラットフォームを真空にさらすことにより、サンプルを脱気しました。IBEX試験でよく適用される単純なITKサンプル登録は、画像解析ソフトウェアへのデータ入力が圧倒的であったため、実行できませんでした。それにもかかわらず、個々のデータセットを比較することで、同一の細胞集団を簡単に特定できます。全体として、反復サイクルは、1 つのサイクルが 1 日で完了し、イメージングが全サイクルの大部分 (~ 8 時間) を占めるようにタイミングが調整されました。
この手法には、言及に値する制限があります。プロトコルの時間要件により、この方法は広く採用される可能性は低く、むしろ特定の状況で採用されます。このプロトコルは、治療前および治療後の腫瘍免疫微小環境の変化(がん免疫療法の二重特異性抗体など)を特徴付けるため、または一般的な治療結果を予測するために最もよく利用されると考えています。このプロトコルは3D特性評価を提供するが、腫瘍を効果的に記述するためにどれだけの領域を調査すべきかは不明であり、その複雑な細胞集団28を含む。新鮮なヒト組織へのアクセスも特定のセンターでは難しいかもしれませんが、このプロトコルは動物モデルにも適用できると想定しています29。
このプロトコルのアプリケーションは、複数の固形腫瘍にわたるTME組成を分析する基礎研究から、臨床試験に登録された患者の組織生検前/後生検まで、多岐にわたります。単一細胞層の厚い組織切片から得られるデータは膨大ですが、3D生物学は見落とされがちです。3Dイメージングは、他の空間生物学技術の補助として、その後の分析のための2Dセクションの選択に役立つと考えられます。さらに、記載された組織マウントおよびイメージングセットアップを使用して、ライブイメージングコンポーネントを数時間にわたって組み込むプロトコルが積極的に進行中である。
開示事項
何一つ。
謝辞
この研究は、国立衛生研究所および国立がん研究所(NCI)の学内研究プログラムの支援を受けました。この研究は、ロナルド・ジャーメインが率いるNIAIDとNCIの研究協力であるCAT-Iによっても部分的に支援されました。Andrea Radtke氏の熱心な協力的な努力に感謝の意を表します。彼女の専門知識は、この研究に大いに役立ちました。
資料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor Plus 750 Phalloidin | Invitrogen | A30105 | F-actin dye |
| Alexa Fluor 488 anti-human CD206 (MMR) Antibody | BioLegend | 321114 | antibody |
| Alexa Fluor 488 anti-human CD31 Antibody | BioLegend | 303110 | antibody |
| Alexa Fluor 488 anti-human CD4 Antibody | BioLegend | 300519 | antibody |
| Alexa Fluor 488 anti-human HLA-DR Antibody | BioLegend | 307656 | antibody |
| Alexa Fluor 488 anti-mouse/human CD44 Antibody | BioLegend | 103016 | antibody |
| Alexa Fluor 594 anti-human CD45 Antibody | BioLegend | 304060 | antibody |
| Alexa Fluor 647 Anti-Calretinin antibody [EP1798] | Abcam | ab214244 | antibody |
| Alexa Fluor 647 anti-human CD3 Antibody | BioLegend | 300416 | antibody |
| Alexa Fluor 647 anti-human CD8 Antibody | BioLegend | 344726 | antibody |
| Alexa Fluor 647 anti-human Podoplanin Antibody | BioLegend | 337007 | antibody |
| Alexa Fluor 647 anti-Vimentin Antibody | BioLegend | 677807 | antibody |
| Alexa Fluor 647 CD68 Antibody (KP1) | Santa Cruz | sc-20060AF647 | antibody |
| Alexa Fluor 750 Cytokeratin, pan Antibody (AE-1/AE-3) | Novus | NBP2-33200AF750 | antibody |
| Alexa Fluor 750 Human alpha-Smooth Muscle Actin Antibody | R&D | IC1420S | antibody |
| Alexa Fluor 488 CD20 Monoclonal Antibody (L26) eBioscience | Thermo Fisher | 53-0202-82 | antibody |
| Antibiotic-Antimycotic | Gibco | 15240096 | supplement harvest medium |
| BioMed Clear Resin (Form 3) | FormLabs | RS-F2-BMCL-01 | resin used for platform + incubation plate |
| BSA | Sigma | A7906-500g | blocking solution component |
| Cast acrylic 1/32" thick | material used for cutting slider | ||
| CleanStation DT3 | Stratasys | DT3 | post processing for height adjuster & outer lid |
| Container, Specimen | McKesson | 870203 | transfer of tissue from perating table to prep table |
| CorelDraw | CorelDRAW | Software to prepare the vector-based design file for laser cutting | |
| Cytofix | BD Bioscience | 554655 | fixative |
| Dish 15 cm | Falcon | 353025 | dish used during mounting |
| Dish 35 mm No. 1.5 Coverslip 14 mm Glass Diameter Uncoated | Matek | P35G-1.5-14-C | imaging dish |
| DMEM (no glucose) | Gibco | 11966025 | harvest medium |
| Fc Block | BD Bioscience | 564220 | blocking solution component |
| Form 3B+ | Formlabs | Form 3B+ | printer used for platform + incubation plate |
| Form Cure | Formlabs | FH-CU-01 | post processing for platform + incubation plate |
| Form Wash | Formlabs | FH-WA-01 | post processing for platform + incubation plate |
| GrabCAD Print | GrabCAD | GrabCAD Print | Software to prepare models for Stratasys printers |
| Hoechst 33342 10 mg/mL | Biotium | 40046 | nuclear dye |
| J826 Prime 3D Printer | Stratasys | J826 | printer used for height adjuster & outer lid |
| LAS X | Leica | LAS X | Confocal software |
| Laser cutting system | Universal Laser Systems | ULS PLS6.150D | CO2 Laser cutting used for slider |
| Lithium Borohydride | STREM Chemicals | 93-0397 | bleaching chemical |
| PBS, pH 7.4 | Gibco | 10010023 | base Buffer for washing, blocking, staining |
| PreForm | FormLabs | PreForm | Software to prepare models for Formlab printers |
| Silk sutures 2-0 | Ethicon | A305.O35 | affix tissue to platform |
| Stellaris 8 WLL confocal microscope | Leica | STELLARIS 8 | Confocal Imaging |
| Syringe filter | filter ab solution | ||
| Triton X-100 | American Bio | AB02025-00100 | permeabelizing reagent, blocking solution component |
| Vero ContactClear | Stratasys | CTT610, 4 KG | resin used for height adjuster & outer lid |
| Warming Tray | Spring USA | ST-1220 | keep media and tissue warm |
| Water, distilled | Gibco | 15230-170 | diluent for LiBH4 |
参考文献
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Li, Z., Li, J., Bai, X., Huang, X., Wang, Q. Tumor microenvironment as a complex milieu driving cancer progression: A mini-review. Clin Transl Oncol. , (2024).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nat Rev Clin Oncol. 14 (12), 717-734 (2017).
- Roma-Rodrigues, C., Mendes, R., Baptista, P. V., Fernandes, A. R. Targeting tumor microenvironment for cancer therapy. Int J Mol Sci. 20 (4), 840 (2019).
- Sheng, W., et al. Multiplex immunofluorescence: A powerful tool in cancer immunotherapy. Int J Mol Sci. 24 (4), 3086 (2023).
- Bollhagen, A., Bodenmiller, B. Highly multiplexed tissue imaging in precision oncology and translational cancer research. Cancer Discov. 14 (11), 2071-2088 (2024).
- Jin, Y., et al. Advances in spatial transcriptomics and its applications in cancer research. Mol Cancer. 23 (1), 129 (2024).
- Kashyap, A., et al. Quantification of tumor heterogeneity: From data acquisition to metric generation. Trends Biotechnol. 40 (6), 647-676 (2022).
- Chang, Q., Hedley, D. Emerging applications of flow cytometry in solid tumor biology. Methods. 57 (3), 359-367 (2012).
- Zhang, L., et al. Single-cell analyses inform mechanisms of myeloid-targeted therapies in colon cancer. Cell. 181 (2), 442-459.e29 (2020).
- Wang, X. Q., et al. Spatial predictors of immunotherapy response in triple-negative breast cancer. Nature. 621 (7980), 868-876 (2023).
- Maestri, E., et al. Spatial proximity of tumor-immune interactions predicts patient outcome in hepatocellular carcinoma. Hepatology. 79 (4), 768-779 (2024).
- Wang, Q., et al. Role of tumor microenvironment in cancer progression and therapeutic strategy. Cancer Med. 12 (10), 11149-11165 (2023).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Lin, J. R., et al. Multiplexed 3d atlas of state transitions and immune interaction in colorectal cancer. Cell. 186 (2), 363-381.e19 (2023).
- Radtke, A. J., et al. Ibex: An iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- Radtke, A. J., et al. Ibex: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proc Natl Acad Sci U S A. 117 (52), 33455-33465 (2020).
- Van Baal, J. O., et al. The histophysiology and pathophysiology of the peritoneum. Tissue Cell. 49 (1), 95-105 (2017).
- Bridda, A., Padoan, I., Mencarelli, R., Frego, M. Peritoneal mesothelioma: A review. MedGenMed. 9 (2), 32 (2007).
- Demuytere, J., Ernst, S., Van Ovost, J., Cosyns, S., Ceelen, W. The tumor immune microenvironment in peritoneal carcinomatosis. Int Rev Cell Mol Biol. 371, 63-95 (2022).
- Wang, Q., et al. Heterogeneity of tertiary lymphoid structures predicts the response to neoadjuvant therapy and immune microenvironment characteristics in triple-negative breast cancer. Br J Cancer. , (2024).
- Kepenekian, V., et al. Peritoneal mesothelioma: Systematic review of hyperthermic intraperitoneal chemotherapy (HIPEC) protocol outcomes. Indian J Surg Oncol. 14 (Suppl 1), 39-59 (2023).
- Mcquade, C., Renton, M., Chouhan, A., Macdermott, R., O'brien, C. Review of imaging peritoneal disease and treatment. Can Assoc Radiol J. , (2024).
- Kenerson, H. L., et al. Tumor slice culture as a biologic surrogate of human cancer. Ann Transl Med. 8 (4), 114 (2020).
- Arrizabalaga, L., et al. Tumor slice culture system for ex vivo immunotherapy studies. Methods Cell Biol. 189, 55-69 (2024).
- Neumeister, V. M., et al. Quantitative assessment of effect of preanalytic cold ischemic time on protein expression in breast cancer tissues. J Natl Cancer Inst. 104 (23), 1815-1824 (2012).
- Panchuk-Voloshina, N., et al. Alexa dyes: A series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47 (9), 1179-1188 (1999).
- Rajaram, S., et al. Sampling strategies to capture single-cell heterogeneity. Nat Methods. 14 (10), 967-970 (2017).
- Bella, A., et al. Mouse models of peritoneal carcinomatosis to develop clinical applications. Cancers (Basel). 13 (5), 963 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved