Method Article
הדמיה תלת מימדית של רקמה נושאת גידול באמצעות הלבנה איטרטיבית מרחיבה את גישת המולטיפלקסיות
In This Article
Summary
מאמר זה מתאר פרוטוקול לאימונופלואורסצנציה מרובה המותאם לאפיון הארכיטקטורה התלת מימדית של גרורות צפק.
Abstract
ההטרוגניות המרחבית של מיקרו-סביבת הגידול (TME) היא גורם מכריע לתגובה טיפולית, במיוחד עבור תרופות אימונו-אונקולוגיות, כאשר ההצלחה תלויה בהתפלגות של תת-אוכלוסיות ספציפיות של תאים חיסוניים. במהלך העשור האחרון, הוכנסו מספר טכנולוגיות מתוחכמות להשגת רזולוציה מפורטת של ה-TME באמצעות חתכים דו-ממדיים מרקמות קבועות בפורמלין, משובצות פרפין (FFPE) או רקמות קפואות קבועות. בעוד שקל יותר לרכוש ולנתח את החלקים הדקים הללו, הם חסרים את הארכיטקטורה התלת מימדית הדרושה לאפיון אמין ומקיף של גידול. כדי להתמודד עם מגבלה זו, פותחה טכניקת הרכבה והדמיה של רקמות כדי לאפשר ניתוח תלת מימדי של נגעי הגידול במצבם המקורי in vivo . פרוטוקול זה מתאר את רכישת רקמת הגידול האנושית, הרכבת דגימות על פלטפורמות מודפסות בהתאמה אישית ונהלי צביעה לדגימות לאחר קיבוע. טכניקת האימונופלואורסצנציה המולטיפלקס, IBEX (הלבנה איטרטיבית מרחיבה ריבוי), הותאמה לאפיון ה-TME התלת-ממדי עם עד 15 סמנים לתאי גידול, חיסון וסטרומה באמצעות נוגדנים זמינים מסחרית. עומק הדמיה של עד 100 מיקרומטר הושג באמצעות מיקרוסקופ לייזר קונפוקלי באור לבן הפוך עם מתאם הדמיה מודפס בהתאמה אישית וצלחות מסחריות עם תחתית זכוכית כדי להבטיח כיוון רקמות אופטימלי. פרוטוקול זה מדגיש את הפוטנציאל של שיטת IBEX להרחיב מחקרי אימונופלואורסצנציה מרובים, ומספק הבנה מקיפה יותר של הרכב TME.
Introduction
גידולים מוצקים משתנים מאוד, עם הרכב מורכב של סוגי תאים (ממאירים ולא ממאירים), חלבוני מטריצה חוץ-תאיים וגורמים מסיסים 1,2. בסופו של דבר, מיקרו-סביבת גידול הטרוגנית ומורכבת מאוד (TME) קובעת את הרגישות לטיפולים כמו אימונותרפיה 3,4. ככזה, טכנולוגיות כמו אימונופלואורסצנציהמרובה מאוד 5,6 וטרנסקריפטומיקה מרחבית7 יושמו כדי לאפיין את המורכבות של ה-TME בקטעים בעובי שכבת התא (~4 מיקרומטר).
בניגוד לגישות פיזור תאים כגון ריצוף תאים בודדים וזרימהציטומטרית 8,9,10, טכניקות אלו משמרות יחסים מרחביים כדי לתרום מידע קריטי על ערב-דיבור תאי וניתן להשתמש בהן כדי לזהות סמנים ביולוגיים פוטנציאליים לחיזוי תגובה לטיפול 11,12,13. עם זאת, נגעי גידול הם מטבעם מבנים תלת מימדיים (תלת מימדיים), וגישות דו-ממדיות כמו אלה שהוזכרו לעיל אינן לוכדות כראוי את הנוף התאי המורכב. החשיבות של ביולוגיה תלת מימדית הוערכה בתחום, כפי שמעיד השימוש הנרחב בתרביות אורגנואידים של גידול שמקורו בחולה14. עם זאת, אורגנואידים אינם שומרים על המורכבות התאית של ה-TME המקורי in vivo, מה שמגביל את הישימות לשימוש עם תרופות אימונומודולטוריות או לאפיון אוכלוסיות תאי TME המגוונות.
למרות שייתכן שניתן לבצע ניתוחים על חתכים דו-ממדיים סדרתיים ו"לתפור" את התמונות יחד באופן חישובי לעיבוד תלת מימדי, טכניקה זו היא חסכונית ומאתגרת לביצוע בנאמנות גבוהה15. כדי לאפיין רקמות תלת מימד בצורה חסכונית (למשל, גידולים) באופן הניתן לשחזור, פותחה שיטה ייחודית להכנה וניתוח צביעה/ניתוח אימונופלואורסצנטי מרובה והודגמה באמצעות נגעי גידול צפקי מחולה עם סרטן צפק.
בהתבסס על התאמה של טכניקת IBEX המבוססת היטב (הלבנה איטרטיבית מרחיבה ריבוי)16,17, פרוטוקול זה מפרט הדפסת תלת מימד של מחזיק רקמות ומתאם הדמיה, רכש והרכבה של רקמות צפק, מחזורים מרובים של צביעה עם סמנים שונים של גידולים וסוגי תאים, והדמיה תלת מימדית קונפוקלית ברזולוציה גבוהה.
Protocol
המחקר נערך באישור מועצת הביקורת המוסדית של המכונים הלאומיים לבריאות תחת פרוטוקול NCT01915225. רקמה אנושית הושגה בהסכמה מדעת בכתב בזמן הלפרוסקופיה האבחנתית. כל הרקמות היו נושאות גידול, כפי שנקבע בבדיקה גלויה ואושר בבדיקה היסטופתולוגית סופית. פרטים על כל הריאגנטים והציוד המשמשים מפורטים בטבלת החומרים. איור סכמטי של זרימת העבודה כולה מסופק באיור 1.
1. פלטפורמות הדפסה, מתאם הדמיה וצלחת דגירה
- נהלי חיתוך/הדפסת תלת מימד/לאחר עיבוד עבור הפלטפורמה וחלקי הצלחת עם 9 בארות (מתואר באיור 2A-C)
- חיתוך: פתח את תוכנת החיתוך וייבא את קבצי העיצוב ב- . תבנית STL (קובץ משלים 1 וקובץ משלים 2). כוון את הדגמים להדפסה אופטימלית והוסף תומכים. בחר את המדפסת בדרגה רפואית, בחר את השרף השקוף וגובה השכבה של 50 מיקרומטר. בדוק את יכולת ההדפסה ושלח את העבודה למדפסת.
- הדפסת תלת מימד: בדוק שהמדפסת מוכנה (מחסנית שרף, מיכל ופלטפורמה נכונים במקום). במסך המגע של המדפסת, בחר את העבודה שהועלתה מתוכנת הפריסה כדי להתחיל בהדפסה. לאחר השלמת ההדפסה, השתמש בכלי ההסרה כדי לנתק את החלק המודפס מהפלטפורמה.
- לאחר עיבוד: שטפו את החלק ביחידת הכביסה המלאה באלכוהול איזופרופיל 99% (IPA) למשך 15 דקות. הסר חלקים מיחידת הכביסה והשרו ב-IPA טרי למשך 5 דקות.
- לאחר ריפוי החלק למשך 60 דקות ב-60 מעלות צלזיוס. הסר תומכים באמצעות חותכי סומק. שייף את כל סימני התמיכה באמצעות נייר זכוכית עדין במידת הצורך.
- נהלי חיתוך/הדפסת תלת מימד/לאחר עיבוד עבור כוונון גובה ומכסה חיצוני (מתואר באיור 2A-C)
- חיתוך: פתח את תוכנת ההדפסה וייבא את קבצי העיצוב ב- . תבנית STL (קובץ משלים 3 וקובץ משלים 4). כוון את הדגמים והקצה חומרים. בחר את מצב ההדפסה הרצוי (ערבוב גבוה, מהירות גבוהה), והגדר את הגדרות הדגם לסיום מט. בדוק את יכולת ההדפסה ושלח את העבודה למדפסת.
- הדפסת תלת מימד: ודא שהחומרים הנכונים טעונים במדפסת ומגש הבנייה נקי. בממשק הצג של המדפסת, בחר את המשימה שהועלתה כדי להתחיל בהדפסה. לאחר השלמת ההדפסה, השתמש בכלי המגרד כדי להסיר בעדינות את החלק המודפס ממגש הבנייה.
- לאחר עיבוד: הנח את החלקים המודפסים במנקה סילון מים או במערכת ניקוי תסיסה כדי להסיר את חומר התמיכה. בצע כל הסרת תמיכה ידנית, במידת הצורך, באמצעות כלים כמו פינצטה או צבת.
- חיתוך לייזר של מחוון הפלטפורמה (מוצג באיור 2A,C)
- הכנת העיצוב: ייבא את ה-*. קובץ עיצוב DWG בתוכנת וקטור (קובץ משלים 5). הגדר את צבעי הקו לאדום (RGB) לחיתוך וקטורי. שלח את העבודה לחותך הלייזר.
- הגדרת חותך הלייזר: פתח את תוכנת חותך הלייזר וייבא את העיצוב file. בחר את סוג החומר והתאם את ההגדרות עבור הספק, מהירות ורזולוציה עבור אקריליק בעובי 1/32 אינץ'. הנח את החומר על מיטת הלייזר, ודא שהוא מיושר כהלכה ומקד את הלייזר.
- חיתוך בלייזר: התחל את תהליך חיתוך הלייזר ופקח כדי לוודא שהחומר נחתך כהלכה.
2. הרכבת רקמות על פלטפורמות מודפסות
- הכנת מדיום קציר ושולחן הכנה
- יש להוסיף 100 מ"ל של DMEM (גלוקוז נמוך) עם אנטי אנטי ולהניח באינקובטור של 37 מעלות צלזיוס עד הצורך (מדיום קציר).
- הקימו "שולחן הכנה" בחדר הניתוח עם הפריטים הבאים: פלטפורמות מודפסות בתלת מימד אוטומטיות, חבילה של 2-0 קשרי תפרי משי, צלחת חימום, לדוגמא עם מדיום קציר מחומם מראש של 50 מ"ל, צלחת תרבית בגודל 15 ס"מ המכילה 30 מ"ל מדיום קציר מחומם מראש וצלחת 24 בארות עם 4 בארות כל אחת המכילה 1.5 מ"ל מדיום קציר (מניחים הכל על צלחת חימום), זוג מלקחיים וזוג מזמרה כירורגית.
- כריתת רקמות והרכבה
הערה: רקמות מתקבלות מחדר הניתוח. אזורי צפק, עם מוקדי גידול בעובי ובקוטר של פחות מ-0.5 מ"מ, מזוהים בבדיקה ויזואלית (איור 2D). יש לציין כי יש צורך ב~ 2 ס"מ2 של רקמה (צפק) להכנת פלטפורמה אחת.- הפרד בזהירות את הצפק הנושא את הגידול מהשרירים והפאשיה של דופן הבטן הבסיסית (מבוצע על ידי המנתח). העבירו את יריעות הטישו שהתקבלו לכוס דגימה המכילה מדיום קציר חם והניחו על צלחת חימום (שולחן הכנה).
- הרכיבו את הרקמה על פלטפורמות בצלחת 15 ס"מ המכילה את מדיום הקציר. עטפו בזהירות את הרקמה הנושאת את הגידול (הצד המזותלי פונה כלפי מעלה) על צד הפתח הקטן של הפלטפורמה ואבטחו אותה במקומה עם תפר משי 2-0. הנח את פלטפורמת הרקמה המוכנה הפוך (שקועה) בצלחת של 24 בארות המכילה מדיום קציר (איור 2E-G).
הערה: הרכיבו את הרקמה שנלמדה מספיק כדי למנוע קפלים על משטח הפלטפורמה, אך אל תיצרו מתח מכיוון שהדבר יגרום לשינויים ביומכניים ופיזיולוגיים לא רצויים.
3. הליך קיבוע/צביעה/הלבנה
הערה: שינויים מהפרוטוקול המקורי המותאם ל-FFPE דק של 4 מיקרומטר או לחלקים קפואים קבועים מתוארים באיור 3. טבלה 1 מספקת רשימה של נוגדנים (עם דילול) המשמשים לסבבים 1-6 של IBEX.
- קיבוע
- הכן 40 מ"ל של מאגר קיבוע על ידי הוספת 10 מ"ל של מלאי קיבוע לצינור חרוטי של 50 מ"ל המכיל 30 מ"ל של PBS 1x קר.
- בעזרת זוג מלקחיים, העבירו את הרקמה המותקנת על פלטפורמות למאגר הקיבוע ודגרו למשך 24 שעות בטמפרטורה של 4 מעלות צלזיוס.
- רוקנים את הקיבוע ומחליפים אותו ב-40 מ"ל של PBS 1x קר ודוגרים למשך 10 דקות ב-4 מעלות צלזיוס.
- מכתים
- הוסף 1 מ"ל של מאגר חוסם (1% BSA, 0.3% Triton-X-100, 1% Fc Block ב-1x PBS מסונן עם מסנן מזרק 0.22 מיקרומטר) לכל באר והכנס פלטפורמות רקמה. חסום לפחות שעתיים בטמפרטורת החדר על נדנדה המוגדרת למהירות נמוכה (30 סל"ד).
הערה: ודא שהחריץ על הרציף והחורשה מיושרים היטב. שלב זה אינו רגיש לזמן וניתן לבצע אותו במהלך הלילה בטמפרטורה של 4 מעלות צלזיוס. - הכן 0.8 מ"ל של תמיסת נוגדן/צבע בצינור מיקרוצנטריפוגה וצנטריפוגה ב-10,000 x גרם למשך 5 דקות בטמפרטורת החדר. מעבירים 0.75 מ"ל לבאר נקייה של צלחת הדגירה בת 9 הבארות ומכניסים פלטפורמה שטופה.
- עוטפים את הצלחת בנייר אלומיניום ומדגרים לפחות שעתיים בטמפרטורת החדר על נדנדה המוגדרת למהירות נמוכה (30 סל"ד).
- שטפו את הפלטפורמה בצינור חרוטי של 50 מ"ל עם 40 מ"ל של 1x PBS למשך 10 דקות ב-4 מעלות צלזיוס. הפלטפורמה מוכנה כעת להכנסה למתאם ההדמיה.
- הוסף 1 מ"ל של מאגר חוסם (1% BSA, 0.3% Triton-X-100, 1% Fc Block ב-1x PBS מסונן עם מסנן מזרק 0.22 מיקרומטר) לכל באר והכנס פלטפורמות רקמה. חסום לפחות שעתיים בטמפרטורת החדר על נדנדה המוגדרת למהירות נמוכה (30 סל"ד).
- הלבנת
- לאחר כל סבב של צביעה והדמיה, הלבינו את הפלואורופורים באמצעות החומר מפחית אסטר ליתיום בורוהידריד (LiBH4). טיפול זה יבטל אותות פלואורסצנטיים מ-Alexa Fluor (AF)488, AF647 ו-AF750 אך לא מ-AF594 והצבע הגרעיני Hoechst.
זהירות: ליתיום בורוהידריד מגיב מאוד עם מים. גזי מימן דליקים משתחררים במגע עם מים; יש להשליך ליתיום בורוהידריד משומש וכלים חד פעמיים המזוהמים בליתיום בורוהידריד כפסולת מסוכנת. - הכינו 5 מ"ל של תמיסת LiBH4 של 1.5 מ"ג/מ"ל במים מזוקקים (במכסה מנוע כימי) ודגרו למשך 30 דקות בטמפרטורת החדר.
הערה: תמיסת LiBH4 תאבד את יעילות ההפחתה/הלבנה שלה כאשר מכינים אותה >4 שעות לפני השימוש. - העבירו 1 מ"ל של תמיסת LiBH4 לבאר נקייה של צלחת הדגירה עם 9 בארות והכנסו את הפלטפורמה השטופה למשך 60 דקות בטמפרטורת החדר.
- שטפו את הפלטפורמה לזמן קצר ב-20 מ"ל של 1x PBS בצינור חרוטי ובדקו את אות הקרינה שנותר באמצעות הגדרת הלייזר הגבוהה ביותר עבור פיצוי Z בסבב ההדמיה הקודם לפני שתמשיכו לסבבי הצביעה הבאים.
- חזור על חסימת הדגימה למשך שעתיים בטמפרטורת החדר לפני שתמשיך לשלב הדגירה הבא של הנוגדנים.
- לאחר כל סבב של צביעה והדמיה, הלבינו את הפלואורופורים באמצעות החומר מפחית אסטר ליתיום בורוהידריד (LiBH4). טיפול זה יבטל אותות פלואורסצנטיים מ-Alexa Fluor (AF)488, AF647 ו-AF750 אך לא מ-AF594 והצבע הגרעיני Hoechst.
4. הליך הדמיה
- הרכבת מתאמים/פלטפורמות הדמיה
- הוסף 0.1 מ"ל של 1x PBS למרכז תחתית הזכוכית של צלחת הדמיה בגודל 3.5 ס"מ והניח בצד. הברג את טבעת כוונון הגובה באופן רופף בכיוון השעון לתוך המכסה החיצוני והתקן את הפלטפורמה במחזיק הפלסטיק הפנימי (יישור חריץ). אבטח את הפלטפורמה באמצעות המחוון.
- הנח את מתאם ההדמיה המורכב על צלחת הזכוכית התחתונה והורד בזהירות את טבעת כוונון הגובה עד שהרקמה נוגעת במאגר. הימנע מסיבוב הפלטפורמה בתחתית הזכוכית.
- לאחר שמגיעים למרחק האופטימלי מהזכוכית, הוסף 0.2 מ"ל של 1x PBS על הרקמה (כעת הצד התחתון כלפי מעלה) כדי למנוע התייבשות רקמות במהלך ההדמיה.
- הדמיה קונפוקלית
- הפעל את כל הרכיבים של המיקרוסקופ הקונפוקלי ההפוך, כולל המחשב, המיקרוסקופ, הלייזר ומקור האור LED לשימוש בעינית. הפעל את התוכנה לרכישת תמונות .
- בחר את המטרה המתאימה (למשל, 20x או 40x) והוסף את מדיום הטבילה המתאים. לדוגמה, יעד מים פי 20 משמש במחקר זה; ~200 מיקרוליטר מים מתווספים למטרה כדי למנוע ייבוש במהלך רכישות תמונה ארוכות.
- הנח את צלחת ההדמיה המורכבת לתוך מחזיק הדגימה על המיקרוסקופ stage וודא שהדגימה מאובטחת (לא זזה).
הערה: בעת הנחת הדגימה המורכבת על המיקרוסקופ stage, שימו לב למיקום החריץ והשתמשו באותו מיקום עבור מחזורים איטרטיביים כדי להקל על יישור התמונה. חשוב לשמור על מתאם ההדמיה בהגדרת הגובה האופטימלי לסבבים עוקבים. - מרכז את הדגימה באמצעות בקרת XY והביא את המטרה עד לזכוכית הכיסוי. הסתכלות דרך העינית ושימוש באות Hoechst כהתייחסות, הזז את המטרה כדי להשיג מיקוד עדין ברקמה.
- בחר קווי לייזר מתאימים או התאם את WLL לספקטרום העירור והפליטה של הפלואורופורים המשמשים לצביעה של דגימת הרקמה. בטל חפיפה בין ערוצים על ידי התאמת ההגדרות והוסף רצפים אם לפלואורופורים יש ספקטרום עירור דומה.
- בחר את הפרמטרים הבאים לרכישת תמונות: מהירות סריקה 600 הרץ, רזולוציית XY 1024 x 1024, ממוצעים של 3 שורות וסריקה דו-כיוונית .
- בחר את הפרמטרים הבאים של Z-stack: (1) השתמש בגודל Z-step המותאם למטרה בה נעשה שימוש, (2) הגדר את ההתחלה והסוף של המחסנית, (3) התאם את פרמטרי קיזוז Z כדי להשיג בהירות שווה בכל הערימה, ו-(4) רכוש ערימת בדיקה של אריח אחד עם ממוצע אחד.
- הגדר את האזור להדמיה ורכוש ערימת אריחים-Z ברזולוציה גבוהה.
תוצאות
הצפק הוא מבנה קרומי בעובי של פחות מ-1 מ"מ המצפה את פני דופן הבטן וצמוד למשטחי איברי הבטן. הוא מורכב ממזותל פני השטח ורקמת חיבור בסיסית המשובצת בתאי שומן, לימפוציטים, מקרופאגים ופיברובלסטים, כמו גם כלי דם ולימפה. ממאירויות צפקיות נובעות לרוב מגרורות של גידולי בטן (למשל, סרטן השחלות או סרטן הקיבה)18 או, בתדירות נמוכה יותר, יכולות להיות גידולים ראשוניים של הצפק (למשל, מזותליומה)19. נגעי גידול קטנים אלה (<1 ס"מ) הם מורכבים ביותר אך ניתנים לאפיון תלת מימדי באמצעות הטכניקה המתוארת. הקרנה מקסימלית של חמישה חלקים קונפוקליים משמשת לצפייה בדגימה כולה המותקנת על פלטפורמה (איור 4, משובץ בפינה השמאלית העליונה). שלושה נוגדנים מצומדים עיקריים (AF488-CD44, AF594-CD45 ו-AF647-Podoplanin) יחד עם הצבע הגרעיני Hoechst שימשו לסבב הראשון של IBEX (IBEX1, איור 4). נגעי גידול ניכרים על ידי מבנים דמויי שושנה שהם חיוביים כפולים ל-CD44 ופודופלנין ומראים סידור של גרעינים האופייניים למזותליומה פפילרית.
תאי גידול זוהו באמצעות מורפולוגיה של תאים ושני נוגדנים מכיוון שגם אנטי-פודופלנין וגם אנטי-CD44 מזהים תאים שאינם גידוליים, כפי שמעידים איתור כלי לימפה באמצעות אנטי-פודופלנין וקשירת נוגדן CD44 לתת-קבוצות של תאים חיסוניים. אזורי עניין קטנים יותר (ROI) נלכדים לאחר מכן באמצעות פורמט סריקת אריחים ברזולוציה גבוהה יותר בגדלים ממוטבים של צעד-Z עבור עיבוד הקרנות תלת-ממדיות (איור 5A). הפלטפורמות נלקחו דרך הליכי הצביעה האיטרטיביים, ואותם החזר ROI צולמו במחזורי IBEX 1-6. תמונות מייצגות עבור ממשקי גידול (קופסה צהובה) ומבנה לימפה שלישוני של גידול (TLS) (קופסה כחולה) מורכבות באיור 5B-M.
נוכחות TLS וצפיפות של תאים חיוביים ל-CD3 מצביעים על חדירה משמעותית של תאי חיסון20 ואולי היענות לתרופות אימונומודולטוריות21. יש לציין כי TLS ורוב נגעי הגידול נמצאים בעומקי Z שונים של הרקמה, כפי שמודגם בהשוואת הקרנות מחסנית של חתכים אופטיים שונים באיור 6, תוך הדגשת היתרונות של הדמיה תלת מימדית והביולוגיה הפוטנציאלית שהוחמצה כאשר הדמיה דו-ממדית מיושמת על מבנים תלת מימדיים. האופי התלת-ממדי של הנגעים הללו בולט יותר בקבצי הסרטים (סרט 1-12), המתארים עיבודי נפח של הנגעים הבודדים באיור 5.
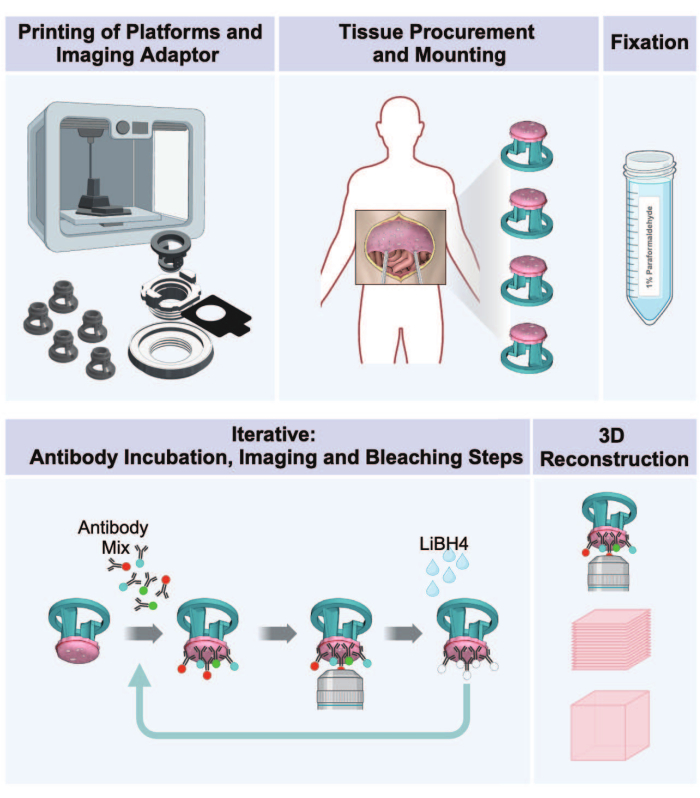
איור 1: זרימת עבודה מהדפסת תלת מימד להדמיה תלת מימדית של גידולי צפק. הפרוטוקול מורכב מרצף של חמישה שלבים להכנת תמונות מרובות תלת מימד מרקמת הצפק הנושאת גידול. (1) הדפסת פלטפורמות לקבלת רקמות, חלקי מתאם הדמיה וצלחת דגירה. (2) נהלי רכש והרכבה של רקמות. (3) קיבוע עם פרפורמלדהיד. (4) מחזורי צביעה והדמיה של IBEX. (5) שחזור תלת מימד באמצעות תוכנת הדמיה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: רכיבי חומרה עם ממשק רקמות עבור הדמיה תלת-ממדית. (A) תרשים סכמטי של הרכבת פלטפורמה בתוך מתאם הדמיה. (B) צלחת דגירה עם 9 בארות. (ג) תצלומים של רכיבי מתאם תמונה עם הרכבה. (D) צפק נושא מזותליומה כפי שנצפה במהלך לפרוסקופיה אבחנתית. (ה) הרכבת רקמה על הרציף. (ו,ז) צפק נושא גידול מותקן על פלטפורמות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
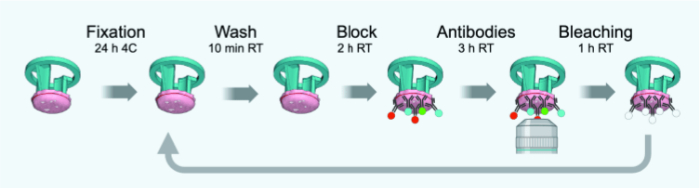
איור 3: סכימת ציר הזמן של מחזורי IBEX. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
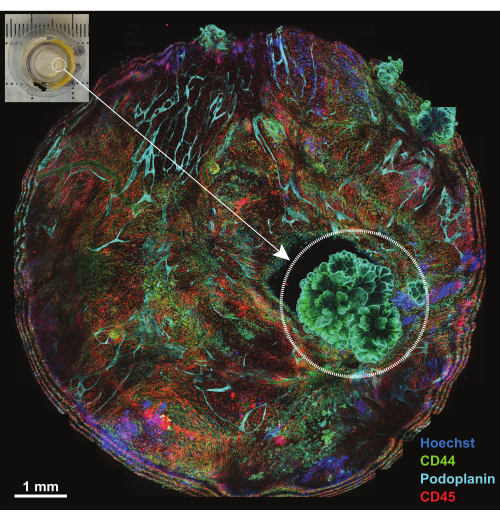
איור 4: סקירה כללית של הפלטפורמה לאחר הדגירה עם פאנל IBEX1. הקרנה מקסימלית של הפלטפורמה כולה לאחר הדגירה עם פאנל IBEX1 (Hoechst, AF488-CD44, AF594-CD45 ו-AF647-Podoplanin). העיגול המקווקו מדגיש את הגידול. שיבוץ: תצלום של הצפק הנושא גידול המותקן על פלטפורמת ההדמיה. סרגל קנה מידה: 1 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
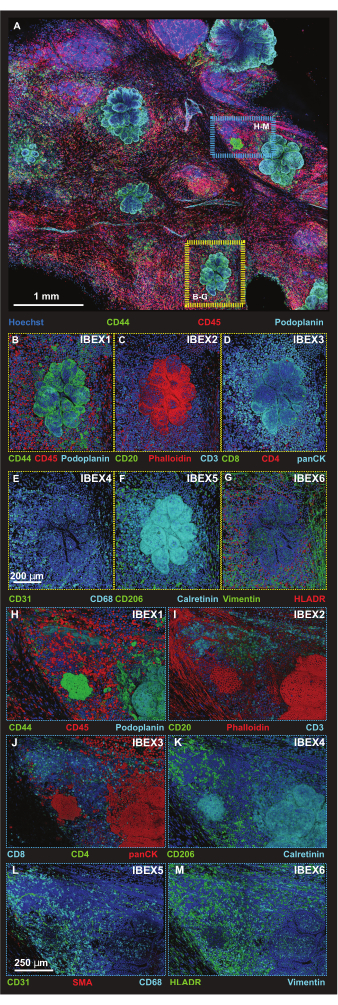
איור 5: תמונות אימונופלואורסצנטיות ברזולוציה גבוהה של אזורי פלטפורמה נבחרים. (A) הקרנה מקסימלית של תמונת Z-stack ממוזגת בת 56 אריחים שנרכשה לאחר הדגירה עם פאנל IBEX1 (Hoechst, AF488-CD44, AF594-CD45 ו-AF647-Podoplanin). מלבן צהוב: נגע גידול המוצג בפאנלים (B-G). מלבן כחול: ממשק מבנה לימפואיד גידול-שלישוני המוצג ב- (H-M). (ב-ז) נגע גידול בודד אחד עם פאנל IBEX 1-6 בעיבוד נפח. (B) IBEX1, ירוק: CD44, אדום: CD45, ציאן: פודופלנין. (C) IBEX2, ירוק: CD20, אדום: F-actin, ציאן: CD3. (D) IBEX3, ירוק: CD8, אדום: CD4, ציאן: panCK. (E) IBEX4, ירוק: CD31, ציאן: CD68. (F) IBEX5, ירוק: CD206, ציאן: קלרטינין. (G) IBEX6, ירוק: וימנטין, אדום: HLADR. (ח-מ) ממשק מבנה לימפואיד יחיד של גידול-שלישוני עם פאנל IBEX 1-6 בעיבוד נפח. (H) IBEX1, ירוק: CD44, אדום: CD45, ציאן: פודופלנין. (I) IBEX2, ירוק: CD20, אדום: F-actin, ציאן: CD3. (J) IBEX3, ירוק: CD4, אדום: panCK, ציאן: CD8. (K) IBEX4, ירוק: CD31, אדום: SMA, ציאן: CD68. (L) IBEX5, ירוק: CD206, ציאן: קלרטינין. (M) IBEX6, ירוק: HLADR, ציאן: Vimentin. כל הפאנלים, כחול: Hoechst. פסי קנה מידה: (A, 1 מ"מ); (B-M, 250 מיקרומטר). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
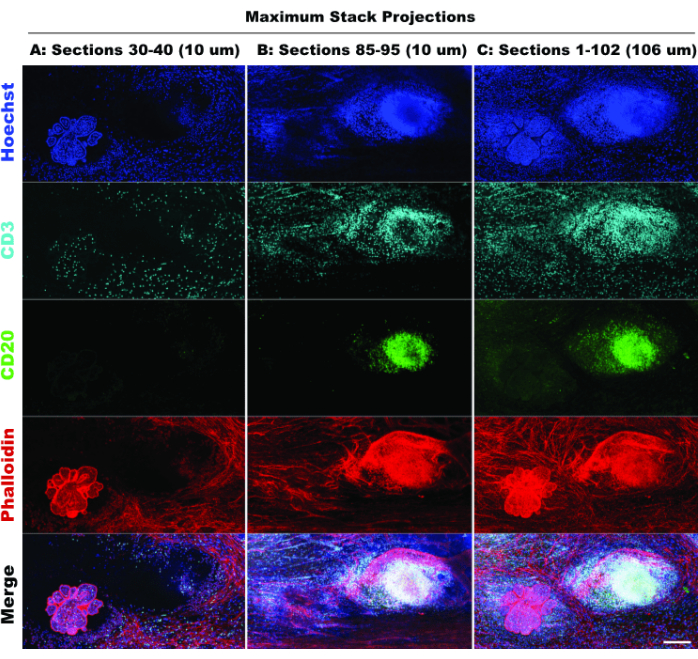
איור 6: הדמיה דו-ממדית מדומה. השוואה בין הקרנות מוגבלות (10 קטעים אופטיים) וערימה מלאה (102 חתכים אופטיים) מאשרת אובדן הקשר רקמה בסימולציה דו-ממדית. (א) הקרנה מקסימלית של קטעים 30-40 (10 מיקרומטר). (ב) הקרנה מקסימלית של קטעים 85-95 (10 מיקרומטר). (ג) הקרנה מקסימלית של סעיפים 1-102 (~100 מיקרומטר). כל הפאנלים, IBEX2 (Hoechst, AF488-CD20, AF647-CD3, AF790-phalloidin). סרגל קנה מידה: 200 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
טבלה 1: נוגדנים המשמשים לפאנלים הבודדים של IBEX. אנא לחץ כאן להורדת טבלה זו.
סרטון 1: עיבוד נפח מונפש של הנגע הבודד עם פאנל IBEX 1 (כחול: Hoechst, ירוק: CD44, אדום: CD45, ציאן: Podoplanin). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 2: עיבוד נפח מונפש של הנגע הבודד עם פאנל IBEX 2 (כחול: Hoechst, ירוק: CD20, אדום: F-actin, ציאן: CD3). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 3: עיבוד נפח מונפש של הנגע הבודד עם לוח IBEX 3 (כחול: Hoechst, ירוק: CD8, אדום: CD4, ציאן: panCK). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 4: עיבוד נפח מונפש של הנגע הבודד עם לוח IBEX 4 (כחול: Hoechst, ירוק: CD31, ציאן: CD68). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 5: עיבוד נפח מונפש של הנגע הבודד עם לוח IBEX 5 (כחול: Hoechst, ירוק: CD206, ציאן: קלרטינין). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 6: עיבוד נפח מונפש של הנגע הבודד עם לוח IBEX 6 (כחול: Hoechst, ירוק: Vimentin, אדום: HLADR). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 7: עיבוד נפח מונפש של ממשק מבנה-נגע לימפואיד שלישוני עם פאנל IBEX 1 (כחול: Hoechst, ירוק: CD44, אדום: CD45, ציאן: Podoplanin). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 8: עיבוד נפח מונפש של ממשק מבנה-נגע לימפואיד שלישוני עם פאנל IBEX 2 (כחול: Hoechst, ירוק: CD20, אדום: F-actin, ציאן: CD3). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 9: עיבוד נפח מונפש של ממשק מבנה לימפואיד שלישוני עם פאנל IBEX 3 (כחול: Hoechst, ירוק: CD8, אדום: CD4, ציאן: panCK). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 10: עיבוד נפח מונפש של ממשק מבנה-נגע לימפואיד שלישוני עם פאנל IBEX 4 (כחול: Hoechst, ירוק: CD31, אדום: SMA, ציאן: CD68). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 11: עיבוד נפח מונפש של ממשק מבנה-נגע לימפואיד שלישוני עם פאנל IBEX 5 (כחול: Hoechst, ירוק: CD206, ציאן: Calretinin). אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון 12: עיבוד נפח מונפש של ממשק מבנה-נגע לימפואיד שלישוני עם פאנל IBEX 6 (כחול: Hoechst, ירוק: Vimentin, אדום: HLADR). אנא לחץ כאן כדי להוריד את הסרט הזה.
קובץ משלים 1: הדפס קובץ עבור צלחת הדגירה. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 2: הדפס קובץ עבור 36 הפלטפורמות הבודדות. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 3: הדפס file עבור טבעת כוונון הגובה. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 4: הדפס file עבור המכסה החיצוני. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 5: קובץ חיתוך לייזר עבור המחוון. אנא לחץ כאן להורדת קובץ זה.
Discussion
טכניקות המולטיפלקס הנוכחיות להדמיה פלואורסצנטית מוגבלות לקטעים דקים ואינן מספקות הקשר תלת מימדי. המחקר הנוכחי מתאר פרוטוקול ליישום שיטת ההדמיה IBEX16,17 על גידולים שלמים המותקנים על פלטפורמות מותאמות אישית. נגעי גידול צפקי נבחרו כדי להדגיש את הטכניקה מכיוון שחולים מציגים בדרך כלל משקעי גידול מרובים בגודל אידיאלי הנלקחים יחד עם הצפק הנורמלי שמסביב כחלק מניתוח ציטודקציה סטנדרטי המבוצע ברוב מרכזי ההפניה השלישוניים ברחבי העולם22,23. עם זאת, הפרוטוקול ישים לגרורות פרנכימליות וגידולי מודל עכברים כאחד באמצעות פרוסות גידול כפי שתוארו בעבר24,25. יתר על כן, ניתן להתאים את קוטר טבעת ההרכבה על הפלטפורמות לצרכי ניסוי/רקמות, אם כי אזורים גדולים יותר מועדים לצניחת רקמות וזמני הדמיה ממושכים. ללא קשר למקור הרקמה ולגודלה, יש לשמור על הזמן בין הרכש לשימור מינימלי כדי להבטיח איכות אופטימלית26. הקמת שולחן הכנה בחדר הניתוח מבטיחה עיבוד מהיר כאשר מעורבים מטופלים. יש לציין את הזמן מהרכש ועד לקיבוע הרקמה כדי להבטיח השוואה בין הניסויים.
דגימות רקמה נלקחות באמצעות פרוטוקול IBEX כאשר תושבות שלמות, כלומר קיבוע והדמיה כמו גם שלבי הלבנה, מבוצעות עם הרקמה השלמה המודבקת לפלטפורמה. זה מבטיח שימור דגימה באמצעות מחזורי הצביעה/הדמיה/הלבנה האיטרטיביים, מכיוון שאין ממשק חתך-זכוכית קבוע למחצה ואין צורך להניח/להסיר שוב ושוב זכוכית כיסוי מהרקמה, שניהם עלולים להוביל לאובדן רקמות. כדי לחסוך בריאגנטים, צלחת 9 הבארות המעוצבת בהתאמה אישית מבטיחה התאמה אופטימלית של הפלטפורמה עם "נפח מת" מינימלי. כל הנוגדנים המשמשים לצביעה הם נוגדנים מצומדים ראשוניים, וכל צימודי הפלואורופור המשמשים (למעט צבע הוכסט) הם צבעי Alexa Fluor, שנבחרו בשל בהירותם המצוינת27. לוחות נוגדנים פלואורופורים אחרים תוכננו על פי נתונים שהופקדו מקהילת ההדמיה של IBEX, מאגר גלובלי פתוח האוסף מערכי נתונים, פרוטוקולים ומשוב מקבוצה בינלאומית של מדענים המשתמשים ב-IBEX (https://ibeximagingcommunity.github.io/ibex_imaging_knowledge_base/). רצף לוחות הנוגדנים נבחר בקפידה. באופן כללי, מטרות עם שפע נמוך הוצבו במחזורים מוקדמים יותר. IBEX מחזור 1 (CD45, CD44 ופודופלנין) הוא יוצא דופן מכיוון ששלושת הסמנים הללו שימשו לזיהוי נגעי גידול בסבב הצביעה הראשוני.
לוחות נוגדנים קטנים יחסית כדי להפחית את הדיבור המוצלב בערוצים בהגדרות עוצמת לייזר גבוהות, הנחוצה כדי לדמות את הרקמה עמוק יותר באמצעות מיקרוסקופ קונפוקלי. מצומדים AF750 נכללו בכל מקום אפשרי כדי להרחיב את הפאנל מ-2 ל-3 נוגדנים. יש לציין כי אין הרבה מצומדים AF750 זמינים מסחרית, והעובדה שהיעד לערוץ זה צריך להיות בשפע מגבילה את השימוש בפלואורופור זה. דוגמה לכך היא הנוגדן המצומד נגד SMA AF750 ששימש בפרוטוקול זה. למרות שמדובר בשיבוט שעובד באופן אמין מצומד ל-AF488 או AF594, עוצמת האות עבור נוגדן זה המצומד ל-AF750 נמוכה משמעותית, מה שמקשה על יצירת ערימות Z באיכות גבוהה.
דגירה של נוגדנים של 3 שעות בטמפרטורת החדר קצרה בהשוואה לפרוטוקול המקורי ומשקפת ככל הנראה את צפיפות התאים הנמוכה יותר בדגימות רקמת הצפק. לעומת זאת, שלב ההלבנה עם 1.5 מ"ג/מ"ל ליתיום בורוהידריד למשך 60 דקות היה מחמיר יותר. פרמטרים אלה נקבעו באופן אמפירי ויכולים להשתנות בהתאם לשימוש ברקמות ונוגדנים. יש לציין כי עקב הדגירה בתמיסת ההלבנה התגובתית, בועות אוויר קטנות עלולות להילכד ברקמה. בכל פעם שהדבר התברר במהלך שלב ההדמיה של ההליך, הדגימות הוסרו על ידי חשיפת הפלטפורמה בצלחת הדגירה בת 9 הבארות לשואב אבק באמצעות מיכל יניקה. רישומי דגימות ITK פשוטים, המיושמים לעתים קרובות במחקרי IBEX, לא יכלו להתבצע עקב הזנת נתונים עצומה לתוכנת ניתוח התמונה. עם זאת, אוכלוסיות תאים זהות מזוהות בקלות על ידי השוואת מערכי נתונים בודדים. בסך הכל, המחזורים האיטרטיביים היו מתוזמנים כך שניתן היה להשלים מחזור אחד ביום אחד, כאשר הדמיה תופסת את רוב המחזור כולו (~ 8 שעות).
לטכניקה יש מגבלות שראויות לאזכור. דרישת הזמן של הפרוטוקול הופכת את השיטה הזו לבלתי סבירה לאימוץ נרחב אלא בנסיבות נבחרות. אנו מדמיינים פרוטוקול זה מנוצל בצורה הטובה ביותר כדי לאפיין שינויים במיקרו-סביבה החיסונית של הגידול לפני ואחרי הטיפול (למשל, נוגדנים דו-ספציפיים לאימונותרפיה של סרטן) או כדי לחזות תוצאות טיפול כלליות. למרות שפרוטוקול זה מציע אפיון תלת מימדי, לא ידוע כמה שטח יש לחקור כדי לתאר ביעילות גידול, כולל אוכלוסיות התאים המורכבות שלו28. גישה לרקמות אנושיות טריות עשויה להיות קשה גם במרכזים מסוימים, אך אנו צופים שפרוטוקול זה ישים גם למודלים של בעלי חיים29.
היישומים לפרוטוקול זה מגוונים, החל ממחקר בסיסי המנתח את הרכב ה-TME על פני גידולים מוצקים מרובים ועד לביופסיות לפני/אחרי רקמות עבור חולים שנרשמו לניסויים קליניים. למרות שהנתונים שניתן להשיג מקטע רקמה עבה של שכבת תא בודדת הם עצומים, ניתן להתעלם בקלות מביולוגיה תלת מימדית. אנו רואים בהדמיה תלת מימדית תוספת לטכניקות אחרות של ביולוגיה מרחבית, ככל הנראה מסייעת בבחירת חלקים דו-ממדיים לניתוחים הבאים. בנוסף, פרוטוקול לשילוב רכיב הדמיה חיה במשך מספר שעות באמצעות הרכבת הרקמה המתוארת ומערך ההדמיה נמשך באופן פעיל.
Disclosures
ללא.
Acknowledgements
מחקר זה נתמך על ידי תוכנית המחקר התוך-כיתתית של המכונים הלאומיים לבריאות והמכון הלאומי לסרטן (NCI). מחקר זה נתמך בחלקו גם על ידי CAT-I, שיתוף פעולה מחקרי בין NIAID ו-NCI, בהובלת רונלד ג'רמיין. ברצוננו להביע את תודתנו לאנדריאה רדטקה על מאמציה הנלהבים ושיתופי הפעולה. המומחיות שלה הועילה מאוד למחקר זה.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor Plus 750 Phalloidin | Invitrogen | A30105 | F-actin dye |
| Alexa Fluor 488 anti-human CD206 (MMR) Antibody | BioLegend | 321114 | antibody |
| Alexa Fluor 488 anti-human CD31 Antibody | BioLegend | 303110 | antibody |
| Alexa Fluor 488 anti-human CD4 Antibody | BioLegend | 300519 | antibody |
| Alexa Fluor 488 anti-human HLA-DR Antibody | BioLegend | 307656 | antibody |
| Alexa Fluor 488 anti-mouse/human CD44 Antibody | BioLegend | 103016 | antibody |
| Alexa Fluor 594 anti-human CD45 Antibody | BioLegend | 304060 | antibody |
| Alexa Fluor 647 Anti-Calretinin antibody [EP1798] | Abcam | ab214244 | antibody |
| Alexa Fluor 647 anti-human CD3 Antibody | BioLegend | 300416 | antibody |
| Alexa Fluor 647 anti-human CD8 Antibody | BioLegend | 344726 | antibody |
| Alexa Fluor 647 anti-human Podoplanin Antibody | BioLegend | 337007 | antibody |
| Alexa Fluor 647 anti-Vimentin Antibody | BioLegend | 677807 | antibody |
| Alexa Fluor 647 CD68 Antibody (KP1) | Santa Cruz | sc-20060AF647 | antibody |
| Alexa Fluor 750 Cytokeratin, pan Antibody (AE-1/AE-3) | Novus | NBP2-33200AF750 | antibody |
| Alexa Fluor 750 Human alpha-Smooth Muscle Actin Antibody | R&D | IC1420S | antibody |
| Alexa Fluor 488 CD20 Monoclonal Antibody (L26) eBioscience | Thermo Fisher | 53-0202-82 | antibody |
| Antibiotic-Antimycotic | Gibco | 15240096 | supplement harvest medium |
| BioMed Clear Resin (Form 3) | FormLabs | RS-F2-BMCL-01 | resin used for platform + incubation plate |
| BSA | Sigma | A7906-500g | blocking solution component |
| Cast acrylic 1/32" thick | material used for cutting slider | ||
| CleanStation DT3 | Stratasys | DT3 | post processing for height adjuster & outer lid |
| Container, Specimen | McKesson | 870203 | transfer of tissue from perating table to prep table |
| CorelDraw | CorelDRAW | Software to prepare the vector-based design file for laser cutting | |
| Cytofix | BD Bioscience | 554655 | fixative |
| Dish 15 cm | Falcon | 353025 | dish used during mounting |
| Dish 35 mm No. 1.5 Coverslip 14 mm Glass Diameter Uncoated | Matek | P35G-1.5-14-C | imaging dish |
| DMEM (no glucose) | Gibco | 11966025 | harvest medium |
| Fc Block | BD Bioscience | 564220 | blocking solution component |
| Form 3B+ | Formlabs | Form 3B+ | printer used for platform + incubation plate |
| Form Cure | Formlabs | FH-CU-01 | post processing for platform + incubation plate |
| Form Wash | Formlabs | FH-WA-01 | post processing for platform + incubation plate |
| GrabCAD Print | GrabCAD | GrabCAD Print | Software to prepare models for Stratasys printers |
| Hoechst 33342 10 mg/mL | Biotium | 40046 | nuclear dye |
| J826 Prime 3D Printer | Stratasys | J826 | printer used for height adjuster & outer lid |
| LAS X | Leica | LAS X | Confocal software |
| Laser cutting system | Universal Laser Systems | ULS PLS6.150D | CO2 Laser cutting used for slider |
| Lithium Borohydride | STREM Chemicals | 93-0397 | bleaching chemical |
| PBS, pH 7.4 | Gibco | 10010023 | base Buffer for washing, blocking, staining |
| PreForm | FormLabs | PreForm | Software to prepare models for Formlab printers |
| Silk sutures 2-0 | Ethicon | A305.O35 | affix tissue to platform |
| Stellaris 8 WLL confocal microscope | Leica | STELLARIS 8 | Confocal Imaging |
| Syringe filter | filter ab solution | ||
| Triton X-100 | American Bio | AB02025-00100 | permeabelizing reagent, blocking solution component |
| Vero ContactClear | Stratasys | CTT610, 4 KG | resin used for height adjuster & outer lid |
| Warming Tray | Spring USA | ST-1220 | keep media and tissue warm |
| Water, distilled | Gibco | 15230-170 | diluent for LiBH4 |
References
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Li, Z., Li, J., Bai, X., Huang, X., Wang, Q. Tumor microenvironment as a complex milieu driving cancer progression: A mini-review. Clin Transl Oncol. , (2024).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nat Rev Clin Oncol. 14 (12), 717-734 (2017).
- Roma-Rodrigues, C., Mendes, R., Baptista, P. V., Fernandes, A. R. Targeting tumor microenvironment for cancer therapy. Int J Mol Sci. 20 (4), 840 (2019).
- Sheng, W., et al. Multiplex immunofluorescence: A powerful tool in cancer immunotherapy. Int J Mol Sci. 24 (4), 3086 (2023).
- Bollhagen, A., Bodenmiller, B. Highly multiplexed tissue imaging in precision oncology and translational cancer research. Cancer Discov. 14 (11), 2071-2088 (2024).
- Jin, Y., et al. Advances in spatial transcriptomics and its applications in cancer research. Mol Cancer. 23 (1), 129 (2024).
- Kashyap, A., et al. Quantification of tumor heterogeneity: From data acquisition to metric generation. Trends Biotechnol. 40 (6), 647-676 (2022).
- Chang, Q., Hedley, D. Emerging applications of flow cytometry in solid tumor biology. Methods. 57 (3), 359-367 (2012).
- Zhang, L., et al. Single-cell analyses inform mechanisms of myeloid-targeted therapies in colon cancer. Cell. 181 (2), 442-459.e29 (2020).
- Wang, X. Q., et al. Spatial predictors of immunotherapy response in triple-negative breast cancer. Nature. 621 (7980), 868-876 (2023).
- Maestri, E., et al. Spatial proximity of tumor-immune interactions predicts patient outcome in hepatocellular carcinoma. Hepatology. 79 (4), 768-779 (2024).
- Wang, Q., et al. Role of tumor microenvironment in cancer progression and therapeutic strategy. Cancer Med. 12 (10), 11149-11165 (2023).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Lin, J. R., et al. Multiplexed 3d atlas of state transitions and immune interaction in colorectal cancer. Cell. 186 (2), 363-381.e19 (2023).
- Radtke, A. J., et al. Ibex: An iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- Radtke, A. J., et al. Ibex: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proc Natl Acad Sci U S A. 117 (52), 33455-33465 (2020).
- Van Baal, J. O., et al. The histophysiology and pathophysiology of the peritoneum. Tissue Cell. 49 (1), 95-105 (2017).
- Bridda, A., Padoan, I., Mencarelli, R., Frego, M. Peritoneal mesothelioma: A review. MedGenMed. 9 (2), 32 (2007).
- Demuytere, J., Ernst, S., Van Ovost, J., Cosyns, S., Ceelen, W. The tumor immune microenvironment in peritoneal carcinomatosis. Int Rev Cell Mol Biol. 371, 63-95 (2022).
- Wang, Q., et al. Heterogeneity of tertiary lymphoid structures predicts the response to neoadjuvant therapy and immune microenvironment characteristics in triple-negative breast cancer. Br J Cancer. , (2024).
- Kepenekian, V., et al. Peritoneal mesothelioma: Systematic review of hyperthermic intraperitoneal chemotherapy (HIPEC) protocol outcomes. Indian J Surg Oncol. 14 (Suppl 1), 39-59 (2023).
- Mcquade, C., Renton, M., Chouhan, A., Macdermott, R., O'brien, C. Review of imaging peritoneal disease and treatment. Can Assoc Radiol J. , (2024).
- Kenerson, H. L., et al. Tumor slice culture as a biologic surrogate of human cancer. Ann Transl Med. 8 (4), 114 (2020).
- Arrizabalaga, L., et al. Tumor slice culture system for ex vivo immunotherapy studies. Methods Cell Biol. 189, 55-69 (2024).
- Neumeister, V. M., et al. Quantitative assessment of effect of preanalytic cold ischemic time on protein expression in breast cancer tissues. J Natl Cancer Inst. 104 (23), 1815-1824 (2012).
- Panchuk-Voloshina, N., et al. Alexa dyes: A series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47 (9), 1179-1188 (1999).
- Rajaram, S., et al. Sampling strategies to capture single-cell heterogeneity. Nat Methods. 14 (10), 967-970 (2017).
- Bella, A., et al. Mouse models of peritoneal carcinomatosis to develop clinical applications. Cancers (Basel). 13 (5), 963 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved