Method Article
عزل وتثبيت وتوصيف كريات البيض في الكلى ذات الرأس الذهبي للدنيس عن طريق قياس التدفق الخلوي
In This Article
Summary
تصف هذه المخطوطة عزل وتثبيت الكريات البيض المستخرجة من رأس الدنيس المذهب وتقييم قابليتها للحياة عن طريق قياس التدفق الخلوي. يساهم هذا العمل في توحيد البروتوكولات ويستفيد من معالجة عدد أكبر من العينات دون المساس بجودة العينة ، مما يعزز التقدم في المعرفة بمناعة الأسماك.
Abstract
المناعة ضرورية للتنظيم الفسيولوجي للكائنات الحية ، حيث تعمل كدفاع أساسي ضد مسببات الأمراض والضغوطات البيئية. يوفر عزل الخلايا المناعية وتحليلها رؤى رئيسية حول الاستجابات المناعية للضغوط الخارجية. ومع ذلك ، فإن الافتقار إلى بروتوكولات منسقة للأنواع الأقل دراسة ، مثل الأسماك البحرية ، غالبا ما يؤدي إلى تحديات تقنية وتحليلية تعيق تفسير البيانات والفهم الشامل للاستجابات المناعية الخاصة بالأنواع. هدفت هذه الدراسة إلى إعداد إجراء تحليلي محسن قائم على قياس التدفق الخلوي لتوصيف وتحديد صلاحية الكريات البيض من كلية الرأس (العضو الرئيسي المكونة للدم في أسماك teleost) من الدنيس الصغير ذو الرأس المذهب (Sparus aurata). بدأ الإجراء بعزل الكريات البيض من خلال عملية التجانس باستخدام محلول الملح المتوازن من هانكس ، متبوعا بطريقة طرد مركزي محسنة لتدرج الكثافة Percoll لضمان معدلات استرداد عالية للكريات البيض مع الحد الأدنى من تلوث كريات الدم الحمراء المطلوبة لتحليل قياس التدفق الخلوي اللاحق الفعال. بالإضافة إلى ذلك ، تم استخدام تقنية جديدة باستخدام صبغة تفاعلية للخلية (LIVE / DEAD Fixable Dead Cell Stain Kit) للتمييز بين الخلايا القابلة للحياة والخلايا الميتة بناء على أنماط تلطيخ الفلورسنت. تم تحقيق التثبيت بنسبة 3.7٪ من الفورمالديهايد ، مما يحافظ على مورفولوجيا الخلية ، وقابليتها للحياة ، وكفاءة التلوين. حدد تحليل قياس التدفق الخلوي بنجاح ثلاثة مجموعات بيضاء سائدة: الخلايا الليمفاوية والخلايا الوحيدة والخلايا الحبيبية. لم تسمح هذه الطريقة باختبارات الجدوى فحسب ، بل سمحت أيضا بالتمايز الدقيق لأنواع الخلايا. يمثل التحسن في بروتوكولات قياس التدفق الخلوي خطوة إلى الأمام في مناعة الأسماك من خلال زيادة دقة وكفاءة تحليل الخلايا المناعية. علاوة على ذلك ، من خلال السماح بتثبيت الخلايا للتحليل اللاحق ، يقلل هذا البروتوكول بشكل كبير من الوقت والجهد اللازمين لتقييمات المناعة ، مما يجعله أداة قيمة لكل من التطبيقات البحثية والعملية في مختلف مجالات البحث.
Introduction
تلعب المناعة دورا مركزيا في التنظيم الفسيولوجي للكائنات الحية ، حيث تعمل كدفاع أساسي ضد مجموعة واسعة من مسببات الأمراض والضغوطالبيئية 1. مثل الفقاريات الأخرى ، تمتلك الأسماك نظام مناعة معقد وديناميكي ومنسق ضروري لصحتها العامةورفاهيتها 1.
تمتلك أسماك Teleost كلا من أجهزة المناعة الفطرية والتكيفية ، والتي تعمل في وقت واحد لاكتشاف الغزاة الضارين والاستجابة لهم وتحييدهم2. يعمل الجهاز المناعي الفطري كخط دفاع أول ، حيث يوفر استجابات فورية وغير محددة لمسببات الأمراض2 ، بينما يتطور الجهاز المناعي التكيفي بمرور الوقت ، مما يوفر استجابة أكثر تخصصا تمكن الأسماك من التعرف على مسببات الأمراض المحددة وإنشاء ذاكرة مناعية3. يعتمد الجهاز المناعي للأسماك على الأعضاء اللمفاوية الأولية المتخصصة (مثل الغدة الصعترية وكلى الرأس) والأعضاء اللمفاوية الثانوية (مثل الأنسجة اللمفاوية المرتبطة بالطحال والغشاء المخاطي (MALT)) لدعم الدفاع المناعي والحفاظ على الصحةالعامة 4. كلية الرأس هي العضو الأساسي المكونة للدم في أسماك teleost وتلعب دورا مهما في نمو ونضج الخلايا المناعية ، بما في ذلك الكريات البيض5.
في السنوات الأخيرة ، تم إحراز تقدم كبير في دراسة الاستجابات المناعية للعديد من أنواع الأسماك2. كان أحد مجالات التركيز الرئيسية هو فهم مجموعات الكريات البيض ونشاطها. تصنف الكريات البيض ، والمعروفة أيضا باسم خلايا الدم البيضاء ، بشكل عام إلى خلايا وحيدة وخلايا ليمفاوية وخلايا حبيبية وتلعب دورا مهما في الدفاع المناعي للأسماك. لديهم خلايا البلعمة ، وهي المسؤولة عن ابتلاع وتدمير مسببات الأمراض وإطلاق أنواع الأكسجين التفاعلية المضادة للجراثيم ، مما يساهم في القضاء على الكائنات الحية الدقيقة الغازية6. تشارك الكريات البيض أيضا في العملية الالتهابية ، مما يساعد على عزل الالتهابات والقضاء عليها مع تعزيز إصلاح الأنسجة6. تعد وفرة ونشاط مجموعات الكريات البيض مؤشرات مهمة للحالة المناعية في صحةومرضه 7،8.
أظهرت بعض الدراسات أن عوامل الإجهاد ، مثل الظروف البيئية المعاكسة ، يمكن أن تغير عدد وتشكل كريات الدم الحمراء وتكوين الكريات البيض المنتشرة9،10. على سبيل المثال ، كما استعرض Franke et al. (2024) ، من الأهمية بمكان دراسة الجهاز المناعي للأسماك في سيناريوهات تغير المناخ ، حيث يمكن للضغوط البيئية أن تضر بمناعة الأسماك ، وتزيد من قابليتها للإصابة بالأمراض ، وتعزز عدوى بعض مسببات الأمراض ، مما يؤدي في النهاية إلى تسريع تطور المرض11. علاوة على ذلك ، فإن فهم مناعة الأسماك ضروري ليس فقط للنهوض بالبحوث البيولوجية الأساسية ولكن أيضا لدعم قطاعات مختلفة من المجتمع ، مثل صناعة تربية الأحياء المائية. مع استمرار توسع تربية الأحياء المائية على مستوى العالم، أصبح ضمان صحة ورفاهية أنواع الأسماك المستزرعة أمرا مهما بشكل متزايد. ومع ذلك، لا تزال رعاية الأسماك مجالا جديدا نسبيا للبحث، ولا تزال الاستجابات المناعية للأسماك المستزرعة تتطلب تقييمات شاملة وموحدة. يعد إعطاء الأولوية لدراسات الاستجابة المناعية أمرا في غاية الأهمية ، حيث يمكن للمعلومات المكتسبة أن تعزز استدامة تربية الأحياء المائية وإنتاجيتها من خلال مناهج فعالة ومصممة خصيصا لتحسين رفاهية ومرونة المستزرعة.
عادة ما يتم إجراء القياس الكمي للكريات البيض وتحديدها باستخدام طرق أمراض الدم ، مثل العد اليدوي باستخدام مقاييس الدم Bürker أو Neubauer أو Thoma ، بالإضافة إلى مسحات الدم الملطخة7،10. للمساعدة في تصور خلايا الدم وتمايزها ، غالبا ما يتم استخدام مجموعات التلوين ، مثل Wright و May-Grünwald-Giemsa و Hemacolor، 7،12. ومع ذلك ، فإن تقنيات عد الخلايا اليدوية هذه مملة وتستغرق وقتا طويلا وعرضة للخطأ البشري8،10. تشمل المصادر الشائعة للخطأ عدم كفاية الخلط أو التخفيف للدم ، ومشاكل التلوين ، والتحميل غير الصحيح لغرفة مقياس الدم ، وكلها يمكن أن تؤدي إلى عدد الخلايا غير الدقيق12. علاوة على ذلك ، يتطلب تحليل الدم اليدوي مستوى عال من الخبرة والتجربة لضمان موثوقية النتائج وقابليتها للتكرار7. مع زيادة الطلب على أدوات التشخيص الدقيقة والفعالة ، يصبح تطوير طرق مبتكرة توفر فهما متعمقا للحالة المناعية لمجموعات الأسماك خطوة متزايدة الأهمية في النهوض بهذا المجال.
ظهر قياس التدفق الخلوي كأداة قوية في هذا السياق ، حيث يقدم نهجا كميا عالي الإنتاجية لتحليل مجموعات الكريات البيض وقابلية الخلايا للحياة8. تسمح تقنية التشخيص الحديثة هذه بالكشف السريع عن الخلايا الفردية في مجموعات مختلطة وعدها وتوصيفها بدقةملحوظة 13. علاوة على ذلك ، يسمح قياس التدفق الخلوي بقياسات متزامنة متعددة العوامل لكل من التوصيف الظاهري والوظيفي. على الرغم من استخدامه على نطاق واسع في البيئات السريرية البشرية والطب البيطري ، إلا أن تطبيقه في دراسة كريات البيض في الأسماك لا يزال محدوداللغاية 8. بينما تم إجراء بعض الأبحاث على أنواع مختلفة من الأسماك1،6،8،13،14،15،16،17 ، لا تزال هناك العديد من التحديات الحرجة التي لا تزال بحاجة إلى معالجة. يتمثل أحد التحديات الرئيسية في هذه التحليلات في ضرورة الحصول على معلقات الكريات البيض الحية المستخرجة من الدم المحيطي أو الأنسجة اللمفاوية ، مثل كلية الرأس1. غالبا ما يكون عزل الكريات البيض صعبا بسبب خاصية فريدة من نوعها لأسماك teleost: وجود كريات الدم الحمراء ذات النواة. يمكن أن يتداخل التلوث غير المقصود بكريات الدم الحمراء مع تحليل الكريات البيض بسبب حجمها وشكلها البيضاوي ووجود نواة1. لذلك ، من الضروري القضاء على كريات الدم الحمراء من معلقات الكريات البيض لتحقيق نقاء عال للكريات البيض ودراسة الخصائص المظهرية والوظيفية للكريات البيض عن طريق تحليل قياس التدفق الخلوي. في الثدييات ، عادة ما يتضمن عزل الكريات البيض التحلل التناضحي لكريات الدم الحمراء أو فصل تدرج الكثافة مع Ficoll أو Percoll1. ومع ذلك ، فإن التحلل التناضحي غير فعال لكل من أسماك المياه البحرية والمياه العذبة بسبب كريات الدم الحمراء ذات النواة ، والتي لا يمكن تحللها بشكل صحيح1. بدلا من ذلك ، يفضل فصل تدرج الكثافة للأسماك لأنه يحافظ بشكل فعال على استقرار الخلية بمرور الوقت1. على الرغم من أن بعض الدراسات نجحت في عزل الكريات البيض من الأسماك الصغيرة ، إلا أن الكثير من الأبحاث لا تزال تركز بشكل أساسي على السكان البالغين17. ومع ذلك، فإن مراحل الحياة المبكرة ليست أكثر عرضة لتفشي الأمراض فحسب، بل إنها أصغر حجما أيضا، مما يجعل عملية أخذ العينات أكثر تعقيدا وصعوبة. قيد آخر هو أن الطرق الحالية غالبا ما تقتصر على عدد محدود من العينات أو التكرارات في وقت واحد ، حيث يتطلب تقييم صلاحية الكريات البيض معالجة فورية. يمكن أن يؤثر التأخير في معالجة العينات سلبا على الجدوى الخلوية ، وبالتالي إدخال المزيد من التعقيدات في عملية أخذ العينات ويحتمل أن يعرض العمل بأكمله للخطر.
على حد علمنا ، لم تنجح أي من الطرق المنشورة في إصلاح خلايا الكريات البيض لتحليل الجدوى اللاحق عن طريق قياس التدفق الخلوي. تعتبر الدراسة الحالية رائدة ، حيث أنها تؤسس طريقة فعالة لعزل الكريات البيض عن كلية رأس الدنيس الصغير (Sparus aurata) ، وهي الأنواع السمكية الرئيسية المستزرعة في دول جنوب أوروبا ، باستخدام منهجية فصل تدرج الكثافة Percoll. نقدم أيضا تقنية محسنة قائمة على التلوين تميز بين الخلايا الميتة والخلايا الميتة أثناء تحديد مجموعات الكريات البيض الرئيسية (الخلايا الليمفاوية والخلايا الوحيدة والخلايا الحبيبية) من خلال قياس التدفق الخلوي. يستلزم البروتوكول المحسن تثبيت الخلايا ، والذي يتيح تحليل الخلايا القابل للتطبيق لمدة تصل إلى شهر واحد بعد العملية. إن تطبيق بروتوكول قياس التدفق الخلوي هذا لديه القدرة على تقليل الوقت والجهد المطلوبين عادة لتقييم المناعة بشكل كبير ، مما يجعله تقنية قيمة لكل من الأبحاث والتطبيقات العملية في قطاع الاستزراع المائي. يوفر تطبيق هذه المنهجية مزايا لتحليل عدد كبير من العينات ، والحفاظ على الخلايا ، والسماح بالتحليل المتأخر عن طريق قياس التدفق الخلوي. لذلك ، قد يكون من المفيد جدا إنتاج رؤى قيمة حول آليات المناعة للأسماك وكيف تتأثر صلاحية الخلية بالظروف البيئية أو التجريبية المختلفة. علاوة على ذلك ، يمكن دمج مقايسة الجدوى هذه مع التوصيف الظاهري والوظيفي متعدد العوامل لمجموعات معينة من الخلايا المناعية. يتيح هذا النهج تحليلا أكثر شمولا للعديد من المعلمات المناعية ، وربطها مباشرة بأنواع الخلايا المقابلة ويوفر فهما أوضح للاستجابات المناعية. ويمكن أن تساهم هذه النتائج في وضع استراتيجيات أكثر فعالية، بما في ذلك تحسين النهج لإدارة الأمراض في تربية الأحياء المائية.
Protocol
يجب تنفيذ هذا البروتوكول من قبل باحثين معتمدين في التجارب على (وظائف الاتحاد الأوروبي A و B). يجب أن تتوافق جميع الإجراءات المتعلقة بالتعامل مع وجمع العينات مع إرشادات ARRIVE (أبحاث: الإبلاغ عن التجارب في الجسم الحي ) والالتزام بالمعايير الأخلاقية لرعاية واستخدامها وفقا لتوصيات الاتحاد الأوروبي لجمعيات علوم المختبرات (FELASA). اتبعت هذه الدراسة كل هذه المعايير بالإضافة إلى التشريعات البرتغالية لعلوم المختبر (توجيه الاتحاد الأوروبي 2010/63; المرسوم بقانون رقم 113/2013). تمت الموافقة على البحث من قبل هيئة رعاية وأخلاقياته (ORBEA ، LABVIVOS-002-AquaClimAdapt) ، تحت إشراف الهيئة الوطنية لاستخدام الحية ، والمعروفة باسم المديرية العامة للأغذية والبيطرية (DGAV) ، بموجب رقم التصريح الأخلاقي 20596 / 25-S.
1. دراسة النموذج وصيانة الكائنات الحية
ملاحظة: صممت هذه الدراسة خصيصا لصالح الدنيس الذهبي اليافع (Sparus aurata) ، بمتوسط وزن 30.0 ± 5.0 جم وطول إجمالي 12.0 ± 2.0 سم. قد لا تنطبق هذه الطريقة بشكل مباشر على أنواع الأسماك الأخرى ، حيث أن الأنواع المختلفة لها خصائص فسيولوجية ومناعية فريدة قد تؤثر على عزل الكريات البيض وتثبيت الخلايا وتقييم البقاء. قد تكون هناك حاجة إلى تعديلات على البروتوكول لأنواع أخرى ، ويوصى بإجراء دراسات أولية لتحسين الظروف لكل نوع مستهدف.
- التأقلم مع الأسماك (فترة الحجر الصحي)
- وزع الأسماك بالتساوي في أحواض ذات سعة كبيرة (على سبيل المثال، خزانان بسعة إجمالية قدرها 660 لترا لكل منهما - انظر الشكل التكميلي 1).
ملاحظة: قد تكون الخزانات التي سيتم استخدامها جزءا من نظام إعادة تدوير الاستزراع المائي (RAS) ، والذي يسمح باستخدام المياه بكفاءة وتحسين التحكم في جودة المياه. في RAS ، يتم إعادة تدوير المياه ومعالجتها بشكل مستمر داخل النظام ، مما يوفر بيئة مستقرة وخاضعة للرقابة للأسماك. يساعد هذا الإعداد في الحفاظ على الظروف المثلى لصحة الأسماك ونموها ، مما يضمن توزيعا موحدا وتقليل التوتر أثناء الدراسة. - الحفاظ على الظروف اللاأحيائية المثلى.
- احتفظ بالأسماك في الحجر الصحي لمدة 3 أسابيع في ظل ظروف تحاكي بيئتها الطبيعية:
درجة الحرارة: 20.0 ± 0.5 درجة مئوية ؛
الأكسجين المذاب: 7.2 ± 0.2 مجم / لتر ؛
الملوحة: 35.0 ± 0.5 ‰ ؛
الرقم الهيدروجيني: 8.0 ± 0.1 وحدة ؛
فترة التصوير: 14 ساعة ضوء / 10 ساعات مظلمة.
ملاحظة: قد تختلف ظروف الصيانة المثالية بين أنواع الأسماك المختلفة. قد يكون للأنواع الأخرى متطلبات مختلفة ، لذلك من المهم تكييف هذه الظروف مع الاحتياجات المحددة للأنواع المستهدفة لضمان صحة ورفاهية الكائنات الحية. بالإضافة إلى ذلك ، يمكن أن تتغير درجة حرارة مياه البحر والفترة الضوئية مع الفصول ، لذلك يجب مراعاة الاختلافات الموسمية عند تكرار الظروف الطبيعية في المختبر.
- احتفظ بالأسماك في الحجر الصحي لمدة 3 أسابيع في ظل ظروف تحاكي بيئتها الطبيعية:
- وزع الأسماك بالتساوي في أحواض ذات سعة كبيرة (على سبيل المثال، خزانان بسعة إجمالية قدرها 660 لترا لكل منهما - انظر الشكل التكميلي 1).
- بدء الدراسة التجريبية.
- تحديد عدد الخزانات والأسماك المطلوبة بناء على تصميم الإعداد التجريبي لكل دراسة حالة.
- بعد فترة الحجر الصحي ، انقل الأسماك إلى RAS مستقل (انظر الشكل التكميلي 2).
- تجهيز كل نظام بكاشطات البروتين لإزالة المركبات العضوية الزائدة من الماء ؛ الترشيح الفيزيائي (كيس الفلتر [400 ميكرومتر] ، إسفنجة المرشح ، والصوف الزجاجي) ؛ الترشيح البيولوجي (الكرات الحيوية [1.5 بوصة] ، معقم الماء بالأشعة فوق البنفسجية ، وأحجار الهواء المغمورة) ؛ أنظمة تبريد مياه البحر الأوتوماتيكية والسخانات الرقمية المغمورة ، وكلاهما متصل بنظام تحكم محوسب (ProfiLux) مع مستشعرات درجة الحرارة لضبط درجة الحرارة في كل خزان ؛ أحجار الهواء المغمورة في كل خزان للتحكم في الأكسجين المذاب.
- تأقلم الأسماك لمدة أسبوعين في الأنظمة الجديدة قبل الشروع في التجربة.
- إجراء الصيانة اليومية
- قم بإزالة براز الأسماك من كل حوض حضانة وقم بتجديد مياه البحر بنسبة 25٪.
- قم بقياس درجة الحرارة باستخدام مقياس حرارة دقيق محمول.
- راقب المعلمات اللاأحيائية الأخرى لمياه البحر (الملوحة والأكسجين المذاب ودرجة الحموضة) باستخدام أداة قياس متعددة المعلمات.
- اضبط المعلمات اللاأحيائية لمياه البحر حسب الضرورة لضمان الاستقرار طوال التجربة.
ملاحظة: يمكن أن تختلف الظروف اللاأحيائية في الأنظمة التجريبية اعتمادا على المتطلبات المحددة لكل دراسة حالة. على سبيل المثال ، إذا كانت الدراسة تهدف إلى محاكاة التغيرات الموسمية أو موجات الحر البحرية ، فيجب تعديل درجة الحرارة والفترة الضوئية وفقا لذلك لتقليد التغيرات الموسمية الطبيعية. وبالمثل ، إذا ركزت الدراسة على محاكاة ظروف نقص الأكسجين أو تحمض المحيطات ، فيجب إجراء تعديلات على مستويات الأكسجين ودرجة الحموضة في مياه البحر. هذا يضمن أن تكون الظروف التجريبية واقعية وذات صلة قدر الإمكان ، مما يعزز صحة نتائج الدراسة وقابليتها للتطبيق. - تقييم صحة الأسماك ورفاهيتها ، وتحديد وإدارة علامات الإجهاد أو المرض كما هو موضح في الخطوات 1.2.4.6-1.2.4.8.
- ابحث عن سلوكيات غير طبيعية مثل السباحة غير المنتظمة أو فقدان الشهية أو الخمول أو العدوان أو العزلة.
- تحقق من علامات المرض ، بما في ذلك الآفات أو القرحة أو تغير اللون أو الزعانف المثبتة أو المخاط المفرط أو حركة الخياشيم السريعة.
- سجل جميع الملاحظات مع ملاحظة التاريخ والإجراءات المتخذة.
- إجراء اختبارات جودة المياه الأسبوعية.
- قم بقياس مستويات الأمونيا (NH3 / NH4) والنتريت (NO2-) والنترات (NO3-) باستخدام اختبارات قياس الألوان.
ملاحظة: تأكد من أن جميع هذه المعلمات أقل من المستويات التي يمكن اكتشافها. إذا تجاوزت المستويات الحدود ، فقم بإجراء تغيير إضافي للمياه أو زيادة التهوية أو ضبط الترشيح.
- قم بقياس مستويات الأمونيا (NH3 / NH4) والنتريت (NO2-) والنترات (NO3-) باستخدام اختبارات قياس الألوان.
- إطعام ومراقبة تغذية الأسماك.
- توفير نظام غذائي عالي الجودة يلبي المتطلبات الغذائية المحددة للأسماك الصغيرة (انظر الجدول التكميلي 1 للحصول على مثال على التركيب التفصيلي للنظام الغذائي).
ملاحظة: تأكد من أن حجم كريات العلف المائي (2-3 مم) مناسب للأحداث ، مما يسهل الابتلاع والهضم. - اضبط كمية العلف لتتوافق مع 2٪ من متوسط وزن جسم السمكة يوميا.
- قم بإطعام الأسماك يدويا مرتين يوميا - مرة في الصباح ومرة في فترة ما بعد الظهر (حدد وقتا محددا للحفاظ على روتين تغذية مستقر).
- توفير نظام غذائي عالي الجودة يلبي المتطلبات الغذائية المحددة للأسماك الصغيرة (انظر الجدول التكميلي 1 للحصول على مثال على التركيب التفصيلي للنظام الغذائي).
2. أخذ عينات الأسماك ، والقتل الرحيم ، والتشريح ، وجمع كلى الرأس
- تذوق الأسماك من الخزانات.
- اختر الأسماك بشكل عشوائي من الخزانات لتجنب تحيز أخذ العينات.
- استخدم شبكة لنقل الأسماك برفق إلى وعاء تخزين مؤقت مملوء بمياه الخزان.
ملاحظة: قلل من وقت المناولة لتقليل التوتر.
- تحضير محلول القتل الرحيم.
- استخدم حاوية مناسبة (على سبيل المثال ، دلو سعة 3 لتر) مناسبة لحمل الأسماك.
- قم بإذابة الكمية المناسبة من التريكايين (MS-222) في مياه البحر لتحقيق تركيز نهائي يتراوح بين 200 و300 ملغم/لتر18 (تنبيه انظر الجدول التكميلي 2 والملف التكميلي 1).
- قم بتخزين المحلول ببيكربونات الصوديوم إلى درجة حموضة 7.2-7.5.
- إدارة حل القتل الرحيم.
- ضع السمكة في محلول القتل الرحيم لمدة 10 دقائق على الأقل أو حتى يتم ملاحظة توقف الحركة الجراحية وفقدان ردود الفعل (تأكد من القتل الرحيم عن طريق التحقق من عدم الاستجابة للمنبهات الخارجية).
- سجل وزن جسم السمكة (جم) والطول الكلي (سم).
- إجراء تشريح الأسماك.
ملاحظة: لضمان جودة العينة المثلى وقابلية الخلية للحياة ، يجب إكمال عملية التشريح في أسرع وقت ممكن ، ويفضل في غضون 5 دقائق بعد القتل الرحيم.- تأكد من الحفاظ على درجة حرارة المختبر عند 19 درجة مئوية باستخدام تكييف الهواء لتقليل التقلبات أثناء أخذ العينات والمعالجة.
- قم بتعقيم أدوات التشريح (يفضل أدوات الأوتوكلاف المعدنية كلما أمكن ذلك) وقم بإعداد مساحة عمل نظيفة تحتوي على 70٪ من الإيثانول (تنبيه ، انظر الجدول التكميلي 2).
- ضع السمكة القتل الرحيم على جانبها على صينية تشريح معقمة مع توجيه الرأس نحو اليد غير المهيمنة.
- باستخدام مشرط ، قم بعمل شق دقيق على طول خط الوسط البطني للأسماك من فتحة التهوية (فتحة الشرج) باتجاه الخياشيم.
ملاحظة: كن حذرا من عدم القطع بعمق شديد لتجنب إتلاف الأعضاء الداخلية. - استخدم مقص التشريح بعناية لتمديد الشق وفضح الأعضاء الداخلية. ارفع اللوحات الجانبية لجدار الجسم برفق لتوفير رؤية واضحة للتشريح الداخلي.
- تحديد موقع كلية الرأس: يتم وضع كلية الرأس خلف الخياشيم مباشرة ، بالقرب من المنطقة الظهرية الأمامية من تجويف الجسم ، وتمتد على طول الجانب العلوي من تجويف الجسم ، أسفل العمود الفقري.
ملاحظة: عادة ما تكون كلية الرأس أغمق في اللون مقارنة بالأنسجة المحيطة (الشكل 1). - قم بإزالة أي أنسجة محيطة بعناية ، مثل الدهون والأنسجة الضامة ، لتصور كلية الرأس بشكل أفضل.
ملاحظة: تتطلب هذه الخطوة معالجة دقيقة لتجنب إتلاف كلية الرأس. - باستخدام ملقط ومقص رفيع الرؤوس ، ارفع كلية الرأس بعناية وقم بعمل جروح دقيقة حولها لتحريرها من الأنسجة المحيطة.
ملاحظة: تعامل مع الأنسجة برفق لمنع التلف. في سمكة تزن حوالي 30 جراما ، من المتوقع أن تزن كلية الرأس حوالي 20-30 مجم. - ضع العضو المستأصل على الفور في مصفاة خلية (شبكة نايلون 100 ميكرومتر) داخل طبق بتري معقم لضمان العقم ولتسهيل خطوات المعالجة اللاحقة.
ملاحظة: من هذه النقطة فصاعدا ، يجب تنفيذ جميع الخطوات في أسرع وقت ممكن (في غضون 5 دقائق) للحفاظ على بقاء الخلية. للحفاظ على برودة العينة ، قم بتنفيذ الخطوات التالية مع وضع طبق بتري على وعاء مملوء بالثلج ومغطى بورق الألمنيوم.

الشكل 1: موضع كلية الرأس: (أ) رسم توضيحي يصور الموقع النموذجي لكلية الرأس خلف الخياشيم وعلى طول المنطقة الظهرية الأمامية لتجويف الجسم ؛ (ب) صورة تمثيلية لكلية الرأس في الدنيس ، مع التأكيد على لونها الأغمق مقارنة بالأنسجة المحيطة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. عزل كريات البيض في الكلى في الرأس (الشكل 2)
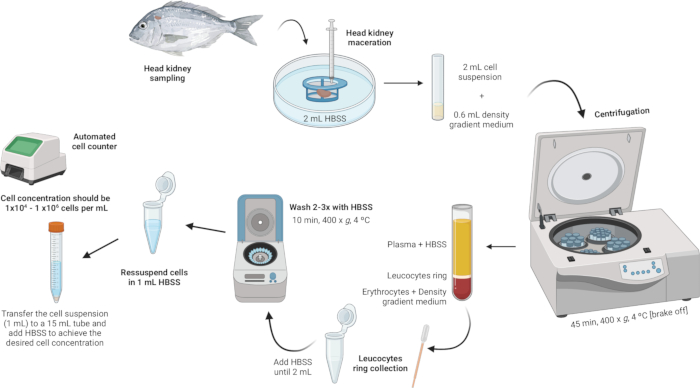
الشكل 2: وصف توضيحي لعزل الكريات البيض من كلية الرأس. يتضمن البروتوكول عدة خطوات: بدءا من تجانس الأنسجة ، متبوعا بالطرد المركزي المتدرج للكثافة ، وجمع حلقة الكريات البيض ، وغسل حلقة الكريات البيض ، والانتهاء بإعادة تعليق وتعديل تركيز الخلية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تجانس الأنسجة.
- ضع 2 مل من محلول الملح المتوازن من هانكس (HBSS) في طبق بتري معقم.
- تأكد من أن شبكة مصفاة الخلية (شبكة نايلون 100 ميكرومتر) على اتصال مع HBSS ولكنها غير مغمورة بالكامل.
- نقع كلية الرأس على مصفاة الخلية باستخدام مكبس المحقنة. استخدم ضغطا برفق لإجبار شظايا العضو على المرور عبر شبكة النايلون ، مما يؤدي إلى تعليق الخلية.
ملاحظة: في حالة معالجة عينات متعددة ، يمكن تخزين طبق بتري الذي يحتوي على تعليق الخلية في الثلاجة عند 4 درجات مئوية لبضع دقائق حتى الخطوة التالية. سيتم استخدام تعليق الخلية هذا لعزل الكريات البيض.
- إجراء الطرد المركزي المتدرج الكثافة.
- قم بإعداد محلول متوسط تدرج الكثافة بكثافة 1.077 جم / مل ، والأسمولية 353 mOsm / kg ، ودرجة الحموضة 7.4 (انظر الملف التكميلي 1).
ملاحظة: قد تختلف الأسمولية بين أنواع الأسماك المختلفة ، لذلك من الضروري ضبط الأسمولية لمحلول متوسط تدرج الكثافة لتلبية المتطلبات المحددة لكل نوع. - في أنابيب البوليسترين المستديرة القاع سعة 5 مل ، أضف بعناية 600 ميكرولتر من محلول متوسط تدرج الكثافة.
- خذ معلق الخلية (2 مل) وأضفه ببطء إلى الأنبوب الذي يحتوي على وسط تدرج الكثافة. القطرة الأولى حاسمة - أضفها برفق شديد لتجنب زعزعة استقرار الطور المتوسط لتدرج الكثافة.
ملاحظة: يجب أن يتم ذلك بنسبة 3:10 (وسط تدرج الكثافة: تعليق الخلية). استخدم ماصة باستور معقمة سعة 1 مل لإضافة دقيقة ولطيفة. تأكد من أن طرف الماصة يلامس جانب الأنبوب لمنع إزعاج الطبقة المتوسطة المتدرجة للكثافة. تجنب خلط العينة مع وسط تدرج الكثافة. - قم بالطرد المركزي للأنابيب عند 400 × جم لمدة 45 دقيقة عند 4 درجات مئوية مع إيقاف تشغيل الفرامل. هذا يضمن بقاء الطبقات سليمة أثناء العملية.
ملاحظة: بعد الطرد المركزي ، يجب أن تكون الطبقات المميزة مرئية. ستشكل الكريات البيض حلقة عند الواجهة بين وسط تدرج الكثافة وحبيبات الحطام الخلوي (الشكل 3).
- قم بإعداد محلول متوسط تدرج الكثافة بكثافة 1.077 جم / مل ، والأسمولية 353 mOsm / kg ، ودرجة الحموضة 7.4 (انظر الملف التكميلي 1).
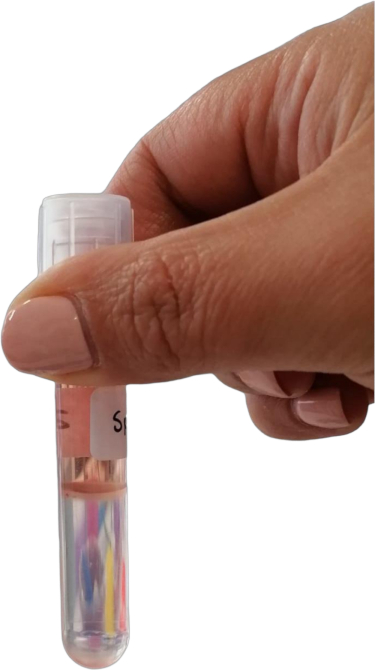
الشكل 3: حلقة الكريات البيض عند الواجهة بين وسط تدرج الكثافة وحبيبات الحطام الخلوي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- اجمع حلقة الكريات البيض.
- باستخدام ماصة باستور معقمة، قم بشفط حلقة الكريات البيض برفق (~ 100 ميكرولتر) ونقلها إلى أنبوب طرد مركزي دقيق سعة 2 مل.
ملاحظة: احرص على عدم إزعاج الطبقات بشكل كبير لتجنب التلوث. إذا بدا أن حلقة الكريات البيض تحتوي على حطام أو معلقات داكنة ، فمن المستحسن تمرير معلق الكريات البيض الذي تم جمعه عبر مصفاة خلية صغيرة جديدة (100 ميكرومتر) لضمان النقاء. ضع مصفاة الخلية الصغيرة فوق أنبوب الطرد المركزي الدقيق سعة 2 مل وانقل تعليق الكريات البيض برفق عبر المصفاة.
- باستخدام ماصة باستور معقمة، قم بشفط حلقة الكريات البيض برفق (~ 100 ميكرولتر) ونقلها إلى أنبوب طرد مركزي دقيق سعة 2 مل.
- اغسل حلقة الكريات البيض.
- أضف HBSS إلى أنابيب الطرد المركزي الدقيقة التي تحتوي على حلقة الكريات البيض حتى يصل الحجم إلى 2 مل وأعد تعليق الخلايا برفق.
ملاحظة: احتفظ بالأنابيب في وعاء مملوء بالثلج ومغطى بورق الألمنيوم للحفاظ على العينة عند درجة حرارة منخفضة. تأكد من أن الأنابيب لا تتلامس بشكل مباشر مع الجليد. حافظ على إعداد التبريد هذا طوال عملية الغسيل. - الطرد المركزي للعينات عند 400 × جم لمدة 10 دقائق عند 4 درجات مئوية (يمكن تشغيل الفرامل).
- بعد الطرد المركزي ، تخلص من المادة الطافية بعناية ، واترك الحبيبات في الأسفل (والتي قد تكون غير مرئية تقريبا).
- كرر خطوات الغسيل (إضافة HBSS ، وإعادة التعليق ، والطرد المركزي ، والتخلص من المادة الطافية) حتى تصبح الحبيبات خالية من الشوائب.
- أضف HBSS إلى أنابيب الطرد المركزي الدقيقة التي تحتوي على حلقة الكريات البيض حتى يصل الحجم إلى 2 مل وأعد تعليق الخلايا برفق.
- إعادة تعليق وضبط تركيز الخلية.
- أعد تعليق الخلايا في 1 مل من HBSS داخل نفس أنابيب الطرد المركزي الدقيقة سعة 2 مل المستخدمة في الغسيل.
- حقق تركيزا للخلية بين 1 × 104 و 1 × 106 خلايا لكل مل. إذا كانت الحبيبات الأولية كبيرة ، فقد تكون هناك حاجة إلى HBSS إضافي لتخفيف تركيز الخلية إلى النطاق المطلوب. انقل معلق الخلية إلى أنبوب سعة 15 مل وأضف المزيد من HBSS حسب الحاجة بناء على عدد الخلايا التي تم الحصول عليها.
ملاحظة: يوصى باستخدام عداد خلوي آلي لتسهيل العملية.
4. تلطيخ وتثبيت الكريات البيض (الشكل 4)
ملاحظة: توفر مجموعات بقع الخلايا الميتة القابلة للإصلاح LIVE / DEAD طريقة محسنة لتقييم صلاحية الخلية في الخلايا الثابتة باستخدام قياس التدفق الخلوي. تستخدم هذه المقايسات صبغة تفاعلية فلورية تتفاعل مع الأمينات الخلوية. إذا تعرضت أغشية الخلايا للخطر ، يمكن للصبغة أن تخترق الخلايا ، وتتفاعل مع الأمينات الحرة داخل الخلية وعلى سطح الخلية ، مما يؤدي إلى تلطيخ الفلورسنت الشديد. على العكس من ذلك ، في الخلايا القابلة للحياة ، تتوفر فقط الأمينات على سطح الخلية للتفاعل مع الصبغة ، مما يؤدي إلى تلطيخ خافت نسبيا. يتم الحفاظ على شدة التلوين بعد التثبيت بالفورمالديهايد ، والذي يحافظ أيضا على العينة عن طريق منع نمو الكائنات الحية الدقيقة. مجموعات بقع الخلايا الميتة القابلة للإصلاح LIVE / DEAD متطابقة باستثناء صبغة الفلورسنت - متوفرة باللون الأزرق أو البنفسجي أو المائي أو الأصفر أو الأخضر أو الأحمر أو الأحمر البعيد أو الأشعة تحت الحمراء القريبة (الأشعة تحت الحمراء). في هذه الدراسة ، استخدمنا صبغة الفلورسنت التفاعلية Near-IR. بالإضافة إلى ذلك ، يسمح هذا الاختبار أحادي اللون باختبار المعلمات الأخرى بالتوازي في تجربة متعددة الألوان.
- تحضير الصبغة.
- أحضر الكواشف إلى درجة حرارة الغرفة (RT): اسمح لقارورة واحدة من الصبغة التفاعلية الفلورية وقارورة ثنائي ميثيل سلفوكسيد اللامائية (DMSO) للوصول إلى RT قبل إزالة الأغطية.
- أعد تكوين الصبغة: أضف 50 ميكرولتر من DMSO إلى القارورة التي تحتوي على الصبغة التفاعلية. تخلط جيدا وتأكدي من ذوبان الصبغة تماما.
- استخدم محلول الصبغة المعاد تكوينه في أسرع وقت ممكن ، ويفضل أن يكون ذلك في غضون ساعات قليلة.
ملاحظة: تشتمل كل مجموعة على خمس قوارير فردية من الصبغة التفاعلية ، مما يوفر مادة كافية لتلطيخ ما لا يقل عن 40 عينة من الخلية. ومع ذلك ، بعد إعادة التكوين ، يكون محلول DMSO للصبغة غير مستقر نسبيا ، خاصة عند تعرضه للرطوبة. يمكن تخزين أي أجزاء غير مستخدمة لمدة تصل إلى أسبوعين عند ≤-20 درجة مئوية ، محمية من الضوء والرطوبة.
- وصمة عار وإصلاح الخلايا.
ملاحظة: تشمل المخازن المؤقتة المناسبة لتلوين الخلايا محلول الملح المتوازن هانكس (HBSS) ، والمحلول الملحي المخزن بالفوسفات (PBS) ، و D-PBS (D-PBS) من Dulbecco ، طالما أنها لا تحتوي على بروتينات غريبة مثل ألبومين مصل الأبقار أو المصل. عند استخدام صبغة متفاعلة أمينية، تجنب مخازن ومحاليل تريس التي تحتوي على أزيد الصوديوم أو البروتين الدخيل لإعادة تعليق الخلايا وغسلها. في هذه الدراسة ، استخدمنا HBSS نظرا لتركيبته الأيونية المتوازنة ، مما يساعد على الحفاظ على التوازن التناضحي ويوفر الأيونات الأساسية والجلوكوز لدعم عملية التمثيل الغذائي للخلايا وقابليتها للحياة أثناء عملية التلوين. HBSS أيضا خالي من البروتينات الدخيلة ، مما يمنع التداخل مع الصبغة التفاعلية ويضمن تقييما دقيقا للبقاء.- بعد عد الخلايا وضبط الكثافة إلى 1 × 106 خلايا لكل مل باستخدام HBSS ، قم بنقل 1 مل من تعليق الخلية هذا إلى أنابيب طرد مركزي دقيقة سعة 2 مل.
- لكل يوم ، قم بتحفيز موت الخلايا في عينة واحدة على الأقل لاستخدامها كعنصر تحكم لتحديد عتبة شدة التألق بين الخلايا الحية والميتة. تحضير العينات في أنابيب الطرد المركزي الدقيقة على النحو التالي:
الأنبوب 1: الخلايا الحية - غير ملوثة
الأنبوب 2: الخلايا الحية - ملطخة
الأنبوب 3: الخلايا الميتة - غير ملوثة
الأنبوب 4: الخلايا الميتة - ملطخة
ملاحظة: تحتاج هذه الأنابيب الأربعة فقط إلى التحضير لعينة واحدة في كل تجربة كعناصر تحكم. بالنسبة للعينات المتبقية ، هناك أنبوبان فقط ضروريان (الأنبوب 1: عينة - غير ملوثة والأنبوب 2: عينة - ملطخة) ، حيث سيوفر معلومات حول الخلايا التي كانت حية وتلك التي كانت ميتة.
- لكل يوم ، قم بتحفيز موت الخلايا في عينة واحدة على الأقل لاستخدامها كعنصر تحكم لتحديد عتبة شدة التألق بين الخلايا الحية والميتة. تحضير العينات في أنابيب الطرد المركزي الدقيقة على النحو التالي:
- التحكم الإيجابي في موت الخلايا: ضع الأنبوب المسمى ميت غير ملطخ (الأنبوب 3) والملطخ الميت (الأنبوب 4) في حمام مائي عند 50 درجة مئوية لمدة 7 دقائق للحث على موت الخلايا عن طريق المعالجة الحرارية.
- تلطيخ الخلايا: أضف 1 ميكرولتر من الصبغة التفاعلية الفلورية المعاد تكوينها (من الخطوة 4.1.2) إلى 1 مل من تعليق الخلية في الأنبوبين 2 و 4 (الأنابيب التي سيتم تلطيخها) واخلطها جيدا.
- احتضن في RT لمدة 30 دقيقة ، محمية من الضوء.
ملاحظة: إذا لم يكن التثبيت مطلوبا، فيمكنك تخطي الخطوات 4.2.5-4.2.7 أدناه. بدلا من ذلك ، اغسل الخلايا مرتين ب 1 مل من HBSS مع 1٪ ألبومين مصل بقري (انظر الملف التكميلي 1) وأعد تعليقه في 1 مل من HBSS مع 1٪ زلال مصل البقري. إجراء التحليل على مقياس التدفق الخلوي في أسرع وقت ممكن ؛ خلاف ذلك ، قد تتعرض صلاحية الخلية للخطر لأن الخلايا غير ثابتة. - اغسل الخلايا مرتين ب 1 مل من HBSS وأعد تعليق الخلايا في 900 ميكرولتر من HBSS.
- أضف 100 ميكرولتر من 37٪ فورمالديهايد (تنبيه ، انظر الجدول التكميلي 2).
- احتضن لمدة 15 دقيقة في RT.
- يغسل مرتين ب 1 مل من HBSS مع 1٪ ألبومين مصل بقري (BSA) ، ثم يعلق الخلايا في 1 مل من HBSS مع 1٪ BSA.
- قم بتخزين العينات في الثلاجة عند 4 درجات مئوية. تحليل الخلايا في غضون 1 شهر بعد التثبيت.
- قم بتحليل تعليق الخلية الثابتة عن طريق قياس التدفق الخلوي باستخدام قناة الإثارة والكشف المناسبة.
ملاحظة: قد تختلف قنوات الإثارة والكشف الصحيحة بناء على الأداة المستخدمة (انظر الجدول التكميلي 3).
- بعد عد الخلايا وضبط الكثافة إلى 1 × 106 خلايا لكل مل باستخدام HBSS ، قم بنقل 1 مل من تعليق الخلية هذا إلى أنابيب طرد مركزي دقيقة سعة 2 مل.
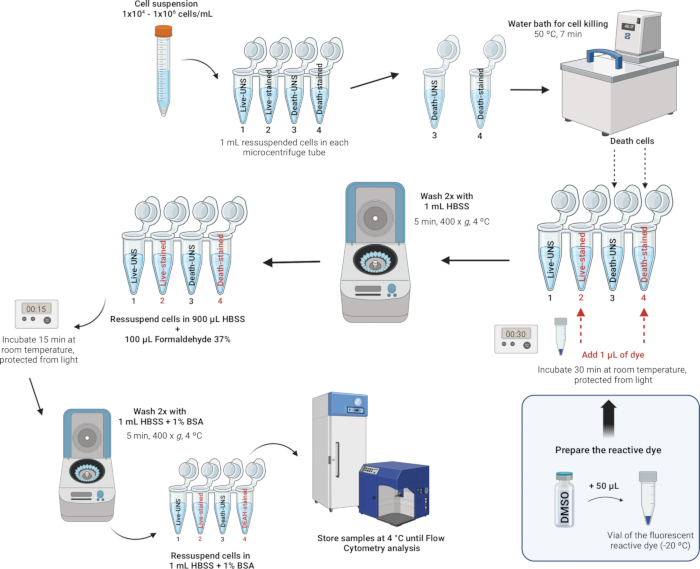
الشكل 4: وصف توضيحي لتلوين وتثبيت الكريات البيض. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. قياس التدفق الخلوي
- الحصول على البيانات.
ملاحظة: قد تختلف الإجراءات التي يجب اتباعها على مقياس التدفق الخلوي اعتمادا على مقياس الخلوي المحدد المستخدم. في هذه الدراسة ، تم الحصول على البيانات باستخدام مقياس التدفق الخلوي Attune NTx.- تشغيل العينات.
- ضع أنبوب العينة في منفذ العينة.
- ابدأ الاستحواذ بالضغط على ابدأ ثم انقر فوق تسجيل بمجرد استقرار معدل الحدث (الأحداث / الثانية).
- سجل ما لا يقل عن 10,000 حدث لكل عينة في بوابة المفردات لتحليل موثوق.
- احفظ جميع البيانات لكل عينة وقم بنسخها احتياطيا على محركات أقراص خارجية أو تخزين سحابي.
- تحليل البيانات.
ملاحظة: لتحليل قياس التدفق الخلوي ، تتوفر العديد من خيارات البرامج. في هذه الدراسة ، تم إجراء تحليل البيانات باستخدام FlowJo v10.8.119.- تحميل ملفات البيانات: قم بتشغيل برنامج تحليل قياس التدفق الخلوي وقم بتحميل ملفات .fcs المكتسبة من التجربة.
- تصور البيانات (الشكل 5 أ): رسم التشتت الأمامي (FSC-A) (XX) مقابل الانتثار الجانبي (SSC-A) (YY) لتقييم حجم الخلية وحدبتها.
ملاحظة: تستخدم هذه المؤامرة بشكل شائع لتحديد مجموعات الخلايا واستبعاد الحطام بناء على خصائص التشتت. - استبعاد بوابات الخلية المفردة والمضاعفات (الشكل 5 ب): استخدم مخطط منطقة التشتت الأمامي (FSC-A) مقابل ارتفاع التشتت الأمامي (FSC-H) لاستبعاد المضاعفات. ارسم بوابة لتضمين جميع الأحداث المحاذاة في الرسم البياني (الخلايا المفردة) واستبعاد الأحداث غير المحاذاة (المتعددات). إذا كانت العينة تحتوي على أحداث ذات FSC منخفض جدا ، فاستبعدها بعدم تضمينها في بوابة الخلية الفردية ، مع الإبقاء على الخلايا المفردة فقط.
- تحديد مجموعات الكريات البيض (الشكل 5 ج): قم بتمييز 3 مجموعات من الكريات البيض بناء على ملف تعريف FSC-A / SSC-A: FSC-AHIGH / SSC-Aهي الخلايا الحبيبية ،ومتوسط FSC-A / SSC-A هو الخلايا الوحيدة و FSC-Aمنخفضة / SSC-Aمنخفضة هي الخلايا الليمفاوية.
- بوابة الجدوى (الشكل 5 د): قم بإعداد عتبة تلطيخ صبغة الجدوى على قناة التألق المقابلة (NIR ، RL3-A). يتم تعريف الخلايا الحية مقابل الخلايا الميتة بناء على شدة التلوين باستخدام صبغة الخلايا الميتة القابلة للإصلاح الحية / الميتة: يتم تعريف الخلايا الملطخة الخافتة على أنها الخلايا الحية ، ويتم تعريف الخلايا الملطخة بشدة على أنها خلايا ميتة.
- الإحصاءات السكانية: انظر إلى الإحصائيات التي يوفرها البرنامج ، بما في ذلك إجمالي الأحداث (الخلايا) في كل بوابة والنسب المئوية للخلايا الإجمالية والمسورة.
- تصدير البيانات: قم بتصدير البيانات إلى جدول بيانات واستخدم البرامج الإحصائية المناسبة (GraphPad Prism أو R) لمزيد من التحليل الإحصائي.
ملاحظة: يعتمد اختيار طرق التحليل على أهداف البحث.
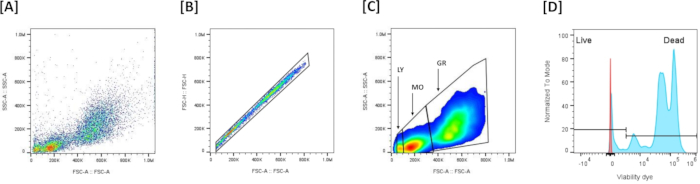
الشكل 5: استراتيجية بوابات قياس التدفق الخلوي لتقييم الجدوى في خلايا الكلى الرئيسية: (أ) يمثل ملف تعريف FSC-A / SSC-A لجميع الأحداث التي تم جمعها. (ب) يمثل استبعاد المضاعفات بناء على تعريف منطقة المفردات على أساس الخطية على الرسم البياني للتبعثر الأمامي (FSC-A)/الانتثار الأمامي (FSC-H). (ج) يمثل المجموعات السكانية الرئيسية الثلاثة التي تم تعريفها على أساس FSC-A/SSC-A، بعد استبعاد المضاعفات. (د) يمثل رسما بيانيا يوضح تلطيخ صبغة البقاء الحية / الميتة. لإعداد العتبة التي تسمح بالتمييز بين الخلايا الحية والميتة ، تم إخضاع الكريات البيض لصدمة حرارية خفيفة (50 درجة مئوية ، 7 دقائق) ثم تلطيخها بصبغة البقاء. الخلايا عالية الشدة الموجبة (++) هي الخلايا الميتة ، والخلايا الموجبة منخفضة التلوين (+-) هي الخلايا الحية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يقدم الشكل 6 بيانات قياس التدفق الخلوي التمثيلية التي توضح مجموعات الكريات البيض المعزولة من كلية الرأس من الدنيس الصغير (Sparus aurata) وقابليتها للحياة الخلوية باستخدام البروتوكول الموصوف في هذه الدراسة. يقارن الشكل عينتين: واحدة ذات قابلية خلوية عالية ، حيث تعرضت الأسماك للظروف المثلى (الشكل 6 أ) ، والأخرى ذات قابلية خلوية منخفضة ، حيث تعرضت الخلايا للإجهاد الحراري (الشكل 6 ب).
في كلتا العينتين ، حددت الطريقة الحالية بشكل فعال ثلاثة مجموعات رئيسية من الكريات البيض: الخلايا الليمفاوية (LY) ، والخلايا الوحيدة (MO) ، والخلايا المحببة (GR). تم تمييز هذه المجموعات بناء على الاختلافات في حجم الخلية وتعقيدها ، كما يتضح من مخططات التشتت الأمامي (FSC-A) والمبعثر الجانبي (SSC-A). يشير التشتت الأمامي (FSC-A) إلى الحجم النسبي للخلية ، بينما يعكس التشتت الجانبي (SSC-A) التعقيد الداخلي أو الدقة للخلايا ، مما يسمح بفصل واضح للمجموعات. في ظل الظروف المثلى (الشكل 6 أ) ، تم توزيع مجموعات الكريات البيض على النحو التالي: LY بنسبة 31.0٪ ، MO بنسبة 38.0٪ ، والموارد الوراثية بنسبة 31.0٪. ومع ذلك، لوحظ تحول في العينة المعرضة للإجهاد الحراري (الشكل 6 ب)، مع انخفاض نسبة الكثافة السكانية إلى 21.3٪، وزيادة معدل الكثافة الوراثية إلى 45.6٪، وظل الموارد الوراثية مستقرة نسبيا عند 33.1٪.
يكشف التحليل الإضافي لصلاحية الخلية ، المفصل في الشكل 6 أ1-A3 والشكل 6 ب1-ب 3 ، عن تباين كبير بين العينتين. كما يمكن ملاحظته ، أظهرت العينة المعرضة للظروف المثلى (الشكل 6 أ) قابلية أعلى للحياة ، مع غلبة الخلايا الحية (الممثلة باللون الأزرق) عبر جميع مجموعات الكريات البيض. في المقابل ، أظهرت العينة المجهدة حراريا (الشكل 6 ب) زيادة كبيرة في موت الخلايا (تلطيخ أكثر كثافة موضح باللون الأحمر) ، حيث أظهر LY 50.7٪ موت الخلايا ، MO 83.7٪ ، و GR 84.5٪.
بشكل عام ، توضح النتائج بوضوح فعالية البروتوكول في كل من عزل وتحليل مجموعات الكريات البيض وتقييم صلاحية الخلية. علاوة على ذلك ، توفر البيانات رؤى قيمة حول كيفية تأثير الظروف المجهدة ، مثل التعرض الحراري ، على ديناميكيات أعداد الكريات البيض وقابلية الخلايا للبقاء. تشير التحولات الملحوظة في توزيع الخلايا وقابليتها للحياة تحت الضغط إلى أن التعرض الحراري لا يعطل توازن مجموعات الكريات البيض فحسب ، بل يضر أيضا بصحة الخلايا. قد تشير هذه التغييرات إلى استجابة مناعية للإجهاد ، مما يشير إلى آلية دفاع نشطة ناتجة عن الضغوطات البيئية.

الشكل 6: مخططات قياس التدفق الخلوي التمثيلية التي توضح تحديد وصلاحية مجموعات مختلفة من الكريات البيض من كلية رأس الدنيس المذهب (Sparus aurata): (أ) عينة ذات قابلية عالية للخلايا ، معرضة للظروف المثلى: تظهر اللوحة اليسرى بوابة مجموعات الكريات البيض بناء على FSC-A / SSC-A ، وتحديد الخلايا الليمفاوية (LY) ، والخلايا الوحيدة (MO) ، والخلايا الحبيبية (GR) ؛ جدوى LY (A.1) و MO (A.2) و GR (A.3). (ب) عينة ذات قابلية منخفضة للخلايا ، معرضة للإجهاد الحراري: تظهر اللوحة اليسرى بوابات مجموعات الكريات البيض بناء على FSC-A / SSC-A ، وتحديد الخلايا الليمفاوية (LY) ، والخلايا الوحيدة (MO) ، والخلايا الحبيبية (GR) ؛ جدوى LY (B.1) و MO (B.2) و GR (B.3). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: صورة تمثيلية لخزان الحجر الصحي بسعة إجمالية تبلغ 660 لترا. الرجاء النقر هنا لتنزيل هذا الرقم.
الشكل التكميلي 2: صورة لإعداد نظام RAS. (1) بروفيلوكس. (2) المصابيح. (3) أحواض السمك / الدبابات. (4) ثلاجة. (5) صنابير مدخل المياه في أحواض السمك. (6) سيفون أزرق لمنافذ مياه حوض السمك. (7) الغطاء. (8) مقشدة البروتين. (9) مرشح ميكانيكي (كيس فلتر) ؛ (10) مرشح ميكانيكي (إسفنجة زرقاء + صوف زجاجي) ؛ (11) مرشح بيولوجي (الكرات الحيوية) ؛ (12) ترموستات. (13) المضخة الرئيسية (14) معقم للأشعة فوق البنفسجية. (15) مستشعر درجة الحرارة (أ) مرشح ميكانيكي (إسفنجة زرقاء) ؛ (ب) مرشح ميكانيكي (صوف زجاجي). الرجاء النقر هنا لتنزيل هذا الرقم.
الجدول التكميلي 1: تكوين المكونات (٪) والتحليل القريب (٪ DM) للنظام الغذائي التجريبي المستخدم في الدراسة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 2: الكواشف المستخدمة في البروتوكول: المخاطر الصحية ، وبيانات المخاطر ، والبيانات التحذيرية ، وتدابير الإسعافات الأولية. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 3: قنوات الإثارة والكشف المناسبة لاستخدامها مع بقع الخلايا الميتة LIVE / DEAD القابلة للإصلاح التفاعلية مع الأمين. الرجاء الضغط هنا لتحميل هذا الجدول.
الملف التكميلي 1: حسابات إعداد الحلول. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تمثل الطريقة التي تم تطويرها في هذه الدراسة تقدما كبيرا في أبحاث مناعة الأسماك وتعد بتحسين فهم الاستجابات المناعية للأسماك واستدامة الموارد البحرية. S. aurata هو نوع قيم من الأسماك البحرية من عائلة Sparidae يعمل ككائن حي نموذجي مثالي لعدة أسباب ، بما في ذلك أهميته البيئية والاقتصادية ، فضلا عن تعدد استخداماته في الأبحاث المختبرية عبر العديد من مجالات الدراسة مثل علم وظائف الأعضاء والمناعة وعلم السموم وتربية الأحياءالمائية 20. تتمثل إحدى المزايا الرئيسية ل S. aurata في سهولة التعامل معها وتربيتها في المختبر ، مع بروتوكولات تربية راسخة تضمن ظروفا تجريبية متسقة وقابلة للتكرار21. علاوة على ذلك ، فإن قدرتها على التكيف البيئي (أي تحمل كبير لمجموعة واسعة من الظروف البيئية ، مثل تقلبات درجات الحرارة والملوحة) تجعلها مرشحا مثاليا للدراسات التي تهدف إلى تحسين تقنيات الزراعة وتقييم الآثار البيئية على الكائنات البحرية22. S. aurata ، بنظامها المناعي المميز جيدا وتوافر البيانات الجينومية ، تسمح بإطلاق العنان للاستجابات المناعية للأسماك ، ومقاومة مسببات الأمراض ، وفعالية اللقاح ، والصحة العامة20. نظرا لأهميته في تربية الأحياء المائية ، وكذلك في العادات الغذائية لسكان جنوب أوروبا ، يمكن للبحث عن هذا النوع أن يؤثر بشكل مباشر على الممارسات الزراعية ، وتعزيز إنتاجه واستدامته مع معالجة التحديات البيئية داخل الصناعة20.
بهذا المعنى ، يقدم هذا البروتوكول العديد من المزايا والتطبيقات المحتملة في مجالات البحث المختلفة ، مثل: (ط) علم مناعة الأسماك: يوفر تحليلا دقيقا ومفصلا للخلايا المناعية من كلية رأس المكورات العنقودية الذهبية ، مما يسمح بتحديد وتوصيف مجموعات الكريات البيض المختلفة ، بالإضافة إلى تقييمات قوية لصلاحية الخلايا عن طريق قياس التدفق الخلوي. (2) بحوث الاستزراع المائي: ضرورية لدراسة تقنيات الاستزراع والتغذية وإدارة الأمراض، ودعم البحوث المستقبلية الرامية إلى تقليل الاعتماد على المضادات الحيوية والمعالجات الكيميائية، وبالتالي تعزيز ممارسات الاستزراع المائي الأكثر استدامة؛ (ثالثا) علم السموم الإيكولوجية: ذو قيمة في تقييم الآثار الناجمة عن الملوثات وغيرها من الضغوطات البيئية على صحة المناعة للأسماك، وتوفير البيانات لتقييم المخاطر البيئية وصياغة اللوائح الوقائية للنظم الإيكولوجية المائية؛ (رابعا) علم وظائف الأعضاء المقارن: يسمح للباحثين بمتابعة التكيفات التطورية لأجهزة المناعة مع التحديات البيئية المختلفة ، مما يوفر فهما أعمق للأساس الجيني والفسيولوجي لوظيفة المناعة ؛ (ت) البيولوجيا والبيئة البحرية: تحسين فهم الأدوار والتفاعلات الإيكولوجية للبكتيريا العنقودية الهاوية، وتوفير رؤى حول توزيع الأنواع، وتفضيلات الموائل، وتأثير التغيرات البيئية على التنوع البيولوجي البحري؛ (سادسا) البحوث الطبية الحيوية: غالبا ما تستخدم الأسماك بشكل متزايد ككائنات نموذجية في البحوث الطبية الحيوية. يمكن أن يساعد عزل الخلايا المناعية وتحليلها في فهم الجوانب الخلوية والجزيئية الحاسمة لاكتشاف الأدوية وحتى الطب.
لسنوات عديدة ، اعتمد القياس الكمي للكريات البيض وتحديدها في الأسماك على تقنيات أمراض الدم التقليدية ، مثل العد اليدوي باستخدام مقاييس الدم Bürker أو Neubauer أو Thoma ، بالإضافة إلى مسحات الدم الملطخة10،12. تم تقييم صلاحية الخلية أيضا باستخدام اختبار استبعاد التريبان الأزرق ، متبوعا بالفحص المجهري15،22،23،24،25،26،27،28. في حين أن هذه الأساليب ساهمت في فهمنا لمناعة الأسماك ، إلا أن لها العديد من القيود. كان عد الكريات البيض اليدوي يستغرق وقتا طويلا ويتطلب عمالة مكثفة ، وغالبا ما تتأثر دقة هذه التقنيات بسبب تباين المشغل والخطأ البشري ، مما أثر بشكل كبير على اتساق النتائج10.
في عام 1994 ، Esteban et al. أحدث ثورة في تحليل كريات البيض للأسماك من خلال إدخال تقنية لتقييم آلية الدفاع البلعمية في سمك القاروص (Dicentrarchus labrax)23. في دراستهم ، تم عزل الكريات البيض من الدم المحيطي والرأس والكلى والإفرازات البريتونية باستخدام الطرد المركزي المتدرج بكثافة بيركول23. يمثل هذا التقدم المنهجي قفزة كبيرة إلى الأمام ، مما عزز دقة وموثوقية تحليل الكريات البيض. بعد العمل الرائد ل Esteban et al. ، هدفت الدراسات اللاحقة إلى تحسين وتحسين تقنيات قياس التدفق الخلوي لتحليل الكريات البيض ، مع التركيز على جوانب مختلفة مثل توصيف مجموعة الخلايا6،15،16،28،29 ، وقابلية الخليةللحياة 3،6،27،28 ، ونشاط البلعمة6،23 ،24،27،28. أدى التقدم في إجراءات العزل ، بما في ذلك استخدام وسائط التدرج المختلفة (على سبيل المثال ، Ficoll مقابل Percoll) وبروتوكولات الطرد المركزي المحسنة ، إلى تحسين نقاء وإنتاجية الكريات البيض المعزولة1،8،14،26. أدى تطوير تقنيات التلوين المتقدمة واستخدام الأصباغ الفلورية ، مثل يوديد البروبيديوم (PI) و 3،3'-Dihexyloxacarbocyanine يوديد (DiOC6 (3)) إلى تمكين تمييز أكثر دقة بين الخلايا القابلة للحياة وغير القابلة للحياة ، بالإضافة إلى التوصيف التفصيلي لمجموعات الكريات البيض ، على التوالي16،30. تتمثل إحدى المزايا الرئيسية لهذه التقنية في قدرتها على التمييز في وقت واحد بين مجموعات الكريات البيض المختلفة (الخلايا الليمفاوية والخلايا الوحيدة والخلايا الحبيبية) وتقييم صلاحية الخلايا لكل مجموعة. يسمح ذلك للباحثين بتحديد المجموعات السكانية الأكثر تضررا في ظل ظروف معينة ، مما يوفر رؤى أعمق للاستجابة المناعية والكشف عن المجموعات الفرعية الأكثر ضعفا من الكريات البيض ومع ذلك ، على الرغم من هذه التحسينات ، لا تزال الأساليب الحالية تواجه قيودا. ركزت معظم الأبحاث على الأسماك البالغة ، مما ترك فجوة في دراسة مراحل الأحداث. تمثل الأسماك الصغيرة تحديات فريدة لاستخراج الكريات البيض نظرا لصغر حجمها وصعوبة الحصول على عينات عالية الجودة من أعضائها المناعية الأصغر نسبيا17. تتناول الدراسة الموضحة هنا هذه المشكلات على وجه التحديد من خلال تحسين بروتوكول الأسماك الصغيرة ، وتعديل نسبة تعليق الخلية ، وحل Percoll لتحسين جودة استخراج الكريات البيض بالإضافة إلى ذلك ، غالبا ما تكون الطرق الحالية محدودة بعدد العينات أو التكرارات التي يمكن معالجتها في وقت واحد بسبب الحاجة الفورية لتقييم صلاحية الكريات البيض. يمكن أن يؤثر أي تأخير في معالجة العينات سلبا على بقاء الخلية ، مما يعقد عملية أخذ العينات ويحتمل أن يضر بالنتائج. للتغلب على هذا القيد ، تقدم هذه الدراسة استخدام تقنية تلطيخ جديدة تسمح بتثبيت الخلايا وتحليلها حتى شهر واحد بعد التثبيت. يوفر هذا الابتكار مرونة أكبر في جداول أخذ العينات ، مما يسمح للباحثين بمعالجة العينات وتحليلها في الوقت الذي يناسبهم ، مما يحسن بشكل كبير من سير العمل وموثوقية تقييمات قياس التدفق الخلوي.
يعتمد نجاح هذا البروتوكول على عدة خطوات حاسمة ، كل منها يتطلب تنفيذا دقيقا لضمان سلامة وصلاحية الكريات البيض ، والتي يتم تحليلها لاحقا عن طريق قياس التدفق الخلوي. يعد التحضير الصحيح لمحلول القتل الرحيم وتعديل درجة الحموضة أمرا بالغ الأهمية للقتل الرحيم الفعال. قد تؤدي المحاليل المعدة بشكل غير صحيح إلى القتل الرحيم غير الكامل أو الضغط الإضافي على الأسماك18. يعد التشريح الدقيق والدقيق لكلية الرأس أمرا حيويا لتجنب التلوث. يعد الحفاظ على العقم وسلامة الأنسجة أمرا بالغ الأهمية للحصول على عينات بيضاء عالية الجودة. يجب ضبط الكثافة والأسمولية ودرجة الحموضة لمحلول Percoll بشكل صحيح لفصل الكريات البيض بكفاءة. يعد شفط حلقة الكريات البيض برفق باستخدام ماصة معقمة أمرا بالغ الأهمية لتجنب تلوث واضطراب طبقات التدرج. يعد الغسيل الفعال للخلايا بعد التجميع أمرا ضروريا لإزالة بقايا بيركول والشوائب الأخرى. يضمن تكرار عملية الغسيل وجود حبيبات خلية نظيفة جاهزة للتثبيت. يجب تحضير الصبغة التفاعلية مباشرة قبل الاستخدام لضمان فعاليتها ، لأن التعامل غير السليم يمكن أن يضر بثباتها. تعد إضافة الصبغة المناسبة ووقت الحضانة أمرا بالغ الأهمية للتمييز بدقة بين الخلايا الحية والميتة. يعد تثبيت الخلايا بنسبة 3.7٪ فورمالديهايد خطوة حاسمة للحفاظ على مورفولوجيا الخلايا وضمان التحديد الدقيق للخلايا الميتة. يجب أن يكون تركيز الفورمالديهايد دقيقا ، ويجب اتباع أوقات الحضانة بدقة لتجنب النتائج غير الدقيقة. يعد غسل الخلايا بعد التثبيت أمرا مهما لإزالة أي صبغة زائدة وفورمالديهايد ، مما قد يتداخل مع التحليل اللاحق. يعد التخزين السليم للعينات الثابتة وتحليلها في الوقت المناسب ضروريين للحفاظ على دقة البيانات. يعد ضبط قنوات الإثارة والكشف لتتناسب مع الصبغة المحددة المستخدمة أمرا ضروريا للحصول على نتائج دقيقة لقياس التدفق الخلوي.
على الرغم من مزاياها العديدة ، إلا أن هذه الطريقة لها بعض القيود التي يجب مراعاتها. أحد القيود الرئيسية هو طبيعته الخاصة بالأنواع ، حيث تم تحسين البروتوكول لسمك الدنيس الصغير (S. aurata) ، وهي سمكة بحرية. هذا يعني أن فعاليته قد تختلف عند تطبيقه على أنواع الأسماك الأخرى ، وخاصة أسماك المياه العذبة. قد تتطلب الاختلافات في التوازن التناضحي بين أنواع المياه البحرية والمياه العذبة تعديلات على المحاليل المستعملة في البروتوكول ، حيث أن المحاليل المناسبة للظروف المالحة قد لا تكون مناسبة لأنواع المياه العذبة. بالإضافة إلى ذلك ، قد تتطلب الاختلافات في بنية الأنسجة وكثافة الخلايا والاستجابات الفسيولوجية تعديلات على البروتوكول ، مما قد يؤثر على قابلية التكاثر والاتساق عبر الأنواع المختلفة.
عامل مهم آخر هو صيانة الأسماك قبل جمع العينات. لكل نوع ظروف مائية مثالية محددة ضرورية للحفاظ على صحة الأسماك وضمان جودة النتائجالتجريبية 20. يمكن أن تؤثر الاختلافات في المعلمات مثل درجة الحرارة والملوحة ودرجة الحموضة على بقاء الخلية وجودة البيانات ، حيث قد تؤدي الظروف دون المستوى الأمثل إلى إجهاد فسيولوجي يضر بسلامة الخلية. لضمان نتائج تجريبية متسقة ، من المهم الحفاظ على جميع التكرارات في ظل نفس الظروف الخاضعة للرقابة ، سواء كانت مثالية أو دون المستوى الأمثل عن قصد (اعتمادا على أهداف الدراسة).
يمكن أن يؤثر التباين في تقنيات المناولة والتشريح أيضا على جودة وكمية كريات البيض في كلى الرأس ، مما يجعل مهارة وخبرة المشغل عاملا حاسما لنجاح البروتوكول. بالإضافة إلى ذلك ، يمكن أن يمثل الحفاظ على صلاحية الخلية طوال عملية العزل تحديا ، حيث يمكن أن يؤدي أي تأخير بين القتل الرحيم وتثبيت الخلايا إلى انخفاض قابلية البقاء والنتائج المتحيزة. تعد المعالجة الفورية للأنسجة والخلايا ضرورية للحفاظ على قابلية عالية للخلايا ، ولكن قد يكون من الصعب تحقيق هذا المطلب باستمرار ، خاصة عند العمل مع عدد كبير من العينات.
Disclosures
يعلن المؤلفون عن عدم وجود تضارب في المصالح المالية أو الشخصية أو المهنية التي يمكن أن تؤثر على البحث أو التحليل أو تفسير البيانات أو الكتابة أو قرار تقديم المخطوطة للنشر.
Acknowledgements
تم دعم هذا العمل من قبل مؤسسة Portuguesa para a Ciência e Tecnologia (FCT I.P.) ، في إطار مشروع Aqua-CLIMADAPT (PTDC/CTA-AMB / 0592/2021 ، https://doi.org/10.54499/PTDC/CTA-AMB/0592/2021). نحن نقدر المختبر الحيوي المدعوم من وحدة العلوم البيولوجية الجزيئية التطبيقية (UCIBIO) والمختبر المرتبط بوحدة أبحاث الكيمياء الخضراء - LAQV ، والتي يتم تمويلها من الأموال الوطنية من FCT / MCTES (UIDB / 04378/2020 و UIDB / 50006/2020 ، على التوالي) ، بالإضافة إلى معهد المختبر المساعد للصحة والاقتصاد الحيوي - i4HB (LA / P / 0140/2020). تم دعم هذا العمل أيضا من قبل المفوضية الأوروبية من خلال مشروع GLYCOTwinning (اتفاقية المنحة رقم 101079417) و FCT من خلال InnoGlyco (2022.04607.PTDC). يعترف عيسى مارميلو أيضا ب FCT I.P. لمنحة الدكتوراه (2020.04413.BD ، https://doi.org/10.54499/2020.04413.BD).
Materials
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
References
- Samaï, H. C., et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93(2023).
- Lulijwa, R., et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A., et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498(2022).
- Titus, J., et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142(2024).
- Marmelo, I., et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135(2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955(2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change. Biol Lett. 20 (2), 20230346(2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398(2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á, Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R., et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. , American Veterinary Medical Association. Schaumburg, IL. (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). , At https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software (2023).
- Mhalhel, K., et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008(2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739(2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á, Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á, Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M. -A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved