Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение, фиксация и характеристика лейкоцитов почки ювенильной головы морского леща методом проточной цитометрии
В этой статье
Резюме
В данной рукописи описывается выделение и фиксация лейкоцитов, выделенных из головной почки морского леща, и оценка их жизнеспособности с помощью проточной цитометрии. Эта работа способствует стандартизации протоколов и позволяет обрабатывать большее количество образцов без ущерба для качества образцов, способствуя достижениям в области иммунологии рыб.
Аннотация
Иммунитет имеет решающее значение для физиологической регуляции организмов, выступая в качестве основной защиты от патогенов и стрессоров окружающей среды. Выделение и анализ иммунных клеток позволяют получить ключевую информацию об иммунных реакциях на внешнее давление. Тем не менее, отсутствие гармонизированных протоколов для менее изученных видов, таких как морские рыбы, часто приводит к техническим и аналитическим проблемам, которые затрудняют интерпретацию данных и глубокое понимание видоспецифичных иммунных реакций. Целью данного исследования было создание оптимизированной аналитической процедуры на основе проточной цитометрии для характеристики и определения жизнеспособности лейкоцитов из головной почки (основного кроветворного органа костистых рыб) молоди золотистого морского леща (Sparus aurata). Процедура началась с выделения лейкоцитов с помощью процесса гомогенизации с использованием сбалансированного раствора соли Хэнкса, за которым последовал оптимизированный метод центрифугирования с градиентом плотности Перколла для обеспечения высоких скоростей восстановления лейкоцитов с минимальным загрязнением эритроцитов, необходимым для эффективного последующего анализа проточной цитометрии. Кроме того, была использована новая методика с использованием клеточно-реактивного красителя (LIVE/DEAD Fixable Dead Dead Dead Dead Stain Kit) для отличия жизнеспособных клеток от мертвых на основе их флуоресцентного окрашивания. Фиксация достигалась с помощью 3,7% формальдегида, сохраняя морфологию клеток, жизнеспособность и эффективность окрашивания. Анализ проточной цитометрии успешно идентифицировал три преобладающие популяции лейкоцитов: лимфоциты, моноциты и гранулоциты. Этот метод позволил не только провести тесты на жизнеспособность, но и точную дифференцировку типов клеток. Усовершенствование протоколов проточной цитометрии представляет собой шаг вперед в иммунологии рыб за счет повышения точности и эффективности анализа иммунных клеток. Кроме того, позволяя фиксировать клетки для последующего анализа, этот протокол значительно сокращает время и усилия, необходимые для оценки иммунитета, что делает его ценным инструментом как для исследований, так и для практического применения в различных областях исследований.
Введение
Иммунитет играет центральную роль в физиологической регуляции организмов, выступая в качестве первичной защиты от широкого спектра патогенов истрессоров окружающей среды. Как и другие позвоночные, рыбы имеют сложную, динамичную и скоординированную иммунную систему, необходимую для их общего здоровьяи благополучия.
Костистые рыбы обладают как врожденной, так и адаптивной иммунной системой, которая функционирует одновременно, обнаруживая, реагируя и нейтрализуя вредных захватчиков2. Врожденная иммунная система действует как первая линия защиты, обеспечивая немедленные и неспецифические реакции напатогены2, в то время как адаптивная иммунная система развивается с течением времени, предлагая более специализированную реакцию, которая позволяет рыбам распознавать специфические патогены и устанавливать иммунологическуюпамять3. Иммунная система рыб опирается на специализированные первичные лимфоидные органы (т.е. вилочковую железу и головную почку) и вторичные лимфоидные органы (например, селезенку и слизистые оболочки лимфоидных тканей (MALT)) для поддержки иммунной защиты и поддержания общего здоровья4. Головная почка является основным кроветворным органом у костистых рыб и играет решающую роль в развитии и созревании иммунных клеток, в том числе лейкоцитов5.
В последние годы был достигнут значительный прогресс в изучении иммунных реакций нескольких видов рыб2. Одной из ключевых областей внимания было понимание популяций лейкоцитов и их активности. Лейкоциты, также известные как белые кровяные тельца, обычно классифицируются на моноциты, лимфоциты и гранулоциты и играют решающую роль в иммунной защите рыб. У них есть фагоцитарные клетки, которые отвечают за поглощение и уничтожение патогенов и выделяют бактерицидные активные формы кислорода, способствуя элиминации вторгшихся микроорганизмов6. Лейкоциты также участвуют в воспалительном процессе, помогая изолировать и искоренять инфекции, способствуя восстановлению тканей6. Численность и активность популяций лейкоцитов являются важными показателями иммунного статуса в отношении здоровья и болезней животных 7,8.
Некоторые исследования показали, что стрессовые факторы, такие как неблагоприятные условия окружающей среды, могут изменять количество и морфологию эритроцитов и состав циркулирующих лейкоцитов 9,10. Например, как было рассмотрено Franke et al. (2024), крайне важно изучать иммунную систему рыб в сценариях изменения климата, поскольку стрессоры окружающей среды могут поставить под угрозу иммунитет рыб, повысить восприимчивость к болезням и повысить инфекционность некоторых патогенов, что в конечном итоге ускоряет прогрессирование болезни11. Кроме того, понимание иммунитета рыб имеет важное значение не только для продвижения фундаментальных биологических исследований, но и для поддержки различных секторов общества, таких как аквакультура. По мере того, как аквакультура продолжает расширяться во всем мире, обеспечение здоровья и благополучия выращиваемых видов рыб становится все более важным. Тем не менее, благополучие рыб остается относительно новой областью исследований, а иммунные реакции выращиваемой рыбы все еще требуют тщательной и стандартизированной оценки. Приоритизация исследований иммунного ответа имеет первостепенное значение, поскольку полученная информация может повысить устойчивость и продуктивность аквакультуры за счет эффективных и адаптированных подходов, улучшающих благополучие и устойчивость сельскохозяйственных животных.
Количественное определение и идентификация лейкоцитов обычно проводятся с помощью гематологических методов, таких как ручной подсчет с помощью гемоцитометров Бюркера, Нейбауэра или Томы, а также мазков окрашенной крови 7,10. Для помощи в визуализации и дифференцировке клеток кровичасто используются наборы для окрашивания, такие как Wright, May-Grünwald-Giemsa и Hemacolor. Тем не менее, эти методы ручного подсчета клеток утомительны, отнимают много времени и подвержены человеческим ошибкам 8,10. Распространенными источниками ошибок являются недостаточное смешивание или разжижение крови, проблемы с окрашиванием и неправильная загрузка камеры гемоцитометра, что может привести к неточномуподсчету клеток. Кроме того, ручной гематологический анализ требует высокого уровня знаний и опыта для обеспечения надежности и воспроизводимости результатов7. По мере роста спроса на точные и эффективные диагностические инструменты разработка инновационных методов, обеспечивающих глубокое понимание иммунного статуса популяций рыб, становится все более важным шагом в развитии этой области.
Проточная цитометрия стала мощным инструментом в этом контексте, предлагая высокопроизводительный, количественный подход к анализу популяций лейкоцитов и жизнеспособности клеток8. Эта современная диагностическая технология позволяет быстро обнаруживать, подсчитывать и характеризовать отдельные клетки в смешанных популяциях с удивительнойточностью. Кроме того, проточная цитометрия позволяет проводить одновременные многопараметрические измерения как для фенотипической, так и для функциональной характеризации. Несмотря на широкое использование в клинических условиях человека и ветеринарии, его применение в изучении лейкоцитов рыб остается весьма ограниченным8. Несмотря на то, что некоторые исследования были проведены на различных видах рыб 1,6,8,13,14,15,16,17, все еще необходимо решить несколько критических проблем. Одной из основных проблем в этих анализах является необходимость получения суспензий живых лейкоцитов, извлеченных из периферической крови или лимфоидных тканей, таких как головная почка1. Выделение лейкоцитов часто затруднено из-за уникальной характеристики костистых рыб: наличия ядросодержащих эритроцитов. Непреднамеренное загрязнение эритроцитами может помешать анализу лейкоцитов из-за их размера, яйцевидной формы и наличия ядра1. В связи с этим крайне важно устранить эритроциты из лейкоцитарных суспензий для достижения высокой чистоты лейкоцитов и изучения фенотипических и функциональных характеристик лейкоцитов с помощью анализа проточной цитометрии. У млекопитающих выделение лейкоцитов обычно включает осмотический лизис эритроцитов или разделение градиента плотности с помощью Фиколла или Перколла1. Тем не менее, осмотический лизис неэффективен как для морских, так и для пресноводных рыб из-за их эритроцитов с ядрами, которые не могут быть должным образом лизированы1. Вместо этого разделение по градиенту плотности предпочтительно для рыб, поскольку оно эффективно сохраняет стабильность клеток с течением времени1. Несмотря на то, что в некоторых исследованиях были успешно выделены лейкоциты из молоди рыб, многие исследования по-прежнему сосредоточены в основном на взрослыхпопуляциях. Тем не менее, ранние стадии жизни не только более уязвимы к вспышкам заболеваний, но и меньше по размеру, что делает процесс отбора проб более сложным и трудным. Еще одним ограничением является то, что современные методы часто ограничены ограниченным числом образцов или реплик за один раз, поскольку оценка жизнеспособности лейкоцитов требует немедленной обработки. Задержки в обработке образцов могут негативно сказаться на жизнеспособности клеток, тем самым внося дополнительные осложнения в процесс отбора проб и потенциально ставя под угрозу всю работу.
Насколько нам известно, ни один из опубликованных методов не позволил успешно зафиксировать лейкоцитарные клетки для последующего анализа жизнеспособности методом проточной цитометрии. Настоящее исследование является новаторским, так как оно устанавливает эффективный метод выделения лейкоцитов из головной почки молоди золотистого морского леща (Sparus aurata), основного вида рыб, выращиваемых в странах Южной Европы, с использованием методологии разделения градиента плотности Перколла. Мы также представляем усовершенствованную методику, основанную на окрашивании, которая отличает живые клетки от мертвых и идентифицирует основные популяции лейкоцитов (лимфоциты, моноциты и гранулоциты) с помощью проточной цитометрии. Усовершенствованный протокол предусматривает фиксацию клеток, что позволяет проводить анализ жизнеспособных клеток в течение 1 месяца после процедуры. Внедрение этого протокола проточной цитометрии может значительно сократить время и усилия, обычно необходимые для оценки иммунитета, что делает его ценным методом как для исследований, так и для более практического применения в секторе аквакультуры. Применение данной методологии дает преимущества для анализа большого количества образцов, сохранения клеток и позволяет проводить отсроченный анализ с помощью проточной цитометрии. Таким образом, может быть очень полезно получить ценную информацию об иммунных механизмах рыб и о том, как на жизнеспособность клеток влияют различные условия окружающей среды или эксперимента. Кроме того, этот анализ жизнеспособности может быть интегрирован с многопараметрической фенотипической и функциональной характеристикой конкретных иммунных клеточных популяций. Такой подход позволяет проводить более комплексный анализ нескольких иммунологических параметров, связывая их непосредственно с соответствующими типами клеток и обеспечивая более четкое понимание иммунных реакций. Эти результаты могут способствовать разработке более эффективных стратегий, включая усовершенствованные подходы к борьбе с болезнями в аквакультуре.
Access restricted. Please log in or start a trial to view this content.
протокол
Этот протокол должен выполняться исследователями, сертифицированными в области экспериментов на животных (функции А и В ЕС). Все процедуры, связанные с обращением с животными и сбором образцов, должны соответствовать рекомендациям ARRIVE, а также этическим нормам по уходу за животными и их использованию в соответствии с рекомендациями Федерации европейских ассоциаций лабораторных животных (FELASA). В настоящем исследовании учитывались все эти стандарты, а также португальское законодательство в области лабораторных животных (Директива ЕС 2010/63; Декрет-закон No 113/2013). Исследование было одобрено Органом по благополучию животных и этике IPMA (ORBEA, LABVIVOS-002-AquaClimAdapt), надзором за которым является Национальное управление по использованию живых животных, известное как Генеральный директорат по пищевым продуктам и ветеринарии (DGAV), под этическим номером 20596/25-S.
1. Изучение модели и содержания организмов
ПРИМЕЧАНИЕ: Данное исследование было специально разработано для молоди золотистого морского леща (Sparus aurata) со средним весом 30,0 ± 5,0 г и общей длиной 12,0 ± 2,0 см. Этот метод может быть неприменим непосредственно к другим видам рыб, так как разные виды обладают уникальными физиологическими и иммунологическими характеристиками, которые могут влиять на выделение лейкоцитов, фиксацию клеток и оценку жизнеспособности. Для других видов может потребоваться адаптация к протоколу, и рекомендуется проведение предварительных исследований для оптимизации условий для каждого целевого вида.
- Акклиматизация рыб (период карантина)
- Равномерно распределите рыб по аквариумам большой емкости (например, два аквариума общей емкостью 660 л каждый - см. дополнительный рисунок 1).
ПРИМЕЧАНИЕ: Используемые резервуары могут быть частью системы замкнутого водоснабжения (УЗВ), которая обеспечивает эффективное использование воды и улучшенный контроль качества воды. В УЗВ вода постоянно рециркулируется и обрабатывается внутри системы, обеспечивая стабильную и контролируемую среду для рыб. Такая установка помогает поддерживать оптимальные условия для здоровья и роста рыб, обеспечивая равномерное распределение и минимизируя стресс во время исследования. - Поддерживайте оптимальные абиотические условия.
- Держите рыб на карантине в течение 3 недель в условиях, имитирующих их естественную среду обитания:
температура: 20,0 ± 0,5 °C;
растворенный кислород: 7,2 ± 0,2 мг/л;
соленость: 35,0 ± 0,5 ‰;
рН: 8,0 ± 0,1 единиц;
Период фотообращения: 14 ч светлый/10 ч темный.
ПРИМЕЧАНИЕ: Идеальные условия содержания могут варьироваться в зависимости от вида рыбы. Другие виды могут иметь другие требования, поэтому важно адаптировать эти условия к конкретным потребностям целевого вида, чтобы обеспечить здоровье и благополучие организмов. Кроме того, температура морской воды и фотопериод могут меняться в зависимости от времени года, поэтому при воспроизведении природных условий в лаборатории следует учитывать сезонные колебания.
- Держите рыб на карантине в течение 3 недель в условиях, имитирующих их естественную среду обитания:
- Равномерно распределите рыб по аквариумам большой емкости (например, два аквариума общей емкостью 660 л каждый - см. дополнительный рисунок 1).
- Начните экспериментальное исследование.
- Определите необходимое количество аквариумов и рыб на основе экспериментальной установки для каждого конкретного исследования.
- После периода карантина переведите рыб в самостоятельные УЗВ (см. дополнительный рисунок 2).
- Оснастите каждую систему белковыми скиммерами для удаления излишних органических соединений из воды; физическая фильтрация (фильтр-мешок [400 мкм], фильтрующая губка и стекловата); биологическая фильтрация (биошарики [1,5"], ультрафиолетовый стерилизатор воды, погружные воздушные камни); автоматические системы охлаждения морской воды и погружные цифровые нагреватели, подключенные к компьютеризированной системе управления (ProfiLux) с датчиками температуры для регулировки температуры в каждом резервуаре; Погружные воздушные камни в каждый резервуар для контроля растворенного кислорода.
- Акклиматизируйте рыб в течение 2 недель в новых системах, прежде чем приступать к эксперименту.
- Выполняйте ежедневное техническое обслуживание
- Удалите фекалии рыб из каждого инкубационного аквариума и обновите морскую воду на 25%.
- Измеряйте температуру с помощью портативного прецизионного термометра.
- Контролируйте другие абиотические параметры морской воды (соленость, растворенный кислород и pH) с помощью многопараметрического измерительного прибора.
- При необходимости регулируйте абиотические параметры морской воды, чтобы обеспечить стабильность на протяжении всего эксперимента.
Примечание: Абиотические условия в экспериментальных системах могут варьироваться в зависимости от конкретных требований каждого конкретного случая. Например, если исследование направлено на моделирование сезонных изменений или морских волн тепла, температура и фотопериод должны быть скорректированы соответствующим образом, чтобы имитировать естественные сезонные колебания. Аналогичным образом, если исследование сосредоточено на моделировании гипоксических условий или закисления океана, следует внести коррективы в уровни кислорода и pH морской воды. Это гарантирует, что условия эксперимента будут максимально реалистичными и актуальными, повышая достоверность и применимость результатов исследования. - Оценка здоровья и благополучия рыб, выявление и устранение признаков стресса или заболевания, как описано в шагах 1.2.4.6-1.2.4.8.
- Обращайте внимание на ненормальное поведение, такое как беспорядочное плавание, потеря аппетита, вялость, агрессия или изоляция.
- Проверьте наличие признаков заболевания, включая поражения, язвы, изменение цвета, зажатые плавники, чрезмерное выделение слизи или быстрое движение жабр.
- Запишите все наблюдения, отметив дату и предпринятые действия.
- Проводите еженедельные проверки качества воды.
- Измерьте уровень аммиака (NH3/NH4), нитритов (NO2-) и нитратов (NO3-) с помощью колориметрических тестов.
ПРИМЕЧАНИЕ: Убедитесь, что все эти параметры находятся ниже обнаруживаемых уровней. Если уровень превышает допустимые значения, проведите дополнительную подмену воды, увеличьте аэрацию или отрегулируйте фильтрацию.
- Измерьте уровень аммиака (NH3/NH4), нитритов (NO2-) и нитратов (NO3-) с помощью колориметрических тестов.
- Кормите и следите за питанием рыб.
- Обеспечить высококачественный рацион, отвечающий конкретным пищевым потребностям молоди рыб (см. Дополнительную таблицу 1 для примера подробного состава рациона).
ПРИМЕЧАНИЕ: Убедитесь, что размер гранул аквакорма (2-3 мм) подходит для молоди, облегчая проглатывание и пищеварение. - Отрегулируйте количество корма так, чтобы оно соответствовало 2% от средней массы тела рыбы в день.
- Кормите рыб вручную два раза в день - один раз утром и один раз днем (установите конкретное время для поддержания стабильного режима кормления).
- Обеспечить высококачественный рацион, отвечающий конкретным пищевым потребностям молоди рыб (см. Дополнительную таблицу 1 для примера подробного состава рациона).
2. Отбор проб рыбы, эвтаназия, вскрытие и забор почек головы
- Возьмите образцы рыб из аквариумов.
- Выбирайте рыб случайным образом из аквариумов, чтобы избежать систематической ошибки выборки.
- С помощью сачка аккуратно переложите рыб во временную емкость, наполненную водой из аквариума.
ПРИМЕЧАНИЕ: Сведите к минимуму время обработки, чтобы снизить стресс.
- Приготовьте раствор для эвтаназии.
- Используйте подходящую емкость (например, ведро объемом 3 л), подходящую для хранения рыбы.
- Растворите соответствующее количество трикаина (MS-222) в морской воде до достижения конечной концентрации 200-300 мг/л18 (ВНИМАНИЕ: см. Дополнительную таблицу 2 и Дополнительный файл 1).
- Буферизируйте раствор бикарбонатом натрия до pH 7,2-7,5.
- Введите раствор для эвтаназии.
- Поместите рыбу в раствор для эвтаназии не менее чем на 10 минут или до тех пор, пока не будет наблюдаться прекращение двигательных движений и потеря рефлексов (подтвердите эвтаназию, проверив отсутствие реакции на внешние раздражители).
- Запишите массу тела рыбы (г) и общую длину (см).
- Проведите вскрытие рыбы.
ПРИМЕЧАНИЕ: Чтобы обеспечить оптимальное качество образца и жизнеспособность клеток, процесс вскрытия должен быть завершен как можно быстрее, в идеале в течение 5 минут после эвтаназии.- Обеспечьте поддержание лабораторной температуры на уровне 19 °C с помощью кондиционера, чтобы свести к минимуму колебания во время отбора проб и обработки.
- Простерилизуйте инструменты для препарирования (желательно автоклавные металлические, когда это возможно) и создайте чистое рабочее место с 70% этанолом (ВНИМАНИЕ, см. дополнительную таблицу 2).
- Положите усыпленную рыбу на бок на стерильный поднос для препарирования головой к недоминантной руке.
- С помощью скальпеля сделайте аккуратный надрез по вентральной средней линии рыбы от отверстия (ануса) вверх по направлению к жабрам.
ПРИМЕЧАНИЕ: Будьте осторожны и не режьте слишком глубоко, чтобы не повредить внутренние органы. - Осторожно с помощью ножниц для рассечения удлините разрез и обнажите внутренние органы. Аккуратно поднимите створки стенки тела, чтобы обеспечить четкий обзор внутренней анатомии.
- Найдите головную почку: Головная почка расположена сразу за жабрами, рядом с передней дорсальной областью полости тела, и проходит вдоль верхней стороны полости тела, под позвоночным столбом.
ПРИМЕЧАНИЕ: Головная почка обычно темнее по сравнению с окружающими тканями (Рисунок 1). - Тщательно очистите все окружающие ткани, такие как жир и соединительная ткань, чтобы лучше визуализировать головную почку.
ПРИМЕЧАНИЕ: Этот шаг требует деликатного обращения, чтобы не повредить головную почку. - С помощью щипцов и ножниц с тонкими наконечниками осторожно приподнимите головную почку и сделайте точные надрезы вокруг нее, чтобы освободить ее от окружающих тканей.
ПРИМЕЧАНИЕ: Обращайтесь с салфеткой осторожно, чтобы не повредить ее. У рыбы весом около 30 г ожидается, что головная почка будет весить около 20-30 мг. - Немедленно поместите иссеченный орган в клеточное ситечко (нейлоновая сетка 100 мкм) в стерильную чашку Петри, чтобы обеспечить стерильность и облегчить последующие этапы обработки.
ПРИМЕЧАНИЕ: С этого момента все шаги должны быть выполнены как можно быстрее (в течение 5 минут) для поддержания жизнеспособности клеток. Чтобы образец оставался прохладным, выполните следующие действия, поместив чашку Петри на контейнер, наполненный льдом и накрытый алюминиевой фольгой.

Рисунок 1: Положение головной почки: (А) Иллюстрация, изображающая типичное расположение головной почки за жабрами и вдоль передней дорсальной области полости тела; (Б) Репрезентативное изображение головной почки у морского леща, подчеркивающее ее более темную окраску по сравнению с окружающими тканями. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Выделение лейкоцитов головы почки (Рисунок 2)
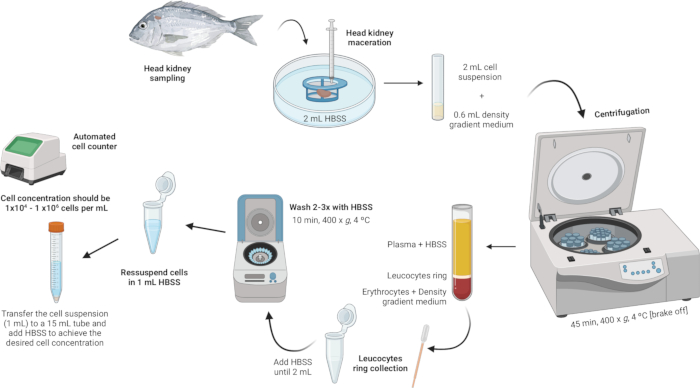
Рисунок 2: Иллюстративное описание выделения лейкоцитов из головной почки. Протокол включает в себя несколько этапов: начиная с гомогенизации ткани, за которым следует центрифугирование с градиентом плотности, сбор кольца лейкоцитов, промывка кольца лейкоцитов и заканчивая ресуспензией и коррекцией концентрации клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Гомогенизируйте ткань.
- Поместите 2 мл сбалансированного солевого раствора Хэнкса (HBSS) в стерильную чашку Петри.
- Убедитесь, что сетка сетчатого фильтра (нейлоновая сетка 100 мкм) находится в контакте с HBSS, но не полностью погружена в воду.
- Размачивайте головку почки на клеточном ситечке с помощью поршня шприца. Приложите мягкое давление, чтобы протолкнуть фрагменты органа через капроновую сетку, создавая клеточную суспензию.
ПРИМЕЧАНИЕ: При обработке нескольких образцов чашку Петри, содержащую клеточную суспензию, можно хранить в холодильнике при температуре 4 °C в течение нескольких минут до следующего этапа. Эта клеточная суспензия будет использоваться для выделения лейкоцитов.
- Выполните центрифугирование с градиентом плотности.
- Приготовьте раствор среды с градиентом плотности с плотностью 1,077 г/мл, осмолярностью 353 мОсм/кг и pH 7,4 (см. Дополнительный файл 1).
ПРИМЕЧАНИЕ: Осмолярность может варьироваться у разных видов рыб, поэтому крайне важно регулировать осмолярность градиента плотности среднего раствора в соответствии с конкретными требованиями каждого вида. - В полистирольные пробирки с круглым дном объемом 5 мл осторожно добавьте 600 мкл среднего раствора с градиентом плотности.
- Возьмите клеточную суспензию (2 мл) и медленно добавьте ее в пробирку, содержащую среду с градиентом плотности. Первая капля имеет решающее значение - добавьте ее очень аккуратно, чтобы избежать дестабилизации плотности градиента средней фазы.
ПРИМЕЧАНИЕ: Это должно быть сделано в соотношении 3:10 (Градиент плотности среда:Клеточная суспензия). Используйте стерильную пипетку Пастера объемом 1 мл для точного и бережного добавления. Убедитесь, что кончик пипетки соприкасается с боковой стороной пробирки, чтобы не нарушить средний слой градиента плотности. Избегайте смешивания образца со средой с градиентом плотности. - Центрифугируйте пробирки при давлении 400 x g в течение 45 мин при 4 °C при выключенном тормозе. Это гарантирует, что слои останутся неповрежденными во время процесса.
ПРИМЕЧАНИЕ: После центрифугирования должны быть видны отчетливые слои. Лейкоциты образуют кольцо на границе между градиентной средой плотности и гранулой клеточного мусора (Рисунок 3).
- Приготовьте раствор среды с градиентом плотности с плотностью 1,077 г/мл, осмолярностью 353 мОсм/кг и pH 7,4 (см. Дополнительный файл 1).
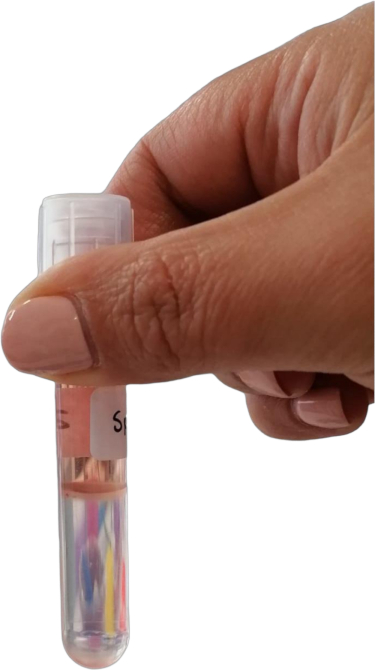
Рисунок 3: Кольцо лейкоцитов на границе между градиентом плотности среды и гранулой клеточного мусора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Соберите лейкоцитарное кольцо.
- С помощью стерильной пипетки Пастера аккуратно аспирируйте лейкоцитарное кольцо (~100 мкл) и перенесите его в микроцентрифужную пробирку объемом 2 мл.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не повредить слои в значительной степени, чтобы избежать загрязнения. Если лейкоцитарное кольцо содержит мусор или темные суспензии, рекомендуется пропустить собранную лейкоцитарную суспензию через новое сетчатое фильтр мини-ячеек (100 мкм) для обеспечения чистоты. Поместите мини-клеточный фильтр над микроцентрифужной пробиркой объемом 2 мл и осторожно пропустите лейкоцитарную суспензию через сетчатый фильтр.
- С помощью стерильной пипетки Пастера аккуратно аспирируйте лейкоцитарное кольцо (~100 мкл) и перенесите его в микроцентрифужную пробирку объемом 2 мл.
- Промойте лейкоцитарное кольцо.
- Добавьте HBSS в микроцентрифужные пробирки, содержащие лейкоцитарное кольцо, пока объем не достигнет 2 мл, и аккуратно ресуспендируйте клетки.
ПРИМЕЧАНИЕ: Храните пробирки в контейнере, наполненном льдом и накрытом алюминиевой фольгой, чтобы поддерживать низкую температуру образца. Следите за тем, чтобы трубки не соприкасались со льдом напрямую. Поддерживайте эту настройку охлаждения на протяжении всего процесса стирки. - Центрифугируйте образцы при 400 × г в течение 10 минут при 4 °C (можно включить тормоз).
- После центрифугирования аккуратно выбросьте надосадочную жидкость, оставив гранулу на дне (которое может быть практически незаметным).
- Повторяйте этапы промывки (добавление HBSS, повторная суспензия, центрифугирование и выброс надосадочной жидкости) до тех пор, пока гранулы не освободятся от загрязнений.
- Добавьте HBSS в микроцентрифужные пробирки, содержащие лейкоцитарное кольцо, пока объем не достигнет 2 мл, и аккуратно ресуспендируйте клетки.
- Ресуспендируйте и отрегулируйте концентрацию клеток.
- Ресуспендируйте клетки в 1 мл HBSS в тех же микроцентрифужных пробирках объемом 2 мл, которые использовались для промывки.
- Достижение концентрации клеток в диапазоне от 1 × 104 до 1 × 106 клеток на мл. Если исходная гранула имеет большие размеры, может потребоваться дополнительное содержание HBSS для разбавления концентрации клеток до желаемого диапазона. Перенесите клеточную суспензию в пробирку объемом 15 мл и добавьте больше HBSS по мере необходимости в зависимости от количества полученных клеток.
ПРИМЕЧАНИЕ: Для облегчения процесса рекомендуется использовать автоматический счетчик ячеек.
4. Окрашивание и фиксация лейкоцитов (рисунок 4)
ПРИМЕЧАНИЕ: Наборы для окрашивания мертвых клеток LIVE/DEAD представляют собой улучшенный метод оценки жизнеспособности клеток в фиксированных клетках с помощью проточной цитометрии. В этих анализах используется флуоресцентный реактивный краситель, который взаимодействует с клеточными аминами. Если клеточные мембраны нарушены, краситель может проникать в клетки, вступая в реакцию со свободными аминами как внутри, так и на поверхности клетки, что приводит к интенсивному флуоресцентному окрашиванию. И наоборот, в жизнеспособных клетках только амины клеточной поверхности доступны для реакции с красителем, что приводит к относительно тусклому окрашиванию. Интенсивность окрашивания сохраняется после фиксации формальдегидом, который также сохраняет образец, предотвращая рост микроорганизмов. Наборы для окрашивания мертвых клеток LIVE/DEAD идентичны, за исключением флуоресцентного красителя - доступны в синем, фиолетовом, голубом, желтом, зеленом, красном, дальнем красном или ближнем инфракрасном (инфракрасном) диапазоне. В этом исследовании мы использовали флуоресцентный реактивный краситель ближнего инфракрасного диапазона. Кроме того, этот одноцветный анализ позволяет параллельно тестировать другие параметры в многоцветном эксперименте.
- Приготовьте краситель.
- Доведите реагенты до комнатной температуры (RT): дайте одному флакону флуоресцентного реактивного красителя и флакону безводного диметилсульфоксида (ДМСО) достичь RT, прежде чем снимать крышки.
- Восстановите краситель: Добавьте 50 мкл ДМСО во флакон, содержащий реактивный краситель. Тщательно перемешайте и убедитесь, что краситель полностью растворился.
- Используйте восстановленный раствор красителя как можно скорее, желательно в течение нескольких часов.
ПРИМЕЧАНИЕ: Каждый набор включает в себя пять отдельных флаконов с реакционноспособным красителем, что обеспечивает достаточный материал для окрашивания не менее 40 образцов клеток. Однако после восстановления раствор ДМСО красителя относительно нестабилен, особенно при воздействии влаги. Любые неиспользованные порции можно хранить до 2 недель при температуре ≤-20 °С, в защищенном от света и влаги месте.
- Запачкайте и зафиксируйте клетки.
ПРИМЕЧАНИЕ: Буферы, подходящие для окрашивания клеток, включают сбалансированный солевой раствор Хэнкса (HBSS), фосфатно-солевой буфер (PBS) и PBS Дульбекко (D-PBS), при условии, что они не содержат посторонних белков, таких как бычий сывороточный альбумин или сыворотка. При использовании аминорически активного красителя следует избегать трис-буферов и растворов с азидом натрия или посторонним белком для ресуспензии и промывки клеток. В этом исследовании мы использовали HBSS из-за его сбалансированного ионного состава, который помогает поддерживать осмотический баланс и обеспечивает необходимые ионы и глюкозу для поддержки клеточного метаболизма и жизнеспособности во время процесса окрашивания. HBSS также не содержит посторонних белков, что предотвращает вмешательство в реактивный краситель и обеспечивает точную оценку жизнеспособности.- После подсчета клеток и регулировки плотности до 1 х 106 клеток на мл с помощью HBSS переведите 1 мл этой клеточной суспензии в микроцентрифужные пробирки объемом 2 мл.
- Каждый день индуцируйте гибель клеток по крайней мере в одном образце, который будет использоваться в качестве контроля для установления порога интенсивности флуоресценции между живыми и мертвыми клетками. Подготовьте образцы в микроцентрифужных пробирках следующим образом:
Трубка 1: Живые клетки - неокрашенные
Трубка 2: Живые клетки - окрашенные
Пробирка 3: Мертвые клетки - неокрашенные
Трубка 4: Мертвые клетки - окрашенные
ПРИМЕЧАНИЕ: Эти четыре пробирки должны быть подготовлены только для одного образца в каждом эксперименте в качестве контрольных. Для остальных образцов необходимы только две пробирки (Пробирка 1: образец - неокрашенный и Пробирка 2: образец - окрашенный), так как она предоставит информацию о клетках, которые были живыми, и тех, которые были мертвыми.
- Каждый день индуцируйте гибель клеток по крайней мере в одном образце, который будет использоваться в качестве контроля для установления порога интенсивности флуоресценции между живыми и мертвыми клетками. Подготовьте образцы в микроцентрифужных пробирках следующим образом:
- Положительный контроль гибели клеток: поместите меченую пробирку «Мертвая неокрашенная» (пробирка 3) и «Мертво окрашенная» (пробирка 4) в водяную баню при температуре 50 °C на 7 минут, чтобы вызвать гибель клеток путем термической обработки.
- Окрашивание клеток: Добавьте 1 мкл восстановленного флуоресцентного реактивного красителя (из шага 4.1.2) в 1 мл клеточной суспензии в пробирках 2 и 4 (пробирки, которые будут окрашены) и хорошо перемешайте.
- Инкубировать при RT в течение 30 мин в защищенном от света месте.
ПРИМЕЧАНИЕ: Если фиксация не требуется, то вы можете пропустить шаги 4.2.5-4.2.7 ниже. Вместо этого дважды промойте клетки 1 мл HBSS с 1% бычьим сывороточным альбумином (см. Дополнительный файл 1) и повторно суспендируйте в 1 мл HBSS с 1% бычьим сывороточным альбумином. Выполнить анализ на проточном цитометре как можно быстрее; В противном случае жизнеспособность клеток может быть нарушена, так как клетки не фиксируются. - Дважды промойте клетки 1 мл HBSS и повторно суспендируйте клетки в 900 мкл HBSS.
- Добавьте 100 мкл 37% формальдегида (ВНИМАНИЕ, см. дополнительную таблицу 2).
- Инкубировать в течение 15 минут при RT.
- Дважды промойте 1 мл HBSS с 1% бычьим сывороточным альбумином (BSA), затем повторно суспендируйте клетки в 1 мл HBSS с 1% BSA.
- Храните образцы в холодильнике при температуре 4 °C. Анализируйте клетки в течение 1 месяца после фиксации.
- Анализ суспензии фиксированных клеток методом проточной цитометрии с использованием соответствующего канала возбуждения и детектирования.
ПРИМЕЧАНИЕ: Правильные каналы возбуждения и детектирования могут различаться в зависимости от используемого прибора (см. Дополнительную таблицу 3).
- После подсчета клеток и регулировки плотности до 1 х 106 клеток на мл с помощью HBSS переведите 1 мл этой клеточной суспензии в микроцентрифужные пробирки объемом 2 мл.
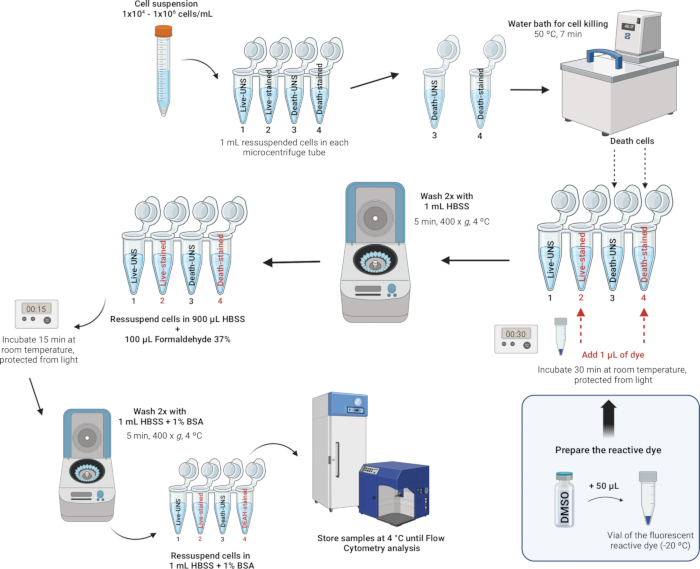
Рисунок 4: Иллюстративное описание окрашивания и фиксации лейкоцитов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Проточная цитометрия
- Получение данных.
ПРИМЕЧАНИЕ: Процедуры, которые необходимо выполнять на проточном цитометре, могут варьироваться в зависимости от конкретного используемого цитометра. В этом исследовании данные были получены с помощью проточного цитометра Attune NTx.- Запустите примеры.
- Поместите пробирку с образцом в отверстие для образца.
- Начните сбор данных, нажав кнопку «Старт», а затем нажмите кнопку «Запись», как только частота событий (событий в секунду) стабилизируется.
- Запишите не менее 10 000 событий для каждого образца в синглетный вентиль для надежного анализа.
- Сохраняйте все данные по каждому образцу и создавайте резервные копии на внешних дисках или в облачном хранилище.
- Проанализируйте данные.
ПРИМЕЧАНИЕ: Для анализа проточной цитометрии доступно несколько вариантов программного обеспечения. В данном исследовании анализ данных проводился с помощью FlowJo v10.8.119.- Загрузка файлов данных: Запустите программное обеспечение для анализа проточной цитометрии и загрузите файлы .fcs, полученные в ходе эксперимента.
- Визуализируйте данные (рис. 5A): Постройте график прямого рассеяния (FSC-A) (XX) в зависимости от бокового рассеяния (SSC-A) (YY) для оценки размера и гранулярности ячейки.
ПРИМЕЧАНИЕ: Этот график обычно используется для идентификации клеточных популяций и исключения мусора на основе их рассеивающих свойств. - Гейтинг синглетных ячеек и исключение мультиплетов (рис. 5B): Используйте график зависимости области прямого рассеяния (FSC-A) от высоты прямого рассеяния (FSC-H) для исключения кратных клеток. Нарисуйте вентиль, чтобы включить все события, выровненные на графике (отдельные ячейки), и исключить невыровненные (кратные). Если в выборке есть события с очень низким FSC, исключите их, не включив их в вентиль одиночной ячейки, оставив только синглетные клетки.
- Идентификация популяций лейкоцитов (Рисунок 5C): Различайте 3 популяции лейкоцитов на основе профиля FSC-A/SSC-A:FSC-A высокий/SSC-Aвысокий - гранулоциты,среда FSC-A/среда SSC-A - моноциты, а FSC-Aнизкий/SSC-Aнизкий - лимфоциты.
- Гейтирование жизнеспособности (Рисунок 5D): Установите порог окрашивания жизнеспособности красителем на соответствующем флуоресцентном канале (NIR, RL3-A). Живые и мертвые клетки определяются на основе интенсивности окрашивания с помощью LIVE/DEAD Fixable Dead Dead Dead Dead Stain: тускло окрашенные клетки определяются как живые клетки, а сильно окрашенные клетки определяются как мертвые клетки.
- Статистика популяции: Посмотрите на статистику, предоставленную программным обеспечением, включая общее количество событий (ячеек) в каждом затворе и процентное соотношение общего количества и закрытых ячеек.
- Экспорт данных: Экспортируйте данные в электронную таблицу и используйте соответствующее статистическое программное обеспечение (GraphPad Prism или R) для дальнейшего статистического анализа.
ПРИМЕЧАНИЕ: Выбор методов анализа будет зависеть от целей исследования.
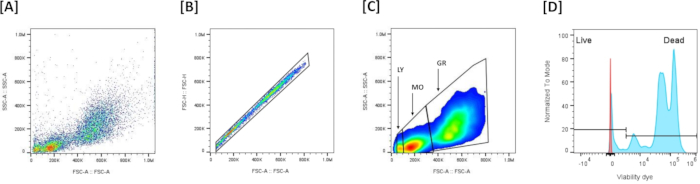
Рисунок 5: Стратегия гейтирования проточной цитометрии для оценки жизнеспособности клеток головки почек: (A) Представляет профиль FSC-A/SSC-A всех собранных событий. (B) Представляет собой исключение мультиплетов на основе определения области синглетов на основе линейности на графике прямого рассеяния (FSC-A)/прямого рассеяния (FSC-H). (C) Представляет 3 основные популяции, которые были определены на основе FSC-A/SSC-A после исключения мультиплетов. (D) Представляет собой гистограмму, показывающую окрашивание красителя для живых/мертвых жизнеспособных веществ. Для установления порога, позволяющего различать живые и мертвые клетки, лейкоциты подвергали легкому тепловому шоку (50 °С, 7 мин), а затем окрашивали красителем жизнеспособности. Положительные клетки с высокой интенсивностью окрашивания (++) являются мертвыми клетками, а положительные клетки с низкой интенсивностью окрашивания (+-) являются живыми клетками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Access restricted. Please log in or start a trial to view this content.
Результаты
На рисунке 6 представлены репрезентативные данные проточной цитометрии, показывающие популяции лейкоцитов, выделенных из головной почки молоди золотистого морского леща (Sparus aurata), и их клеточную жизнеспособность с использовани...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Метод, разработанный в этом исследовании, представляет собой значительный шаг вперед в исследованиях в области иммунологии рыб и обещает улучшить понимание иммунных реакций рыб и устойчивости морских ресурсов. S. aurata является ценным видом морских рыб семейства S...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии финансовых, личных или профессиональных конфликтов интересов, которые могли бы повлиять на исследование, анализ, интерпретацию данных, написание или решение о подаче рукописи для публикации.
Благодарности
Эта работа была поддержана Fundação Portuguesa para a Ciência e Tecnologia (FCT I.P.) в рамках проекта Aqua-CLIMADAPT (PTDC/CTA-AMB/0592/2021, https://doi.org/10.54499/PTDC/CTA-AMB/0592/2021). Мы выражаем признательность Биолаборатории, поддерживаемой Подразделением прикладных молекулярных биологических наук (UCIBIO) и Ассоциированной лабораторией исследований в области зеленой химии – LAQV, которые финансируются за счет национальных средств FCT/MCTES (UIDB/04378/2020 и UIDB/50006/2020 соответственно), а также Ассоциированным лабораторным институтом здоровья и биоэкономики – i4HB (LA/P/0140/2020). Эта работа также была поддержана Европейской комиссией в рамках проекта GLYCOTwinning (Соглашение о гранте No 101079417) и FCT через InnoGlyco (2022.04607.PTDC). Иса Мармело также благодарит FCT I.P. за грант PhD (2020.04413.BD, https://doi.org/10.54499/2020.04413.BD).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
Ссылки
- Samaï, H. C., et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93(2023).
- Lulijwa, R., et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A., et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498(2022).
- Titus, J., et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142(2024).
- Marmelo, I., et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135(2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955(2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change. Biol Lett. 20 (2), 20230346(2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398(2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á, Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R., et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. , American Veterinary Medical Association. Schaumburg, IL. (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). , At https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software (2023).
- Mhalhel, K., et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008(2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739(2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á, Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á, Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M. -A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены