Method Article
בידוד, קיבוע ואפיון של לויקוציטים של ראש דניס צעיר על ידי ציטומטריית זרימה
In This Article
Summary
כתב יד זה מתאר את הבידוד והקיבוע של לויקוציטים המופקים מכליות הראש של דניס הזהב ואת הערכת כדאיותם על ידי זרימה ציטומטרית. עבודה זו תורמת לסטנדרטיזציה של פרוטוקולים וממנפת עיבוד של מספר גבוה יותר של דגימות מבלי לפגוע באיכות הדגימה, ומקדמת התקדמות בידע על אימונולוגיה של דגים.
Abstract
חסינות חיונית לוויסות הפיזיולוגי של אורגניזמים, ומשמשת כהגנה העיקרית מפני פתוגנים וגורמי לחץ סביבתיים. הבידוד והניתוח של תאי מערכת החיסון מספקים תובנות מפתח לגבי התגובות החיסוניות ללחצים חיצוניים. עם זאת, היעדר פרוטוקולים הרמוניים עבור מינים פחות נחקרים, כגון דגים ימיים, מוביל לעתים קרובות לאתגרים טכניים ואנליטיים המעכבים את פירוש הנתונים והבנה מעמיקה של תגובות חיסוניות ספציפיות למין. מחקר זה נועד להקים הליך אנליטי מבוסס ציטומטריית זרימה אופטימלית כדי לאפיין ולקבוע את הכדאיות של לויקוציטים מכליות הראש (האיבר ההמטופויאטי העיקרי בדגי טלאוסט) של דניס זהוב צעיר (Sparus aurata). ההליך החל בבידוד לויקוציטים בתהליך הומוגניזציה באמצעות תמיסת המלח המאוזנת של הנקס, ואחריו שיטת צנטריפוגה אופטימלית של שיפוע צפיפות פרקול כדי להבטיח שיעורי התאוששות גבוהים של לויקוציטים עם זיהום אריתרוציטים מינימלי הנדרש לניתוח יעיל של ציטומטריית זרימה לאחר מכן. בנוסף, נעשה שימוש בטכניקה חדשה המשתמשת בצבע תגובתי לתאים (LIVE/DEAD Fixable Dead Cell Stain Kit) כדי להבחין בין תאים ברי קיימא לתאים מתים על סמך דפוסי הצביעה הפלואורסצנטיים שלהם. קיבוע הושג עם פורמלדהיד 3.7%, תוך שמירה על מורפולוגיה של התא, כדאיות ויעילות הצביעה. ניתוח ציטומטריית זרימה זיהה בהצלחה שלוש אוכלוסיות לויקוציטים דומיננטיות: לימפוציטים, מונוציטים וגרנולוציטים. שיטה זו אפשרה לא רק בדיקות כדאיות אלא גם התמיינות מדויקת של סוגי תאים. השיפור בפרוטוקולי ציטומטריית הזרימה מייצג צעד קדימה באימונולוגיה של דגים על ידי הגדלת הדיוק והיעילות של ניתוח תאי חיסון. יתר על כן, על ידי מתן אפשרות לקיבוע תאים לניתוח מאוחר יותר, פרוטוקול זה מפחית משמעותית את הזמן והמאמץ הנדרשים להערכות חיסוניות, מה שהופך אותו לכלי רב ערך הן למחקר והן ליישומים מעשיים בתחומי מחקר שונים.
Introduction
חסינות ממלאת תפקיד מרכזי בוויסות הפיזיולוגי של אורגניזמים, ופועלת כהגנה ראשונית מפני מגוון רחב של פתוגנים וגורמי לחץ סביבתיים1. כמו בעלי חוליות אחרים, לדגים יש מערכת חיסון מורכבת, דינמית ומתואמת החיונית לבריאותם הכללית ולרווחתם1.
לדגי טלאוסט יש מערכת חיסון מולדת ונרכשת, המתפקדות בו זמנית כדי לזהות, להגיב ולנטרל פולשים מזיקים2. מערכת החיסון המולדת פועלת כקו ההגנה הראשון, ומספקת תגובות מיידיות ולא ספציפיות לפתוגנים2, בעוד שמערכת החיסון הנרכשת מתפתחת עם הזמן, ומציעה תגובה מיוחדת יותר המאפשרת לדגים לזהות פתוגנים ספציפיים ולבסס זיכרון חיסוני3. מערכת החיסון של הדגים מסתמכת על איברי לימפה ראשוניים מיוחדים (כלומר, בלוטת התימוס וכליות הראש) ואיברי לימפה משניים (למשל, רקמות לימפה הקשורות לטחול ולרירית (MALT)) כדי לתמוך בהגנה החיסונית ולשמור על הבריאות הכללית4. כליית הראש היא האיבר ההמטופויאטי העיקרי בדגי טלאוסט וממלאת תפקיד מכריע בהתפתחות ובהתבגרות של תאי חיסון, כולל לויקוציטים5.
בשנים האחרונות חלה התקדמות משמעותית בחקר התגובות החיסוניות של מספר מיני דגים2. אחד התחומים המרכזיים שבהם התמקדנו היה הבנת אוכלוסיות הלויקוציטים ופעילותן. לויקוציטים, הידועים גם כתאי דם לבנים, מסווגים בדרך כלל למונוציטים, לימפוציטים וגרנולוציטים וממלאים תפקיד מכריע בהגנה החיסונית של דגים. יש להם תאים פגוציטים, האחראים על בליעה והשמדה של פתוגנים ומשחררים מיני חמצן תגובתי קוטלי חיידקים, התורמים לחיסול מיקרואורגניזמים פולשים6. לויקוציטים מעורבים גם בתהליך הדלקתי, ועוזרים לבודד ולמגר זיהומים תוך קידום תיקון רקמות6. השפע והפעילות של אוכלוסיות הלויקוציטים הם אינדיקטורים חשובים למצב החיסוני בבריאות בעלי חיים ומחלות 7,8.
כמה מחקרים הראו שגורמי לחץ, כגון תנאים סביבתיים שליליים, יכולים לשנות את המספר והמורפולוגיה של אריתרוציטים ואת הרכב הלויקוציטים במחזור 9,10. לדוגמה, כפי שנסקר על ידי Franke et al. (2024), חיוני לחקור את המערכת החיסונית של דגים בתרחישי שינויי אקלים, שכן גורמי לחץ סביבתיים יכולים לפגוע בחסינות הדגים, להגביר את הרגישות למחלות ולשפר את ההדבקה של פתוגנים מסוימים, ובסופו של דבר להאיץ את התקדמות המחלה11. יתרה מכך, הבנת חסינות הדגים חיונית לא רק לקידום מחקר ביולוגי בסיסי אלא גם לתמיכה במגזרים שונים בחברה, כגון תעשיית החקלאות הימית. ככל שהחקלאות הימית ממשיכה להתרחב ברחבי העולם, הבטחת בריאותם ורווחתם של מיני דגים מעובדים הופכת חשובה יותר ויותר. עם זאת, רווחת הדגים נותרה תחום מחקר חדש יחסית, והתגובות החיסוניות של דגים מעובדים עדיין דורשות הערכות יסודיות וסטנדרטיות. יש חשיבות עליונה למתן עדיפות למחקרי תגובה חיסונית, שכן המידע שנרכש יכול לשפר את הקיימות והפרודוקטיביות של החקלאות הימית באמצעות גישות יעילות ומותאמות המשפרות את הרווחה והחוסן של חיות משק.
כימות וזיהוי לויקוציטים מבוצעים בדרך כלל בשיטות המטולוגיות, כגון ספירה ידנית עם Bürker, Neubauer או Thoma, כמו גם מריחות דם מוכתמות 7,10. כדי לסייע בהדמיה ובהתמיינות של תאי דם, ערכות צביעה, כגון רייט, מאי-גרינוולד-גימסה והמקולור, משמשות לעתים קרובות 7,12. עם זאת, טכניקות ספירת תאים ידניות אלו מייגעות, גוזלות זמן ונוטות לטעויות אנוש 8,10. מקורות שגיאות נפוצים כוללים ערבוב או דילול לא מספקים של הדם, בעיות צביעה וטעינה לא נכונה של תא ההמוציטומטר, כל אלה עלולים להוביל לספירת תאים לא מדויקת12. יתר על כן, ניתוח המטולוגי ידני דורש רמה גבוהה של מומחיות וניסיון כדי להבטיח את האמינות והשחזור של התוצאות7. ככל שהביקוש לכלי אבחון מדויקים ויעילים גובר, פיתוח שיטות חדשניות המספקות הבנה מעמיקה של המצב החיסוני של אוכלוסיות הדגים הופך לצעד חשוב יותר ויותר בקידום תחום זה.
ציטומטריית זרימה התגלתה ככלי רב עוצמה בהקשר זה, המציעה גישה כמותית בעלת תפוקה גבוהה לניתוח אוכלוסיות לויקוציטים וכדאיות תאים8. טכנולוגיית אבחון מודרנית זו מאפשרת זיהוי, ספירה ואפיון מהירים של תאים בודדים באוכלוסיות מעורבות בדיוק יוצא דופן13. יתר על כן, זרימה ציטומטרית מאפשרת מדידות רב-פרמטריות בו זמנית לאפיון פנוטיפי ופונקציונלי כאחד. למרות שנעשה בו שימוש נרחב במסגרות קליניות אנושיות וברפואה וטרינרית, יישומו בחקר לויקוציטים של דגים נותר מוגבל מאוד8. בעוד שכמה מחקרים נערכו על מיני דגים שונים 1,6,8,13,14,15,16,17, עדיין יש לטפל במספר אתגרים קריטיים. אתגר מרכזי אחד בניתוחים אלה הוא הצורך להשיג תרחיפים של לויקוציטים חיים המופקים מדם היקפי או רקמות לימפואידיות, כגון כליית הראש1. בידוד של לויקוציטים הוא לרוב קשה בגלל מאפיין ייחודי של דגי טלאוסט: נוכחותם של אריתרוציטים גרעיניים. הזיהום הלא מכוון באריתרוציטים יכול להפריע לניתוח לויקוציטים בשל גודלם, צורתם הביצית ונוכחותו של גרעין1. לכן, חובה לסלק אריתרוציטים ממתלי לויקוציטים כדי להשיג טוהר לויקוציטים גבוה ולחקור את המאפיינים הפנוטיפיים והתפקודיים של לויקוציטים על ידי ניתוח ציטומטריית זרימה. ביונקים, בידוד לויקוציטים כולל בדרך כלל ליזה אוסמוטית של אריתרוציטים או הפרדת שיפוע צפיפות עם פיקול או פרקול1. עם זאת, ליזה אוסמוטית אינה יעילה הן עבור דגי ים והן עבור דגי מים מתוקים בשל אריתרוציטים גרעיניים שלהם, שלא ניתן ליז כראוי1. במקום זאת, הפרדת שיפוע צפיפות עדיפה לדגים מכיוון שהיא שומרת ביעילות על יציבות התא לאורך זמן1. למרות שכמה מחקרים בודדו בהצלחה לויקוציטים מדגים צעירים, מחקרים רבים עדיין מתמקדים בעיקר באוכלוסיות בוגרות17. עם זאת, שלבי החיים המוקדמים לא רק פגיעים יותר להתפרצויות מחלות, אלא גם קטנים יותר בגודלם, מה שהופך את תהליך הדגימה למורכב ומאתגר יותר. מגבלה נוספת היא שהשיטות הנוכחיות מוגבלות לרוב למספר מוגבל של דגימות או שכפולים בכל פעם, שכן הערכת כדאיות הלויקוציטים דורשת עיבוד מיידי. עיכובים בעיבוד הדגימה עלולים להשפיע לרעה על כדאיות התא, ובכך להכניס סיבוכים נוספים לתהליך הדגימה ולסכן את העבודה כולה.
למיטב ידיעתנו, אף אחת מהשיטות שפורסמו לא הצליחה לתקן תאי לויקוציטים לניתוח כדאיות לאחר מכן על ידי ציטומטריית זרימה. המחקר הנוכחי הוא חלוצי, שכן הוא מבסס שיטה יעילה לבידוד לויקוציטים מכליות הראש של דניס זהוב צעיר (Sparus aurata), מיני הדגים העיקריים המגודלים במדינות דרום אירופה, תוך שימוש במתודולוגיית הפרדת שיפוע צפיפות פרקול. אנו מציגים גם טכניקה משופרת מבוססת צביעה המבחינה בין תאים חיים לתאים מתים תוך זיהוי אוכלוסיות הלויקוציטים העיקריות (לימפוציטים, מונוציטים וגרנולוציטים) באמצעות ציטומטריית זרימה. הפרוטוקול המשופר כרוך בקיבוע תאים, המאפשר ניתוח תאים בר-קיימא עד חודש לאחר ההליך. ליישום פרוטוקול ציטומטריית זרימה זה יש פוטנציאל להפחית משמעותית את הזמן והמאמץ הנדרשים בדרך כלל להערכות חיסוניות, מה שהופך אותו לטכניקה בעלת ערך הן למחקר והן ליישומים מעשיים יותר במגזר החקלאות הימית. יישום מתודולוגיה זו מספק יתרונות לניתוח מספר רב של דגימות, שימור התאים ומתן אפשרות לניתוח מושהה על ידי ציטומטריית זרימה. לכן, זה עשוי להיות מועיל מאוד לייצר תובנות חשובות לגבי מנגנוני חיסון של דגים וכיצד כדאיות התאים מושפעת מתנאים סביבתיים או ניסויים שונים. יתר על כן, ניתן לשלב בדיקת כדאיות זו עם אפיון פנוטיפי ותפקודי רב-פרמטרי של אוכלוסיות תאי חיסון ספציפיות. גישה זו מאפשרת ניתוח מקיף יותר של מספר פרמטרים אימונולוגיים, מקשרת אותם ישירות לסוגי התאים המתאימים ומספקת הבנה ברורה יותר של התגובות החיסוניות. ממצאים אלה יכולים לתרום לפיתוח אסטרטגיות יעילות יותר, כולל גישות משופרות לניהול מחלות בחקלאות ימית.
Protocol
פרוטוקול זה חייב להתבצע על ידי חוקרים מוסמכים בניסויים בבעלי חיים (פונקציות האיחוד האירופי A ו-B). כל ההליכים הקשורים לטיפול בבעלי חיים ואיסוף דגימות חייבים לעמוד בהנחיות ARRIVE (מחקר בבעלי חיים: דיווח על ניסויים in vivo ) ולעמוד בסטנדרטים אתיים לטיפול ושימוש בבעלי חיים בהתאם להמלצות הפדרציה האירופית של איגודי מדעי חיות המעבדה האירופיים (FELASA). המחקר הנוכחי עקב אחר כל הסטנדרטים הללו כמו גם החקיקה הפורטוגזית למדעי חיות מעבדה (EU Directive 2010/63; צו חוק מס' 113/2013). המחקר אושר על ידי הגוף לרווחת בעלי חיים ואתיקה של IPMA (ORBEA, LABVIVOS-002-AquaClimAdapt), בפיקוח הרשות הלאומית לשימוש בבעלי חיים חיים, הידועה בשם המנהל הכללי למזון ווטרינריה (DGAV), תחת האישור האתי מספר 20596/25-S.
1. לחקור מודל ותחזוקת אורגניזמים
הערה: מחקר זה תוכנן במיוחד עבור דניס זהוב צעיר (Sparus aurata), עם משקל ממוצע של 30.0 ±-5.0 גרם ואורך כולל של 12.0 ±-2.0 ס"מ. ייתכן ששיטה זו לא תחול ישירות על מיני דגים אחרים, שכן למינים שונים יש מאפיינים פיזיולוגיים ואימונולוגיים ייחודיים שעשויים להשפיע על בידוד הלויקוציטים, קיבוע התאים והערכת הכדאיות. ייתכן שיידרשו התאמות לפרוטוקול עבור מינים אחרים, ומומלץ לבצע מחקרים ראשוניים כדי לייעל את התנאים עבור כל מין מטרה.
- התאקלמות הדגים (תקופת הסגר)
- חלקו את הדגים באופן שווה במיכלים בעלי קיבולת גדולה (למשל, שני מכלים עם קיבולת כוללת של 660 ליטר כל אחד - ראו איור משלים 1).
הערה: המיכלים לשימוש עשויים להיות חלק ממערכת חקלאות ימית מחזורית (RAS), המאפשרת שימוש יעיל במים ושליטה משופרת על איכות המים. ב-RAS, המים ממוחזרים ומטופלים באופן רציף בתוך המערכת, ומספקים סביבה יציבה ומבוקרת לדגים. מערך זה מסייע בשמירה על תנאים אופטימליים לבריאות וגדילת הדגים, הבטחת פיזור אחיד ומזעור הלחץ במהלך המחקר. - שמור על תנאים אביוטיים אופטימליים.
- החזיקו את הדגים בהסגר למשך 3 שבועות בתנאים המדמים את בית הגידול הטבעי שלהם:
טמפרטורה: 20.0 ± 0.5 מעלות צלזיוס;
חמצן מומס: 7.2 ± 0.2 מ"ג/ליטר;
מליחות: 35.0 ± 0.5 ‰;
pH: 8.0 ± 0.1 יחידות;
תקופת צילום: 14 שעות אור / 10 שעות חושך.
הערה: תנאי התחזוקה האידיאליים עשויים להשתנות בין מיני דגים שונים. למינים אחרים עשויות להיות דרישות שונות, ולכן חשוב להתאים את התנאים האלה לצרכים הספציפיים של מיני היעד כדי להבטיח את בריאותם ורווחתם של האורגניזמים. בנוסף, טמפרטורת מי הים ותקופת האור יכולים להשתנות עם עונות השנה, ולכן יש לקחת בחשבון שינויים עונתיים בעת שכפול התנאים הטבעיים במעבדה.
- החזיקו את הדגים בהסגר למשך 3 שבועות בתנאים המדמים את בית הגידול הטבעי שלהם:
- חלקו את הדגים באופן שווה במיכלים בעלי קיבולת גדולה (למשל, שני מכלים עם קיבולת כוללת של 660 ליטר כל אחד - ראו איור משלים 1).
- ליזום את המחקר הניסיוני.
- הגדר את מספר המיכלים והדגים הנדרשים על סמך תכנון מערך הניסוי של כל מקרה מבחן.
- לאחר תקופת ההסגר, העבירו את הדגים ל-RAS עצמאי (ראו איור משלים 2).
- ציידו כל מערכת ברחפני חלבון כדי להסיר תרכובות אורגניות מוגזמות מהמים; סינון פיזי (שקית סינון [400 מיקרומטר], ספוג פילטר וצמר זכוכית); סינון ביולוגי (כדורי ביו [1.5 אינץ'], מעקר מים אולטרה סגול ואבני אוויר שקועות); מערכות קירור אוטומטיות למי ים ותנורי חימום דיגיטליים שקועים, שניהם מחוברים למערכת בקרה ממוחשבת (ProfiLux) עם חיישני טמפרטורה להתאמת הטמפרטורה בכל מיכל; אבני אוויר שקועות בכל מיכל כדי לשלוט בחמצן מומס.
- התאקלמו את הדגים במשך שבועיים במערכות החדשות לפני שתמשיכו בניסוי.
- בצע תחזוקה יומיומית
- הסר צואת דגים מכל מיכל דגירה ובצע חידוש של 25% מי ים.
- מדוד טמפרטורה באמצעות מדחום דיוק נייד.
- עקוב אחר פרמטרים אביוטיים אחרים של מי ים (מליחות, חמצן מומס ו-pH) באמצעות מכשיר מדידה רב-פרמטרים.
- התאם פרמטרים אביוטיים של מי ים לפי הצורך כדי להבטיח יציבות לאורך כל הניסוי.
הערה: התנאים האביוטיים במערכות הניסוי יכולים להשתנות בהתאם לדרישות הספציפיות של כל מקרה מקרה. לדוגמה, אם המחקר נועד לדמות שינויים עונתיים או גלי חום ימיים, יש להתאים את הטמפרטורה ותקופת האור בהתאם כדי לחקות שינויים עונתיים טבעיים. באופן דומה, אם המחקר מתמקד בהדמיית תנאים היפוקסיים או החמצת האוקיינוס, יש לבצע התאמות לרמות החמצן ול-pH של מי הים. זה מבטיח שתנאי הניסוי מציאותיים ורלוונטיים ככל האפשר, ומשפר את התוקף והישימות של ממצאי המחקר. - להעריך את בריאותם ורווחתם של הדגים, לזהות ולנהל סימני לחץ או מחלה כמתואר בשלבים 1.2.4.6-1.2.4.8.
- חפש התנהגויות חריגות כגון שחייה לא יציבה, אובדן תיאבון, עייפות, תוקפנות או בידוד.
- יש לבדוק אם יש סימני מחלה, כולל נגעים, כיבים, שינוי צבע, סנפירים מהודקים, ליחה מוגזמת או תנועת זימים מהירה.
- רשום את כל התצפיות, תוך ציון התאריך והפעולות שננקטו.
- ערכו בדיקות איכות מים שבועיות.
- מדוד את רמות האמוניה (NH3/NH4), ניטריט (NO2-) וניטראט (NO3-) באמצעות בדיקות קולורימטריות.
הערה: ודא שכל הפרמטרים הללו נמצאים מתחת לרמות הניתנות לזיהוי. אם הרמות חורגות מהמגבלות, בצע החלפת מים נוספת, הגדל את האוורור או התאם את הסינון.
- מדוד את רמות האמוניה (NH3/NH4), ניטריט (NO2-) וניטראט (NO3-) באמצעות בדיקות קולורימטריות.
- האכילו ועקבו אחר תזונת הדגים.
- לספק תזונה איכותית העונה על הדרישות התזונתיות הספציפיות של דגים צעירים (ראה טבלה משלימה 1 לדוגמא להרכב המפורט של התזונה).
הערה: ודא שגודל כדורי ההזנה (2-3 מ"מ) מתאים לצעירים, מה שמקל על הבליעה והעיכול. - התאם את כמות ההזנה כך שתתאים ל-2% ממשקל הגוף הממוצע של הדג ליום.
- האכילו את הדגים באופן ידני פעמיים ביום - פעם בבוקר ופעם אחר הצהריים (קבעו זמן ספציפי לשמירה על שגרת האכלה יציבה).
- לספק תזונה איכותית העונה על הדרישות התזונתיות הספציפיות של דגים צעירים (ראה טבלה משלימה 1 לדוגמא להרכב המפורט של התזונה).
2. דגימת דגים, המתת חסד, דיסקציה ואיסוף כליות ראש
- טעמו את הדגים מהמיכלים.
- בחר דגים באופן אקראי מהמכלים כדי למנוע הטיית דגימה.
- השתמש ברשת כדי להעביר בעדינות את הדגים למיכל אחיזה זמני מלא במי מיכל.
הערה: צמצם את זמן הטיפול כדי להפחית מתח.
- הכן את תמיסת המתת החסד.
- השתמש במיכל מתאים (למשל, דלי של 3 ליטר) המתאים להחזקת הדג.
- יש להמיס את הכמות המתאימה של טריקאין (MS-222) במי ים כדי להגיע לריכוז סופי של 200-300 מ"ג/ליטר18 (זהירות ראה טבלה משלימה 2 וקובץ משלים 1).
- חוצץ את התמיסה עם נתרן ביקרבונט ל-pH של 7.2-7.5.
- נהל את פתרון המתת החסד.
- מניחים את הדג בתמיסת המתת החסד למשך 10 דקות לפחות או עד שנצפים הפסקת התנועה האופרקולרית ואובדן רפלקסים (אשר המתת חסד על ידי בדיקת חוסר תגובה לגירויים חיצוניים).
- רשום את משקל גופו של הדג (גרם) ואת אורכו הכולל (ס"מ).
- בצע דיסקציה של דגים.
הערה: כדי להבטיח איכות דגימה אופטימלית וכדאיות תאים, יש להשלים את תהליך הדיסקציה במהירות האפשרית, באופן אידיאלי תוך 5 דקות לאחר המתת חסד.- ודא שטמפרטורת המעבדה נשמרת על 19 מעלות צלזיוס באמצעות מיזוג אוויר כדי למזער תנודות במהלך הדגימה והעיבוד.
- עקר את כלי החיתוך (רצוי מכשירי מתכת חיטוי במידת האפשר) והגדר סביבת עבודה נקייה עם 70% אתנול (זהירות, ראה טבלה משלימה 2).
- הניחו את הדג המומת על צדו על מגש דיסקציה סטרילי כשהראש פונה לכיוון היד הלא דומיננטית.
- בעזרת אזמל, בצע חתך זהיר לאורך קו האמצע הגחוני של הדג מהאוורור (פי הטבעת) כלפי מעלה לכיוון הזימים.
הערה: היזהר לא לחתוך עמוק מדי כדי למנוע פגיעה באיברים פנימיים. - השתמש בזהירות במספריים לדיסקציה כדי להאריך את החתך ולחשוף את האיברים הפנימיים. הרם בעדינות את דשי דופן הגוף כדי לספק תצוגה ברורה של האנטומיה הפנימית.
- אתר את כליית הראש: כליית הראש ממוקמת ממש מאחורי הזימים, ליד האזור הגבי הקדמי של חלל הגוף, ומשתרעת לאורך הצד העליון של חלל הגוף, מתחת לעמוד החוליות.
הערה: כליית הראש בדרך כלל בצבע כהה יותר בהשוואה לרקמות שמסביב (איור 1). - נקה בזהירות את כל הרקמות שמסביב, כגון שומן ורקמת חיבור, כדי לדמיין טוב יותר את כליית הראש.
הערה: שלב זה דורש טיפול עדין כדי למנוע נזק לראש, הכליה. - בעזרת מלקחיים ומספריים עדינים הרם בזהירות את כליית הראש ובצע חתכים מדויקים סביבה כדי לשחרר אותה מהרקמות שמסביב.
הערה: טפל ברקמה בעדינות כדי למנוע נזק. בדג במשקל של כ-30 גרם, כליית הראש צפויה לשקול בסביבות 20-30 מ"ג. - הנח מיד את האיבר שנכרת במסננת תאים (רשת ניילון 100 מיקרומטר) בתוך צלחת פטרי סטרילית כדי להבטיח סטריליות ולהקל על שלבי העיבוד הבאים.
הערה: מנקודה זו ואילך, יש לבצע את כל השלבים במהירות האפשרית (תוך 5 דקות) כדי לשמור על כדאיות התא. כדי לשמור על הדגימה קרירה, בצע את השלבים הבאים כשצלחת הפטרי מונחת על מיכל מלא בקרח ומכוסה בנייר אלומיניום.

איור 1: מיקום כליית הראש: (A) איור המתאר את המיקום הטיפוסי של כליית הראש מאחורי הזימים ולאורך האזור הגבי הקדמי של חלל הגוף; (B) תמונה מייצגת של כליית הראש בדניס, המדגישה את צבעה הכהה יותר בהשוואה לרקמות שמסביב. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
3. בידוד לויקוציטים של כליות ראש (איור 2)
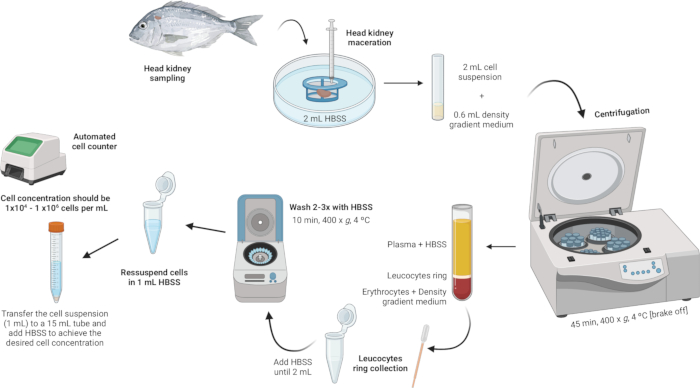
איור 2: תיאור המחשה של בידוד לויקוציטים מהכליה הראשית. הפרוטוקול כולל מספר שלבים: החל מהומוגניזציה של הרקמה, ואחריו צנטריפוגה בשיפוע צפיפות, איסוף טבעת הלויקוציטים, שטיפת טבעת הלויקוציטים וכלה בהשעיה מחדש והתאמת ריכוז התאים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- הומוגניזציה של הרקמה.
- מניחים 2 מ"ל של תמיסת המלח המאוזנת של הנקס (HBSS) בצלחת פטרי סטרילית.
- ודא שהרשת של מסננת התאים (רשת ניילון 100 מיקרומטר) נמצאת במגע עם ה-HBSS אך לא שקועה במלואה.
- השרו את כליית הראש על מסננת התאים באמצעות בוכנה של מזרק. הפעל לחץ עדין כדי לאלץ את שברי האיברים דרך רשת הניילון, וליצור תרחיף תאים.
הערה: אם מעבדים מספר דגימות, ניתן לאחסן את צלחת הפטרי המכילה את תרחיף התאים במקרר בטמפרטורה של 4 מעלות צלזיוס למשך מספר דקות עד לשלב הבא. תרחיף תאים זה ישמש לבידוד לויקוציטים.
- בצע צנטריפוגה של שיפוע צפיפות.
- הכן תמיסה בינונית בשיפוע צפיפות עם צפיפות של 1.077 גרם/מ"ל, אוסמולריות של 353 mOsm/kg ו-pH של 7.4 (ראה קובץ משלים 1).
הערה: האוסמולריות עשויה להשתנות בין מיני דגים שונים, ולכן חיוני להתאים את האוסמולריות של תמיסת המדיום של שיפוע הצפיפות כדי לעמוד בדרישות הספציפיות של כל מין. - בצינורות תחתונים עגולים מפוליסטירן בנפח 5 מ"ל, הוסף בזהירות 600 מיקרוליטר מתמיסת המדיום של שיפוע הצפיפות.
- קח את תרחיף התאים (2 מ"ל) והוסף אותו לאט לצינור המכיל את מדיום שיפוע הצפיפות. הטיפה הראשונה היא קריטית - הוסף אותה בעדינות רבה כדי למנוע ערעור היציבות של שיפוע הצפיפות.
הערה: יש לעשות זאת ביחס של 3:10 (מדיום שיפוע צפיפות: מתלה תאים). השתמש בפיפטה פסטר סטרילית בנפח 1 מ"ל לתוספת מדויקת ועדינה. ודא שקצה הפיפטה נוגע בצד הצינור כדי למנוע הפרעה לשכבה הבינונית של שיפוע הצפיפות. הימנע מערבוב הדגימה עם מדיום שיפוע הצפיפות. - צנטריפוגה את הצינורות ב-400 x גרם למשך 45 דקות ב-4 מעלות צלזיוס כשהבלם כבוי. זה מבטיח שהשכבות יישארו שלמות במהלך התהליך.
הערה: לאחר צנטריפוגה, שכבות ברורות צריכות להיות גלויות. לויקוציטים ייצרו טבעת בממשק בין תווך שיפוע הצפיפות לגלולת הפסולת התאית (איור 3).
- הכן תמיסה בינונית בשיפוע צפיפות עם צפיפות של 1.077 גרם/מ"ל, אוסמולריות של 353 mOsm/kg ו-pH של 7.4 (ראה קובץ משלים 1).
איור 3: לויקוציטים מצלצלים בממשק בין מדיום שיפוע הצפיפות לגלולת הפסולת התאית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- אוספים את טבעת הלויקוציטים.
- בעזרת פיפטה סטרילית של פסטר, שאבו בעדינות את טבעת הלויקוציטים (~100 מיקרוליטר) והעבירו אותה לצינור מיקרו-צנטריפוגה של 2 מ"ל.
הערה: הקפד לא להפריע לשכבות באופן משמעותי כדי למנוע זיהום. אם נראה שטבעת הלויקוציטים מכילה פסולת או מתלים כהים, רצוי להעביר את תרחיף הלויקוציטים שנאסף דרך מסננת תאים מיני חדשה (100 מיקרומטר) כדי להבטיח טוהר. הנח את מסננת התאים המיני מעל צינור המיקרו-צנטריפוגה בנפח 2 מ"ל והעביר בעדינות את מתלה הלויקוציטים דרך המסננת.
- בעזרת פיפטה סטרילית של פסטר, שאבו בעדינות את טבעת הלויקוציטים (~100 מיקרוליטר) והעבירו אותה לצינור מיקרו-צנטריפוגה של 2 מ"ל.
- שוטפים את טבעת הלויקוציטים.
- הוסף HBSS לצינורות המיקרו-צנטריפוגה המכילים את טבעת הלויקוציטים עד שהנפח מגיע ל -2 מ"ל והשהה בעדינות את התאים.
הערה: שמור את הצינורות בכלי מלא בקרח ומכוסה בנייר אלומיניום כדי לשמור על הדגימה בטמפרטורה נמוכה. ודא שהצינורות אינם באים במגע ישיר עם הקרח. שמור על מערך קירור זה לאורך כל תהליך הכביסה. - צנטריפוגה את הדגימות ב-400 × גרם למשך 10 דקות ב-4 מעלות צלזיוס (ניתן להפעיל את הבלם).
- לאחר צנטריפוגה, השליכו בזהירות את הסופרנטנט והשאירו את הגלולה בתחתית (שעשויה להיות כמעט בלתי נראית).
- חזור על שלבי הכביסה (הוספת HBSS, השעיה, צנטריפוגה והשלכת הסופרנטנט) עד שהגלולה נקייה מזיהומים.
- הוסף HBSS לצינורות המיקרו-צנטריפוגה המכילים את טבעת הלויקוציטים עד שהנפח מגיע ל -2 מ"ל והשהה בעדינות את התאים.
- השעיה והתאמת ריכוז התאים.
- השעו מחדש את התאים ב-1 מ"ל של HBSS בתוך אותם צינורות מיקרו-צנטריפוגה של 2 מ"ל המשמשים לשטיפות.
- השג ריכוז תאים בין 1 × 104 ו- 1 × 106 תאים למ"ל. אם הגלולה הראשונית גדולה, ייתכן שיידרש HBSS נוסף כדי לדלל את ריכוז התא לטווח הרצוי. העבירו את תרחיף התאים לצינור של 15 מ"ל והוסיפו עוד HBSS לפי הצורך על סמך ספירת התאים שהתקבלו.
הערה: מומלץ להשתמש במונה סלולרי אוטומטי כדי להקל על התהליך.
4. צביעה וקיבוע של לויקוציטים (איור 4)
הערה: ערכות כתמי התאים המתים הניתנים לתיקון LIVE/DEAD מספקות שיטה משופרת להערכת כדאיות התאים בתאים קבועים באמצעות ציטומטריית זרימה. בדיקות אלו משתמשות בצבע תגובתי פלואורסצנטי המקיים אינטראקציה עם אמינים תאיים. אם קרומי התאים נפגעים, הצבע יכול לחדור לתאים, להגיב עם אמינים חופשיים הן בתוך התא והן על פני התא, וכתוצאה מכך צביעה פלואורסצנטית עזה. לעומת זאת, בתאים ברי קיימא, רק האמינים על פני התא זמינים להגיב עם הצבע, מה שמוביל לצביעה עמומה יחסית. עוצמת הצביעה נשמרת לאחר קיבוע עם פורמלדהיד, המשמר גם את הדגימה על ידי מניעת צמיחה של מיקרואורגניזמים. ערכות כתמי התאים המתים הניתנים לתיקון LIVE/DEAD זהות למעט הצבע הפלואורסצנטי - זמין בכחול, סגול, אקווה, צהוב, ירוק, אדום, אדום רחוק או קרוב ל-IR (אינפרא אדום). במחקר זה, השתמשנו בצבע תגובתי פלואורסצנטי Near-IR. בנוסף, בדיקה בצבע יחיד זו מאפשרת בדיקה של פרמטרים אחרים במקביל בניסוי רב צבעוני.
- מכינים את הצבע.
- הביאו את הריאגנטים לטמפרטורת החדר (RT): אפשר לבקבוקון אחד של הצבע הריאקטיבי הפלואורסצנטי ולבקבוקון של דימתיל סולפוקסיד נטול מים (DMSO) להגיע ל-RT לפני הסרת המכסים.
- הרכיב מחדש את הצבע: הוסף 50 מיקרוליטר של DMSO לבקבוקון המכיל את הצבע הריאקטיבי. מערבבים היטב ומוודאים שהצבע נמס במלואו.
- השתמש בתמיסת הצבע המחודשת בהקדם האפשרי, רצוי תוך מספר שעות.
הערה: כל ערכה כוללת חמישה בקבוקונים בודדים של צבע תגובתי, המספקים חומר מספיק כדי להכתים לפחות 40 דגימות תאים. עם זאת, לאחר הרכבה מחדש, תמיסת ה-DMSO של הצבע אינה יציבה יחסית, במיוחד כאשר היא נחשפת ללחות. ניתן לאחסן כל מנה שאינה בשימוש עד שבועיים בטמפרטורה של ≤-20 מעלות צלזיוס, מוגנת מפני אור ולחות.
- לצבוע ולתקן את התאים.
הערה: חוצצים המתאימים לצביעה של תאים כוללים את תמיסת המלח המאוזנת של הנקס (HBSS), תמיסת מלח עם חוצץ פוספט (PBS) ו-PBS (D-PBS) של Dulbecco, כל עוד הם אינם מכילים חלבונים זרים כגון אלבומין בסרום בקר או סרום. בעת שימוש בצבע מגיב אמינו, הימנע ממאגרי Tris ותמיסות עם נתרן אזיד או חלבון זר להשעיית תאים ושטיפה. במחקר זה, השתמשנו ב-HBSS בשל הרכב היונים המאוזן שלו, המסייע בשמירה על איזון אוסמוטי ומספק יונים וגלוקוז חיוניים לתמיכה בחילוף החומרים של התאים ובכדאיות במהלך תהליך הצביעה. HBSS גם נקי מחלבונים זרים, מונע הפרעה לצבע הריאקטיבי ומבטיח הערכת כדאיות מדויקת.- לאחר ספירת התאים והתאמת הצפיפות ל -1 x 106 תאים למ"ל עם HBSS, העבירו 1 מ"ל של תרחיף תאים זה לצינורות מיקרו-צנטריפוגה של 2 מ"ל.
- עבור כל יום, לגרום למוות תאים בדגימה אחת לפחות כדי לשמש כבקרה לקביעת סף עוצמת הקרינה בין תאים חיים ומתים. הכן את הדגימות בצינורות מיקרוצנטריפוגה באופן הבא:
צינור 1: תאים חיים - לא מוכתמים
צינור 2: תאים חיים - מוכתמים
צינור 3: תאים מתים - לא מוכתמים
צינור 4: תאים מתים - מוכתמים
הערה: ארבעת הצינורות הללו צריכים להיות מוכנים רק לדגימה בודדת בכל ניסוי כבקרות. עבור הדגימות הנותרות, יש צורך בשני צינורות בלבד (צינור 1: דגימה - לא מוכתמת וצינור 2: דגימה - מוכתמת), מכיוון שהוא יספק מידע על התאים שהיו בחיים ואלה שהיו מתים.
- עבור כל יום, לגרום למוות תאים בדגימה אחת לפחות כדי לשמש כבקרה לקביעת סף עוצמת הקרינה בין תאים חיים ומתים. הכן את הדגימות בצינורות מיקרוצנטריפוגה באופן הבא:
- בקרה חיובית על מוות תאי: הנח את הצינור המסומן מת לא מוכתם (צינור 3) ומוכתם מת (צינור 4) באמבט מים בטמפרטורה של 50 מעלות צלזיוס למשך 7 דקות כדי לגרום למוות תאים על ידי טיפול בחום.
- צביעת התאים: הוסף 1 מיקרוליטר של הצבע הריאקטיבי הפלואורסצנטי המחודש (משלב 4.1.2) ל-1 מ"ל של תרחיף התא בצינורות 2 ו-4 (צינורות שיוכתמו) וערבב היטב.
- דגירה ב-RT למשך 30 דקות, מוגן מפני אור.
הערה: אם אין צורך בקיבוע, תוכל לדלג על השלבים 4.2.5-4.2.7 להלן. במקום זאת, שטפו את התאים פעמיים עם 1 מ"ל של HBSS עם 1% אלבומין בסרום בקר (ראה קובץ משלים 1) והשעו מחדש ב-1 מ"ל של HBSS עם 1% אלבומין בסרום בקר. בצע את הניתוח על ציטומטר הזרימה במהירות האפשרית; אחרת, כדאיות התאים עלולה להיפגע מכיוון שהתאים אינם קבועים. - שטפו את התאים פעמיים עם 1 מ"ל HBSS והשעו מחדש את התאים ב 900 מיקרוליטר של HBSS.
- הוסף 100 מיקרוליטר של 37% פורמלדהיד (זהירות, ראה טבלה משלימה 2).
- דגירה למשך 15 דקות ב-RT.
- שטפו פעמיים עם 1 מ"ל HBSS עם 1% אלבומין בסרום בקר (BSA), ולאחר מכן השעו מחדש את התאים ב-1 מ"ל של HBSS עם 1% BSA.
- אחסן את הדגימות במקרר בטמפרטורה של 4 מעלות צלזיוס. נתח את התאים תוך חודש לאחר הקיבוע.
- נתח את מתלה התאים הקבועים על ידי ציטומטריית זרימה באמצעות ערוץ העירור והזיהוי המתאים.
הערה: ערוצי העירור והזיהוי הנכונים עשויים להשתנות בהתאם למכשיר שבו נעשה שימוש (ראה טבלה משלימה 3).
- לאחר ספירת התאים והתאמת הצפיפות ל -1 x 106 תאים למ"ל עם HBSS, העבירו 1 מ"ל של תרחיף תאים זה לצינורות מיקרו-צנטריפוגה של 2 מ"ל.
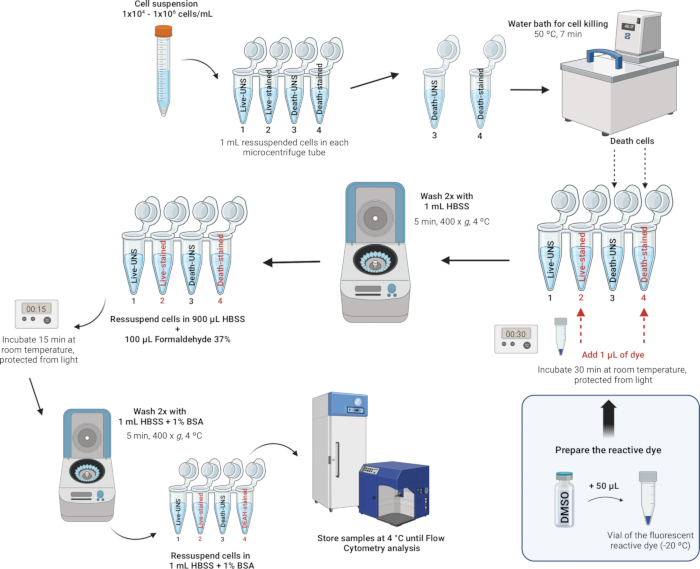
איור 4: תיאור המחשה של צביעה וקיבוע של לויקוציטים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
5. ציטומטריית זרימה
- השגת נתונים.
הערה: ההליכים שיש לבצע על ציטומטר הזרימה עשויים להשתנות בהתאם לציטומטר הספציפי בו נעשה שימוש. במחקר זה נרכשו נתונים באמצעות ציטומטר הזרימה Attune NTx.- הפעל את הדגימות.
- הנח את צינור הדגימה ביציאת הדגימה.
- התחל את הרכישה על ידי לחיצה על התחל ולאחר מכן לחץ על רשומה ברגע שקצב האירועים (אירועים/שנייה) מתייצב.
- רשום מינימום של 10,000 אירועים עבור כל דגימה בשער הסינגלטים לניתוח אמין.
- שמור את כל הנתונים עבור כל דגימה וגבה אותם בכוננים חיצוניים או באחסון בענן.
- נתח את הנתונים.
הערה: לניתוח Flow Cytometry קיימות מספר אפשרויות תוכנה. במחקר זה, ניתוח הנתונים בוצע באמצעות FlowJo v10.8.119.- טען קבצי נתונים: הפעל את תוכנת ניתוח ציטומטריית הזרימה והעלה את קבצי ה-.fcs שנרכשו מהניסוי.
- הדמיה של הנתונים (איור 5A): התוויית פיזור קדימה (FSC-A) (XX) לעומת פיזור צד (SSC-A) (YY) כדי להעריך את גודל התא ואת גרעיניותו.
הערה: תרשים זה משמש בדרך כלל לזיהוי אוכלוסיות תאים ולהוצאת פסולת על סמך תכונות הפיזור שלהם. - אי-הכללת שער תא יחיד ומכפילים (איור 5B): השתמש בתרשים שטח פיזור קדימה (FSC-A) לעומת גובה פיזור קדימה (FSC-H) כדי לא לכלול כפולות. צייר שער כדי לכלול את כל האירועים המיושרים בתרשים (תאים בודדים) ולא לכלול את האירועים הלא מיושרים (כפולות). אם לדגימה יש אירועים עם FSC נמוך מאוד, אל תכלול אותם על ידי אי הכללתם בשער התא הבודד, והשאר רק תאים בודדים.
- זיהוי אוכלוסיות לויקוציטים (איור 5C): הבחין בין 3 אוכלוסיות הלויקוציטים על סמך פרופיל FSC-A/SSC-A: FSC-Aגבוה/SSC-Aגבוה הם גרנולוציטים,מדיום FSC-A/מדיום SSC-A הם המונוציטים ו-FSC-Aנמוך/SSC-Aנמוך הם הלימפוציטים.
- שער כדאיות (איור 5D): הגדר את הסף לצביעת צבע כדאיות על תעלת הקרינה המתאימה (NIR, RL3-A). תאים חיים לעומת תאים מתים מוגדרים על סמך עוצמת הצביעה עם LIVE/DEAD Fixable Dead Cell Stain: תאים מוכתמים עמומים מוגדרים כתאים חיים, והתאים המוכתמים חזק מוגדרים כתאים מתים.
- סטטיסטיקת אוכלוסייה: הסתכל על הנתונים הסטטיסטיים המסופקים על ידי התוכנה, כולל סך האירועים (תאים) בכל שער ואחוזים של תאים כוללים ומגודרים.
- ייצוא נתונים: ייצא את הנתונים לגיליון אלקטרוני והשתמש בתוכנה סטטיסטית מתאימה (GraphPad Prism או R) להמשך ניתוח סטטיסטי.
הערה: בחירת שיטות הניתוח תהיה תלויה במטרות המחקר.
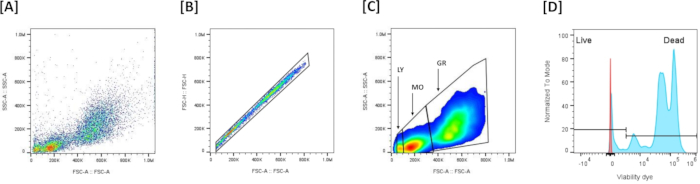
איור 5: אסטרטגיית שער זרימה ציטומטרית להערכת כדאיות בתאי כליה ראשיים: (A) מייצג פרופיל FSC-A/SSC-A של כל האירועים שנאספו. (B) מייצג אי הכללת מכפילים בהתבסס על ההגדרה של אזור סינגלטים בהתבסס על ליניאריות בגרף פיזור קדימה (FSC-A)/פיזור קדימה (FSC-H). (C) מייצג את 3 האוכלוסיות העיקריות שהוגדרו על סמך FSC-A/SSC-A, לאחר אי הכללת מכפילים. (D) מייצג היסטוגרמה שמציגה צביעת צבע חי/מת. כדי להגדיר את הסף המאפשר להבחין בין תאים חיים ומתים, לויקוציטים הוגשו להלם חום קל (50 מעלות צלזיוס, 7 דקות) ולאחר מכן נצבעו בצבע כדאיות. תאים חיוביים בעוצמת צביעה גבוהה (++) הם התאים המתים, ותאים חיוביים בעלי צביעה נמוכה (+-) הם התאים החיים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
תוצאות
איור 6 מציג נתוני זרימה ציטומטרית מייצגים המראים אוכלוסיות לויקוציטים שבודדו מכליות הראש של דניס זהוב צעיר (Sparus aurata) ואת כדאיות התאים שלהם באמצעות הפרוטוקול המתואר במחקר זה. האיור משווה שתי דגימות: אחת עם כדאיות תאית גבוהה, שבה הדגים נחשפו לתנאים אופטימליים (איור 6A), ואחרת עם כדאיות תאית נמוכה, שבה התאים נחשפו לסטרס תרמי (איור 6B).
בשתי הדגימות, השיטה הנוכחית זיהתה ביעילות שלוש אוכלוסיות לויקוציטים עיקריות: לימפוציטים (LY), מונוציטים (MO) וגרנולוציטים (GR). אוכלוסיות אלה הובחנו על סמך הבדלים בגודל התא ובמורכבותו, כפי שמצוין על ידי עלילות פיזור קדימה (FSC-A) ופיזור צד (SSC-A). פיזור קדימה (FSC-A) מציין גודל תא יחסי, בעוד שפיזור הצד (SSC-A) משקף את המורכבות הפנימית או הפירוט של התאים, ומאפשר הפרדה ברורה של האוכלוסיות. בתנאים אופטימליים (איור 6A), אוכלוסיות הלויקוציטים התפלגו באופן הבא: LY ב-31.0%, MO ב-38.0% ו-GR ב-31.0%. עם זאת, במדגם שנחשף ללחץ תרמי (איור 6B), נצפה שינוי בהתפלגות של אוכלוסיות אלה, כאשר LY ירד ל-21.3%, MO עלה ל-45.6%, ו-GR נשאר יציב יחסית ב-33.1%.
ניתוח נוסף של כדאיות התאים, המפורט באיור 6A1-A3 ובאיור 6B1-B3, חושף ניגוד משמעותי בין שתי הדגימות. כפי שניתן לראות, הדגימה שנחשפה לתנאים אופטימליים (איור 6A) הראתה כדאיות גבוהה יותר, עם דומיננטיות של תאים חיים (המיוצגים בכחול) בכל אוכלוסיות הלויקוציטים. לעומת זאת, הדגימה בלחץ תרמי (איור 6B) הראתה עלייה משמעותית במוות התאים (צביעה אינטנסיבית יותר מוצגת באדום), כאשר LY הראה 50.7% מוות תאי, MO 83.7% ו-GR 84.5%.
בסך הכל, התוצאות מדגימות בבירור את יעילות הפרוטוקול הן בבידוד וניתוח אוכלוסיות לויקוציטים והן בהערכת כדאיות התאים. יתר על כן, הנתונים מספקים תובנות חשובות לגבי האופן שבו תנאי לחץ, כגון חשיפה תרמית, משפיעים על הדינמיקה של אוכלוסיית הלויקוציטים ועל כדאיות התאים. השינויים שנצפו בהתפלגות התאים ובכדאיות תחת לחץ מצביעים על כך שחשיפה תרמית לא רק משבשת את האיזון של אוכלוסיות הלויקוציטים אלא גם פוגעת בבריאות התאים. שינויים אלה עשויים להצביע על תגובה חיסונית ללחץ, מה שמצביע על מנגנון הגנה פעיל המופעל על ידי גורמי לחץ סביבתיים.

איור 6: עלילות ציטומטריית זרימה מייצגות הממחישות את הזיהוי והכדאיות של אוכלוסיות לויקוציטים שונות מכליות הראש של דניס (Sparus aurata): (A) דגימה עם כדאיות תאים גבוהה, חשופה לתנאים אופטימליים: הפאנל השמאלי מציג את השער של אוכלוסיות לויקוציטים בהתבסס על FSC-A/SSC-A, זיהוי לימפוציטים (LY), מונוציטים (MO) וגרנולוציטים (GR); כדאיות של LY (A.1), MO (A.2) ו-GR (A.3). (B) דגימה עם כדאיות תאים נמוכה, נתונה ללחץ תרמי: הפאנל השמאלי מראה את השער של אוכלוסיות לויקוציטים בהתבסס על FSC-A/SSC-A, זיהוי לימפוציטים (LY), מונוציטים (MO) וגרנולוציטים (GR); כדאיות של LY (B.1), MO (B.2) ו-GR (B.3). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים 1: תמונה מייצגת של מיכל הסגר בנפח כולל של 660 ליטר. אנא לחץ כאן להורדת איור זה.
איור משלים 2: תמונה של מערך מערכת RAS. (1) Profilux; (2) גופי תאורה; (3) אקווריומים/מיכלים; (4) מקרר; (5) ברזי כניסת מים באקווריומים; (6) סיפון כחול לשקעי מים באקווריום; (7) סומפ; (8) רחפן חלבון; (9) פילטר מכני (שקית סינון); (10) פילטר מכני (ספוג כחול + צמר זכוכית); (11) פילטר ביולוגי (כדורים ביולוגיים); (12) תרמוסטט; (13) משאבה ראשית; (14) מעקר UV; (15) חיישן טמפרטורה; (A) מסנן מכני (ספוג כחול); (B) פילטר מכני (צמר זכוכית). אנא לחץ כאן להורדת איור זה.
טבלה משלימה 1: הרכב המרכיבים (%) וניתוח קרוב (%DM) של הדיאטה הניסיונית ששימשה במחקר. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה 2: ריאגנטים המשמשים בפרוטוקול: סכנות בריאותיות, הצהרות סכנה, הצהרות זהירות ואמצעי עזרה ראשונה. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה 3: ערוצי עירור וזיהוי מתאימים לשימוש עם כתמי תאים מתים הניתנים לתיקון LIVE/DEAD המגיבים לאמין. אנא לחץ כאן להורדת טבלה זו.
קובץ משלים 1: חישובים להכנת פתרונות. אנא לחץ כאן להורדת קובץ זה.
Discussion
השיטה שפותחה במחקר זה מייצגת התקדמות משמעותית במחקר האימונולוגיה של דגים ומבטיחה לשפר את ההבנה של התגובות החיסוניות של הדגים וקיימות המשאבים הימיים. S. aurata הוא מין דג ימי יקר ערך ממשפחת Sparidae המשמש כאורגניזם מודל אידיאלי מכמה סיבות, כולל הרלוונטיות האקולוגית והכלכלית שלו, כמו גם הרבגוניות שלו במחקר מעבדה במספר תחומי מחקר כגון פיזיולוגיה, אימונולוגיה, טוקסיקולוגיה וחקלאות ימית20. אחד היתרונות העיקריים של S. aurata הוא קלות הטיפול והגידול שלו במעבדה, עם פרוטוקולי גידול מבוססים היטב המבטיחים תנאי ניסוי עקביים וניתנים לשחזור21. יתר על כן, יכולת ההסתגלות הסביבתית שלו (כלומר, סובלנות גבוהה למגוון רחב של תנאים סביבתיים, כגון תנודות טמפרטורה ומליחות) הופכת אותו למועמד אידיאלי למחקרים שמטרתם לשפר טכניקות חקלאיות ולהעריך את ההשפעות הסביבתיות על אורגניזמים ימיים22. S. aurata, עם מערכת החיסון המאופיינת היטב שלו וזמינות הנתונים הגנומיים, מאפשר פתיחת תגובות חיסוניות של דגים, עמידות לפתוגנים, יעילות חיסון ובריאות כללית20. בהתחשב בחשיבותו בחקלאות ימית, כמו גם בהרגלי התזונה של אוכלוסיות דרום אירופה, מחקר על מין זה יכול להשפיע ישירות על שיטות החקלאות, לשפר את הייצור והקיימות שלו תוך התמודדות עם אתגרים סביבתיים בתוך התעשייה20.
במובן זה, פרוטוקול זה מציע מספר יתרונות ויישומים פוטנציאליים בתחומי מחקר שונים, כגון: (i) אימונולוגיה של דגים: מספק ניתוח מדויק ומפורט של תאים חיסוניים מכליות הראש של S. aurata, המאפשר זיהוי ואפיון של אוכלוסיות לויקוציטים שונות, כמו גם הערכות חזקות של כדאיות התאים שלהם על ידי זרימה ציטומטרית; (ii) מחקר חקלאות ימית: חיוני לחקר טכניקות חקלאיות, תזונה וניהול מחלות, תומך במחקר עתידי שמטרתו להפחית את ההסתמכות על אנטיביוטיקה וטיפולים כימיים, ובכך לקדם שיטות חקלאות ימיות בנות קיימא יותר; (iii) אקוטוקסיקולוגיה: בעל ערך בהערכת ההשפעות הנגרמות על ידי מזהמים וגורמי לחץ סביבתיים אחרים על בריאות מערכת החיסון של הדגים, מתן נתונים להערכת סיכונים סביבתיים וגיבוש תקנות הגנה למערכות אקולוגיות ימיות; (iv) פיזיולוגיה השוואתית: מאפשרת לחוקרים לעקוב אחר התאמות אבולוציוניות של מערכות חיסון לאתגרים סביבתיים שונים, ומספקת הבנה מעמיקה יותר של הבסיס הגנטי והפיזיולוגי של תפקוד מערכת החיסון; (v) ביולוגיה ואקולוגיה ימית: לשפר את ההבנה של התפקידים האקולוגיים והאינטראקציות של S. aurata, לספק תובנות לגבי תפוצת המינים, העדפות בתי הגידול וההשפעה של שינויים סביבתיים על המגוון הביולוגי הימי; (vi) מחקר ביו-רפואי: דגים משמשים לעתים קרובות יותר ויותר כאורגניזמים מודל במחקר ביו-רפואי. בידוד וניתוח של תאי חיסון יכולים לסייע בהבנת היבטים תאיים ומולקולריים קריטיים לגילוי תרופות ואפילו לרפואה.
במשך שנים רבות, הכימות והזיהוי של לויקוציטים בדגים הסתמכו על טכניקות המטולוגיות מסורתיות, כגון ספירה ידנית עם Bürker, Neubauer או Thoma, כמו גם מריחות דם מוכתמות10,12. כדאיות התאים הוערכה גם באמצעות מבחן אי הכללת הטריפאן הכחול, ואחריו ספירת מיקרוסקופיה 15,22,23,24,25,26,27,28. בעוד שהשיטות האלה תרמו להבנת האימונולוגיה של דגים, יש להן כמה מגבלות. ספירת לויקוציטים ידנית הייתה גם גוזלת זמן וגם עבודה אינטנסיבית, והדיוק של טכניקות אלה נפגע לעתים קרובות על ידי שונות המפעיל וטעויות אנוש, מה שהשפיע באופן משמעותי על עקביות התוצאות10.
בשנת 1994, אסטבן ועמיתיו חוללו מהפכה בניתוח לויקוציטים של דגים על ידי הצגת טכניקה להערכת מנגנון ההגנה הפגוציטי בבס (Dicentrarchus labrax)23. במחקרם, לויקוציטים בודדו מדם היקפי, כליות ראש והפרשות צפקיות באמצעות צנטריפוגה שיפוע צפיפות פרקול23. התקדמות מתודולוגית זו סימנה קפיצת מדרגה משמעותית, ושיפרה את הדיוק והאמינות של ניתוח הלויקוציטים. בעקבות עבודתם החלוצית של אסטבן ועמיתיו, מחקרים עוקבים נועדו לחדד ולייעל טכניקות זרימה ציטומטריות לניתוח לויקוציטים, תוך התמקדות בהיבטים שונים כגון פרופיל אוכלוסיית התאים 6,15,16,28,29, כדאיות התאים 3,6,27,28 ופעילות פגוציטית 6,23, 24,27,28. התקדמות בהליכי בידוד, כולל שימוש במדיות שיפוע שונות (למשל, Ficoll לעומת Percoll) ופרוטוקולי צנטריפוגה אופטימליים, שיפרו את הטוהר והתפוקה של לויקוציטים מבודדים 1,8,14,26. הפיתוח של טכניקות צביעה מתקדמות ושימוש בצבעי פלואורסצנט, כגון פרופידיום יודיד (PI) ו-3,3'-Dihexyloxacarbocyanine iodide (DiOC6(3)) אפשרו הבחנה מדויקת יותר בין תאים ברי קיימא ולא ברי קיימא, כמו גם אפיון מפורט של אוכלוסיות לויקוציטים, בהתאמה16,30. אחד היתרונות העיקריים של טכניקה זו הוא יכולתה להבחין בו זמנית בין אוכלוסיות לויקוציטים שונות (לימפוציטים, מונוציטים וגרנולוציטים) ולהעריך את כדאיות התאים של כל אוכלוסייה. זה מאפשר לחוקרים לזהות אילו אוכלוסיות מושפעות ביותר בתנאים ספציפיים, לספק תובנות עמוקות יותר לגבי התגובה החיסונית ולחשוף את תת-הקבוצות הפגיעות ביותר של לויקוציטים. עם זאת, למרות השיפורים הללו, השיטות הנוכחיות עדיין מתמודדות עם מגבלות. רוב המחקרים התמקדו בדגים בוגרים, מה שמשאיר פער בחקר שלבי הנעורים. דגים צעירים מהווים אתגרים ייחודיים למיצוי לויקוציטים בשל גודלם הקטן יותר והקושי להשיג דגימות באיכות גבוהה מאיברי החיסון הקטנים יחסית שלהם17. המחקר המתואר כאן מתייחס באופן ספציפי לנושאים אלה על ידי אופטימיזציה של הפרוטוקול עבור דגים צעירים, התאמת יחס תרחיף התאים ותמיסת פרקול לשיפור איכות מיצוי הלויקוציטים. בנוסף, שיטות קיימות מוגבלות לרוב על ידי מספר הדגימות או השכפולים שניתן לעבד בבת אחת בשל הצורך המיידי בהערכת כדאיות לויקוציטים. כל עיכוב בטיפול בדגימה עלול להשפיע לרעה על כדאיות התאים, לסבך את תהליך הדגימה ועלול לפגוע בתוצאות. כדי להתגבר על מגבלה זו, מחקר זה מציג את השימוש בטכניקת צביעה חדשה המאפשרת קיבוע וניתוח תאים עד חודש לאחר הקיבוע. חידוש זה מספק גמישות רבה יותר בלוחות הזמנים של הדגימה, ומאפשר לחוקרים לעבד ולנתח דגימות בזמן שנוח להם, ולשפר משמעותית את זרימת העבודה והאמינות של הערכות ציטומטריית זרימה.
הצלחתו של פרוטוקול זה מסתמכת על מספר שלבים קריטיים, שכל אחד מהם דורש ביצוע קפדני כדי להבטיח את שלמותם וכדאיותם של הלויקוציטים, אשר מנותחים לאחר מכן על ידי ציטומטריית זרימה. הכנה נכונה של תמיסת המתת החסד והתאמת ה-pH הם קריטיים להמתת חסד יעילה. פתרונות שהוכנו בצורה לא נכונה עלולים לגרום להמתת חסד לא שלמה או ללחץ נוסף על הדגים18. דיסקציה מדויקת וזהירה של כליית הראש חיונית למניעת זיהום. שמירה על סטריליות ושלמות הרקמות היא חיונית להשגת דגימות לויקוציטים באיכות גבוהה. יש להתאים נכון את הצפיפות, האוסמולריות וה-pH של תמיסת פרקול להפרדת לויקוציטים יעילה. שאיבה עדינה של טבעת הלויקוציטים עם פיפטה סטרילית היא קריטית כדי למנוע זיהום והפרעה של שכבות השיפוע. שטיפה יעילה של תאים לאחר האיסוף חיונית להסרת שאריות פרקול וזיהומים אחרים. חזרה על תהליך הכביסה מבטיחה כדור תא נקי מוכן לקיבוע. יש להכין את הצבע הריאקטיבי מיד לפני השימוש כדי להבטיח את יעילותו, שכן טיפול לא נכון עלול לפגוע ביציבותו. תוספת צבע נכונה וזמן דגירה הם קריטיים להבחנה מדויקת בין תאים חיים ומתים. קיבוע תאים עם 3.7% פורמלדהיד הוא צעד קריטי לשימור מורפולוגיה של התאים והבטחת זיהוי מדויק של תאים מתים. ריכוז הפורמלדהיד חייב להיות מדויק, ויש להקפיד על זמני הדגירה כדי למנוע תוצאות לא מדויקות. שטיפת התאים לאחר הקיבוע חשובה להסרת עודפי צבע ופורמלדהיד, העלולים להפריע לניתוח שלאחר מכן. אחסון נכון של דגימות קבועות וניתוחם בזמן נחוצים כדי לשמור על דיוק הנתונים. התאמת ערוצי העירור והזיהוי כך שיתאימו לצבע הספציפי המשמש חיונית לתוצאות ציטומטריית זרימה מדויקות.
למרות יתרונותיה הרבים, לשיטה זו יש כמה מגבלות שיש לקחת בחשבון. מגבלה מרכזית אחת היא אופיו הספציפי למין, שכן הפרוטוקול מותאם לדניס זהוב צעיר (S. aurata), דג ימי. המשמעות היא שיעילותו עשויה להשתנות כאשר הוא מיושם על מיני דגים אחרים, במיוחד דגי מים מתוקים. הבדלים באיזון האוסמוטי בין מיני מים ימיים למים מתוקים עשויים לדרוש התאמות למאגרים המשמשים בפרוטוקול, מכיוון שהתמיסות המתאימות לתנאי מלח עשויות שלא להתאים למיני מים מתוקים. בנוסף, הבדלים במבנה הרקמה, צפיפות התאים והתגובות הפיזיולוגיות עשויים לדרוש התאמות לפרוטוקול, מה שעלול להשפיע על יכולת השחזור והעקביות בין מינים שונים.
גורם חשוב נוסף הוא תחזוקת הדגים לפני איסוף הדגימות. לכל מין יש תנאי מים אופטימליים ספציפיים החיוניים לשמירה על בריאות הדגים ולהבטחת איכות תוצאות הניסוי20. שינויים בפרמטרים כגון טמפרטורה, מליחות ו-pH יכולים להשפיע על כדאיות התא ואיכות הנתונים, מכיוון שתנאים לא אופטימליים עלולים לגרום ללחץ פיזיולוגי הפוגע בשלמות התא. כדי להבטיח תוצאות ניסוי עקביות, חשוב לשמור את כל השכפולים באותם תנאים מבוקרים, בין אם אופטימליים או תת-אופטימליים במכוון (בהתאם למטרות המחקר).
שונות בטכניקות הטיפול והדיסקציה יכולה גם להשפיע על האיכות והכמות של לויקוציטים בכליות הראש, מה שהופך את המיומנות והניסיון של המפעיל לגורם קריטי להצלחת הפרוטוקול. בנוסף, שמירה על כדאיות התא לאורך תהליך הבידוד יכולה להוות אתגר, שכן כל עיכוב בין המתת חסד לקיבוע התאים עלול לגרום לירידה בכדאיות ולתוצאות מוטות. עיבוד מיידי של רקמות ותאים חיוני לשמירה על כדאיות תאים גבוהה, אך דרישה זו יכולה להיות קשה להשגה באופן עקבי, במיוחד כאשר עובדים עם מספר גבוה של דגימות.
Disclosures
המחברים מצהירים שאין ניגודי עניינים כספיים, אישיים או מקצועיים שיכולים היו להשפיע על המחקר, הניתוח, פירוש הנתונים, הכתיבה או ההחלטה להגיש את כתב היד לפרסום.
Acknowledgements
עבודה זו נתמכה על ידי Fundação Portuguesa para a Ciência e Tecnologia (FCT I.P.), במסגרת הפרויקט Aqua-CLIMADAPT (PTDC/CTA-AMB/0592/2021, https://doi.org/10.54499/PTDC/CTA-AMB/0592/2021). אנו מודים ל-BioLab הנתמכת על ידי היחידה למדעים ביולוגיים מולקולריים יישומיים (UCIBIO) והמעבדה ליחידת המחקר לכימיה ירוקה – LAQV, הממומנות על ידי קרנות לאומיות מ-FCT/MCTES (UIDB/04378/2020 ו-UIDB/50006/2020, בהתאמה), כמו גם מכון המעבדה העמית לבריאות וביו-כלכלה – i4HB (LA/P/0140/2020). עבודה זו נתמכה גם על ידי הנציבות האירופית באמצעות פרויקט GLYCOTwinning (הסכם מענק מס' 101079417) ו-FCT באמצעות InnoGlyco (2022.04607.PTDC). איסה מרמלו גם מכיר ב-FCT I.P. על מענק הדוקטורט (2020.04413.BD, https://doi.org/10.54499/2020.04413.BD).
Materials
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
References
- Samaï, H. C., et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93(2023).
- Lulijwa, R., et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A., et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498(2022).
- Titus, J., et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142(2024).
- Marmelo, I., et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135(2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955(2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change. Biol Lett. 20 (2), 20230346(2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398(2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á, Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R., et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. , American Veterinary Medical Association. Schaumburg, IL. (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). , At https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software (2023).
- Mhalhel, K., et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008(2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739(2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á, Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á, Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M. -A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved