Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Juvenil Gilthead Çipura Başı Böbrek Lökositlerinin Flow Sitometri ile İzolasyonu, Fiksasyonu ve Karakterizasyonu
Bu Makalede
Özet
Bu el yazması, çipuranın baş böbreğinden ekstrakte edilen lökositlerin izolasyonu ve fiksasyonunu ve akış sitometrisi ile canlılıklarının değerlendirilmesini açıklamaktadır. Bu çalışma, protokollerin standardizasyonuna katkıda bulunur ve numune kalitesinden ödün vermeden daha fazla sayıda numunenin işlenmesinden yararlanarak balık immünolojisi bilgisindeki ilerlemeleri teşvik eder.
Özet
Bağışıklık, organizmaların fizyolojik düzenlenmesi için çok önemlidir ve patojenlere ve çevresel stres faktörlerine karşı birincil savunma görevi görür. Bağışıklık hücrelerinin izolasyonu ve analizi, dış baskılara karşı bağışıklık tepkileri hakkında önemli bilgiler sağlar. Bununla birlikte, deniz balıkları gibi daha az çalışılmış türler için uyumlaştırılmış protokollerin olmaması, genellikle verilerin yorumlanmasını ve türe özgü bağışıklık tepkilerinin kapsamlı bir şekilde anlaşılmasını engelleyen teknik ve analitik zorluklara yol açmaktadır. Bu çalışma, yavru çipura (Sparus aurata) baş böbreğinden (teleost balıklarındaki ana hematopoietik organ) lökositlerin karakterize edilmesi ve canlılığının belirlenmesi için optimize edilmiş akış sitometrisine dayalı bir analitik prosedür oluşturmayı amaçlamıştır. Prosedür, Lökositlerin Hanks'in dengeli tuz çözeltisi kullanılarak bir homojenizasyon işlemi yoluyla izole edilmesiyle başladı, ardından verimli sonraki akış sitometrisi analizi için gereken minimum eritrosit kontaminasyonu ile lökositlerin yüksek geri kazanım oranlarını sağlamak için optimize edilmiş bir Percoll yoğunluk gradyan santrifüjleme yöntemi izledi. Ek olarak, floresan boyama modellerine göre canlı hücreleri ölü hücrelerden ayırt etmek için hücre reaktif bir boya (CANLI / ÖLÜ Sabitlenebilir Ölü Hücre Boyama Kiti) kullanan yeni bir teknik kullanıldı. Fiksasyon, hücre morfolojisi, canlılığı ve boyama verimliliği korunarak %3.7 formaldehit ile sağlandı. Akış sitometrisi analizi, üç baskın lökosit popülasyonunu başarıyla tanımladı: lenfositler, monositler ve granülositler. Bu yöntem sadece canlılık testlerine değil, aynı zamanda hücre tiplerinin doğru bir şekilde ayırt edilmesine de izin verdi. Akış sitometrisi protokollerindeki iyileşme, bağışıklık hücresi analizinin doğruluğunu ve verimliliğini artırarak balık immünolojisinde ileriye doğru atılmış bir adımı temsil etmektedir. Ayrıca, daha sonraki analizler için hücrelerin sabitlenmesine izin vererek, bu protokol bağışıklık değerlendirmeleri için gereken zamanı ve çabayı önemli ölçüde azaltır ve bu da onu çeşitli araştırma alanlarında hem araştırma hem de pratik uygulamalar için değerli bir araç haline getirir.
Giriş
Bağışıklık, organizmaların fizyolojik düzenlenmesinde merkezi bir rol oynar ve çok çeşitli patojenlere ve çevresel stres faktörlerine karşı birincil savunma görevi görür1. Diğer omurgalılar gibi, balıklar da genel sağlıkları ve esenlikleri için gerekli olan karmaşık, dinamik ve koordineli bir bağışıklık sistemine sahiptir1.
Teleost balıkları, zararlı istilacıları tespit etmek, bunlara yanıt vermek ve etkisiz hale getirmek için aynı anda işlev gören hem doğuştan gelen hem de uyarlanabilir bağışıklık sistemlerine sahiptir2. Doğuştan gelen bağışıklık sistemi, patojenlere2 karşı anında ve spesifik olmayan tepkiler sağlayan ilk savunma hattı görevi görürken, adaptif bağışıklık sistemi zamanla gelişir ve balıkların belirli patojenleri tanımasını ve immünolojik hafıza oluşturmasını sağlayan daha özel bir yanıt sunar3. Balık bağışıklık sistemi, bağışıklık savunmasını desteklemek ve genel sağlığı korumak için özel birincil lenfoid organlara (yani timus ve baş böbrek) ve ikincil lenfoid organlara (örneğin, dalak ve mukoza ile ilişkili lenfoid dokular (MALT)) dayanır4. Baş böbrek, teleost balıklarında birincil hematopoietik organdır ve lökositler de dahil olmak üzere bağışıklık hücrelerinin gelişiminde ve olgunlaşmasında çok önemli bir rol oynar5.
Son yıllarda, çeşitli balık türlerinin bağışıklık tepkilerinin incelenmesinde önemli ilerlemeler kaydedilmiştir2. Odak noktalarından biri, lökosit popülasyonlarını ve aktivitelerini anlamak olmuştur. Beyaz kan hücreleri olarak da bilinen lökositler genellikle monositler, lenfositler ve granülositler olarak sınıflandırılır ve balıkların bağışıklık savunmasında çok önemli bir rol oynar. Patojenleri yutmaktan ve yok etmekten sorumlu olan ve bakterisidal reaktif oksijen türlerini serbest bırakan, istilacı mikroorganizmaların ortadan kaldırılmasına katkıda bulunan fagositik hücrelere sahiptirler6. Lökositler ayrıca enflamatuar süreçte yer alır ve doku onarımını teşvik ederken enfeksiyonları izole etmeye ve ortadan kaldırmaya yardımcı olur6. Lökosit popülasyonlarının bolluğu ve aktivitesi, hayvan sağlığı ve hastalıklarında bağışıklık durumunun önemli göstergeleridir 7,8.
Bazı çalışmalar, olumsuz çevresel koşullar gibi stres faktörlerinin eritrositlerin sayısını ve morfolojisini ve dolaşımdaki lökositlerin bileşimini değiştirebileceğini göstermiştir 9,10. Örneğin, Franke ve ark. (2024), çevresel stres faktörleri balık bağışıklığını tehlikeye atabileceği, hastalığa yatkınlığı artırabileceği ve belirli patojenlerin bulaşıcılığını artırabileceği ve sonuçta hastalığın ilerlemesini hızlandırabileceği için iklim değişikliği senaryolarında balıkların bağışıklık sistemini incelemek çok önemlidir11. Ayrıca, balık bağışıklığını anlamak, yalnızca temel biyolojik araştırmaları ilerletmek için değil, aynı zamanda su ürünleri yetiştiriciliği endüstrisi gibi toplumun çeşitli sektörlerini desteklemek için de gereklidir. Su ürünleri yetiştiriciliği küresel olarak genişlemeye devam ettikçe, çiftlik balık türlerinin sağlık ve refahını sağlamak giderek daha önemli hale gelmektedir. Yine de, balık refahı nispeten yeni bir araştırma alanı olmaya devam etmektedir ve çiftlik balıklarının bağışıklık tepkileri hala kapsamlı ve standartlaştırılmış değerlendirmeler gerektirmektedir. Elde edilen bilgiler, çiftlik hayvanlarının refahını ve direncini artıran etkili ve özel yaklaşımlar yoluyla su ürünleri yetiştiriciliğinin sürdürülebilirliğini ve üretkenliğini artırabileceğinden, bağışıklık yanıtı çalışmalarına öncelik vermek son derece önemlidir.
Lökosit miktar tayini ve tanımlaması genellikle Bürker, Neubauer veya Thoma hemositometreleri ile manuel sayım gibi hematolojik yöntemler ve ayrıca lekeli kan yaymaları 7,10 kullanılarak gerçekleştirilir. Kan hücrelerinin görselleştirilmesine ve farklılaşmasına yardımcı olmak için Wright, May-Grünwald-Giemsa ve Hemacolor gibi boyama kitleri sıklıkla kullanılır 7,12. Bununla birlikte, bu manuel hücre sayma teknikleri sıkıcı, zaman alıcıdır ve insan hatasına eğilimlidir 8,10. Yaygın hata kaynakları arasında kanın yetersiz karıştırılması veya seyreltilmesi, lekelenme sorunları ve hemositometre odasının yanlış yüklenmesi yer alır ve bunların tümü yanlış hücre sayımlarınayol açabilir 12. Ayrıca, manuel hematolojik analiz, sonuçların güvenilirliğini ve tekrarlanabilirliğini sağlamak için yüksek düzeyde uzmanlık ve deneyim gerektirir7. Kesin ve etkili teşhis araçlarına olan talep arttıkça, balık popülasyonlarının bağışıklık durumunun derinlemesine anlaşılmasını sağlayan yenilikçi yöntemlerin geliştirilmesi, bu alanın ilerlemesinde giderek daha önemli bir adım haline gelmektedir.
Akış sitometrisi, lökosit popülasyonlarını ve hücre canlılığını analiz etmek için yüksek verimli, kantitatif bir yaklaşım sunan bu bağlamda güçlü bir araç olarak ortaya çıkmıştır8. Bu modern teşhis teknolojisi, karışık popülasyonlardaki tek tek hücrelerin dikkate değer bir hassasiyetle hızlı bir şekilde algılanmasına, sayılmasına ve karakterizasyonuna olanak tanır13. Ayrıca, akış sitometrisi hem fenotipik hem de fonksiyonel karakterizasyon için eşzamanlı multiparametrik ölçümlere izin verir. İnsan klinik ortamlarında ve veterinerlik tıbbında yaygın olarak kullanılmasına rağmen, balık lökositlerinin çalışmasında uygulaması çok sınırlı kalmaktadır8. Farklı balık türleri 1,6,8,13,14,15,16,17 üzerinde bazı araştırmalar yapılmış olsa da, hala ele alınması gereken birkaç kritik zorluğun giderilmesi gerekmektedir. Bu analizlerdeki en büyük zorluklardan biri, periferik kandan veya baş böbrek1 gibi lenfoid dokulardan ekstrakte edilen canlı lökositlerin süspansiyonlarının elde edilmesi gerekliliğidir. Lökositlerin izolasyonu, teleost balıklarının benzersiz bir özelliği nedeniyle genellikle zordur: çekirdekli eritrositlerin varlığı. Eritrositlerle kasıtsız kontaminasyon, boyutları, oval şekilleri ve bir çekirdeğin1 varlığı nedeniyle lökosit analizine müdahale edebilir. Bu nedenle, yüksek lökosit saflığı elde etmek için lökosit süspansiyonlarından eritrositlerin çıkarılması ve akış sitometrisi analizi ile lökositlerin fenotipik ve fonksiyonel özelliklerinin incelenmesi zorunludur. Memelilerde, lökosit izolasyonu tipik olarak eritrosit ozmotik lizizini veya Ficoll veya Percoll1 ile yoğunluk gradyan ayrılmasını içerir. Bununla birlikte, ozmotik lizis, uygun şekilde parçalanamayan çekirdekli eritrositleri nedeniyle hem deniz hem de tatlı su balıkları için etkisizdir1. Bunun yerine, zaman içinde hücre stabilitesini etkili bir şekilde koruduğu için balıklar için yoğunluk gradyanı ayrımı tercih edilir1. Bazı çalışmalar lökositleri yavru balıklardan başarılı bir şekilde izole etmiş olsa da, birçok araştırma hala esas olarak yetişkin popülasyonlara odaklanmaktadır17. Bununla birlikte, erken yaşam evreleri yalnızca hastalık salgınlarına karşı daha savunmasız olmakla kalmaz, aynı zamanda boyut olarak daha küçüktür, bu da örnekleme sürecini daha karmaşık ve zorlu hale getirir. Diğer bir sınırlama, lökosit canlılığının değerlendirilmesi hemen işlem gerektirdiğinden, mevcut yöntemlerin genellikle bir seferde sınırlı sayıda numune veya kopya ile sınırlı olmasıdır. Numune işlemedeki gecikmeler, hücresel canlılığı olumsuz etkileyebilir, böylece numune alma sürecine daha fazla komplikasyon getirebilir ve potansiyel olarak tüm işi tehlikeye atabilir.
Bildiğimiz kadarıyla, yayınlanan yöntemlerin hiçbiri, akış sitometrisi ile sonraki canlılık analizi için lökosit hücrelerini başarılı bir şekilde sabitlememiştir. Bu çalışma, güney Avrupa ülkelerinde yetiştirilen başlıca balık türü olan yavru çipuranın (Sparus aurata) baş böbreğinden lökositleri izole etmek için Percoll yoğunluk gradyan ayırma metodolojisi kullanarak etkili bir yöntem oluşturduğu için öncüdür. Ayrıca, akış sitometrisi yoluyla ana lökosit popülasyonlarını (lenfositler, monositler ve granülositler) tanımlarken canlıyı ölü hücrelerden ayıran gelişmiş bir boyama tabanlı teknik sunuyoruz. Geliştirilmiş protokol, işlemden 1 ay sonrasına kadar canlı hücre analizi sağlayan hücre fiksasyonunu gerektirir. Bu akış sitometrisi protokolünün uygulanması, bağışıklık değerlendirmeleri için tipik olarak gereken zaman ve çabayı önemli ölçüde azaltma potansiyeline sahiptir ve bu da onu su ürünleri yetiştiriciliği sektöründe hem araştırma hem de daha pratik uygulamalar için değerli bir teknik haline getirir. Bu metodolojinin uygulanması, çok sayıda numunenin analiz edilmesi, hücrelerin korunması ve akış sitometrisi ile gecikmeli analize izin verilmesi için avantajlar sağlar. Bu nedenle, balıkların bağışıklık mekanizmaları ve hücre canlılığının farklı çevresel veya deneysel koşullardan nasıl etkilendiği hakkında değerli bilgiler üretmek çok yardımcı olabilir. Ayrıca, bu canlılık testi, spesifik immün hücre popülasyonlarının multiparametrik fenotipik ve fonksiyonel karakterizasyonu ile entegre edilebilir. Bu yaklaşım, çeşitli immünolojik parametrelerin daha kapsamlı bir analizini mümkün kılar, bunları doğrudan ilgili hücre tiplerine bağlar ve bağışıklık tepkilerinin daha net bir şekilde anlaşılmasını sağlar. Bu bulgular, su ürünleri yetiştiriciliğinde hastalık yönetimi için geliştirilmiş yaklaşımlar da dahil olmak üzere daha etkili stratejilerin geliştirilmesine katkıda bulunabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu protokol, hayvan deneyleri konusunda sertifikalı araştırmacılar tarafından gerçekleştirilmelidir (AB fonksiyonları A ve B). Hayvanların işlenmesi ve numune toplanması ile ilgili tüm prosedürler, Avrupa Laboratuvar Hayvanları Bilimi Dernekleri Federasyonu'nun (FELASA) tavsiyelerine uygun olarak ARRIVE yönergelerine (Hayvan Araştırmaları: İn vivo Deneylerin Raporlanması) uygun olmalı ve hayvanların bakımı ve kullanımı için etik standartlara uymalıdır. Bu çalışma, tüm bu standartların yanı sıra Laboratuvar Hayvanları Bilimi için Portekiz mevzuatını da takip etmiştir (AB Direktifi 2010/63; 113/2013 sayılı Kanun Hükmünde Kararname). Araştırma, Gıda ve Veterinerlik Genel Müdürlüğü (DGAV) olarak bilinen Canlı Hayvanların Kullanımı Ulusal Otoritesi tarafından denetlenen IPMA'nın Hayvan Refahı ve Etik Kurumu (ORBEA, LABVIVOS-002-AquaClimAdapt) tarafından 20596/25-S etik izin numarası altında onaylandı.
1. Çalışma modeli ve organizmaların bakımı
NOT: Bu çalışma, ortalama ağırlığı 30,0 ± 5,0 g ve toplam uzunluğu 12,0 ± 2,0 cm olan yavru çipura (Sparus aurata) için özel olarak tasarlanmıştır. Farklı türler lökosit izolasyonunu, hücre fiksasyonunu ve canlılık değerlendirmesini etkileyebilecek benzersiz fizyolojik ve immünolojik özelliklere sahip olduğundan, bu yöntem diğer balık türlerine doğrudan uygulanmayabilir. Diğer türler için protokole uyarlamalar gerekebilir ve her hedef tür için koşulları optimize etmek için ön çalışmalar önerilir.
- Balıkları Alıştırın (Karantina Dönemi)
- Balıkları büyük kapasiteli tanklara eşit olarak dağıtın (örneğin, her biri toplam 660 L kapasiteli iki tank - Ek Şekil 1'e bakınız).
NOT: Kullanılacak tanklar, verimli su kullanımına ve su kalitesi üzerinde daha iyi kontrole izin veren bir Devridaim Su Ürünleri Sisteminin (RAS) parçası olabilir. Bir RAS'ta su, sistem içinde sürekli olarak geri dönüştürülür ve arıtılır, bu da balıklar için istikrarlı ve kontrollü bir ortam sağlar. Bu kurulum, balık sağlığı ve büyümesi için en uygun koşulların korunmasına, eşit dağılımın sağlanmasına ve çalışma sırasında stresin en aza indirilmesine yardımcı olur. - Optimal abiyotik koşulları koruyun.
- Balıkları doğal yaşam alanlarını taklit eden koşullar altında 3 hafta karantinada tutun:
sıcaklık: 20,0 ± 0,5 °C;
çözünmüş oksijen: 7,2 ± 0,2 mg/L;
tuzluluk: 35.0 ± 0.5 ‰;
pH: 8.0 ± 0.1 birim;
Fotoperiyot: 14 saat aydınlık/10 saat karanlık.
NOT: İdeal bakım koşulları farklı balık türleri arasında farklılık gösterebilir. Diğer türlerin farklı gereksinimleri olabilir, bu nedenle organizmaların sağlığını ve refahını sağlamak için bu koşulları hedef türün özel ihtiyaçlarına göre uyarlamak önemlidir. Ek olarak, deniz suyu sıcaklığı ve fotoperiyodu mevsimlere göre değişebilir, bu nedenle laboratuvarda doğal koşullar tekrarlanırken mevsimsel değişiklikler dikkate alınmalıdır.
- Balıkları doğal yaşam alanlarını taklit eden koşullar altında 3 hafta karantinada tutun:
- Balıkları büyük kapasiteli tanklara eşit olarak dağıtın (örneğin, her biri toplam 660 L kapasiteli iki tank - Ek Şekil 1'e bakınız).
- Deneysel çalışmayı başlatın.
- Her vaka çalışmasının deney kurulum tasarımına dayalı olarak gereken tank ve balık sayısını tanımlayın.
- Karantina süresinden sonra, balıkları bağımsız RAS'a aktarın (bkz. Ek Şekil 2).
- Sudaki aşırı organik bileşikleri gidermek için her sistemi protein sıyırıcılarla donatın; fiziksel filtrasyon (filtre torbası [400 μm], filtre süngeri ve cam yünü); biyolojik filtrasyon (biyo toplar [1.5"], ultraviyole su sterilizatörü ve batık hava taşları); her ikisi de her tanktaki sıcaklığı ayarlamak için sıcaklık sensörlerine sahip bilgisayarlı bir kontrol sistemine (ProfiLux) bağlı otomatik deniz suyu soğutma sistemleri ve dalgıç dijital ısıtıcılar; Çözünmüş oksijeni kontrol etmek için her tankta batık hava taşları.
- Deneye devam etmeden önce balıkları yeni sistemlerde 2 hafta boyunca alıştırın.
- Günlük bakım gerçekleştirin
- Her kuluçka tankından balık dışkısını çıkarın ve %25 deniz suyu yenilemesi yapın.
- Taşınabilir bir hassas termometre kullanarak sıcaklığı ölçün.
- Çok parametreli bir ölçüm cihazı kullanarak diğer deniz suyu abiyotik parametrelerini (tuzluluk, çözünmüş oksijen ve pH) izleyin.
- Deney boyunca stabiliteyi sağlamak için deniz suyu abiyotik parametrelerini gerektiği gibi ayarlayın.
NOT: Deney sistemlerindeki abiyotik koşullar, her vaka çalışmasının özel gereksinimlerine bağlı olarak değişebilir. Örneğin, çalışma mevsimsel değişiklikleri veya deniz ısı dalgalarını simüle etmeyi amaçlıyorsa, sıcaklık ve fotoperiyot, doğal mevsimsel değişimleri taklit edecek şekilde buna göre ayarlanmalıdır. Benzer şekilde, çalışma hipoksik koşulları veya okyanus asitlenmesini simüle etmeye odaklanıyorsa, deniz suyunun oksijen seviyelerinde ve pH'ında ayarlamalar yapılmalıdır. Bu, deneysel koşulların mümkün olduğunca gerçekçi ve ilgili olmasını sağlayarak çalışmanın bulgularının geçerliliğini ve uygulanabilirliğini artırır. - 1.2.4.6-1.2.4.8 adımlarında açıklandığı gibi stres veya hastalık belirtilerini belirleyerek ve yöneterek balığın sağlığını ve refahını değerlendirin.
- Düzensiz yüzme, iştahsızlık, uyuşukluk, saldırganlık veya izolasyon gibi anormal davranışları arayın.
- Lezyonlar, ülserler, renk değişikliği, kenetlenmiş yüzgeçler, aşırı mukus veya hızlı solungaç hareketi dahil olmak üzere hastalık belirtilerini kontrol edin.
- Tüm gözlemleri, tarihi ve alınan eylemleri not ederek kaydedin.
- Haftalık su kalitesi testleri yapın.
- Kolorimetrik testler kullanarak amonyak (NH3/NH4), nitrit (NO2-) ve nitrat (NO3-) seviyelerini ölçün.
NOT: Tüm bu parametrelerin algılanabilir seviyelerin altında olduğundan emin olun. Seviyeler sınırları aşarsa, ek bir su değişimi yapın, havalandırmayı artırın veya filtrelemeyi ayarlayın.
- Kolorimetrik testler kullanarak amonyak (NH3/NH4), nitrit (NO2-) ve nitrat (NO3-) seviyelerini ölçün.
- Balık beslenmesini besleyin ve izleyin.
- Yavru balıkların özel beslenme gereksinimlerini karşılayan yüksek kaliteli bir diyet sağlayın (diyetin ayrıntılı bileşiminin bir örneği için Ek Tablo 1'e bakınız).
NOT: Su yemi peletlerinin boyutunun (2-3 mm) yavrular için uygun olduğundan emin olun, yutmayı ve sindirimi kolaylaştırır. - Yem miktarını, balığın günlük ortalama vücut ağırlığının %2'sine karşılık gelecek şekilde ayarlayın.
- Balıkları günde iki kez manuel olarak besleyin - sabahları ve öğleden sonra bir kez (istikrarlı bir besleme rutini sürdürmek için belirli bir zaman ayarlayın).
- Yavru balıkların özel beslenme gereksinimlerini karşılayan yüksek kaliteli bir diyet sağlayın (diyetin ayrıntılı bileşiminin bir örneği için Ek Tablo 1'e bakınız).
2. Balık örneklemesi, ötenazi, diseksiyon ve kafa böbrek toplama
- Balıkları tanklardan tadın.
- Örnekleme yanlılığını önlemek için tanklardan rastgele balık seçin.
- Balıkları tank suyuyla dolu geçici bir tutma kabına nazikçe aktarmak için bir ağ kullanın.
NOT: Stresi azaltmak için işlem süresini en aza indirin.
- Ötenazi solüsyonunu hazırlayın.
- Balığı tutmak için uygun bir kap (örneğin 3 L'lik bir kova) kullanın.
- 200-300 mg / L18'lik bir nihai konsantrasyon elde etmek için uygun miktarda Trikain (MS-222) deniz suyunda çözün (DİKKAT: Ek Tablo 2 ve Ek Dosya 1'e bakınız).
- Çözeltiyi sodyum bikarbonat ile 7.2-7.5 pH'a kadar tamponlayın.
- Ötenazi çözümünü uygulayın.
- Balıkları en az 10 dakika boyunca veya operküler hareketin durması ve refleks kaybı gözlenene kadar ötenazi solüsyonuna yerleştirin (dış uyaranlara yanıt verip vermediğini kontrol ederek ötenaziyi onaylayın).
- Balığın vücut ağırlığını (g) ve toplam uzunluğunu (cm) kaydedin.
- Balık diseksiyonu yapın.
NOT: Optimum numune kalitesini ve hücre canlılığını sağlamak için, diseksiyon işlemi mümkün olan en kısa sürede, ideal olarak ötenaziden sonraki 5 dakika içinde tamamlanmalıdır.- Numune alma ve işleme sırasındaki dalgalanmaları en aza indirmek için klima kullanarak laboratuvar sıcaklığının 19 °C'de tutulduğundan emin olun.
- Diseksiyon aletlerini sterilize edin (mümkünse tercihen metal aletleri otoklavlayın) ve %70 etanol ile temiz bir çalışma alanı oluşturun (DİKKAT, Ek Tablo 2'ye bakınız).
- Ötenazi yapılmış balığı, başı baskın olmayan ele bakacak şekilde steril bir diseksiyon tepsisine yan yatırın.
- Bir neşter kullanarak, balığın ventral orta hattı boyunca havalandırma deliğinden (anüs) solungaçlara doğru dikkatli bir kesi yapın.
NOT: İç organlara zarar vermemek için çok derin kesmemeye dikkat edin. - Kesiyi uzatmak ve iç organları ortaya çıkarmak için dikkatlice diseksiyon makası kullanın. İç anatominin net bir görüntüsünü sağlamak için vücut duvarı kanatlarını nazikçe kaldırın.
- Baş böbreği bulun: Baş böbrek, solungaçların hemen arkasında, vücut boşluğunun ön sırt bölgesinin yakınında bulunur ve vücut boşluğunun üst tarafı boyunca, vertebral kolonun altına uzanır.
NOT: Baş böbreği tipik olarak çevre dokulara kıyasla daha koyu renklidir (Şekil 1). - Baş böbreği daha iyi görselleştirmek için yağ ve bağ dokusu gibi çevredeki dokuları dikkatlice temizleyin.
NOT: Bu adım, baş böbreğine zarar vermemek için hassas kullanım gerektirir. - İnce uçlu forseps ve makas kullanarak, baş böbreğini dikkatlice kaldırın ve çevresindeki dokulardan kurtarmak için etrafında hassas kesikler atın.
NOT: Hasarı önlemek için dokuyu nazikçe tutun. Yaklaşık 30 gr ağırlığındaki bir balıkta baş böbreğin 20-30 mg civarında olması beklenir. - Steriliteyi sağlamak ve sonraki işlem adımlarını kolaylaştırmak için eksize edilen organı hemen steril bir Petri kabı içindeki bir hücre süzgecine (100 μm naylon ağ) yerleştirin.
NOT: Bu noktadan itibaren, hücre canlılığını korumak için tüm adımlar mümkün olduğunca çabuk (5 dakika içinde) gerçekleştirilmelidir. Numuneyi serin tutmak için, buzla dolu ve alüminyum folyo ile kaplanmış bir kaba yerleştirilmiş Petri kabı ile aşağıdaki adımları gerçekleştirin.

Şekil 1: Baş böbreğin pozisyonu: (A) Baş böbreğin solungaçların arkasındaki ve vücut boşluğunun ön sırt bölgesi boyunca tipik konumunu gösteren çizim; (B) Çipurada baş böbreğinin, çevre dokulara kıyasla daha koyu rengini vurgulayan temsili görüntüsü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Baş böbrek lökositlerinin izolasyonu (Şekil 2)
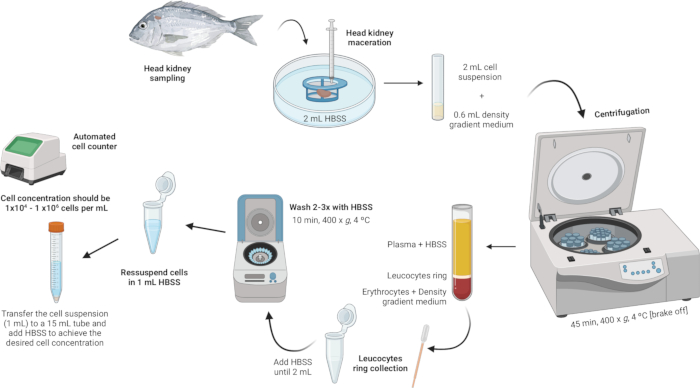
Şekil 2: Baş böbrekten lökosit izolasyonunun açıklayıcı açıklaması. Protokol birkaç adımdan oluşur: dokunun homojenizasyonu ile başlayan, ardından yoğunluk gradyan santrifüjlemesi, lökosit halkasının toplanması, lökosit halkasının yıkanması ve hücre konsantrasyonunun yeniden süspansiyonu ve ayarlanması ile sonuçlandırılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Dokuyu homojenize edin.
- 2 mL Hanks'in Dengeli Tuz Çözeltisini (HBSS) steril bir Petri kabına koyun.
- Hücre süzgecinin ağının (100 μm naylon ağ) HBSS ile temas halinde olduğundan ancak tamamen suya batırılmadığından emin olun.
- Bir şırınganın pistonunu kullanarak hücre süzgeci üzerindeki baş böbreği yumuşatın. Organ parçalarını naylon ağdan geçirmeye zorlamak için hafif bir baskı uygulayın ve bir hücre süspansiyonu oluşturun.
NOT: Birden fazla numune işleniyorsa, hücre süspansiyonunu içeren Petri kabı bir sonraki adıma kadar buzdolabında 4 °C'de birkaç dakika saklanabilir. Bu hücre süspansiyonu lökosit izolasyonu için kullanılacaktır.
- Yoğunluk gradyan santrifüjlemesi gerçekleştirin.
- Yoğunluğu 1.077 g/mL, ozmolaritesi 353 mOsm/kg ve pH'ı 7.4 olan bir yoğunluk gradyan orta çözeltisi hazırlayın (bkz. Ek Dosya 1).
NOT: Ozmolarite farklı balık türleri arasında farklılık gösterebilir, bu nedenle yoğunluk gradyan ortam çözeltisinin ozmolaritesini her türün özel gereksinimlerini karşılayacak şekilde ayarlamak çok önemlidir. - 5 mL polistiren yuvarlak tabanlı tüplerde, dikkatlice 600 μL yoğunluk gradyan orta çözeltisi ekleyin.
- Hücre süspansiyonunu (2 mL) alın ve yoğunluk gradyan ortamını içeren tüpe yavaşça ekleyin. İlk damla çok önemlidir - yoğunluk gradyanı orta fazının dengesini bozmamak için çok nazikçe ekleyin.
NOT: Bu, 3:10 oranında yapılmalıdır (Yoğunluk gradyanı ortamı: Hücre süspansiyonu). Hassas ve nazik ekleme için steril 1 mL Pasteur pipeti kullanın. Yoğunluk gradyanlı orta tabakanın bozulmasını önlemek için pipetin ucunun tüpün yan tarafına temas ettiğinden emin olun. Numuneyi yoğunluk gradyan ortamıyla karıştırmaktan kaçının. - Tüpleri fren kapalıyken 4 ° C'de 45 dakika boyunca 400 x g'da santrifüjleyin. Bu, işlem sırasında katmanların bozulmadan kalmasını sağlar.
NOT: Santrifüjlemeden sonra, farklı katmanlar görünür olmalıdır. Lökositler, yoğunluk gradyan ortamı ile hücresel kalıntı peleti arasındaki arayüzde bir halka oluşturacaktır (Şekil 3).
- Yoğunluğu 1.077 g/mL, ozmolaritesi 353 mOsm/kg ve pH'ı 7.4 olan bir yoğunluk gradyan orta çözeltisi hazırlayın (bkz. Ek Dosya 1).
Şekil 3: Lökositler, yoğunluk gradyan ortamı ile hücresel kalıntı peleti arasındaki arayüzde halkalanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Lökosit halkasını toplayın.
- Steril bir Pasteur pipeti kullanarak, lökosit halkasını (~ 100 μL) nazikçe aspire edin ve 2 mL'lik bir mikrosantrifüj tüpüne aktarın.
NOT: Kontaminasyonu önlemek için katmanları önemli ölçüde rahatsız etmemeye dikkat edin. Lökosit halkası kalıntı veya koyu süspansiyonlar içeriyor gibi görünüyorsa, saflığı sağlamak için toplanan lökosit süspansiyonunun yeni bir mini hücre süzgecinden (100 μm) geçirilmesi tavsiye edilir. Mini hücre süzgecini 2 mL mikrosantrifüj tüpünün üzerine yerleştirin ve lökosit süspansiyonunu süzgeçten yavaşça aktarın.
- Steril bir Pasteur pipeti kullanarak, lökosit halkasını (~ 100 μL) nazikçe aspire edin ve 2 mL'lik bir mikrosantrifüj tüpüne aktarın.
- Lökosit halkasını yıkayın.
- Hacim 2 mL'ye ulaşana kadar lökosit halkasını içeren mikrosantrifüj tüplerine HBSS ekleyin ve hücreleri yavaşça yeniden süspanse edin.
NOT: Numuneyi düşük sıcaklıkta tutmak için tüpleri buzla dolu ve alüminyum folyo ile kaplı bir kapta saklayın. Tüplerin buzla doğrudan temas etmediğinden emin olun. Yıkama işlemi boyunca bu soğutma kurulumunu koruyun. - Numuneleri 400 × g'da 4 °C'de 10 dakika santrifüjleyin (fren açık olabilir).
- Santrifüjlemeden sonra, süpernatanı dikkatlice atın ve peleti altta bırakın (neredeyse görünmez olabilir).
- Pelet safsızlıklardan arınana kadar yıkama adımlarını tekrarlayın (HBSS ekleme, yeniden süspanse etme, santrifüjleme ve süpernatantın atılması).
- Hacim 2 mL'ye ulaşana kadar lökosit halkasını içeren mikrosantrifüj tüplerine HBSS ekleyin ve hücreleri yavaşça yeniden süspanse edin.
- Hücre konsantrasyonunu yeniden askıya alın ve ayarlayın.
- Hücreleri, yıkamalar için kullanılan aynı 2 mL mikrosantrifüj tüpleri içinde 1 mL HBSS'de yeniden süspanse edin.
- mL başına 1 ×ila 104 ila 1 × 106 hücre arasında bir hücre konsantrasyonu elde edin. İlk pelet büyükse, hücre konsantrasyonunu istenen aralığa seyreltmek için ek HBSS gerekebilir. Hücre süspansiyonunu 15 mL'lik bir tüpe aktarın ve elde edilen hücre sayımlarına bağlı olarak gerektiği kadar daha fazla HBSS ekleyin.
NOT: İşlemi kolaylaştırmak için otomatik bir hücre sayacının kullanılması önerilir.
4. Lökositlerin boyanması ve fiksasyonu (Şekil 4)
NOT: LIVE/DEAD Sabitlenebilir Ölü Hücre Leke Kitleri, akış sitometrisi kullanarak sabit hücrelerde hücre canlılığını değerlendirmek için gelişmiş bir yöntem sağlar. Bu tahliller, hücresel aminlerle etkileşime giren floresan reaktif bir boya kullanır. Hücre zarları tehlikeye girerse, boya hücrelere nüfuz edebilir, hem hücre içinde hem de hücre yüzeyinde serbest aminlerle reaksiyona girerek yoğun floresan lekelenmesine neden olabilir. Tersine, canlı hücrelerde, boya ile reaksiyona girmek için sadece hücre yüzeyi aminleri mevcuttur ve bu da nispeten loş lekelenmeye yol açar. Boyama yoğunluğu, mikroorganizmaların büyümesini önleyerek numuneyi de koruyan formaldehit ile fiksasyonun ardından korunur. CANLI/ÖLÜ Sabitlenebilir Ölü Hücre Leke Kitleri, floresan boya dışında aynıdır - mavi, mor, su, sarı, yeşil, kırmızı, uzak kırmızı veya IR'ye yakın (kızılötesi) renklerde mevcuttur. Bu çalışmada Near-IR floresan reaktif boya kullanılmıştır. Ek olarak, bu tek renkli tahlil, çok renkli bir deneyde diğer parametrelerin paralel olarak test edilmesine izin verir.
- Boyayı hazırlayın.
- Reaktifleri oda sıcaklığına (RT) getirin: Kapakları çıkarmadan önce bir floresan reaktif boya şişesinin ve susuz dimetil sülfoksit (DMSO) şişesinin RT'ye ulaşmasına izin verin.
- Boyayı sulandırın: Reaktif boyayı içeren şişeye 50 μL DMSO ekleyin. İyice karıştırın ve boyanın tamamen çözüldüğünden emin olun.
- Sulandırılmış boya çözeltisini mümkün olan en kısa sürede, tercihen birkaç saat içinde kullanın.
NOT: Her kit, en az 40 hücre örneğini lekelemek için yeterli malzeme sağlayan beş ayrı reaktif boya şişesi içerir. Bununla birlikte, sulandırıldıktan sonra, boyanın DMSO çözeltisi, özellikle neme maruz kaldığında nispeten kararsızdır. Kullanılmayan kısımlar, ışık ve nemden korunarak ≤-20 °C'de 2 haftaya kadar saklanabilir.
- Hücreleri boyayın ve sabitleyin.
NOT: Hücre boyama için uygun tamponlar, sığır serum albümini veya serumu gibi yabancı proteinler içermedikleri sürece Hanks'in Dengeli Tuz Çözeltisi (HBSS), fosfat tamponlu salin (PBS) ve Dulbecco'nun PBS'SINI (D-PBS) içerir. Amino-reaktif bir boya kullanırken, hücre yeniden süspansiyonu ve yıkaması için Tris tamponlarından ve sodyum azid veya yabancı protein içeren çözeltilerden kaçının. Bu çalışmada, ozmotik dengenin korunmasına yardımcı olan ve boyama işlemi sırasında hücre metabolizmasını ve canlılığını desteklemek için esansiyel iyonlar ve glikoz sağlayan dengeli iyon bileşimi nedeniyle HBSS'yi kullandık. HBSS ayrıca yabancı proteinler içermez, reaktif boya ile etkileşimi önler ve doğru canlılık değerlendirmesi sağlar.- Hücreleri saydıktan ve yoğunluğu HBSS ile mL başına 1 x 106 hücre olarak ayarladıktan sonra, bu hücre süspansiyonunun 1 mL'sini 2 mL mikrosantrifüj tüplerine aktarın.
- Her gün için, canlı ve ölü hücreler arasındaki floresan yoğunluğu eşiğini ayarlamak için kontrol olarak kullanılacak en az bir örnekte hücre ölümünü indükleyin. Numuneleri mikrosantrifüj tüplerinde aşağıdaki gibi hazırlayın:
Tüp 1: Canlı hücreler - lekesiz
Tüp 2: Canlı hücreler - lekeli
Tüp 3: Ölü hücreler - lekesiz
Tüp 4: Ölü hücreler - lekeli
NOT: Bu dört tüpün kontrol olarak her deneyde yalnızca tek bir numune için hazırlanması gerekir. Kalan numuneler için sadece iki tüp gereklidir (Tüp 1: numune - lekesiz ve Tüp 2: numune - lekeli), çünkü canlı olan hücreler ve ölü olan hücreler hakkında bilgi sağlayacaktır.
- Her gün için, canlı ve ölü hücreler arasındaki floresan yoğunluğu eşiğini ayarlamak için kontrol olarak kullanılacak en az bir örnekte hücre ölümünü indükleyin. Numuneleri mikrosantrifüj tüplerinde aşağıdaki gibi hazırlayın:
- Hücre ölümü için pozitif kontrol: Isıl işlemle hücre ölümünü indüklemek için etiketli tüpü Ölü lekelenmemiş (Tüp 3) ve Ölü lekeli (Tüp 4) 50 °C'de 7 dakika su banyosuna yerleştirin.
- Hücrelerin boyanması: Tüp 2 ve 4'te (boyanacak tüpler) 1 μL sulandırılmış floresan reaktif boyadan (adım 4.1.2'den itibaren) 1 mL hücre süspansiyonuna ekleyin ve iyice karıştırın.
- Işıktan korunarak RT'de 30 dakika inkübe edin.
NOT: Sabitleme gerekmiyorsa, aşağıdaki 4.2.5-4.2.7 adımlarını atlayabilirsiniz. Bunun yerine, hücreleri iki kez% 1 sığır serum albümini ile 1 mL HBSS ile yıkayın (Ek Dosya 1'e bakınız) ve% 1 sığır serum albümini ile 1 mL HBSS'de yeniden süspanse edin. Analizi akış sitometresinde mümkün olan en kısa sürede gerçekleştirin; Aksi takdirde, hücreler sabit olmadığı için hücre canlılığı tehlikeye girebilir. - Hücreleri 1 mL HBSS ile iki kez yıkayın ve hücreleri 900 μL HBSS'de yeniden süspanse edin.
- 100 μL %37 formaldehit ekleyin (DİKKAT, Ek Tablo 2'ye bakınız).
- RT'de 15 dakika inkübe edin.
- % 1 sığır serum albümini (BSA) ile 1 mL HBSS ile iki kez yıkayın, daha sonra% 1 BSA ile 1 mL HBSS'de hücreleri yeniden süspanse edin.
- Numuneleri buzdolabında 4 °C'de saklayın. Fiksasyondan sonraki 1 ay içinde hücreleri analiz edin.
- Uygun uyarma ve algılama kanalını kullanarak sabit hücre süspansiyonunu akış sitometrisi ile analiz edin.
NOT: Doğru uyarma ve algılama kanalları, kullanılan cihaza göre farklılık gösterebilir (bkz. Ek Tablo 3).
- Hücreleri saydıktan ve yoğunluğu HBSS ile mL başına 1 x 106 hücre olarak ayarladıktan sonra, bu hücre süspansiyonunun 1 mL'sini 2 mL mikrosantrifüj tüplerine aktarın.
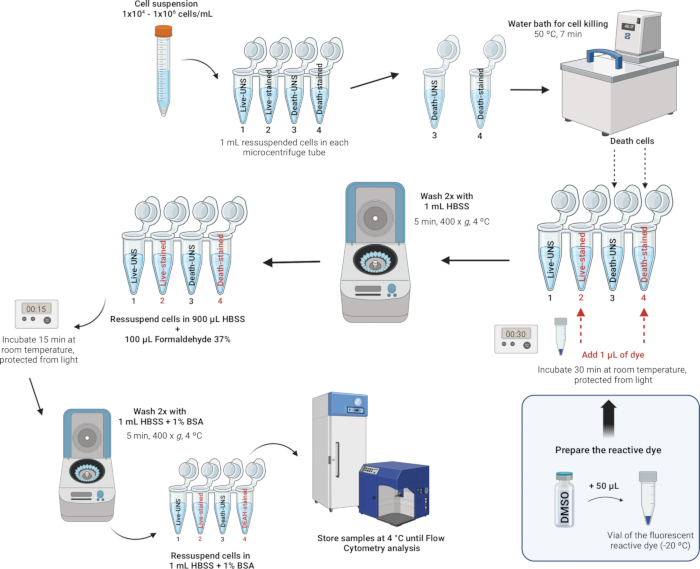
Şekil 4: Lökositlerin boyanması ve fiksasyonunun açıklayıcı açıklaması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Akış sitometrisi
- Veri elde edin.
NOT: Akış sitometresi üzerinde izlenecek prosedürler, kullanılan spesifik sitometreye bağlı olarak değişebilir. Bu çalışmada veriler Attune NTx flow sitometresi kullanılarak elde edilmiştir.- Örnekleri çalıştırın.
- Numune tüpünü numune portuna yerleştirin.
- Başlat düğmesine basarak edinmeye başlayın ve ardından olay hızı (olay/saniye) dengelendiğinde kayda tıklayın.
- Güvenilir analiz için tekil kapıdaki her örnek için en az 10.000 olay kaydedin.
- Her örnek için tüm verileri kaydedin ve harici sürücülerde veya bulut depolamada yedekleyin.
- Verileri analiz edin.
NOT: Akış Sitometrisi analizi için çeşitli yazılım seçenekleri mevcuttur. Bu çalışmada FlowJo v10.8.119 kullanılarak veri analizi yapılmıştır.- Veri dosyalarını yükleyin: Akış sitometrisi analiz yazılımını başlatın ve deneyden alınan .fcs dosyalarını karşıya yükleyin.
- Verileri görselleştirin (Şekil 5A): Hücre boyutunu ve ayrıntı düzeyini değerlendirmek için ileri saçılma (FSC-A) (XX) ve yan saçılma (SSC-A) (YY) grafiğini çizin.
NOT: Bu grafik, hücre popülasyonlarını tanımlamak ve saçılma özelliklerine göre kalıntıları dışlamak için yaygın olarak kullanılır. - Tek hücre geçiti ve çoğul dışlama (Şekil 5B): Çokları dışlamak için ileri saçılma alanı (FSC-A) ve ileri saçılma yüksekliği (FSC-H) grafiğini kullanın. Grafikte hizalanmış tüm olayları dahil etmek (tek hücreler) ve hizalanmamış olayları hariç tutmak (çoğullar) için bir geçit çizin. Numunede çok düşük FSC'ye sahip olaylar varsa, bunları tek hücrenin kapısına dahil etmeyerek hariç tutun, yalnızca tekli hücreler kalır.
- Lökosit popülasyonlarının tanımlanması (Şekil 5C): FSC-A/SSC-A profiline göre 3 lökosit popülasyonunu ayırt edin: FSC-Ayüksek/SSC-Ayüksek granülositler, FSC-Aortamı/SSC-Aortamı monositler ve FSC-Adüşük/SSC-Adüşük lenfositlerdir.
- Canlılık kapısı (Şekil 5D): İlgili floresan kanalında (NIR, RL3-A) canlılık boya boyama eşiğini ayarlayın. Canlı ve ölü hücreler, CANLI/ÖLÜ Düzeltilebilir Ölü Hücre Boyası ile boyama yoğunluğuna göre tanımlanır: sönük lekeli hücreler canlı hücreler olarak tanımlanır ve güçlü lekeli hücreler ölü hücreler olarak tanımlanır.
- Nüfus istatistikleri: Her bir kapıdaki toplam olaylar (hücreler) ve toplam ve kapılı hücrelerin yüzdeleri dahil olmak üzere yazılım tarafından sağlanan istatistiklere bakın.
- Verileri dışa aktar: Verileri bir elektronik tabloya aktarın ve daha fazla istatistiksel analiz için uygun istatistiksel yazılımı (GraphPad Prism veya R) kullanın.
NOT: Analiz yöntemlerinin seçimi, araştırmanın amaçlarına bağlı olacaktır.
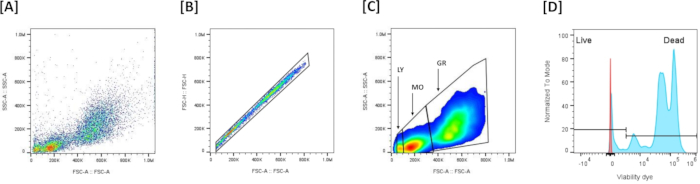
Şekil 5: Baş böbrek hücrelerinde canlılık değerlendirmesi için akış sitometrisi geçit stratejisi: (A) Toplanan tüm olayların FSC-A/SSC-A profilini temsil eder. (B) İleri Dağılım (FSC-A)/İleri Saçılma (FSC-H) grafiğindeki doğrusallığa dayalı tekil bölge tanımına dayalı olarak çoğul dışlamayı temsil eder. (C) Çoğullar hariç tutulduktan sonra FSC-A/SSC-A'ya dayalı olarak tanımlanan 3 ana popülasyonu temsil eder. (D) Canlı/Ölü Canlılık boya lekelenmesini gösteren bir histogramı temsil eder. Canlı ve ölü hücreleri ayırt etmeye izin veren eşiği oluşturmak için, lökositler hafif ısı şokuna (50 ° C, 7 dakika) tabi tutuldu ve daha sonra canlı boya ile boyandı. Yüksek boyama yoğunluklu pozitif hücreler (++) ölü hücrelerdir ve düşük boyanan pozitif hücreler (+-) canlı hücrelerdir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Şekil 6, juvenil gilthead çipuranın (Sparus aurata) baş böbreğinden izole edilen lökosit popülasyonlarını ve bu çalışmada açıklanan protokolü kullanarak hücre canlılığını gösteren temsili akış sitometrisi verilerini sunmaktadır. Şekil, iki numuneyi karşılaştırmaktadır: biri balığın optimal koşullara maruz kaldığı yüksek hücresel canlılığa sahip (Şekil ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu çalışmada geliştirilen yöntem, balık immünolojisi araştırmalarında önemli bir ilerlemeyi temsil etmekte ve balıkların bağışıklık tepkilerinin anlaşılmasını ve deniz kaynaklarının sürdürülebilirliğini geliştirmeyi vaat etmektedir. S. aurata , Sparidae familyasına ait değerli bir deniz balığı türüdür ve ekolojik ve ekonomik öneminin yanı sıra fizyoloji, immünoloji, toksikoloji ve su ürünleri yetiştiriciliği gibi çeşitli çalışma ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar, araştırmayı, analizi, veri yorumlamayı, yazmayı veya makaleyi yayınlanmak üzere gönderme kararını etkileyebilecek hiçbir finansal, kişisel veya profesyonel çıkar çatışması beyan etmezler.
Teşekkürler
Bu çalışma, Aqua-CLIMADAPT (PTDC/CTA-AMB/0592/2021, https://doi.org/10.54499/PTDC/CTA-AMB/0592/2021) projesi çerçevesinde Fundação Portuguesa para a Ciência e Tecnologia (FCT I.P.) tarafından desteklenmiştir. FCT/MCTES (sırasıyla UIDB/04378/2020 ve UIDB/50006/2020) ulusal fonları tarafından finanse edilen Uygulamalı Moleküler Biyobilimler Birimi (UCIBIO) ve Yeşil Kimya Araştırma Birimi için İlişkili Laboratuvar – LAQV tarafından desteklenen BioLab'ın yanı sıra Sağlık ve Biyoekonomi için Ortak Laboratuvar Enstitüsü – i4HB (LA/P/0140/2020) tarafından finanse edilmektedir. Bu çalışma aynı zamanda GLYCOTwinning projesi (Hibe Sözleşmesi No. 101079417) aracılığıyla Avrupa Komisyonu ve InnoGlyco (2022.04607.PTDC) aracılığıyla FCT tarafından da desteklenmiştir. Isa Marmelo ayrıca doktora bursu için FCT IP'yi kabul eder (2020.04413.BD, https://doi.org/10.54499/2020.04413.BD).
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
Referanslar
- Samaï, H. C., et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93(2023).
- Lulijwa, R., et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A., et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498(2022).
- Titus, J., et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142(2024).
- Marmelo, I., et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135(2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955(2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change. Biol Lett. 20 (2), 20230346(2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398(2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á, Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R., et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. , American Veterinary Medical Association. Schaumburg, IL. (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). , At https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software (2023).
- Mhalhel, K., et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008(2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739(2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á, Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á, Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M. -A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır