É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento, Fixação e Caracterização de Leucócitos Renais Juvenis de Cabeça de Dourada por Citometria de Fluxo
Neste Artigo
Resumo
Este manuscrito descreve o isolamento e fixação de leucócitos extraídos da cabeça-rim de dourada e a avaliação da sua viabilidade por citometria de fluxo. Este trabalho contribui para a padronização de protocolos e alavanca o processamento de um maior número de amostras sem comprometer a qualidade das amostras, promovendo avanços no conhecimento da imunologia de peixes.
Resumo
A imunidade é crucial para a regulação fisiológica dos organismos, servindo como a principal defesa contra patógenos e estressores ambientais. O isolamento e a análise de células imunes fornecem informações importantes sobre as respostas imunes a pressões externas. No entanto, a falta de protocolos harmonizados para espécies menos estudadas, como peixes marinhos, muitas vezes leva a desafios técnicos e analíticos que dificultam a interpretação dos dados e uma compreensão completa das respostas imunes específicas da espécie. Este estudo teve como objetivo estabelecer um procedimento analítico otimizado baseado em citometria de fluxo para caracterizar e determinar a viabilidade de leucócitos do rim da cabeça (o principal órgão hematopoiético em peixes teleósteos) de juvenis de dourada (Sparus aurata). O procedimento começou com o isolamento de leucócitos por meio de um processo de homogeneização usando solução salina balanceada de Hanks, seguido por um método otimizado de centrifugação com gradiente de densidade de Percoll para garantir altas taxas de recuperação de leucócitos com contaminação mínima de eritrócitos necessária para uma análise eficiente de citometria de fluxo subsequente. Além disso, uma nova técnica usando um corante reativo celular (LIVE/DEAD Fixable Dead Cell Stain Kit) foi empregada para distinguir células viáveis de mortas com base em seus padrões de coloração fluorescente. A fixação foi realizada com formol a 3,7%, preservando a morfologia celular, a viabilidade e a eficiência da coloração. A análise por citometria de fluxo identificou com sucesso três populações predominantes de leucócitos: linfócitos, monócitos e granulócitos. Este método não só permitiu testes de viabilidade, mas também a diferenciação precisa dos tipos de células. A melhoria nos protocolos de citometria de fluxo representa um passo à frente na imunologia de peixes, aumentando a precisão e a eficiência da análise de células imunes. Além disso, ao permitir a fixação de células para posterior análise, este protocolo reduz significativamente o tempo e o esforço necessários para avaliações imunológicas, tornando-o uma ferramenta valiosa tanto para pesquisa quanto para aplicações práticas em vários campos de pesquisa.
Introdução
A imunidade desempenha um papel central na regulação fisiológica dos organismos, atuando como uma defesa primária contra uma ampla gama de patógenos e estressores ambientais1. Como outros vertebrados, os peixes têm um sistema imunológico complexo, dinâmico e coordenado, essencial para sua saúdee bem-estar geral.
Os peixes teleósteos possuem sistemas imunológicos inatos e adaptativos, que funcionam simultaneamente para detectar, responder e neutralizar invasores nocivos2. O sistema imunológico inato atua como a primeira linha de defesa, fornecendo respostas imediatas e não específicas aos patógenos2, enquanto o sistema imunológico adaptativo se desenvolve ao longo do tempo, oferecendo uma resposta mais especializada que permite aos peixes reconhecer patógenos específicos e estabelecer memória imunológica3. O sistema imunológico dos peixes depende de órgãos linfóides primários especializados (ou seja, timo e rim da cabeça) e órgãos linfóides secundários (por exemplo, baço e tecidos linfóides associados à mucosa (MALT)) para apoiar a defesa imunológica e manter a saúde geral4. O rim da cabeça é o principal órgão hematopoiético dos peixes teleósteos e desempenha um papel crucial no desenvolvimento e maturação das células imunes, incluindo os leucócitos5.
Nos últimos anos, progressos significativos foram feitos no estudo das respostas imunes de várias espécies de peixes2. Uma área-chave de foco tem sido a compreensão das populações de leucócitos e sua atividade. Os leucócitos, também conhecidos como glóbulos brancos, são geralmente classificados em monócitos, linfócitos e granulócitos e desempenham um papel crucial na defesa imunológica dos peixes. Possuem células fagocíticas, que são responsáveis por engolir e destruir patógenos e liberar espécies bactericidas reativas de oxigênio, contribuindo para a eliminação de microrganismos invasores6. Os leucócitos também estão envolvidos no processo inflamatório, ajudando a isolar e erradicar infecções enquanto promovem o reparo tecidual6. A abundância e a atividade das populações de leucócitos são importantes indicadores do estado imunológico na saúde e doença animal 7,8.
Alguns estudos demonstraram que fatores de estresse, como condições ambientais adversas, podem alterar o número e a morfologia dos eritrócitos e a composição dos leucócitos circulantes 9,10. Por exemplo, conforme revisado por Franke et al. (2024), é crucial estudar o sistema imunológico dos peixes em cenários de mudanças climáticas, pois os estressores ambientais podem comprometer a imunidade dos peixes, aumentar a suscetibilidade a doenças e aumentar a infectividade de certos patógenos, acelerando a progressão da doença11. Além disso, entender a imunidade dos peixes é essencial não apenas para avançar na pesquisa biológica fundamental, mas também para apoiar vários setores da sociedade, como a indústria da aquicultura. À medida que a aquicultura continua a se expandir globalmente, garantir a saúde e o bem-estar das espécies de peixes cultivadas está se tornando cada vez mais importante. No entanto, o bem-estar dos peixes continua sendo uma área de pesquisa relativamente nova, e as respostas imunológicas dos peixes cultivados ainda exigem avaliações completas e padronizadas. Priorizar os estudos de resposta imune é de extrema importância, pois as informações adquiridas podem aumentar a sustentabilidade e a produtividade da aquicultura por meio de abordagens eficazes e personalizadas que melhoram o bem-estar e a resiliência dos animais de criação.
A quantificação e identificação de leucócitos geralmente são realizadas por métodos hematológicos, como contagem manual com hemocitômetros de Bürker, Neubauer ou Thoma, além de esfregaços de sangue corados 7,10. Para auxiliar na visualização e diferenciação das células sanguíneas, kits de coloração, como Wright, May-Grünwald-Giemsa e Hemacolor, são frequentemente empregados 7,12. No entanto, essas técnicas manuais de contagem de células são tediosas, demoradas e propensas a erros humanos 8,10. Fontes comuns de erro incluem mistura ou diluição inadequada do sangue, problemas de coloração e carregamento incorreto da câmara do hemocitômetro, o que pode levar a contagens de células imprecisas12. Além disso, a análise hematológica manual requer um alto nível de conhecimento e experiência para garantir a confiabilidade e reprodutibilidade dos resultados7. À medida que aumenta a demanda por ferramentas de diagnóstico precisas e eficientes, o desenvolvimento de métodos inovadores que fornecem uma compreensão profunda do estado imunológico das populações de peixes torna-se um passo cada vez mais importante no avanço desse campo.
A citometria de fluxo emergiu como uma ferramenta poderosa neste contexto, oferecendo uma abordagem quantitativa de alto rendimento para analisar as populações de leucócitos e a viabilidade celular8. Essa moderna tecnologia de diagnóstico permite a rápida detecção, contagem e caracterização de células individuais em populações mistas com notável precisão13. Além disso, a citometria de fluxo permite medições multiparamétricas simultâneas para caracterização fenotípica e funcional. Embora amplamente utilizado em ambientes clínicos humanos e medicina veterinária, sua aplicação no estudo de leucócitos de peixes permanece muito limitada8. Embora algumas pesquisas tenham sido realizadas em diferentes espécies de peixes 1,6,8,13,14,15,16,17, vários desafios críticos ainda precisam ser enfrentados. Um grande desafio nessas análises é a necessidade de obter suspensões de leucócitos vivos extraídos do sangue periférico ou de tecidos linfoides, como o rim da cabeça1. O isolamento de leucócitos é muitas vezes difícil devido a uma característica única dos peixes teleósteos: a presença de eritrócitos nucleados. A contaminação não intencional com eritrócitos pode interferir na análise leucocitária devido ao seu tamanho, formato ovóide e presença de núcleo1. É, portanto, imperativo eliminar eritrócitos de suspensões de leucócitos para obter alta pureza leucocitária e estudar as características fenotípicas e funcionais dos leucócitos por análise de citometria de fluxo. Em mamíferos, o isolamento de leucócitos geralmente envolve lise osmótica de eritrócitos ou separação por gradiente de densidade com Ficoll ou Percoll1. No entanto, a lise osmótica é ineficaz para peixes marinhos e de água doce devido aos seus eritrócitos nucleados, que não podem ser lisados adequadamente1. Em vez disso, a separação do gradiente de densidade é preferida para peixes, pois preserva efetivamente a estabilidade celular ao longo do tempo1. Embora alguns estudos tenham isolado com sucesso leucócitos de peixes juvenis, muitas pesquisas ainda se concentram principalmente em populações adultas17. No entanto, os estágios iniciais da vida não são apenas mais vulneráveis a surtos de doenças, mas também menores em tamanho, tornando o processo de amostragem mais complexo e desafiador. Outra limitação é que os métodos atuais geralmente são restritos a um número limitado de amostras ou réplicas por vez, pois a avaliação da viabilidade dos leucócitos requer processamento imediato. Atrasos no processamento da amostra podem afetar adversamente a viabilidade celular, introduzindo assim mais complicações no processo de amostragem e potencialmente comprometendo todo o trabalho.
Até onde sabemos, nenhum dos métodos publicados fixou com sucesso células leucocitárias para posterior análise de viabilidade por citometria de fluxo. O presente estudo é pioneiro, pois estabelece um método eficiente para isolar leucócitos do rim cefálico de juvenis de dourada (Sparus aurata), a principal espécie de peixe cultivada em países do sul da Europa, utilizando uma metodologia de separação por gradiente de densidade de Percoll. Também apresentamos uma técnica aprimorada baseada em coloração que discrimina células vivas de mortas enquanto identifica as principais populações de leucócitos (linfócitos, monócitos e granulócitos) por meio de citometria de fluxo. O protocolo aprimorado envolve a fixação celular, o que permite a análise celular viável até 1 mês após o procedimento. A implementação deste protocolo de citometria de fluxo tem o potencial de reduzir significativamente o tempo e o esforço normalmente necessários para avaliações imunológicas, tornando-o uma técnica valiosa tanto para pesquisas quanto para aplicações mais práticas no setor de aquicultura. A aplicação dessa metodologia oferece vantagens para a análise de um grande número de amostras, preservando as células e permitindo a análise tardia por citometria de fluxo. Portanto, pode ser muito útil produzir informações valiosas sobre os mecanismos imunológicos dos peixes e como a viabilidade celular é influenciada por diferentes condições ambientais ou experimentais. Além disso, este ensaio de viabilidade pode ser integrado com a caracterização fenotípica e funcional multiparamétrica de populações específicas de células imunes. Essa abordagem permite uma análise mais abrangente de vários parâmetros imunológicos, vinculando-os diretamente aos tipos de células correspondentes e fornecendo uma compreensão mais clara das respostas imunes. Essas descobertas podem contribuir para o desenvolvimento de estratégias mais eficazes, incluindo abordagens aprimoradas para o manejo de doenças na aquicultura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Este protocolo deve ser realizado por investigadores certificados em experimentação animal (funções A e B da UE). Todos os procedimentos relacionados ao manuseio de animais e coleta de amostras devem estar em conformidade com as diretrizes ARRIVE (Animal Research: Reporting of in vivo Experiments) e aderir aos padrões éticos para o cuidado e uso de animais de acordo com as recomendações da Federação das Associações Europeias de Ciência de Animais de Laboratório (FELASA). O presente estudo seguiu todas estas normas, bem como a legislação portuguesa para a Ciência de Animais de Laboratório (Diretiva UE 2010/63; Decreto-Lei n.º 113/2013). A investigação foi aprovada pelo Organismo de Ética e Bem-Estar Animal do IPMA (ORBEA, LABVIVOS-002-AquaClimAdapt), tutelado pela Autoridade Nacional para a Utilização de Animais Vivos, conhecida como Direção-Geral de Alimentação e Veterinária (DGAV), sob o número de autorização ética 20596/25-S.
1. Modelo de estudo e manutenção dos organismos
NOTA: Este estudo foi especificamente desenhado para juvenis de dourada (Sparus aurata), com um peso médio de 30,0 ± 5,0 g e um comprimento total de 12,0 ± 2,0 cm. Este método pode não se aplicar diretamente a outras espécies de peixes, pois diferentes espécies têm características fisiológicas e imunológicas únicas que podem afetar o isolamento de leucócitos, a fixação celular e a avaliação da viabilidade. Adaptações ao protocolo podem ser necessárias para outras espécies, e estudos preliminares são recomendados para otimizar as condições para cada espécie-alvo.
- Aclimatar os peixes (Período de Quarentena)
- Distribua o peixe igualmente em tanques de grande capacidade (por exemplo, dois tanques com capacidade total de 660 L cada - ver Figura 1 suplementar).
NOTA: Os tanques a serem utilizados podem fazer parte de um Sistema de Aquicultura de Recirculação (RAS), que permite o uso eficiente da água e um melhor controle da qualidade da água. Em um RAS, a água é continuamente reciclada e tratada dentro do sistema, proporcionando um ambiente estável e controlado para os peixes. Essa configuração ajuda a manter as condições ideais para a saúde e o crescimento dos peixes, garantindo uma distribuição uniforme e minimizando o estresse durante o estudo. - Manter condições abióticas ideais.
- Mantenha os peixes em quarentena por 3 semanas em condições que imitam seu habitat natural:
temperatura: 20,0 ± 0,5 °C;
oxigênio dissolvido: 7,2 ± 0,2 mg/L;
salinidade: 35,0 ± 0,5 ‰;
pH: 8,0 ± 0,1 unidades;
fotoperíodo: 14 h claro/10 h escuro.
NOTA: As condições ideais de manutenção podem variar entre as diferentes espécies de peixes. Outras espécies podem ter requisitos diferentes, por isso é importante adaptar essas condições às necessidades específicas das espécies-alvo para garantir a saúde e o bem-estar dos organismos. Além disso, a temperatura e o fotoperíodo da água do mar podem mudar com as estações, portanto, as variações sazonais devem ser consideradas ao replicar as condições naturais em laboratório.
- Mantenha os peixes em quarentena por 3 semanas em condições que imitam seu habitat natural:
- Distribua o peixe igualmente em tanques de grande capacidade (por exemplo, dois tanques com capacidade total de 660 L cada - ver Figura 1 suplementar).
- Inicie o estudo experimental.
- Defina o número de tanques e peixes necessários com base no projeto de configuração experimental de cada estudo de caso.
- Após o período de quarentena, transferir o peixe para um SRA independente (ver figura suplementar 2).
- Equipar cada sistema com skimmers de proteína para remover o excesso de compostos orgânicos da água; filtração física (saco de filtro [400 μm], esponja de filtro e lã de vidro); filtragem biológica (bio balls [1,5"], esterilizador de água ultravioleta e pedras de ar submersas); sistemas automáticos de refrigeração de água do mar e aquecedores digitais submersos, ambos conectados a um sistema de controle computadorizado (ProfiLux) com sensores de temperatura para ajustar a temperatura em cada tanque; pedras de ar submersas em cada tanque para controlar o oxigênio dissolvido.
- Aclimatar os peixes por 2 semanas nos novos sistemas antes de prosseguir com o experimento.
- Realize a manutenção diária
- Remova as fezes dos peixes de cada tanque de incubação e realize uma renovação de 25% da água do mar.
- Meça a temperatura usando um termômetro de precisão portátil.
- Monitore outros parâmetros abióticos da água do mar (salinidade, oxigênio dissolvido e pH) usando um instrumento de medição multiparâmetro.
- Ajustar os parâmetros abióticos da água do mar conforme necessário para garantir a estabilidade durante todo o experimento.
NOTA: As condições abióticas nos sistemas experimentais podem variar dependendo dos requisitos específicos de cada estudo de caso. Por exemplo, se o estudo tiver como objetivo simular mudanças sazonais ou ondas de calor marinhas, a temperatura e o fotoperíodo devem ser ajustados de acordo com as variações sazonais naturais. Da mesma forma, se o estudo se concentrar em simular condições hipóxicas ou acidificação dos oceanos, ajustes devem ser feitos nos níveis de oxigênio e no pH da água do mar. Isso garante que as condições experimentais sejam tão realistas e relevantes quanto possível, aumentando a validade e aplicabilidade dos resultados do estudo. - Avaliar a saúde e o bem-estar dos peixes, identificando e gerindo os sinais de stress ou doença, conforme descrito nos passos 1.2.4.6-1.2.4.8.
- Procure comportamentos anormais, como natação errática, perda de apetite, letargia, agressão ou isolamento.
- Verifique se há sinais de doença, incluindo lesões, úlceras, descoloração, barbatanas presas, muco excessivo ou movimento rápido das guelras.
- Registre todas as observações, anotando a data e as ações tomadas.
- Realize testes semanais de qualidade da água.
- Meça os níveis de amônia (NH3 / NH4), nitrito (NO2-) e nitrato (NO3-) usando testes colorimétricos.
NOTA: Certifique-se de que todos esses parâmetros estejam abaixo dos níveis detectáveis. Se os níveis excederem os limites, execute uma troca adicional de água, aumente a aeração ou ajuste a filtração.
- Meça os níveis de amônia (NH3 / NH4), nitrito (NO2-) e nitrato (NO3-) usando testes colorimétricos.
- Alimente e monitore a nutrição dos peixes.
- Fornecer uma dieta de alta qualidade que atenda às necessidades nutricionais específicas dos peixes juvenis (consulte a Tabela Suplementar 1 para um exemplo da composição detalhada da dieta).
NOTA: Certifique-se de que o tamanho dos pellets de aquafeed (2-3 mm) é adequado para os juvenis, facilitando a ingestão e digestão. - Ajuste a quantidade de ração para corresponder a 2% do peso corporal médio do peixe por dia.
- Alimente os peixes manualmente duas vezes ao dia - uma de manhã e outra à tarde (defina um horário específico para manter uma rotina de alimentação estável).
- Fornecer uma dieta de alta qualidade que atenda às necessidades nutricionais específicas dos peixes juvenis (consulte a Tabela Suplementar 1 para um exemplo da composição detalhada da dieta).
2. Amostragem de peixes, eutanásia, dissecção e coleta de rim de cabeça
- Prove os peixes dos tanques.
- Selecione peixes aleatoriamente dos tanques para evitar viés de amostragem.
- Use uma rede para transferir suavemente o peixe para um recipiente temporário cheio de água do tanque.
NOTA: Minimize o tempo de manuseio para reduzir o estresse.
- Prepare a solução de eutanásia.
- Use um recipiente apropriado (por exemplo, um balde de 3 L) adequado para segurar o peixe.
- Dissolva a quantidade apropriada de tricaína (MS-222) na água do mar para atingir uma concentração final de 200-300 mg / L18 (CUIDADO Consulte a Tabela Suplementar 2 e o Arquivo Suplementar 1).
- Tamponar a solução com bicarbonato de sódio a um pH de 7,2-7,5.
- Administre a solução de eutanásia.
- Coloque o peixe na solução de eutanásia por pelo menos 10 minutos ou até que seja observada cessação do movimento opercular e perda de reflexos (confirme a eutanásia verificando se não há resposta a estímulos externos).
- Registre o peso corporal (g) e o comprimento total (cm) do peixe.
- Realize a dissecação de peixes.
NOTA: Para garantir a qualidade ideal da amostra e a viabilidade celular, o processo de dissecção deve ser concluído o mais rápido possível, idealmente dentro de 5 minutos após a eutanásia.- Certifique-se de que a temperatura do laboratório seja mantida em 19 ° C usando ar condicionado para minimizar as flutuações durante a amostragem e o processamento.
- Esterilize as ferramentas de dissecção (de preferência instrumentos de metal em autoclave sempre que possível) e configure um espaço de trabalho limpo com etanol a 70% (CUIDADO, consulte a Tabela Suplementar 2).
- Coloque o peixe sacrificado de lado em uma bandeja de dissecação estéril com a cabeça apontando para a mão não dominante.
- Usando um bisturi, faça uma incisão cuidadosa ao longo da linha média ventral do peixe, da abertura (ânus) em direção às brânquias.
NOTA: Tenha cuidado para não cortar muito profundamente para evitar danos aos órgãos internos. - Use cuidadosamente uma tesoura de dissecção para estender a incisão e expor os órgãos internos. Levante suavemente as abas da parede do corpo para fornecer uma visão clara da anatomia interna.
- Localize o rim da cabeça: O rim da cabeça está posicionado logo atrás das brânquias, perto da região dorsal anterior da cavidade corporal, e se estende ao longo da parte superior da cavidade corporal, abaixo da coluna vertebral.
NOTA: O rim da cabeça é tipicamente de cor mais escura em comparação com os tecidos circundantes (Figura 1). - Limpe cuidadosamente todos os tecidos circundantes, como gordura e tecido conjuntivo, para visualizar melhor o rim da cabeça.
NOTA: Esta etapa requer manuseio delicado para evitar danos ao rim da cabeça. - Usando pinças e tesouras de ponta fina, levante cuidadosamente o rim da cabeça e faça cortes precisos ao redor dele para libertá-lo dos tecidos circundantes.
NOTA: Manuseie o lenço com cuidado para evitar danos. Em um peixe pesando aproximadamente 30 g, espera-se que o rim da cabeça pese cerca de 20-30 mg. - Colocar imediatamente o órgão excisado num filtro de células (malha de nylon de 100 μm) dentro de uma placa de Petri estéril para garantir a esterilidade e facilitar as etapas de processamento subsequentes.
NOTA: A partir deste ponto, todas as etapas devem ser executadas o mais rápido possível (dentro de 5 min) para manter a viabilidade celular. Para manter a amostra fria, execute as etapas a seguir com a placa de Petri colocada em um recipiente cheio de gelo e coberto com papel alumínio.

Figura 1: Posição do rim da cabeça: (A) Ilustração que descreve a localização típica do rim da cabeça atrás das brânquias e ao longo da região dorsal anterior da cavidade corporal; (B) Imagem representativa do rim da cabeça em dourada, enfatizando sua coloração mais escura em comparação com os tecidos circundantes. Clique aqui para ver uma versão maior desta figura.
3. Isolamento de leucócitos cabeça-rim (Figura 2)
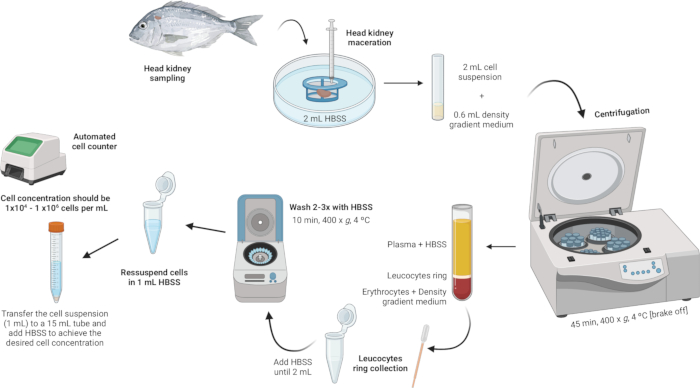
Figura 2: Descrição ilustrativa do isolamento de leucócitos do rim da cabeça. O protocolo envolve várias etapas: iniciando-se com a homogeneização do tecido, seguindo-se a centrifugação do gradiente de densidade, a coleta do anel de leucócitos, a lavagem do anel de leucócitos e concluindo com a ressuspensão e ajuste da concentração celular. Clique aqui para ver uma versão maior desta figura.
- Homogeneizar o tecido.
- Coloque 2 mL de solução salina balanceada de Hanks (HBSS) em uma placa de Petri estéril.
- Certifique-se de que a malha do filtro de células (malha de nylon de 100 μm) esteja em contato com o HBSS, mas não totalmente submersa.
- Macerar o rim da cabeça no filtro de células usando o êmbolo de uma seringa. Aplique uma leve pressão para forçar os fragmentos do órgão através da malha de náilon, criando uma suspensão celular.
NOTA: Se estiver processando várias amostras, a placa de Petri contendo a suspensão celular pode ser armazenada na geladeira a 4 ° C por alguns minutos até a próxima etapa. Esta suspensão celular será usada para isolamento de leucócitos.
- Realize a centrifugação com gradiente de densidade.
- Prepare uma solução de meio gradiente de densidade com densidade de 1,077 g/mL, osmolaridade de 353 mOsm/kg e pH de 7,4 (ver Arquivo Suplementar 1).
NOTA: A osmolaridade pode variar entre as diferentes espécies de peixes, por isso é crucial ajustar a osmolaridade da solução do meio de gradiente de densidade para atender aos requisitos específicos de cada espécie. - Em tubos de fundo redondo de poliestireno de 5 mL, adicione cuidadosamente 600 μL da solução do meio de gradiente de densidade.
- Pegue a suspensão celular (2 mL) e adicione-a lentamente ao tubo que contém o meio de gradiente de densidade. A primeira gota é crucial - adicione-a muito suavemente para evitar desestabilizar a fase média do gradiente de densidade.
NOTA: Isso deve ser feito na proporção de 3:10 (gradiente de densidade médio: suspensão celular). Use uma pipeta Pasteur estéril de 1 mL para uma adição precisa e suave. Certifique-se de que a ponta da pipeta esteja tocando a lateral do tubo para evitar perturbar a camada média do gradiente de densidade. Evite misturar a amostra com o meio de gradiente de densidade. - Centrifugue os tubos a 400 x g durante 45 min a 4 °C com o travão desligado. Isso garante que as camadas permaneçam intactas durante o processo.
NOTA: Após a centrifugação, camadas distintas devem ser visíveis. Os leucócitos formarão um anel na interface entre o meio de gradiente de densidade e o pellet de detritos celulares (Figura 3).
- Prepare uma solução de meio gradiente de densidade com densidade de 1,077 g/mL, osmolaridade de 353 mOsm/kg e pH de 7,4 (ver Arquivo Suplementar 1).
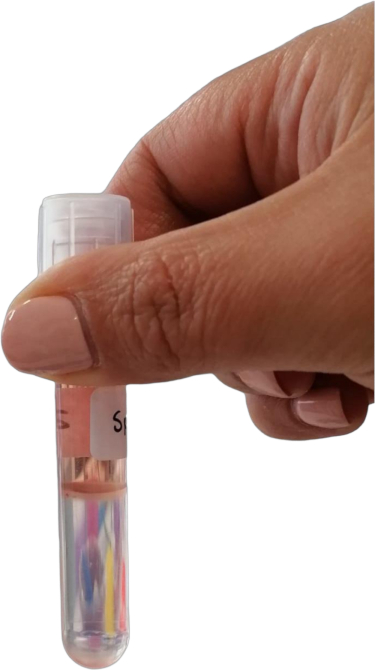
Figura 3: Anel de leucócitos na interface entre o meio de gradiente de densidade e o pellet de detritos celulares. Clique aqui para ver uma versão maior desta figura.
- Colete o anel leucocitário.
- Usando uma pipeta Pasteur estéril, aspire suavemente o anel leucocitário (~ 100 μL) e transfira-o para um tubo de microcentrífuga de 2 mL.
NOTA: Tome cuidado para não perturbar significativamente as camadas para evitar contaminação. Se o anel leucocitário parecer conter detritos ou suspensões escuras, é aconselhável passar a suspensão leucocitária coletada por um novo filtro de mini célula (100 μm) para garantir a pureza. Coloque o filtro de mini células sobre o tubo de microcentrífuga de 2 mL e transfira suavemente a suspensão de leucócitos através do filtro.
- Usando uma pipeta Pasteur estéril, aspire suavemente o anel leucocitário (~ 100 μL) e transfira-o para um tubo de microcentrífuga de 2 mL.
- Lave o anel leucocitário.
- Adicione HBSS aos tubos de microcentrífuga contendo o anel leucocitário até que o volume atinja 2 mL e ressuspenda suavemente as células.
NOTA: Mantenha os tubos em um recipiente cheio de gelo e coberto com papel alumínio para manter a amostra em baixa temperatura. Certifique-se de que os tubos não entrem em contato direto com o gelo. Mantenha esta configuração de resfriamento durante todo o processo de lavagem. - Centrifugar as amostras a 400 × g durante 10 min a 4 °C (o travão pode ser acionado).
- Após a centrifugação, descarte cuidadosamente o sobrenadante, deixando o pellet no fundo (que pode ser quase invisível).
- Repita as etapas de lavagem (adicionar HBSS, ressuspender, centrifugar e descartar o sobrenadante) até que o pellet esteja livre de impurezas.
- Adicione HBSS aos tubos de microcentrífuga contendo o anel leucocitário até que o volume atinja 2 mL e ressuspenda suavemente as células.
- Ressuspenda e ajuste a concentração da célula.
- Ressuspenda as células em 1 mL de HBSS dentro dos mesmos tubos de microcentrífuga de 2 mL usados para as lavagens.
- Atingir uma concentração celular entre 1 × 104 e 1 × 106 células por ml. Se o pellet inicial for grande, HBSS adicional pode ser necessário para diluir a concentração da célula até a faixa desejada. Transfira a suspensão celular para um tubo de 15 mL e adicione mais HBSS conforme necessário com base nas contagens de células obtidas.
NOTA: Recomenda-se o uso de um contador de células automatizado para facilitar o processo.
4. Coloração e fixação de leucócitos (Figura 4)
NOTA: Os kits de coloração de células mortas corrigíveis LIVE/DEAD fornecem um método aprimorado para avaliar a viabilidade celular em células fixas usando citometria de fluxo. Esses ensaios utilizam um corante reativo fluorescente que interage com aminas celulares. Se as membranas celulares estiverem comprometidas, o corante pode penetrar nas células, reagindo com aminas livres tanto no interior quanto na superfície celular, resultando em intensa coloração fluorescente. Por outro lado, em células viáveis, apenas as aminas da superfície celular estão disponíveis para reagir com o corante, levando a uma coloração relativamente fraca. A intensidade da coloração é mantida após a fixação com formaldeído, que também preserva a amostra, impedindo o crescimento de microrganismos. Os kits de coloração de células mortas corrigíveis LIVE/DEAD são idênticos, exceto pelo corante fluorescente - disponível em azul, violeta, aqua, amarelo, verde, vermelho, vermelho distante ou infravermelho próximo (infravermelho). Neste estudo, usamos o corante reativo fluorescente Near-IR. Além disso, este ensaio de cor única permite o teste de outros parâmetros em paralelo em um experimento multicolorido.
- Prepare o corante.
- Leve os reagentes à temperatura ambiente (RT): Deixe um frasco do corante reativo fluorescente e o frasco de dimetilsulfóxido anidro (DMSO) atingirem o RT antes de remover as tampas.
- Reconstituir o corante: Adicione 50 μL de DMSO ao frasco para injetáveis que contém o corante reativo. Misture bem e certifique-se de que o corante esteja totalmente dissolvido.
- Use a solução de corante reconstituído o mais rápido possível, de preferência dentro de algumas horas.
NOTA: Cada kit inclui cinco frascos individuais de corante reativo, fornecendo material suficiente para corar pelo menos 40 amostras de células. No entanto, após a reconstituição, a solução de DMSO do corante é relativamente instável, principalmente quando exposta à umidade. Quaisquer porções não utilizadas podem ser armazenadas por até 2 semanas a ≤-20 °C, protegidas da luz e da umidade.
- Manchar e fixar as células.
NOTA: Os tampões adequados para coloração celular incluem solução salina balanceada de Hanks (HBSS), solução salina tamponada com fosfato (PBS) e PBS de Dulbecco (D-PBS), desde que não contenham proteínas estranhas, como albumina ou soro bovino. Ao usar um corante amino-reativo, evite tampões Tris e soluções com azida de sódio ou proteína estranha para ressuspensão e lavagem celular. Neste estudo, usamos HBSS devido à sua composição iônica equilibrada, que ajuda a manter o equilíbrio osmótico e fornece íons essenciais e glicose para apoiar o metabolismo e a viabilidade celular durante o processo de coloração. O HBSS também é livre de proteínas estranhas, evitando interferência com o corante reativo e garantindo uma avaliação precisa da viabilidade.- Depois de contar as células e ajustar a densidade para 1 x 106 células por mL com HBSS, transfira 1 mL desta suspensão celular para tubos de microcentrífuga de 2 mL.
- Para cada dia, induzir a morte celular em pelo menos uma amostra a ser usada como controle para definir o limiar de intensidade de fluorescência entre células vivas e mortas. Preparar as amostras em tubos de microcentrífuga do seguinte modo:
Tubo 1: Células vivas - não coradas
Tubo 2: Células vivas - coradas
Tubo 3: Células mortas - não coradas
Tubo 4: Células mortas - coradas
NOTA: Esses quatro tubos só precisam ser preparados para uma única amostra em cada experimento como controles. Para as amostras restantes, são necessários apenas dois tubos (Tubo 1: amostra - não corada e Tubo 2: amostra - corada), pois fornecerá informações sobre as células que estavam vivas e as que estavam mortas.
- Para cada dia, induzir a morte celular em pelo menos uma amostra a ser usada como controle para definir o limiar de intensidade de fluorescência entre células vivas e mortas. Preparar as amostras em tubos de microcentrífuga do seguinte modo:
- Controle positivo para morte celular: Coloque o tubo marcado como Morto não corado (Tubo 3) e Morto (Tubo 4) em banho-maria a 50 ° C por 7 min para induzir a morte celular por tratamento térmico.
- Coloração das células: Adicione 1 μL do corante reativo fluorescente reconstituído (da etapa 4.1.2) a 1 mL da suspensão celular nos tubos 2 e 4 (tubos que serão corados) e misture bem.
- Incubar em RT por 30 min, protegido da luz.
NOTA: Se a fixação não for necessária, você pode pular as etapas 4.2.5-4.2.7 abaixo. Em vez disso, lave as células duas vezes com 1 mL de HBSS com albumina de soro bovino a 1% (consulte o Arquivo Suplementar 1) e ressuspenda em 1 mL de HBSS com albumina de soro bovino a 1%. Efectuar a análise no citómetro de fluxo o mais rapidamente possível; caso contrário, a viabilidade celular pode ser comprometida, pois as células não são fixas. - Lave as células duas vezes com 1 mL de HBSS e ressuspenda as células em 900 μL de HBSS.
- Adicione 100 μL de formaldeído a 37% (CUIDADO, consulte a Tabela Suplementar 2).
- Incubar por 15 min em RT.
- Lave duas vezes com 1 mL de HBSS com albumina de soro bovino (BSA) a 1% e, em seguida, ressuspenda as células em 1 mL de HBSS com BSA a 1%.
- Conservar as amostras no frigorífico a 4 °C. Analise as células dentro de 1 mês após a fixação.
- Analisar a suspensão de células fixas por citometria de fluxo, utilizando o canal de excitação e detecção adequado.
NOTA: Os canais corretos de excitação e detecção podem diferir com base no instrumento que está sendo usado (consulte a Tabela Suplementar 3).
- Depois de contar as células e ajustar a densidade para 1 x 106 células por mL com HBSS, transfira 1 mL desta suspensão celular para tubos de microcentrífuga de 2 mL.
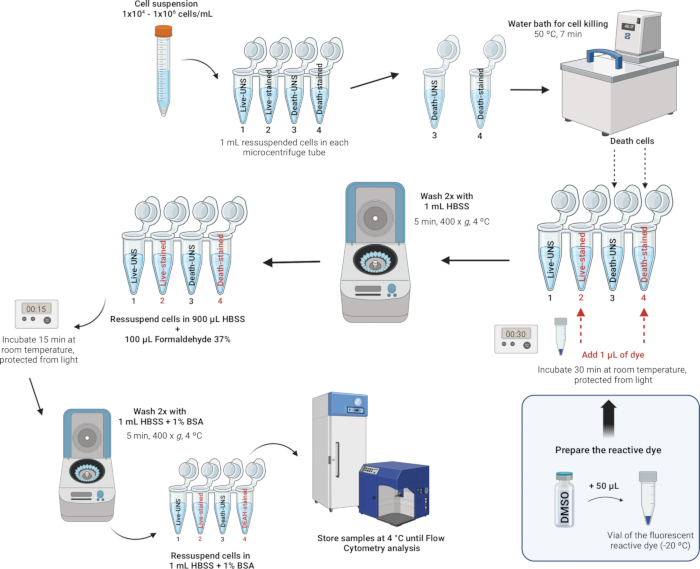
Figura 4: Descrição ilustrativa da coloração e fixação de leucócitos. Clique aqui para ver uma versão maior desta figura.
5. Citometria de fluxo
- Adquira dados.
NOTA: Os procedimentos a serem seguidos no citômetro de fluxo podem variar dependendo do citômetro específico usado. Neste estudo, os dados foram adquiridos usando o citômetro de fluxo Attune NTx.- Execute os exemplos.
- Coloque o sample tubo na sample porta.
- Comece a aquisição pressionando iniciar e clique em gravar assim que a taxa de eventos (eventos/segundo) se estabilizar.
- Registre um mínimo de 10.000 eventos para cada amostra na porta de singlets para uma análise confiável.
- Salve todos os dados de cada amostra e faça backup em unidades externas ou armazenamento em nuvem.
- Analise os dados.
NOTA: Para análise de citometria de fluxo, várias opções de software estão disponíveis. Neste estudo, a análise dos dados foi realizada por meio do FlowJo v10.8.119.- Carregar arquivos de dados: Inicie o software de análise de citometria de fluxo e carregue os arquivos .fcs adquiridos do experimento.
- Visualize os dados (Figura 5A): Plote a dispersão direta (FSC-A) (XX) vs. dispersão lateral (SSC-A) (YY) para avaliar o tamanho e a granularidade da célula.
NOTA: Este gráfico é comumente usado para identificar populações de células e excluir detritos com base em suas propriedades de dispersão. - Exclusão de gating e multipletos de células singlete (Figura 5B): Use o gráfico de área de dispersão direta (FSC-A) versus altura de dispersão direta (FSC-H) para excluir múltiplos. Desenhe uma porta para incluir todos os eventos alinhados no gráfico (células únicas) e exclua os não alinhados (múltiplos). Se a amostra tiver eventos com FSC muito baixo, exclua-os não incluindo-os na porta da célula única, permanecendo apenas células singlete.
- Identificação de populações de leucócitos (Figura 5C): Distinguir as 3 populações de leucócitos com base no perfil FSC-A/SSC-A: FSC-Aalto/SSC-Aalto são granulócitos, omeio FSC-A/SSC-Amédio são os monócitos e FSC-Abaixo/SSC-Abaixo são os linfócitos.
- Gating de viabilidade (Figura 5D): Configure o limite para coloração de corante de viabilidade no canal de fluorescência correspondente (NIR, RL3-A). As células vivas versus mortas são definidas com base na intensidade da coloração com LIVE/DEAD Coloração de células mortas corrigíveis: as células com coloração fraca são definidas como as células vivas e as células fortemente coradas são definidas como células mortas.
- Estatísticas populacionais: observe as estatísticas fornecidas pelo software, incluindo o total de eventos (células) em cada portão e porcentagens do total e das células fechadas.
- Exportar dados: exporte os dados para uma planilha e use o software estatístico apropriado (GraphPad Prism ou R) para análise estatística adicional.
NOTA: A escolha dos métodos de análise dependerá dos objetivos da pesquisa.
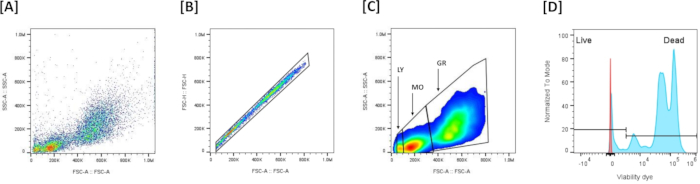
Figura 5: Estratégia de bloqueio por citometria de fluxo para avaliação de viabilidade em células renais da cabeça: (A) Representa o perfil FSC-A/SSC-A de todos os eventos coletados. (B) Representa a exclusão de multipletos com base na definição da região dos singlets com base na linearidade no gráfico Forward Scatter (FSC-A)/Forward Scatter (FSC-H). (C) Representa as 3 principais populações que foram definidas com base no FSC-A/SSC-A, após a exclusão de múltiplos pletos. (D) Representa um histograma mostrando a coloração de corante de viabilidade viva/morta. Para estabelecer o limiar que permite distinguir células vivas e mortas, os leucócitos foram submetidos a um leve choque térmico (50 °C, 7 min) e, em seguida, corados com corante de viabilidade. Células positivas de alta intensidade de coloração (++) são as células mortas e células positivas de baixa coloração (+-) são as células vivas. Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
A Figura 6 apresenta dados representativos de citometria de fluxo mostrando populações de leucócitos isolados do rim cefálico de juvenis de dourada (Sparus aurata) e sua viabilidade celular usando o protocolo descrito neste estudo. A figura compara duas amostras: uma com alta viabilidade celular, onde os peixes foram expostos a condições ótimas (Figura 6A), e outra com baixa viabi...
Access restricted. Please log in or start a trial to view this content.
Discussão
O método desenvolvido neste estudo representa um avanço significativo na pesquisa em imunologia de peixes e promete melhorar a compreensão das respostas imunes dos peixes e a sustentabilidade dos recursos marinhos. S. aurata é uma valiosa espécie de peixe marinho da família Sparidae que serve como um organismo modelo ideal por várias razões, incluindo sua relevância ecológica e econômica, bem como sua versatilidade em pesquisas laboratoriais em vários campos de estud...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram não haver conflitos de interesse financeiros, pessoais ou profissionais que possam ter influenciado a pesquisa, análise, interpretação dos dados, redação ou decisão de submeter o manuscrito para publicação.
Agradecimentos
Este trabalho foi apoiado pela Fundação Portuguesa para a Ciência e Tecnologia (FCT, I.P.), no âmbito do projeto Aqua-CLIMADAPT (PTDC/CTA-AMB/0592/2021, https://doi.org/10.54499/PTDC/CTA-AMB/0592/2021). Agradecemos o BioLab apoiado pela Unidade de Biociências Moleculares Aplicadas (UCIBIO) e pela Unidade de Investigação do Laboratório Associado para a Química Verde – LAQV, que são financiados por fundos nacionais da FCT/MCTES (UIDB/04378/2020 e UIDB/50006/2020, respetivamente), bem como o Laboratório Associado Institute for Health and Bioeconomy – i4HB (LA/P/0140/2020). Este trabalho contou ainda com o apoio da Comissão Europeia através do projeto GLYCOTwinning (Acordo de Subvenção n.º 101079417) e da FCT através do InnoGlyco (2022.04607.PTDC). Isa Marmelo agradece ainda à FCT I.P. pela bolsa de doutoramento (2020.04413.BD, https://doi.org/10.54499/2020.04413.BD).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
Referências
- Samaï, H. C., et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93(2023).
- Lulijwa, R., et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A., et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498(2022).
- Titus, J., et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142(2024).
- Marmelo, I., et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135(2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955(2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change. Biol Lett. 20 (2), 20230346(2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398(2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á, Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R., et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. , American Veterinary Medical Association. Schaumburg, IL. (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). , At https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software (2023).
- Mhalhel, K., et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008(2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739(2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á, Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á, Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M. -A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados