Method Article
Isolierung, Fixierung und Charakterisierung von juvenilen Leukozyten der Goldbrassenkopfniere mittels Durchflusszytometrie
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt die Isolierung und Fixierung von Leukozyten, die aus der Kopfniere der Goldbrasse extrahiert wurden, und die Beurteilung ihrer Lebensfähigkeit mittels Durchflusszytometrie. Diese Arbeit trägt zur Standardisierung von Protokollen bei und ermöglicht die Verarbeitung einer größeren Anzahl von Proben, ohne die Probenqualität zu beeinträchtigen, wodurch Fortschritte im Wissen über die Fischimmunologie gefördert werden.
Zusammenfassung
Die Immunität ist entscheidend für die physiologische Regulation von Organismen und dient als primäre Abwehr gegen Krankheitserreger und Umweltstressoren. Die Isolierung und Analyse von Immunzellen liefert wichtige Einblicke in die Immunantwort auf äußeren Druck. Der Mangel an harmonisierten Protokollen für weniger untersuchte Arten, wie z. B. Meeresfische, führt jedoch oft zu technischen und analytischen Herausforderungen, die die Interpretation der Daten und ein gründliches Verständnis der artspezifischen Immunantworten behindern. Ziel dieser Studie war es, ein optimiertes, auf Durchflusszytometrie basierendes Analyseverfahren zur Charakterisierung und Bestimmung der Lebensfähigkeit von Leukozyten aus der Kopfniere (dem wichtigsten hämatopoetischen Organ bei Teleostfischen) von juvenilen Dorade (Sparus aurata) zu etablieren. Das Verfahren begann mit der Isolierung von Leukozyten durch einen Homogenisierungsprozess unter Verwendung der ausgewogenen Salzlösung von Hanks, gefolgt von einer optimierten Percoll-Dichtegradientenzentrifugationsmethode, um hohe Wiederfindungsraten von Leukozyten bei minimaler Erythrozytenkontamination zu gewährleisten, die für eine effiziente nachfolgende Durchflusszytometrie-Analyse erforderlich ist. Zusätzlich wurde eine neuartige Technik unter Verwendung eines zellreaktiven Farbstoffs (LIVE/DEAD Fixable Dead Cell Stain Kit) eingesetzt, um lebensfähige von toten Zellen anhand ihrer fluoreszierenden Färbemuster zu unterscheiden. Die Fixierung wurde mit 3,7 % Formaldehyd erreicht, wodurch die Zellmorphologie, die Lebensfähigkeit und die Färbeeffizienz erhalten blieben. Bei der durchflusszytometrischen Analyse wurden erfolgreich drei vorherrschende Leukozytenpopulationen identifiziert: Lymphozyten, Monozyten und Granulozyten. Diese Methode ermöglichte nicht nur Viabilitätstests, sondern auch die genaue Differenzierung von Zelltypen. Die Verbesserung der Durchflusszytometrie-Protokolle stellt einen Fortschritt in der Fischimmunologie dar, indem sie die Genauigkeit und Effizienz der Immunzellanalyse erhöht. Darüber hinaus reduziert dieses Protokoll durch die Fixierung von Zellen für eine spätere Analyse den Zeit- und Arbeitsaufwand für Immunbewertungen erheblich, was es zu einem wertvollen Werkzeug sowohl für die Forschung als auch für praktische Anwendungen in verschiedenen Forschungsbereichen macht.
Einleitung
Die Immunität spielt eine zentrale Rolle bei der physiologischen Regulation von Organismen und fungiert als primäre Abwehr gegen eine Vielzahl von Krankheitserregern und Umweltstressoren1. Wie andere Wirbeltiere verfügen auch Fische über ein komplexes, dynamisches und koordiniertes Immunsystem, das für ihre allgemeine Gesundheit und ihr Wohlbefinden unerlässlich ist1.
Teleostfische verfügen sowohl über ein angeborenes als auch über ein adaptives Immunsystem, das gleichzeitig schädliche Eindringlinge erkennt, darauf reagiert und sie neutralisiert2. Das angeborene Immunsystem fungiert als erste Verteidigungslinie und reagiert sofort und unspezifisch auf Krankheitserreger2, während sich das adaptive Immunsystem im Laufe der Zeit entwickelt und eine spezialisiertere Reaktion bietet, die es den Fischen ermöglicht, spezifische Krankheitserreger zu erkennen und ein immunologisches Gedächtnis aufzubauen3. Das Immunsystem von Fischen stützt sich auf spezialisierte primäre lymphatische Organe (d. h. Thymus und Kopfniere) und sekundäre lymphatische Organe (z. B. Milz und Mukosa-assoziiertes lymphatisches Gewebe (MALT)), um die Immunabwehr zu unterstützen und die allgemeine Gesundheit zu erhalten4. Die Kopfniere ist das primäre hämatopoetische Organ bei Teleostfischen und spielt eine entscheidende Rolle bei der Entwicklung und Reifung von Immunzellen, einschließlich Leukozyten5.
In den letzten Jahren wurden erhebliche Fortschritte bei der Untersuchung der Immunantworten mehrerer Fischartenerzielt 2. Ein Schwerpunkt lag dabei auf dem Verständnis von Leukozytenpopulationen und ihrer Aktivität. Leukozyten, auch weiße Blutkörperchen genannt, werden im Allgemeinen in Monozyten, Lymphozyten und Granulozyten eingeteilt und spielen eine entscheidende Rolle bei der Immunabwehr von Fischen. Sie verfügen über phagozytische Zellen, die für das Verschlingen und Zerstören von Krankheitserregern verantwortlich sind und bakterizide reaktive Sauerstoffspezies freisetzen, die zur Eliminierung eindringender Mikroorganismen beitragen6. Leukozyten sind ebenfalls am Entzündungsprozess beteiligt und tragen dazu bei, Infektionen zu isolieren und auszurotten und gleichzeitig die Gewebereparatur zu fördern6. Die Häufigkeit und Aktivität von Leukozytenpopulationen sind wichtige Indikatoren für den Immunstatus bei Tiergesundheit und -krankheit 7,8.
Einige Studien haben gezeigt, dass Stressfaktoren, wie z. B. ungünstige Umweltbedingungen, die Anzahl und Morphologie der Erythrozyten und die Zusammensetzung der zirkulierenden Leukozyten verändern können 9,10. Wie von Franke et al. (2024) überprüft, ist es beispielsweise von entscheidender Bedeutung, das Immunsystem von Fischen in Szenarien des Klimawandels zu untersuchen, da Umweltstressoren die Immunität der Fische beeinträchtigen, die Krankheitsanfälligkeit erhöhen und die Infektiosität bestimmter Krankheitserreger erhöhen können, was letztendlich das Fortschreiten der Krankheit beschleunigt11. Darüber hinaus ist das Verständnis der Immunität von Fischen nicht nur für die Förderung der biologischen Grundlagenforschung, sondern auch für die Unterstützung verschiedener Bereiche der Gesellschaft, wie z. B. der Aquakulturindustrie, von entscheidender Bedeutung. Da die Aquakultur weltweit weiter expandiert, wird die Gewährleistung der Gesundheit und des Wohlergehens von Zuchtfischarten immer wichtiger. Dennoch ist das Wohlergehen von Fischen nach wie vor ein relativ neues Forschungsgebiet, und die Immunreaktionen von Zuchtfischen erfordern immer noch gründliche und standardisierte Bewertungen. Die Priorisierung von Immunantwortstudien ist von größter Bedeutung, da die gewonnenen Informationen die Nachhaltigkeit und Produktivität der Aquakultur durch effektive und maßgeschneiderte Ansätze verbessern können, die das Wohlergehen und die Widerstandsfähigkeit von Nutztieren verbessern.
Die Quantifizierung und Identifizierung von Leukozyten erfolgt in der Regel mit hämatologischen Methoden, wie z. B. der manuellen Zählung mit Bürker-, Neubauer- oder Thoma-Hämozytometern sowie mit gefärbten Blutausstrichen 7,10. Um die Visualisierung und Differenzierung von Blutzellen zu unterstützen, werden häufig Färbekits wie Wright, May-Grünwald-Giemsa und Hemacolor eingesetzt 7,12. Diese manuellen Zellzähltechniken sind jedoch mühsam, zeitaufwändig und anfällig für menschliche Fehler 8,10. Häufige Fehlerquellen sind unzureichendes Mischen oder Verdünnen des Blutes, Färbeprobleme und eine falsche Beladung der Hämozytometerkammer, die alle zu ungenauen Zellzählungen führen können12. Darüber hinaus erfordert die manuelle hämatologische Analyse ein hohes Maß an Fachwissen und Erfahrung, um die Zuverlässigkeit und Reproduzierbarkeit der Ergebnisse zu gewährleisten7. Da die Nachfrage nach präzisen und effizienten Diagnosewerkzeugen steigt, wird die Entwicklung innovativer Methoden, die ein tiefgreifendes Verständnis des Immunstatus von Fischpopulationen ermöglichen, zu einem immer wichtigeren Schritt, um dieses Gebiet voranzubringen.
Die Durchflusszytometrie hat sich in diesem Zusammenhang als leistungsstarkes Werkzeug erwiesen und bietet einen quantitativen Ansatz mit hohem Durchsatz zur Analyse von Leukozytenpopulationen und der Zellviabilität8. Diese moderne Diagnosetechnologie ermöglicht den schnellen Nachweis, die Zählung und die Charakterisierung einzelner Zellen in gemischten Populationen mit bemerkenswerter Präzision13. Darüber hinaus ermöglicht die Durchflusszytometrie simultane multiparametrische Messungen sowohl zur phänotypischen als auch zur funktionellen Charakterisierung. Obwohl seine Anwendung im klinischen Umfeld am Menschen und in der Veterinärmedizin weit verbreitet ist, bleibt seine Anwendung bei der Untersuchung von Fischleukozyten sehr begrenzt8. Obwohl einige Forschungsarbeiten an verschiedenen Fischarten durchgeführt wurden 1,6,8,13,14,15,16,17, müssen noch einige kritische Herausforderungen angegangen werden. Eine große Herausforderung bei diesen Analysen ist die Notwendigkeit, Suspensionen von lebenden Leukozyten zu erhalten, die aus peripherem Blut oder lymphatischen Geweben, wie z.B. der Kopfniere, extrahiertwurden 1. Die Isolierung von Leukozyten ist oft schwierig, da es ein einzigartiges Merkmal von Teleostfischen gibt: das Vorhandensein von kernhaltigen Erythrozyten. Die unbeabsichtigte Kontamination mit Erythrozyten kann die Leukozytenanalyse aufgrund ihrer Größe, ihrer eiförmigen Form und des Vorhandenseins eines Zellkerns beeinträchtigen1. Es ist daher zwingend erforderlich, Erythrozyten aus Leukozytensuspensionen zu eliminieren, um eine hohe Leukozytenreinheit zu erreichen und die phänotypischen und funktionellen Eigenschaften von Leukozyten durch durchflusszytometrische Analyse zu untersuchen. Bei Säugetieren beinhaltet die Leukozytenisolierung typischerweise eine osmotische Lyse von Erythrozyten oder eine Trennung durch Dichtegradient mit Ficoll oder Percoll1. Die osmotische Lyse ist jedoch sowohl bei Meer- als auch bei Süßwasserfischen unwirksam, da ihre kernhaltigen Erythrozyten nicht richtig lysiert werden können1. Stattdessen wird die Trennung durch Dichtegradienten bei Fischen bevorzugt, da sie die Zellstabilität über die Zeit effektiv bewahrt1. Obwohl es in einigen Studien gelungen ist, Leukozyten aus Jungfischen zu isolieren, konzentriert sich ein Großteil der Forschung immer noch hauptsächlich auf erwachsene Populationen17. Nichtsdestotrotz sind die frühen Lebensstadien nicht nur anfälliger für Krankheitsausbrüche, sondern auch kleiner, was den Probenahmeprozess komplexer und herausfordernder macht. Eine weitere Einschränkung besteht darin, dass die derzeitigen Methoden oft auf eine begrenzte Anzahl von Proben oder Replikaten gleichzeitig beschränkt sind, da die Bewertung der Lebensfähigkeit von Leukozyten eine sofortige Verarbeitung erfordert. Verzögerungen bei der Probenverarbeitung können sich negativ auf die Lebensfähigkeit der Zellen auswirken, wodurch weitere Komplikationen in den Probenahmeprozess eingeführt werden und möglicherweise die gesamte Arbeit gefährdet wird.
Nach unserem Kenntnisstand ist es bei keiner der veröffentlichten Methoden gelungen, Leukozytenzellen für eine anschließende Viabilitätsanalyse mittels Durchflusszytometrie zu fixieren. Die vorliegende Studie ist wegweisend, da sie eine effiziente Methode zur Isolierung von Leukozyten aus der Kopfniere von juvenilen Goldbrassen (Sparus aurata), der wichtigsten Fischart in südeuropäischen Ländern, unter Verwendung einer Percoll-Dichtegradienten-Trennungsmethode etabliert. Wir stellen auch eine verbesserte färbebasierte Technik vor, die lebende von toten Zellen unterscheidet und gleichzeitig die wichtigsten Leukozytenpopulationen (Lymphozyten, Monozyten und Granulozyten) durch Durchflusszytometrie identifiziert. Das verbesserte Protokoll beinhaltet eine Zellfixierung, die eine Analyse lebensfähiger Zellen bis zu 1 Monat nach dem Eingriff ermöglicht. Die Implementierung dieses Durchflusszytometrie-Protokolls hat das Potenzial, den Zeit- und Arbeitsaufwand, der normalerweise für Immunbewertungen erforderlich ist, erheblich zu reduzieren, was es zu einer wertvollen Technik sowohl für die Forschung als auch für praktischere Anwendungen im Aquakultursektor macht. Die Anwendung dieser Methodik bietet Vorteile für die Analyse einer großen Anzahl von Proben, die Konservierung der Zellen und die Ermöglichung einer verzögerten Analyse durch Durchflusszytometrie. Daher könnte es sehr hilfreich sein, wertvolle Einblicke in die Immunmechanismen von Fischen zu gewinnen und zu erfahren, wie die Lebensfähigkeit von Zellen durch verschiedene Umwelt- oder Versuchsbedingungen beeinflusst wird. Darüber hinaus kann dieser Viabilitätsassay in die multiparametrische phänotypische und funktionelle Charakterisierung spezifischer Immunzellpopulationen integriert werden. Dieser Ansatz ermöglicht eine umfassendere Analyse mehrerer immunologischer Parameter, die direkt mit den entsprechenden Zelltypen verknüpft und ein klareres Verständnis der Immunantworten ermöglicht wird. Diese Erkenntnisse könnten zur Entwicklung wirksamerer Strategien beitragen, einschließlich verbesserter Ansätze für das Krankheitsmanagement in Aquakulturen.
Protokoll
Dieses Protokoll muss von Forschern durchgeführt werden, die für Tierversuche zertifiziert sind (EU-Funktionen A und B). Alle Verfahren im Zusammenhang mit dem Umgang mit Tieren und der Probenentnahme müssen den ANARRIVE-Richtlinien (Animal Research: Reporting of in vivo Experiments) entsprechen und ethischen Standards für die Pflege und Verwendung von Tieren gemäß den Empfehlungen der Federation of European Laboratory Animal Science Associations (FELASA) entsprechen. Die vorliegende Studie folgte all diesen Standards sowie der portugiesischen Gesetzgebung für die Versuchstierkunde (EU-Richtlinie 2010/63; Gesetzesdekret Nr. 113/2013). Die Forschung wurde von der Tierschutz- und Ethikstelle der IPMA (ORBEA, LABVIVOS-002-AquaClimAdapt) unter der Aufsicht der Nationalen Behörde für die Verwendung lebender Tiere, bekannt als Generaldirektion Lebensmittel und Veterinärwesen (DGAV), unter der ethischen Freigabenummer 20596/25-S genehmigt.
1. Untersuchung des Modells und der Erhaltung von Organismen
HINWEIS: Diese Studie wurde speziell für juvenile Dorade (Sparus aurata) mit einem Durchschnittsgewicht von 30,0 ± 5,0 g und einer Gesamtlänge von 12,0 ± 2,0 cm durchgeführt. Diese Methode lässt sich möglicherweise nicht direkt auf andere Fischarten anwenden, da verschiedene Arten einzigartige physiologische und immunologische Eigenschaften aufweisen, die die Leukozytenisolierung, die Zellfixierung und die Viabilitätsbewertung beeinflussen können. Für andere Arten können Anpassungen des Protokolls erforderlich sein, und es werden Vorstudien empfohlen, um die Bedingungen für jede Zielart zu optimieren.
- Akklimatisierung der Fische (Quarantänezeit)
- Verteilen Sie die Fische gleichmäßig auf Becken mit großem Fassungsvermögen (z.B. zwei Becken mit einem Gesamtfassungsvermögen von je 660 l - siehe Ergänzende Abbildung 1).
HINWEIS: Die zu verwendenden Tanks können Teil eines rezirkulierenden Aquakultursystems (RAS) sein, das eine effiziente Wassernutzung und eine verbesserte Kontrolle der Wasserqualität ermöglicht. In einem RAS wird das Wasser kontinuierlich recycelt und innerhalb des Systems aufbereitet, um eine stabile und kontrollierte Umgebung für die Fische zu schaffen. Dieser Aufbau trägt dazu bei, optimale Bedingungen für die Gesundheit und das Wachstum der Fische aufrechtzuerhalten, eine gleichmäßige Verteilung zu gewährleisten und den Stress während der Studie zu minimieren. - Halten Sie optimale abiotische Bedingungen aufrecht.
- Halten Sie die Fische 3 Wochen lang in Quarantäne unter Bedingungen, die ihren natürlichen Lebensraum nachahmen:
Temperatur: 20,0 ± 0,5 °C;
gelöster Sauerstoff: 7,2 ± 0,2 mg/l;
Salzgehalt: 35,0 ± 0,5 ‰;
pH-Wert: 8,0 ± 0,1 Einheiten;
Photoperiode: 14 h hell/10 h dunkel.
HINWEIS: Die idealen Pflegebedingungen können je nach Fischart variieren. Andere Arten können andere Anforderungen haben, daher ist es wichtig, diese Bedingungen an die spezifischen Bedürfnisse der Zielart anzupassen, um die Gesundheit und das Wohlergehen der Organismen zu gewährleisten. Darüber hinaus können sich die Temperatur des Meerwassers und die Photoperiode mit den Jahreszeiten ändern, so dass saisonale Schwankungen bei der Nachbildung natürlicher Bedingungen im Labor berücksichtigt werden sollten.
- Halten Sie die Fische 3 Wochen lang in Quarantäne unter Bedingungen, die ihren natürlichen Lebensraum nachahmen:
- Verteilen Sie die Fische gleichmäßig auf Becken mit großem Fassungsvermögen (z.B. zwei Becken mit einem Gesamtfassungsvermögen von je 660 l - siehe Ergänzende Abbildung 1).
- Starten Sie die experimentelle Studie.
- Definieren Sie die Anzahl der erforderlichen Tanks und Fische auf der Grundlage des Versuchsaufbaus jeder Fallstudie.
- Nach der Quarantänezeit wird der Fisch in ein unabhängiges RAS überführt (siehe ergänzende Abbildung 2).
- Statten Sie jedes System mit Proteinabschäumern aus, um überschüssige organische Verbindungen aus dem Wasser zu entfernen. physikalische Filtration (Filterbeutel [400 μm], Filterschwamm und Glaswolle); biologische Filtration (Bio-Kugeln [1,5"], UV-Wassersterilisator und Unterwasser-Ausströmsteine); automatische Meerwasserkühlsysteme und digitale Tauchheizungen, die beide mit einem computergestützten Steuerungssystem (ProfiLux) mit Temperatursensoren verbunden sind, um die Temperatur in jedem Tank einzustellen; Untergetauchte Ausströmersteine in jedem Tank, um den gelösten Sauerstoff zu kontrollieren.
- Akklimatisieren Sie die Fische 2 Wochen lang in den neuen Systemen, bevor Sie mit dem Experiment fortfahren.
- Führen Sie tägliche Wartungsarbeiten durch
- Entfernen Sie Fischkot aus jedem Inkubationsbecken und führen Sie eine Meerwassererneuerung von 25 % durch.
- Messen Sie die Temperatur mit einem tragbaren Präzisionsthermometer.
- Überwachen Sie andere abiotische Parameter des Meerwassers (Salzgehalt, gelöster Sauerstoff und pH-Wert) mit einem Multiparameter-Messgerät.
- Passen Sie die abiotischen Parameter des Meerwassers nach Bedarf an, um die Stabilität während des gesamten Experiments zu gewährleisten.
HINWEIS: Die abiotischen Bedingungen in den experimentellen Systemen können je nach den spezifischen Anforderungen der jeweiligen Fallstudie variieren. Wenn die Studie beispielsweise darauf abzielt, saisonale Veränderungen oder marine Hitzewellen zu simulieren, sollten die Temperatur und die Photoperiode entsprechend angepasst werden, um natürliche saisonale Schwankungen nachzuahmen. Wenn sich die Studie auf die Simulation hypoxischer Bedingungen oder der Ozeanversauerung konzentriert, sollten auch der Sauerstoffgehalt und der pH-Wert des Meerwassers angepasst werden. Dies stellt sicher, dass die experimentellen Bedingungen so realistisch und relevant wie möglich sind, und erhöht die Validität und Anwendbarkeit der Studienergebnisse. - Beurteilen Sie die Gesundheit und das Wohlbefinden der Fische, indem Sie Anzeichen von Stress oder Krankheiten erkennen und behandeln, wie in den Schritten 1.2.4.6 bis 1.2.4.8 beschrieben.
- Achte auf abnormale Verhaltensweisen wie unregelmäßiges Schwimmen, Appetitlosigkeit, Lethargie, Aggression oder Isolation.
- Achte auf Anzeichen einer Krankheit, einschließlich Läsionen, Geschwüre, Verfärbungen, eingeklemmte Flossen, übermäßiger Schleim oder schnelle Kiemenbewegungen.
- Notieren Sie alle Beobachtungen und notieren Sie das Datum und die ergriffenen Maßnahmen.
- Führen Sie wöchentliche Wasserqualitätstests durch.
- Messen Sie den Gehalt an Ammoniak (NH3/NH 4), Nitrit (NO2-) und Nitrat (NO3-) mit kolorimetrischen Tests.
HINWEIS: Stellen Sie sicher, dass alle diese Parameter unter den erkennbaren Werten liegen. Wenn die Werte die Grenzwerte überschreiten, führen Sie einen zusätzlichen Wasserwechsel durch, erhöhen Sie die Belüftung oder passen Sie die Filtration an.
- Messen Sie den Gehalt an Ammoniak (NH3/NH 4), Nitrit (NO2-) und Nitrat (NO3-) mit kolorimetrischen Tests.
- Füttern und überwachen Sie die Ernährung der Fische.
- Bereitstellung eines qualitativ hochwertigen Futters, das den spezifischen Ernährungsbedürfnissen von Jungfischen entspricht (siehe Ergänzende Tabelle 1 für ein Beispiel für die detaillierte Zusammensetzung des Futters).
HINWEIS: Stellen Sie sicher, dass die Größe der Aquafeed-Pellets (2-3 mm) für die Jungtiere geeignet ist, um die Aufnahme und Verdauung zu erleichtern. - Stellen Sie die Futtermenge so ein, dass sie 2 % des durchschnittlichen Körpergewichts des Fisches pro Tag entspricht.
- Füttern Sie die Fische zweimal täglich manuell - einmal morgens und einmal nachmittags (legen Sie eine bestimmte Zeit fest, um eine stabile Fütterungsroutine aufrechtzuerhalten).
- Bereitstellung eines qualitativ hochwertigen Futters, das den spezifischen Ernährungsbedürfnissen von Jungfischen entspricht (siehe Ergänzende Tabelle 1 für ein Beispiel für die detaillierte Zusammensetzung des Futters).
2. Fischprobenahme, Euthanasie, Sektion und Entnahme von Kopfnieren
- Probieren Sie die Fische aus den Aquarien.
- Wählen Sie Fische nach dem Zufallsprinzip aus den Tanks aus, um eine Verzerrung der Probenahme zu vermeiden.
- Setzen Sie den Fisch mit einem Netz vorsichtig in einen mit Aquarienwasser gefüllten temporären Auffangbehälter um.
HINWEIS: Minimieren Sie die Bearbeitungszeit, um Stress zu reduzieren.
- Bereite die Euthanasielösung vor.
- Verwenden Sie einen geeigneten Behälter (z. B. einen 3-Liter-Eimer), der für die Aufbewahrung des Fisches geeignet ist.
- Die entsprechende Menge an Tricain (MS-222) wird in Meerwasser gelöst, um eine Endkonzentration von 200-300 mg/L18 zu erreichen (VORSICHT: Siehe Ergänzende Tabelle 2 und Ergänzende Datei 1).
- Puffern Sie die Lösung mit Natriumbicarbonat auf einen pH-Wert von 7,2-7,5.
- Verabreichen Sie die Euthanasielösung.
- Legen Sie den Fisch für mindestens 10 Minuten in die Euthanasielösung oder bis eine Einstellung der Operkularbewegung und ein Verlust der Reflexe beobachtet werden (bestätigen Sie die Euthanasie, indem Sie überprüfen, ob keine Reaktion auf äußere Reize vorliegt).
- Notieren Sie das Körpergewicht (g) und die Gesamtlänge (cm) des Fisches.
- Führen Sie die Fischsektion durch.
HINWEIS: Um eine optimale Probenqualität und Zellviabilität zu gewährleisten, sollte der Dissektionsprozess so schnell wie möglich abgeschlossen werden, idealerweise innerhalb von 5 Minuten nach der Euthanasie.- Stellen Sie sicher, dass die Labortemperatur mit einer Klimaanlage auf 19 °C gehalten wird, um Schwankungen während der Probenahme und Verarbeitung zu minimieren.
- Sterilisieren Sie die Präparierwerkzeuge (vorzugsweise Metallinstrumente, wenn möglich) und richten Sie einen sauberen Arbeitsbereich mit 70%igem Ethanol ein (VORSICHT, siehe Ergänzende Tabelle 2).
- Legen Sie den eingeschläferten Fisch auf die Seite auf ein steriles Seziertablett, wobei der Kopf zur nicht dominanten Hand zeigt.
- Machen Sie mit einem Skalpell einen vorsichtigen Schnitt entlang der ventralen Mittellinie des Fisches von der Öffnung (Anus) bis zu den Kiemen.
HINWEIS: Achten Sie darauf, nicht zu tief zu schneiden, um innere Organe nicht zu beschädigen. - Verwenden Sie vorsichtig eine Präparierschere, um den Schnitt zu verlängern und die inneren Organe freizulegen. Heben Sie die Flaps an der Körperwand vorsichtig an, um einen freien Blick auf die innere Anatomie zu haben.
- Lokalisieren Sie die Kopfniere: Die Kopfniere befindet sich direkt hinter den Kiemen, in der Nähe des vorderen dorsalen Bereichs der Körperhöhle, und erstreckt sich entlang der Oberseite der Körperhöhle unterhalb der Wirbelsäule.
HINWEIS: Die Kopfniere ist im Vergleich zum umgebenden Gewebe in der Regel dunkler gefärbt (Abbildung 1). - Entfernen Sie vorsichtig umliegendes Gewebe wie Fett und Bindegewebe, um die Kopfniere besser sichtbar zu machen.
HINWEIS: Dieser Schritt erfordert eine vorsichtige Handhabung, um eine Beschädigung der Kopfniere zu vermeiden. - Heben Sie mit einer feinen Pinzette und einer Schere vorsichtig die Kopfniere an und machen Sie präzise Schnitte um sie herum, um sie vom umgebenden Gewebe zu befreien.
HINWEIS: Gehen Sie vorsichtig mit dem Taschentuch um, um Schäden zu vermeiden. Bei einem Fisch mit einem Gewicht von etwa 30 g wird erwartet, dass die Kopfniere etwa 20-30 mg wiegt. - Legen Sie das herausgeschnittene Organ sofort in ein Zellsieb (100 μm Nylonnetz) in einer sterilen Petrischale, um die Sterilität zu gewährleisten und die nachfolgenden Verarbeitungsschritte zu erleichtern.
HINWEIS: Von diesem Zeitpunkt an sollten alle Schritte so schnell wie möglich (innerhalb von 5 Minuten) durchgeführt werden, um die Lebensfähigkeit der Zellen zu erhalten. Um die Probe kühl zu halten, führen Sie die folgenden Schritte aus, indem Sie die Petrischale auf einen mit Eis gefüllten und mit Alufolie abgedeckten Behälter stellen.

Abbildung 1: Stellung der Kopfniere: (A) Abbildung, die die typische Lage der Kopfniere hinter den Kiemen und entlang des vorderen dorsalen Bereichs der Körperhöhle darstellt; (B) Repräsentatives Bild der Kopfniere in der Dorade, das ihre dunklere Färbung im Vergleich zum umgebenden Gewebe hervorhebt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Isolierung von Leukozyten der Kopfniere (Abbildung 2)
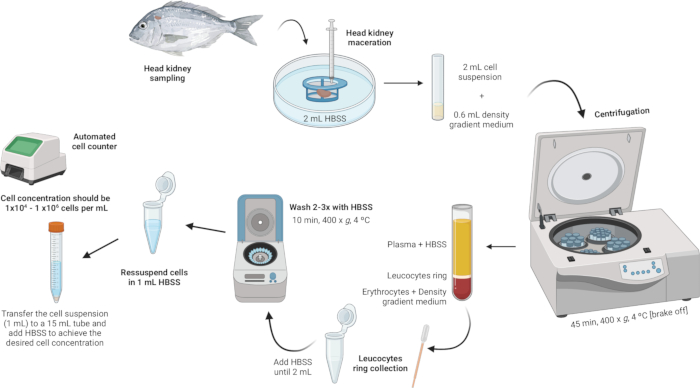
Abbildung 2: Illustrative Beschreibung der Leukozytenisolierung aus der Kopfniere. Das Protokoll umfasst mehrere Schritte: Beginnend mit der Homogenisierung des Gewebes, gefolgt von der Zentrifugation des Dichtegradienten, der Entnahme des Leukozytenrings, dem Waschen des Leukozytenrings und schließlich der Resuspension und Einstellung der Zellkonzentration. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Homogenisieren Sie das Gewebe.
- Geben Sie 2 ml Hanks' Balanced Salt Solution (HBSS) in eine sterile Petrischale.
- Stellen Sie sicher, dass das Netz des Zellsiebs (100 μm Nylonnetz) in Kontakt mit dem HBSS ist, aber nicht vollständig untergetaucht ist.
- Mazerieren Sie die Kopfniere mit dem Kolben einer Spritze auf dem Zellsieb. Üben Sie sanften Druck aus, um die Organfragmente durch das Nylonnetz zu drücken, wodurch eine Zellsuspension entsteht.
HINWEIS: Wenn mehrere Proben verarbeitet werden, kann die Petrischale, die die Zellsuspension enthält, einige Minuten bis zum nächsten Schritt bei 4 °C im Kühlschrank gelagert werden. Diese Zellsuspension wird für die Isolierung von Leukozyten verwendet.
- Führen Sie eine Dichtegradientenzentrifugation durch.
- Bereiten Sie eine Dichtegradienten-Mediumlösung mit einer Dichte von 1,077 g/ml, einer Osmolarität von 353 mOsm/kg und einem pH-Wert von 7,4 vor (siehe Zusatzdatei 1).
HINWEIS: Die Osmolarität kann zwischen verschiedenen Fischarten variieren, daher ist es wichtig, die Osmolarität der Dichtegradienten-Mediumlösung an die spezifischen Anforderungen jeder Art anzupassen. - In 5-ml-Polystyrol-Röhrchen mit rundem Boden geben Sie vorsichtig 600 μl der Dichtegradienten-Medium-Lösung hinzu.
- Nehmen Sie die Zellsuspension (2 ml) und geben Sie sie langsam in das Röhrchen mit dem Dichtegradientenmedium. Der erste Tropfen ist entscheidend - fügen Sie ihn sehr vorsichtig hinzu, um eine Destabilisierung des Dichtegradienten in der mittleren Phase zu vermeiden.
HINWEIS: Dies sollte im Verhältnis 3:10 erfolgen (Dichtegradient Medium: Zellsuspension). Verwenden Sie eine sterile 1 mL Pasteur-Pipette für eine präzise und schonende Zugabe. Stellen Sie sicher, dass die Spitze der Pipette die Seite des Röhrchens berührt, um eine Störung der Dichtegradienten-Mediumschicht zu vermeiden. Vermeiden Sie es, die Probe mit dem Dichtegradientenmedium zu mischen. - Die Röhrchen bei 400 x g für 45 min bei 4 °C zentrifugieren, wobei die Bremse ausgeschaltet ist. So wird sichergestellt, dass die Schichten während des Prozesses intakt bleiben.
HINWEIS: Nach der Zentrifugation sollten deutliche Schichten sichtbar sein. Leukozyten bilden einen Ring an der Grenzfläche zwischen dem Dichtegradientenmedium und dem Zelltrümmerpellet (Abbildung 3).
- Bereiten Sie eine Dichtegradienten-Mediumlösung mit einer Dichte von 1,077 g/ml, einer Osmolarität von 353 mOsm/kg und einem pH-Wert von 7,4 vor (siehe Zusatzdatei 1).
Abbildung 3: Leukozytenring an der Grenzfläche zwischen dem Dichtegradientenmedium und dem Zelltrümmerpellet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Sammeln Sie den Leukozytenring.
- Aspirieren Sie den Leukozytenring (~100 μl) vorsichtig mit einer sterilen Pasteurpipette und überführen Sie ihn in ein 2-ml-Mikrozentrifugenröhrchen.
HINWEIS: Achten Sie darauf, die Schichten nicht wesentlich zu stören, um eine Kontamination zu vermeiden. Wenn der Leukozytenring Ablagerungen oder dunkle Suspensionen zu enthalten scheint, ist es ratsam, die gesammelte Leukozytensuspension durch ein neues Minizellsieb (100 μm) zu leiten, um die Reinheit zu gewährleisten. Legen Sie das Minizellsieb über das 2 mL Mikrozentrifugenröhrchen und übertragen Sie die Leukozytensuspension vorsichtig durch das Sieb.
- Aspirieren Sie den Leukozytenring (~100 μl) vorsichtig mit einer sterilen Pasteurpipette und überführen Sie ihn in ein 2-ml-Mikrozentrifugenröhrchen.
- Waschen Sie den Leukozytenring.
- Geben Sie HBSS in die Mikrozentrifugenröhrchen mit dem Leukozytenring, bis das Volumen 2 ml erreicht, und resuspendieren Sie die Zellen vorsichtig.
HINWEIS: Bewahren Sie die Röhrchen in einem mit Eis gefüllten und mit Aluminiumfolie abgedeckten Behälter auf, um die Probe auf einer niedrigen Temperatur zu halten. Stellen Sie sicher, dass die Rohre nicht in direkten Kontakt mit dem Eis kommen. Behalten Sie diese Kühlung während des gesamten Waschvorgangs bei. - Die Proben werden bei 400 × g für 10 min bei 4 °C zentrifugiert (Bremse kann eingeschaltet werden).
- Entsorgen Sie nach dem Zentrifugieren den Überstand vorsichtig und lassen Sie das Pellet am Boden (der fast unsichtbar sein kann).
- Wiederholen Sie die Waschschritte (Zugabe von HBSS, Resuspendieren, Zentrifugieren und Verwerfen des Überstands), bis das Pellet frei von Verunreinigungen ist.
- Geben Sie HBSS in die Mikrozentrifugenröhrchen mit dem Leukozytenring, bis das Volumen 2 ml erreicht, und resuspendieren Sie die Zellen vorsichtig.
- Resuspendieren und Anpassen der Zellkonzentration.
- Resuspendieren Sie die Zellen in 1 ml HBSS in denselben 2 ml-Mikrozentrifugenröhrchen, die für die Waschvorgänge verwendet wurden.
- Erreichen Sie eine Zellkonzentration zwischen 1 × 104 und 1 × 106 Zellen pro ml. Wenn das anfängliche Pellet groß ist, kann zusätzliches HBSS erforderlich sein, um die Zellkonzentration auf den gewünschten Bereich zu verdünnen. Übertragen Sie die Zellsuspension in ein 15-ml-Röhrchen und fügen Sie bei Bedarf mehr HBSS hinzu, basierend auf den erhaltenen Zellzahlen.
HINWEIS: Die Verwendung eines automatisierten Zellzählers wird empfohlen, um den Prozess zu erleichtern.
4. Färbung und Fixierung von Leukozyten (Abbildung 4)
HINWEIS: Die LIVE/DEAD Fixable Dead Cell Stain Kits bieten eine verbesserte Methode zur Bewertung der Zellviabilität in fixierten Zellen mittels Durchflusszytometrie. Diese Assays verwenden einen fluoreszierenden reaktiven Farbstoff, der mit zellulären Aminen interagiert. Wenn die Zellmembranen beeinträchtigt sind, kann der Farbstoff in die Zellen eindringen und mit freien Aminen sowohl im Inneren als auch auf der Zelloberfläche reagieren, was zu einer intensiven Fluoreszenzfärbung führt. Umgekehrt stehen in lebensfähigen Zellen nur die Amine der Zelloberfläche zur Verfügung, um mit dem Farbstoff zu reagieren, was zu einer relativ schwachen Färbung führt. Die Färbeintensität bleibt nach der Fixierung mit Formaldehyd erhalten, das auch die Probe konserviert, indem es das Wachstum von Mikroorganismen verhindert. Die LIVE/DEAD Fixable Dead Cell Stain Kits sind bis auf den Fluoreszenzfarbstoff identisch - erhältlich in Blau, Violett, Aqua, Gelb, Grün, Rot, Fernrot oder Nahinfrarot (Infrarot). In dieser Studie haben wir den Nah-IR-Fluoreszenz-Reaktivfarbstoff verwendet. Darüber hinaus ermöglicht dieser einfarbige Assay die parallele Prüfung anderer Parameter in einem Mehrfarbenexperiment.
- Bereite die Farbe vor.
- Bringen Sie die Reagenzien auf Raumtemperatur (RT): Lassen Sie eine Durchstechflasche mit dem fluoreszierenden Reaktivfarbstoff und die Durchstechflasche mit wasserfreiem Dimethylsulfoxid (DMSO) RT erreichen, bevor Sie die Kappen entfernen.
- Rekonstituieren Sie den Farbstoff: Geben Sie 50 μl DMSO in die Durchstechflasche mit dem Reaktivfarbstoff. Gründlich mischen und sicherstellen, dass sich der Farbstoff vollständig aufgelöst hat.
- Verwenden Sie die rekonstituierte Färbelösung so schnell wie möglich, vorzugsweise innerhalb weniger Stunden.
HINWEIS: Jedes Kit enthält fünf einzelne Fläschchen mit Reaktivfarbstoff, die ausreichend Material zum Färben von mindestens 40 Zellproben enthalten. Nach der Rekonstitution ist die DMSO-Lösung des Farbstoffs jedoch relativ instabil, insbesondere wenn sie Feuchtigkeit ausgesetzt wird. Unbenutzte Portionen können bis zu 2 Wochen bei ≤-20 °C gelagert werden, geschützt vor Licht und Feuchtigkeit.
- Färzen und fixieren Sie die Zellen.
HINWEIS: Zu den für die Zellfärbung geeigneten Puffern gehören Hanks' Balanced Salt Solution (HBSS), phosphatgepufferte Kochsalzlösung (PBS) und Dulbecco's PBS (D-PBS), solange sie keine Fremdproteine wie Rinderserumalbumin oder Serum enthalten. Wenn Sie einen aminoreaktiven Farbstoff verwenden, vermeiden Sie Tris-Puffer und Lösungen mit Natriumazid oder Fremdprotein zur Zellresuspension und zum Waschen. In dieser Studie haben wir HBSS aufgrund seiner ausgewogenen Ionenzusammensetzung verwendet, die zur Aufrechterhaltung des osmotischen Gleichgewichts beiträgt und essentielle Ionen und Glukose liefert, um den Zellstoffwechsel und die Lebensfähigkeit während des Färbeprozesses zu unterstützen. HBSS ist außerdem frei von Fremdproteinen, wodurch eine Interferenz mit dem Reaktivfarbstoff verhindert und eine genaue Viabilitätsbewertung gewährleistet wird.- Nachdem Sie die Zellen gezählt und die Dichte mit HBSS auf 1 x 106 Zellen pro ml eingestellt haben, übertragen Sie 1 ml dieser Zellsuspension in 2 ml-Mikrozentrifugenröhrchen.
- Induzieren Sie für jeden Tag den Zelltod in mindestens einer Probe, die als Kontrolle zur Einstellung des Schwellenwerts für die Fluoreszenzintensität zwischen lebenden und toten Zellen verwendet wird. Bereiten Sie die Proben in Mikrozentrifugenröhrchen wie folgt vor:
Röhrchen 1: Lebende Zellen - ungefärbt
Röhrchen 2: Lebende Zellen - gefärbt
Röhrchen 3: Abgestorbene Zellen - ungefärbt
Röhrchen 4: Tote Zellen - gefärbt
HINWEIS: Diese vier Röhrchen müssen nur für eine einzige Probe in jedem Experiment als Kontrollen vorbereitet werden. Für die restlichen Proben sind nur zwei Röhrchen notwendig (Röhrchen 1: Probe - ungefärbt und Röhrchen 2: Probe - gefärbt), da es Aufschluss über die Zellen gibt, die lebendig waren, und diejenigen, die tot waren.
- Induzieren Sie für jeden Tag den Zelltod in mindestens einer Probe, die als Kontrolle zur Einstellung des Schwellenwerts für die Fluoreszenzintensität zwischen lebenden und toten Zellen verwendet wird. Bereiten Sie die Proben in Mikrozentrifugenröhrchen wie folgt vor:
- Positivkontrolle für den Zelltod: Legen Sie das markierte Röhrchen Tot ungefärbt (Röhrchen 3) und Totgefärbt (Röhrchen 4) für 7 Minuten in ein Wasserbad bei 50 °C, um den Zelltod durch Wärmebehandlung zu induzieren.
- Färben der Zellen: 1 μl des rekonstituierten fluoreszierenden Reaktivfarbstoffs (aus Schritt 4.1.2) zu 1 ml der Zellsuspension in den Röhrchen 2 und 4 (Röhrchen, die gefärbt werden) geben und gut mischen.
- 30 min bei RT lichtgeschützt inkubieren.
HINWEIS: Wenn keine Fixierung erforderlich ist, können Sie die Schritte 4.2.5-4.2.7 unten überspringen. Stattdessen werden die Zellen zweimal mit 1 ml HBSS mit 1 % Rinderserumalbumin gewaschen (siehe Zusatzdatei 1) und in 1 ml HBSS mit 1 % Rinderserumalbumin resuspendiert. Führen Sie die Analyse am Durchflusszytometer so schnell wie möglich durch. Andernfalls kann die Lebensfähigkeit der Zellen beeinträchtigt werden, da die Zellen nicht fixiert sind. - Waschen Sie die Zellen zweimal mit 1 mL HBSS und resuspendieren Sie die Zellen in 900 μl HBSS.
- 100 μl 37 % Formaldehyd zugeben (VORSICHT, siehe Ergänzende Tabelle 2).
- 15 min bei RT inkubieren.
- Waschen Sie zweimal mit 1 ml HBSS mit 1 % Rinderserumalbumin (BSA) und resuspendieren Sie dann die Zellen in 1 ml HBSS mit 1 % BSA.
- Die Proben werden im Kühlschrank bei 4 °C gelagert. Analysieren Sie die Zellen innerhalb von 1 Monat nach der Fixierung.
- Analysieren Sie die fixierte Zellsuspension mittels Durchflusszytometrie unter Verwendung des geeigneten Anregungs- und Nachweiskanals.
HINWEIS: Die korrekten Anregungs- und Detektionskanäle können je nach verwendetem Gerät unterschiedlich sein (siehe Ergänzende Tabelle 3).
- Nachdem Sie die Zellen gezählt und die Dichte mit HBSS auf 1 x 106 Zellen pro ml eingestellt haben, übertragen Sie 1 ml dieser Zellsuspension in 2 ml-Mikrozentrifugenröhrchen.
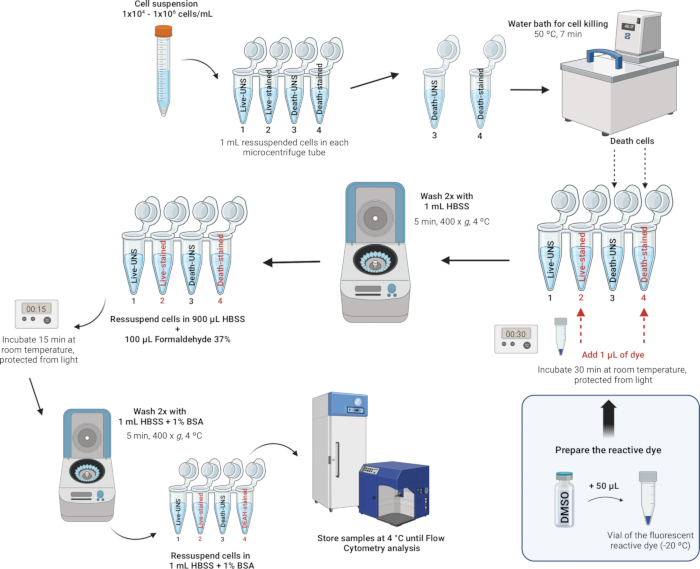
Abbildung 4: Illustrative Beschreibung der Färbung und Fixierung von Leukozyten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Durchflusszytometrie
- Erfassen Sie Daten.
HINWEIS: Die auf dem Durchflusszytometer zu befolgenden Verfahren können je nach verwendetem Zytometer variieren. In dieser Studie wurden die Daten mit dem Attune NTx Durchflusszytometer erfasst.- Führen Sie die Beispiele aus.
- Setzen Sie das Probenröhrchen in den Probenanschluss ein.
- Starten Sie die Erfassung, indem Sie auf Start drücken und dann auf Aufnahme klicken, sobald sich die Ereignisrate (Ereignisse/Sekunde) stabilisiert hat.
- Zeichnen Sie mindestens 10.000 Ereignisse für jede Probe im Einzelgatter auf, um eine zuverlässige Analyse zu gewährleisten.
- Speichern Sie alle Daten für jede Probe und sichern Sie sie auf externen Laufwerken oder Cloud-Speicher.
- Analysieren Sie die Daten.
HINWEIS: Für die Durchflusszytometrie-Analyse stehen mehrere Softwareoptionen zur Verfügung. In dieser Studie wurde die Datenanalyse mit dem FlowJo v10.8.119 durchgeführt.- Datendateien laden: Starten Sie die Durchflusszytometrie-Analysesoftware und laden Sie die erfassten .fcs-Dateien aus dem Experiment hoch.
- Visualisieren Sie die Daten (Abbildung 5A): Plotten Sie die Vorwärtsstreuung (FSC-A) (XX) im Vergleich zur Seitenstreuung (SSC-A) (YY), um die Zellengröße und -granularität zu bewerten.
HINWEIS: Dieses Diagramm wird häufig verwendet, um Zellpopulationen zu identifizieren und Ablagerungen basierend auf ihren Streueigenschaften auszuschließen. - Singulett-Zell-Gating und Multiplett-Ausschluss (Abbildung 5B): Verwenden Sie das Diagramm Forward Scatter Area (FSC-A) vs. Forward Scatter Height (FSC-H), um Multipletts auszuschließen. Zeichnen Sie ein Gate, um alle im Diagramm ausgerichteten Ereignisse einzuschließen (einzelne Zellen) und die nicht ausgerichteten Ereignisse auszuschließen (Multipletts). Wenn die Stichprobe Ereignisse mit sehr niedrigem FSC enthält, schließen Sie diese aus, indem Sie sie nicht in das Gate der Einzelzelle aufnehmen, sodass nur Singulett-Zellen übrig bleiben.
- Identifizierung von Leukozytenpopulationen (Abbildung 5C): Unterscheiden Sie die 3 Leukozytenpopulationen anhand des FSC-A/SSC-A-Profils: FSC-Ahoch/SSC-Ahoch sind Granulozyten, FSC-Amedium/SSC-Amedium sind die Monozyten und FSC-Aniedrig/SSC-Aniedrig sind die Lymphozyten.
- Viabilitäts-Gating (Abbildung 5D): Legen Sie den Schwellenwert für die Viabilitätsfarbstofffärbung auf dem entsprechenden Fluoreszenzkanal (NIR, RL3-A) fest. Lebende und tote Zellen werden basierend auf der Färbeintensität mit LIVE/DEAD Fixable Dead Cell Stain: Schwach gefärbte Zellen werden als lebende Zellen definiert, und die stark gefärbten Zellen werden als tote Zellen definiert.
- Populationsstatistiken: Sehen Sie sich die von der Software bereitgestellten Statistiken an, einschließlich der Gesamtzahl der Ereignisse (Zellen) in jedem Gate und der Prozentsätze der gesamten und geschlossenen Zellen.
- Daten exportieren: Exportieren Sie die Daten in eine Tabellenkalkulation und verwenden Sie eine geeignete Statistiksoftware (GraphPad Prism oder R) für die weitere statistische Analyse.
HINWEIS: Die Wahl der Analysemethoden hängt von den Zielen der Forschung ab.
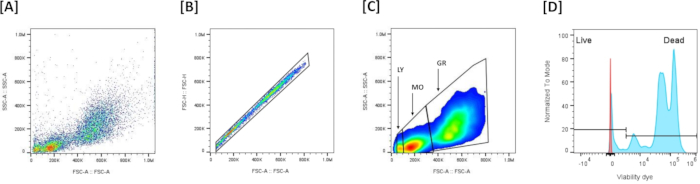
Abbildung 5: Durchflusszytometrische Gating-Strategie zur Beurteilung der Lebensfähigkeit in Kopfnierenzellen: (A) Stellt das FSC-A/SSC-A-Profil aller gesammelten Ereignisse dar. (B) Stellt den Multiplett-Ausschluss basierend auf der Definition des Einzelkornbereichs dar, der auf der Linearität im Diagramm der Vorwärtsstreuung (FSC-A)/Vorwärtsstreuung (FSC-H) basiert. (C) Stellt die 3 Hauptpopulationen dar, die auf der Grundlage von FSC-A/SSC-A definiert wurden, nach Ausschluss von Multipletten. (D) Stellt ein Histogramm dar, das die Lebend-/Tot-Viabilitätsfärbung zeigt. Um den Schwellenwert festzulegen, der die Unterscheidung zwischen lebenden und toten Zellen ermöglicht, wurden die Leukozyten einem leichten Hitzeschock (50 °C, 7 min) unterzogen und dann mit Viabilitätsfarbstoff gefärbt. Zellen mit hoher Färbeintensität positiv (++) sind die toten Zellen, und niedrig färbbare positive Zellen (+-) sind die lebenden Zellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Abbildung 6 zeigt repräsentative durchflusszytometrische Daten, die Leukozytenpopulationen zeigen, die aus der Kopfniere von juvenilen Goldbrassen (Sparus aurata) isoliert wurden, und ihre Zellviabilität unter Verwendung des in dieser Studie beschriebenen Protokolls. Die Abbildung vergleicht zwei Proben: eine mit hoher zellulärer Lebensfähigkeit, bei der die Fische optimalen Bedingungen ausgesetzt waren (Abbildung 6A), und eine andere mit geringer zellulärer Lebensfähigkeit, bei der die Zellen thermischem Stress ausgesetzt waren (Abbildung 6B).
In beiden Proben wurden mit der vorliegenden Methode drei Haupt-Leukozytenpopulationen identifiziert: Lymphozyten (LY), Monozyten (MO) und Granulozyten (GR). Diese Populationen wurden auf der Grundlage von Unterschieden in der Zellgröße und -komplexität unterschieden, wie durch Vorwärtsstreudiagramme (FSC-A) und Seitenstreuung (SSC-A) angezeigt wird. Die Vorwärtsstreuung (FSC-A) gibt die relative Zellgröße an, während die Seitenstreuung (SSC-A) die interne Komplexität bzw. Granularität der Zellen widerspiegelt und so eine klare Trennung der Populationen ermöglicht. Unter optimalen Bedingungen (Abbildung 6A) verteilten sich die Leukozytenpopulationen wie folgt: LY bei 31,0 %, MO bei 38,0 % und GR bei 31,0 %. In der Stichprobe, die thermischem Stress ausgesetzt war (Abbildung 6B), wurde jedoch eine Verschiebung in der Verteilung dieser Populationen beobachtet, wobei die LY auf 21,3 % abnahm, die MO auf 45,6 % anstieg und die GR mit 33,1 % relativ stabil blieb.
Eine weitere Analyse der Zellviabilität, die in Abbildung 6A1-A3 und Abbildung 6B1-B3 detailliert ist, zeigt einen signifikanten Kontrast zwischen den beiden Proben. Wie zu beobachten ist, wies die Probe, die optimalen Bedingungen ausgesetzt war (Abbildung 6A), eine höhere Lebensfähigkeit auf, mit einer Dominanz lebender Zellen (dargestellt in blau) in allen Leukozytenpopulationen. Im Gegensatz dazu zeigte die thermisch belastete Probe (Abbildung 6B) einen signifikanten Anstieg des Zelltods (intensivere Färbung in rot), wobei LY 50,7 % Zelltod, MO 83,7 % und GR 84,5 % zeigte.
Insgesamt zeigen die Ergebnisse deutlich die Wirksamkeit des Protokolls sowohl bei der Isolierung und Analyse von Leukozytenpopulationen als auch bei der Beurteilung der Zellviabilität. Darüber hinaus liefern die Daten wertvolle Erkenntnisse darüber, wie Stressbedingungen, wie z. B. thermische Exposition, die Dynamik der Leukozytenpopulation und die Lebensfähigkeit der Zellen beeinflussen. Die beobachteten Verschiebungen in der Zellverteilung und der Lebensfähigkeit unter Stress deuten darauf hin, dass die thermische Exposition nicht nur das Gleichgewicht der Leukozytenpopulationen stört, sondern auch die Zellgesundheit beeinträchtigt. Diese Veränderungen können auf eine Immunantwort auf Stress hinweisen, was auf einen aktiven Abwehrmechanismus hinweist, der durch Umweltstressoren ausgelöst wird.

Abbildung 6: Repräsentative Diagramme der Durchflusszytometrie, die die Identifizierung und Lebensfähigkeit verschiedener Leukozytenpopulationen aus der Kopfniere der Goldbrasse (Sparus aurata) veranschaulichen: (A) Probe mit hoher Zellviabilität, die optimalen Bedingungen ausgesetzt war: Das linke Feld zeigt das Gating von Leukozytenpopulationen auf der Grundlage von FSC-A/SSC-A, zur Identifizierung von Lymphozyten (LY), Monozyten (MO) und Granulozyten (GR); Lebensfähigkeit von LY (A.1), MO (A.2) und GR (A.3). (B) Probe mit geringer Zellviabilität, thermischer Belastung ausgesetzt: Das linke Feld zeigt das Gating von Leukozytenpopulationen auf der Grundlage von FSC-A/SSC-A, zur Identifizierung von Lymphozyten (LY), Monozyten (MO) und Granulozyten (GR); Lebensfähigkeit von LY (B.1), MO (B.2) und GR (B.3). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Repräsentatives Bild eines Quarantänebeckens mit einem Gesamtfassungsvermögen von 660 L. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Abbildung 2: Bild eines RAS-System-Setups. (1) Profilux; (2) Leuchten; (3) Aquarien/Aquarien; (4) Kühlschrank; (5) Wasserhähne in Aquarien; (6) Blauer Siphon für Aquarienwasserauslässe; (7) Sumpf; (8) Eiweißabschäumer; (9) Mechanischer Filter (Filterbeutel); (10) Mechanischer Filter (blauer Schwamm + Glaswolle); (11) Biologischer Filter (Biobälle); (12) Thermostat; (13) Hauptpumpe; (14) UV-Sterilisator; (15) Temperatursensor; (A) Mechanischer Filter (blauer Schwamm); (B) Mechanischer Filter (Glaswolle). Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Tabelle 1: Zusammensetzung der Inhaltsstoffe (%) und Näherungsanalyse (% TM) des in der Studie verwendeten Versuchsfutters. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 2: Im Protokoll verwendete Reagenzien: Gesundheitsgefahren, Gefahrenhinweise, Sicherheitshinweise und Erste-Hilfe-Maßnahmen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 3: Geeignete Anregungs- und Detektionskanäle für die Verwendung mit den aminreaktiven LIVE/DEAD-fixierbaren Totzellfärbungen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Datei 1: Berechnungen für die Herstellung von Lösungen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die in dieser Studie entwickelte Methode stellt einen bedeutenden Fortschritt in der Forschung zur Fischimmunologie dar und verspricht, das Verständnis der Immunantworten von Fischen und die Nachhaltigkeit der marinen Ressourcen zu verbessern. S. aurata ist eine wertvolle Meeresfischart aus der Familie der Sparidae, die aus mehreren Gründen als idealer Modellorganismus dient, einschließlich ihrer ökologischen und wirtschaftlichen Relevanz sowie ihrer Vielseitigkeit in der Laborforschung in verschiedenen Studienbereichen wie Physiologie, Immunologie, Toxikologie und Aquakultur20. Einer der Hauptvorteile von S. aurata ist die einfache Handhabung und Aufzucht im Labor, mit gut etablierten Haltungsprotokollen, die konsistente und reproduzierbare Versuchsbedingungen gewährleisten21. Darüber hinaus ist es aufgrund seiner Anpassungsfähigkeit an die Umwelt (d. h. seiner hohen Toleranz gegenüber einer Vielzahl von Umweltbedingungen wie Temperatur- und Salzgehaltsschwankungen) ein idealer Kandidat für Studien zur Verbesserung der Zuchttechniken und zur Bewertung der Umweltauswirkungen auf Meeresorganismen22. S. aurata ermöglicht mit seinem gut charakterisierten Immunsystem und der Verfügbarkeit genomischer Daten die Entschlüsselung von Immunreaktionen bei Fischen, die Resistenz von Krankheitserregern, die Wirksamkeit von Impfstoffen und die allgemeine Gesundheit20. Angesichts ihrer Bedeutung für die Aquakultur sowie für die Ernährungsgewohnheiten der südeuropäischen Populationen kann sich die Forschung an dieser Art direkt auf die landwirtschaftlichen Verfahren auswirken, ihre Produktion und Nachhaltigkeit verbessern und gleichzeitig die ökologischen Herausforderungen in der Branche angehen20.
In diesem Sinne bietet dieses Protokoll mehrere Vorteile und potenzielle Anwendungen in verschiedenen Forschungsbereichen, wie zum Beispiel: (i) Fischimmunologie: Bietet eine präzise und detaillierte Analyse von Immunzellen aus der Kopfniere von S. aurata, die die Identifizierung und Charakterisierung verschiedener Leukozytenpopulationen sowie robuste Bewertungen ihrer Zellviabilität durch Durchflusszytometrie ermöglicht; ii) Aquakulturforschung: Von wesentlicher Bedeutung für die Erforschung von Haltungstechniken, Ernährung und Krankheitsmanagement, Unterstützung künftiger Forschung, die darauf abzielt, den Einsatz von Antibiotika und chemischen Behandlungen zu verringern und dadurch nachhaltigere Aquakulturpraktiken zu fördern; iii) Ökotoxikologie: Wertvoll für die Bewertung der Auswirkungen von Schadstoffen und anderen Umweltstressoren auf die Immungesundheit von Fischen, da Daten für die Umweltrisikobewertung und die Formulierung von Schutzvorschriften für aquatische Ökosysteme bereitgestellt werden; (iv) Vergleichende Physiologie: Ermöglicht es Forschern, evolutionäre Anpassungen des Immunsystems an verschiedene Umweltherausforderungen zu verfolgen, und bietet ein tieferes Verständnis der genetischen und physiologischen Grundlagen der Immunfunktion; (v) Meeresbiologie und -ökologie: Verbesserung des Verständnisses der ökologischen Rollen und Wechselwirkungen von S. aurata durch Einblicke in die Artenverteilung, die Präferenzen von Lebensräumen und die Auswirkungen von Umweltveränderungen auf die marine Biodiversität; (vi) Biomedizinische Forschung: Fische werden immer häufiger als Modellorganismen in der biomedizinischen Forschung eingesetzt. Die Isolierung und Analyse von Immunzellen kann dazu beitragen, zelluläre und molekulare Aspekte zu verstehen, die für die Arzneimittelforschung und sogar die Medizin entscheidend sind.
Viele Jahre lang stützte sich die Quantifizierung und Identifizierung von Leukozyten in Fischen auf traditionelle hämatologische Techniken, wie z. B. die manuelle Zählung mit Bürker-, Neubauer- oder Thoma-Hämozytometern sowie auf gefärbte Blutausstriche10,12. Die Zellviabilität wurde ebenfalls mit dem Trypanblau-Ausschlusstest bewertet, gefolgt von der Mikroskopiezählung 15,22,23,24,25,26,27,28. Diese Methoden haben zwar zu unserem Verständnis der Fischimmunologie beigetragen, weisen aber einige Einschränkungen auf. Die manuelle Leukozytenzählung war sowohl zeit- als auch arbeitsintensiv, und die Genauigkeit dieser Techniken wurde oft durch die Variabilität des Bedieners und menschliches Versagen beeinträchtigt, was die Konsistenz der Ergebnisse erheblich beeinträchtigte10.
Im Jahr 1994 revolutionierten Esteban et al. die Leukozytenanalyse von Fischen, indem sie eine Technik zur Beurteilung des phagozytären Abwehrmechanismus bei Wolfsbarsch (Dicentrarchus labrax) einführten23. In ihrer Studie wurden Leukozyten aus peripherem Blut, Kopf-Nieren- und Peritonealexsudaten mittels Percoll-Dichtegradientenzentrifugationisoliert 23. Dieser methodische Fortschritt markierte einen bedeutenden Sprung nach vorn und verbesserte die Genauigkeit und Zuverlässigkeit der Leukozytenanalyse. Nach der Pionierarbeit von Esteban et al. zielten nachfolgende Studien darauf ab, die Durchflusszytometrie-Techniken für die Leukozytenanalyse zu verfeinern und zu optimieren, wobei der Schwerpunkt auf verschiedenen Aspekten lag, wie z. B. der Erstellung von Zellpopulationsprofilen 6,15,16,28,29, der Zellviabilität 3,6,27,28 und der phagozytären Aktivität 6,23. 24,27,28. Fortschritte bei den Isolierungsverfahren, einschließlich der Verwendung verschiedener Gradientenmedien (z. B. Ficoll vs. Percoll) und optimierter Zentrifugationsprotokolle, haben die Reinheit und Ausbeute der isolierten Leukozyten verbessert 1,8,14,26. Die Entwicklung fortschrittlicher Färbetechniken und die Verwendung von Fluoreszenzfarbstoffen wie Propidiumiodid (PI) und 3,3'-Dihexyloxacarbocyaniniodid (DiOC6(3)) haben eine genauere Unterscheidung zwischen lebensfähigen und nicht lebensfähigen Zellen sowie eine detaillierte Charakterisierung von Leukozytenpopulationen ermöglicht16,30. Einer der Hauptvorteile dieser Technik ist ihre Fähigkeit, gleichzeitig zwischen verschiedenen Leukozytenpopulationen (Lymphozyten, Monozyten und Granulozyten) zu unterscheiden und die Lebensfähigkeit der Zellen jeder Population zu beurteilen. Auf diese Weise können die Forscher identifizieren, welche Populationen unter bestimmten Bedingungen am stärksten betroffen sind, was tiefere Einblicke in die Immunantwort ermöglicht und die anfälligsten Leukozyten-Untergruppen aufdeckt. Trotz dieser Verbesserungen stoßen die aktuellen Methoden jedoch immer noch an ihre Grenzen. Die meisten Forschungen konzentrierten sich auf erwachsene Fische, was eine Lücke in der Erforschung der Jungstadien hinterließ. Jungfische stellen aufgrund ihrer geringeren Größe und der Schwierigkeit, qualitativ hochwertige Proben von ihren proportional kleineren Immunorganen zu erhalten, eine besondere Herausforderung für die Leukozytenextraktion dar17. Die hier beschriebene Studie befasst sich speziell mit diesen Problemen, indem sie das Protokoll für Jungfische optimiert, das Zellsuspensionsverhältnis angepasst und die Percoll-Lösung verwendet hat, um die Qualität der Leukozytenextraktion zu verbessern. Darüber hinaus sind bestehende Methoden oft durch die Anzahl der Proben oder Replikate begrenzt, die gleichzeitig verarbeitet werden können, da eine unmittelbare Bewertung der Leukozytenviabilität erforderlich ist. Jede Verzögerung bei der Probenhandhabung kann sich negativ auf die Lebensfähigkeit der Zellen auswirken, den Probenahmeprozess erschweren und möglicherweise die Ergebnisse beeinträchtigen. Um diese Einschränkung zu überwinden, wird in dieser Studie eine neuartige Färbetechnik eingesetzt, die eine Zellfixierung und -analyse bis zu 1 Monat nach der Fixierung ermöglicht. Diese Innovation bietet eine größere Flexibilität bei den Probenahmeplänen, so dass Forscher Proben nach Belieben verarbeiten und analysieren können, was den Arbeitsablauf und die Zuverlässigkeit der Durchflusszytometrie-Bewertungen erheblich verbessert.
Der Erfolg dieses Protokolls hängt von mehreren kritischen Schritten ab, die jeweils eine sorgfältige Ausführung erfordern, um die Integrität und Lebensfähigkeit der Leukozyten zu gewährleisten, die anschließend durch Durchflusszytometrie analysiert werden. Die korrekte Zubereitung der Euthanasielösung und die Einstellung des pH-Werts sind entscheidend für eine effektive Euthanasie. Unsachgemäß zubereitete Lösungen können zu unvollständiger Euthanasie oder zusätzlichem Stress für die Fische führen18. Eine genaue und sorgfältige Dissektion der Kopfniere ist unerlässlich, um eine Kontamination zu vermeiden. Die Aufrechterhaltung der Sterilität und Gewebeintegrität ist entscheidend, um qualitativ hochwertige Leukozytenproben zu erhalten. Die Dichte, die Osmolarität und der pH-Wert der Percoll-Lösung müssen für eine effiziente Leukozytentrennung korrekt eingestellt werden. Die schonende Aspiration des Leukozytenrings mit einer sterilen Pipette ist entscheidend, um eine Kontamination und Störung der Gradientenschichten zu vermeiden. Ein effektives Waschen der Zellen nach der Entnahme ist unerlässlich, um Percoll-Rückstände und andere Verunreinigungen zu entfernen. Die Wiederholung des Waschvorgangs sorgt für ein sauberes Zellpellet, das zur Fixierung bereit ist. Der Reaktivfarbstoff sollte unmittelbar vor der Verwendung hergestellt werden, um seine Wirksamkeit zu gewährleisten, da eine unsachgemäße Handhabung seine Stabilität beeinträchtigen kann. Die richtige Farbstoffzugabe und Inkubationszeit sind entscheidend für die genaue Unterscheidung zwischen lebenden und toten Zellen. Die Fixierung von Zellen mit 3,7 % Formaldehyd ist ein entscheidender Schritt, um die Zellmorphologie zu erhalten und eine genaue Identifizierung toter Zellen zu gewährleisten. Die Formaldehydkonzentration muss genau sein, und die Inkubationszeiten müssen strikt eingehalten werden, um ungenaue Ergebnisse zu vermeiden. Das Waschen der Zellen nach der Fixierung ist wichtig, um überschüssigen Farbstoff und Formaldehyd zu entfernen, die die nachfolgende Analyse beeinträchtigen könnten. Die ordnungsgemäße Lagerung der fixierten Proben und deren rechtzeitige Analyse sind notwendig, um die Datengenauigkeit zu gewährleisten. Die Anpassung der Anregungs- und Detektionskanäle an den verwendeten Farbstoff ist für genaue Ergebnisse der Durchflusszytometrie unerlässlich.
Trotz ihrer zahlreichen Vorteile weist diese Methode einige Einschränkungen auf, die berücksichtigt werden müssen. Eine wesentliche Einschränkung ist die artspezifische Natur, da das Protokoll für die junge Dorade (S. aurata), einen Meeresfisch, optimiert ist. Dies bedeutet, dass seine Wirksamkeit variieren kann, wenn es auf andere Fischarten, insbesondere Süßwasserfische, angewendet wird. Unterschiede im osmotischen Gleichgewicht zwischen Meeres- und Süßwasserarten können Anpassungen der im Protokoll verwendeten Puffer erforderlich machen, da die Lösungen, die für salzhaltige Bedingungen geeignet sind, möglicherweise nicht für Süßwasserarten geeignet sind. Darüber hinaus können Unterschiede in der Gewebestruktur, der Zelldichte und den physiologischen Reaktionen Anpassungen des Protokolls erfordern, was sich möglicherweise auf die Reproduzierbarkeit und Konsistenz zwischen verschiedenen Spezies auswirkt.
Ein weiterer wichtiger Faktor ist die Pflege der Fische vor der Probenentnahme. Jede Art verfügt über spezifische, optimale Wasserbedingungen, die für die Erhaltung der Fischgesundheit und die Sicherung der Qualität der Versuchsergebnisse entscheidend sind20. Schwankungen von Parametern wie Temperatur, Salzgehalt und pH-Wert können die Lebensfähigkeit der Zellen und die Datenqualität beeinträchtigen, da suboptimale Bedingungen physiologischen Stress induzieren können, der die Zellintegrität beeinträchtigt. Um konsistente experimentelle Ergebnisse zu gewährleisten, ist es wichtig, alle Replikate unter denselben kontrollierten Bedingungen zu halten, unabhängig davon, ob sie optimal oder absichtlich suboptimal sind (abhängig von den Zielen der Studie).
Die Variabilität der Handhabungs- und Dissektionstechniken kann sich ebenfalls auf die Qualität und Quantität der Leukozyten der Kopfniere auswirken, so dass die Geschicklichkeit und Erfahrung des Bedieners ein entscheidender Faktor für den Erfolg des Protokolls ist. Darüber hinaus kann die Aufrechterhaltung der Lebensfähigkeit der Zellen während des gesamten Isolierungsprozesses eine Herausforderung darstellen, da Verzögerungen zwischen Euthanasie und Zellfixierung zu einer verminderten Lebensfähigkeit und verzerrten Ergebnissen führen können. Die sofortige Verarbeitung von Geweben und Zellen ist für die Aufrechterhaltung einer hohen Zellviabilität unerlässlich, aber diese Anforderung kann schwierig zu erreichen sein, insbesondere bei der Arbeit mit einer großen Anzahl von Proben.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen, persönlichen oder beruflichen Interessenkonflikte haben, die die Forschung, Analyse, Dateninterpretation, das Schreiben oder die Entscheidung, das Manuskript zur Veröffentlichung einzureichen, beeinflusst haben könnten.
Danksagungen
Diese Arbeit wurde von der Fundação Portuguesa para a Ciência e Tecnologia (FCT I.P.) im Rahmen des Projekts Aqua-CLIMADAPT (PTDC/CTA-AMB/0592/2021, https://doi.org/10.54499/PTDC/CTA-AMB/0592/2021) unterstützt. Wir würdigen das BioLab, das von der Abteilung für angewandte molekulare Biowissenschaften (UCIBIO) und dem Associated Laboratory for Green Chemistry Research Unit – LAQV unterstützt wird, die aus nationalen Mitteln von FCT/MCTES (UIDB/04378/2020 bzw. UIDB/50006/2020) finanziert werden, sowie das Associate Laboratory Institute for Health and Bioeconomy – i4HB (LA/P/0140/2020). Diese Arbeit wurde auch von der Europäischen Kommission durch das Projekt GLYCOTwinning (Grant Agreement No. 101079417) und FCT durch InnoGlyco (2022.04607.PTDC) unterstützt. Isa Marmelo dankt auch FCT I.P. für das PhD Grant (2020.04413.BD, https://doi.org/10.54499/2020.04413.BD).
Materialien
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
Referenzen
- Samaï, H. C., et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93(2023).
- Lulijwa, R., et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A., et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498(2022).
- Titus, J., et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142(2024).
- Marmelo, I., et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135(2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955(2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change. Biol Lett. 20 (2), 20230346(2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398(2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á, Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R., et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. , American Veterinary Medical Association. Schaumburg, IL. (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). , At https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software (2023).
- Mhalhel, K., et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008(2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739(2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á, Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á, Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M. -A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten