需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在鸡胚神经诱导的含量为
摘要
神经诱导是在大脑形成的第一步。它是一种机制,使恒胜的节点(组织者),指示相邻的组织采用了神经的命运,即会引起神经系统。本视频演示了在鸡胚神经诱导实验。
摘要
鸡胚是一个有价值的工具,在早期胚胎发育的研究。其透明度,可获得性和易于操纵,使其为研究神经系统的形成和最初的图案的理想工具。本视频演示了如何移植到主机组织者组织,恒胜小号节点的方法是,(在鸡胚的组织者)被嫁接到一个主机主管外胚层。主办移植指示覆NA已经组织采取通过神经诱导信号的神经命运。这一机制被称为神经诱导,并构成了脊椎动物的大脑和脊髓的形成初始步骤。这种方法实质上是公认的在小鸡的神经诱导分子的特性。本视频演示了在神经诱导实验的不同步骤,首先,德纳胚胎explanted和寄托一道菜。然后,主机胚胎准备为新的文化。移植是切除和移植到主机领域的透明带保证金。主机是培养18-22小时。大会是固定的,为进一步应用(例如原位杂交)处理。这种方法最初设计由沃丁顿
研究方案
一,原理概述:

本视频演示了在不同的步骤检测在鸡胚神经诱导。首先,主机的胚胎是explanted在新的文化[NI1]。然后,德纳胚胎是在生理盐水和恒胜的节点(在鸡的“组织者”)explanted与荧光染料DII标记[NI2]。恒胜的节点是从德纳胚胎切除[NI3]和主机的胚胎移植到[NI4,NI5]。主机的胚胎,然后长达22小时,培养后,期间德纳组织诱导异位轴在主机领域opaca [NI6]。 [网联科技]以下文化,主机胚胎是固定的,民建联存在的光氧化处理:通过这种化学反应,德纳源性细胞,FITC荧光下出现红色光氧化[NI7前,变成褐色与民建联以下反应。原位杂交胚胎处理与神经标记[网联科技];主机派生组织已形成存在德纳移植神经组织。这个组织显示为蓝色。
1:准备新的文化的主机的胚胎
- 这一神经诱导实验协议,已培养汉堡和汉密尔顿第3阶段的鸡蛋开始 +(或HH3) 。这些鸡蛋已经奠定了他们一边在一个潮湿的孵化器孵育13小时。
- 准备新的文化(步骤3.1至5.5 9)主机胚胎。
- 主机胚胎表面覆盖200μL生理盐水。这将有利于以后的转移和定位德纳移植。
- 最后,盖一个倒置的猎鹰35毫米培养皿大会。
2:Explanting德纳胚胎在盐水
- 打开攻壳钳和删除所有周围的壳壳件,蛋。拆下外壳的顶部和丢弃。
- 删除与钳厚白蛋白,粗钳倾斜卵黄囊使胚胎朝上。
- 用细剪刀,切割围绕胚胎的卵黄囊平方米。从蛋黄用勺子取出胚胎,并在含有PBS菜的地方。
- 使用镊子,从区带分离德纳胚胎。
- 德纳胚胎转移到Sylgard盖菜含有PBS。
3:标签,切除和移植德纳移植
- 使用微电极拉马,拉50μL玻璃microcapillary移液器。在显微镜下,削减微量用细镊子的尖端。放置在培养皿中的微管内衬的plasteline剪彩。
- 准备染料溶液,将被用于标签移植前移植:carbocyanine染料DII(1,1' - 双十八烷基- 3,3,3',3' - tetramethylindocarbocyanine高氯酸盐):首先,准备在1毫升一个DII股票在0.5%的无水乙醇。这个股票可以被存储在- 20C在黑暗中。在水浴42℃,混合预热40μLDII股票360μl0.3M蔗糖。水浴温度是必要的,以防止DII和形成不溶性晶体的沉淀。简要自旋对一个小型spectrafuge的解决方案(5-10秒)。 DII的解决方案现在已经可以使用。
- 使用驱虫针,安全德纳胚胎Sylgard盖菜的底部。
- 回到填补DII微量。通过运用柔和的压力使用吸引器管组装,适用于小的DII丸恒胜的节点。确保整个恒胜的节点标记。
- 使用microcapillary吸管或microdissecting刀,切恒胜的节点(“组织者”,德纳移植)。
- 标记的腹侧和胭脂红移植后结束。这将确保移植是适当的步骤4.3背腹方向定位。
- 使用200μL吉尔森移液器,转让主机胚胎移植。
4:保护主机胚胎移植和培养
- 从主机胚胎中取出生理盐水,确保移植仍然定位在与主持人现场靠近。
- 使用microcapillary吸管或microdissecting刀,在该地区的透明带/地区opaca边界地区的一个小切口(80 -100μm的),在恒胜的节点主机胚胎水平。
- 使用一个microcapillary吸管或microdissecting刀,位置嫁接,使腹侧方对你和后部面临的是平行的主机胚胎相当于地区。
- 去除剩余的生理盐水,并处理81-22小时(步骤6.1至6.6 9)为新的文化的主机胚胎。
- 主机的胚胎,然后在4 ° C(7.1至7.7 9步骤)固定过夜。
- 通风柜下,准备一个DAB工作液:Tris缓冲液溶解民建联基板(3,3' - 二氨基tetrahydrochloride)在500μg/ml的Tris缓冲液(100MM的Tris - HCl,pH值7.4);保持在黑暗的解决方案,在冰上,。
- 胚胎洗5分钟,两次在PBS每一次在Tris缓冲液为5分钟。
- 将胚胎含有Tris缓冲液1毫升的玻璃腔幻灯片。
- 更换Tris缓冲液,用1.5毫升民建联溶液。处理的Eppendorf提示中含有10%的漂白粉溶液,以净化民建联桶。将盖玻片上腔幻灯片的顶部。
- FITC(异硫氰酸荧光素)的荧光下,专注于移植(德纳细胞会出现红色荧光)显微镜的目标,直到所有的红色荧光细胞变成褐色(这DII的结果发生,暴露FITC荧光的荧光被photoconverted不溶性的棕色晶体,曝光FITC的激发波长(488nm)在民建联存在。,这个过程需要20分钟和2小时之间。
- 氧化反应完成后,用细镊子取出盖玻片。胚胎转移到玻璃20毫升闪烁瓶中,含PBTw(或0.1%Tween - 20的PBS)。
- 从盖玻片和玻璃腔滑停用民建联在10%的漂白粉溶液孵化。
6:处理的胚胎在原位杂交技术,摄影和切片
- 继续进行原位杂交(步骤3.7至6.5 9),孵化的胚胎只辛标记探针。
- 继续拍摄(步骤8.2 9)和切片(8.3和8.4 9步骤)。
代表性的成果
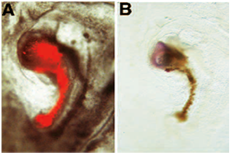
在下面的例子神经诱导实验,德纳移植诱导表达从主机派生组织的神经标记无尾。在这个特殊的例子中,我们评估收购胚胎地区一般不会有“组织者”的能力的神经诱导能力:德纳移植在其中的“组织者”的地区已经从德纳胚胎手术去除阶段的胚胎起源3 +德纳胚胎以下消融,是允许在新的文化发展,直到洞已愈合,并已形成一个结构类似恒胜的节点。这种结构与DII标记,从德纳胚胎切除,嫁接面积透明带/地区opaca主机胚胎的边界。新的文化,形成一个微型轴相邻主机胚胎:这种微型轴组成的红细胞杆(德纳派生)和一个头状结构(主机派生):在(a),德纳衍生DiI标记FITC荧光显微镜下,细胞内固定前。这些德纳源性细胞增殖,形成一个微型的脊索,出现红细胞杆。 (二)以下光转化DII,这些德纳源性细胞出现棕黄色。 [转载]从6德纳移植诱导的神经组织形成从主机,这个组织包括大脑前体,因为它们的表达显示标记原位杂交无尾以下。
注:在此过程中,我们用DiI标记的细胞,以区别于神经诱导德纳组织(红色/棕色)派生的“神经元”的组织(蓝色)的主机。而不是使用小鸡派生,DiI标记德纳移植,有些作者还使用德纳从鹌鹑胚胎,而不是小鸡的组织[如6]。这种替代的方法也可以让宿主组织,以区别于德纳。在这种情况下,移植(德纳组织)源于鹌鹑蛋代替鸡蛋。从协议中省略以下步骤4.5,主机是与特定的抗体,鹌鹑组织(QCP1)和步骤3.1到3.4和5.1至5.7整装免疫组织化学处理。这种替代过程中的一个例子如下所示:在这种情况下,我们使用相同的实验程序,在A,B,但我们用鹌鹑衍生德纳组织(表达QCPN抗体[棕色]所示):再生从鹌鹑胚胎衍生的节点,引起泛神经标记Sox2基因在宿主的表达[转载]从6:

讨论
本视频演示了不同的步骤执行检测神经诱导,这种检测基本上是公认的在小鸡的神经诱导分子的特性,因此可以使用一个广泛的应用, 范围从胚胎 micromanipulations 1-4,; 6日至揭开新的信号级联反应,7,8,所有旨在了解初步形成大脑和神经系统的其余步骤。
致谢
DP是从国家药物滥用研究所露丝Kirschstein奖1F32 DA021977 - 01A1收件人。这项工作是支持的玛格丽特M. Alkek基金会RHF。
材料
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | Fertilized, HH3+ (14 hr) |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Hybridization Incubator | Equipment | Robbins Scientific, SciGene | M1000 | Use with inverted Pyrex dish and 500 ml ddH2O beaker |
| Marsh Automatic Incubator | Equipment | Lyon | RX | |
| Pyrex dish | ||||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| DiI | Reagent | Invitrogen | D-282 | |
| Aspirator tube assembly | Tool | Sigma-Aldrich | A5177-5EA | |
| Micr–lectrode puller | Equipment | Sutter Instrument Co. | Sutter InstrumentsP-97 Flaming/Brown Micropipette | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Culture chamber | Tool | Pioneer Plastics | 030C | |
| Microcapillary tube | Tool | Sigma-Aldrich | P1049-1PAK | |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Tool | Fine Science Tools | 26002-20 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Electron Microscopy Sciences | 15710 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C | |
| Diethylpyrocarbonate (depc) | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave | |
| 16% PFA | Electron Microscopy Sciences | 15710 |
参考文献
- Waddington, C. H. Experiments on the development of chick and duck embryos, cultivated in vitro. Phil. Trans. R. Soc. Lond. B. 221, 179-230 (1932).
- Waddington, C. H. Induction by the primitive streak and its derivatives in the chick. J. Exp. Biol. 10, 38-46 (1933).
- Gallera, J. Excision et transplantation des différentes régions de la ligne primitive chez le poulet. C. R. Ass. Anat. 49, 632-639 (1964).
- Gallera, J. Primary induction in birds. Adv. Morph. 9. , 149-180 (1971).
- Serbedzija, G. N., Fraser, S. E., Bronner-Fraser, M. Pathways of neural crest cell migration in the mouse embryo as revealed by vital dye labeling. Development 108. , 605-612 (1990).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development 122. , 3263-3273 (1996).
- Joubin, K., Stern, C. D. Molecular interactions continuously define the organizer during the cell movements of gastrulation. Cell. 98, 559-571 (1999).
- Streit, A., Berliner, A. J., Papanayotou, C., Sirulnik, A., Stern, C. D. Initiation of neural induction by FGF signaling before gastrulation. Nature. , 406-474 (2000).
- Psychoyos, D., Finnell, R. Method for Culture of Early Chick Embryos ex vivo (New Culture. JoVE. 20, 10-3791 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。