このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
鶏胚における神経誘導のためのアッセイ
要約
神経誘導、脳の形成の最初のステップです。それはヘンゼンのノード(主催者)は、神経の運命を採用する隣接する組織に指示するメカニズムである、神経系を生じさせるために、すなわち。このビデオでは、ニワトリ胚における神経誘導のためのアッセイを示しています。
要約
ニワトリ胚は、初期胚発生の研究に貴重なツールです。その透明性、アクセス性と操作の容易さは、その神経系の形成と初期のパターン形成を研究するための理想的なツールとなっています。このビデオでは、ホストへの移植主催者の組織する、方法これでヘンゼンのノード(ニワトリ胚におけるオーガナイザー)がホスト有能な外胚葉にグラフトされる方法を示しています。主催者の移植は、神経誘導シグナルを介した神経運命を採用する組織をve Naの上に横たわって指示する。このメカニズムは、神経誘導と呼ばれ、羊膜の脳と脊髄の形成の初期段階を構成しています。このメソッドは本質的にニワトリの推定神経誘導の分子の特性評価に使用されます。このビデオでは、神経誘導のためのアッセイの各ステップを示し、まず、donnorの胚を外植し、皿に固定されます。その後、ホストの胚は、新しい文化のために準備されています。移植片を切除し、ホストの明域のマージンに移植される。ホストは、18〜22時間培養されています。アセンブリを固定し、さらにアプリケーション(例えば、in situハイブリダイゼーション)用に処理されます。このメソッドはもともとワディントンによって考案された
プロトコル
I.の概要図:

このビデオでは、ニワトリ胚における神経誘導するためのアッセイの各ステップを示しています。まず、ホスト胚は、新しい文化の中で外植された[NI1]。その後、donnorの胚は、生理食塩水で外植されており、ヘンゼンのノード(ひよこの"主催者")は蛍光色素DII [NI2]のラベルが付いています。ヘンゼンのノードがdonnorの胚から摘出された[NI3]とホスト胚に移植[NI4、NI5]。ホスト胚はその後donnor組織がホストの領域で異所性の軸を誘導ている期間の後に最大22時間、のために培養されopaca [NI6]。以下の文化、ホスト胚は、DABの存在下で光酸化のために固定され、処理されます:この化学反応により、光酸化する前にFITC蛍光の下に赤く写るdonnor由来の細胞は、[NI7]、DAB [NI8]と茶色の次の反応になる。胚はその後神経マーカー[NI8]とin situハイブリダイゼーションのために処理されます。宿主由来の組織はdonnorの移植片の存在下で神経組織を形成しています。この組織は、青色表示されます。
1:新しい文化のために、ホスト胚の準備
- この神経誘導アッセイのプロトコルは、ハンバーガー&ハミルトンステージ3にインキュベートされた卵から始まります+(またはHH3 +)。これらの卵は、13時間湿ったインキュベーターで彼らの側に敷設インキュベートされています。
- 新文化(ステップ3.1 5.5〜9)のホスト胚を準備します。
- 200μlの生理食塩水でホスト胚の表面を覆う。これは後で転送するとdonnorの移植片の位置決めを容易にするでしょう。
- 最後に、反転ファルコン35mmの培養皿を使用してアセンブリをカバー。
2:生理食塩水でdonnorの胚をExplanting
- ピンセットで殻をタップすると、すべてのシェルの周りに、シェルの部分を削除して、卵を開きます。シェルの上部を取り外して廃棄。
- 鉗子と厚いアルブミンを削除して、胚が上向きに向くように粗い鉗子で卵黄嚢を傾けます。
- 細かいハサミを使用して、胚の周りに卵黄嚢の正方形をカット。スプーンで卵黄から胚を取り出し、そしてPBSを含む皿の場所。
- 鉗子を使用して、明域からdonnorの胚を切り離します。
- PBSを含むSylgard覆われた皿にdonnorの胚を移す。
3:、ラベリング切除とdonnorグラフトを移植
- 微小電極プラーを使用して、50μlのガラスマイクロキャピラリーピペットを引き出します。顕微鏡下で、微細な鉗子を用いてマイクロピペットの先端をカット。 plastelineのリボンが並んでペトリ皿の場所のマイクロピペット。
- 移植前の移植片にラベルを付けるために使用される染料溶液を調製します:まず、1mlのDIIの株式を準備:色素DII(1,1' - ジオクタデシル- 3、3,3'、3' - tetramethylindocarbocyanine過塩素酸塩)をカルボシアニン0.5%無水エタノール。この株は、暗所で- 20Cで保存することができます。 42℃に設定したウォーターバス中で、ミックスは360μl0.3Mショ糖に40μlのDIIの株式を温した。水浴の温度は、DIIと不溶性結晶の形成の析出を防止するために必要です。簡単に言えばミニspectrafuge(5〜10秒間)上でソリューションをスピン。 DIIのソリューションが使用できるようになりました。
- 昆虫ピンを使用して、Sylgard覆われた皿の底にdonnorの胚を固定します。
- DIIでマイクロピペットを埋戻し。吸引管のアセンブリを使用して穏やかな圧力を適用することによって、ヘンゼンのノードにDIIの小さな塊を適用する。全体ヘンゼンのノードがラベル付けされていることを確認します。
- マイクロキャピラリーピペットまたはmicrodissectingナイフを使用して、ヘンゼンのノード("主催者"、donnorの移植)をカット。
- カルミンと移植片の腹側と後端をマーク。これは、移植片は、ステップ4.3での適切な背腹方向に配置されることを保証します。
- 200μlのギルソンのピペットを使用して、ホスト胚に移植片を移す。
4:移植片と宿主の培養の胚の保護
- 移植片は、ホストサイトに近接して配置さ残っていることを確認し、ホスト胚から生理食塩水を削除します。
- マイクロキャピラリーピペットまたはmicrodissectingナイフを使用して、ホスト胚のヘンゼンのノードのレベルでは、明域/暗域の境界領域に小さな切開(80 -100μmの)を作る。
- その腹側があなたと後端に向かって直面しているので、マイクロキャピラリーピペットまたはmicrodissectingナイフを使用して、移植片を配置し、ホスト胚に相当する地域に平行である。
- 残りの生理食塩水を削除し、81〜22時間(ステップ6.1から6.6 9)のために新しい文化のためにホストの胚を処理する。
- ホストの胚は、その後4℃(ステップ7.1から7.7 9)で一晩固定されています。
- ヒュームフードの下で、トリス緩衝液にDABワーキング溶液を調製:500μg/mlでトリス緩衝液(100mMのトリス- HCl、pH7.4)中でDAB基質(3,3' - ジアミノベンジジン四塩酸塩)を溶かし、氷の上に、暗闇の中で解決策を保つ。
- トリス緩衝液でそれぞれ一回5分で5分のためにPBSで2回胚を洗浄してください。
- 1ミリリットルTris緩衝液を含むガラスの空洞のスライドに胚を移す。
- 1.5ミリリットルDAB溶液とトリス緩衝液を交換してください。 DABを除染するために10%漂白剤溶液の入ったバケツにエッペンドルフ先端処分する。空洞のスライドの上にカバースリップを置き。
- FITC(フルオレセインイソチオシアネート)蛍光下で、移植片(donnor細胞は蛍光赤を表示されています)上で顕微鏡の目的を集中し、すべての蛍光赤色細胞が茶色(これは、DIIの結果として起こるとなっているまで、FITCの蛍光に公開photoconvertedている蛍光色素DABの存在下でFITC励起波長(488nmの)への暴露によって、不溶性の褐色結晶する。このプロセスは、約20分、2時間かかります。
- 光酸化反応の完了後、微細な鉗子を使用してカバーを取り外します。ガラスPBTwを(または0.1%のTween - 20を含むPBS)を含む20mlのシンチレーションバイアルをするために胚を移す。
- 10%漂白剤溶液中でインキュベートすることによってカバースリップとガラスの空洞のスライドからDABを非アクティブにします。
6:in situハイブリダイゼーション、写真撮影のために胚を処理し、セクショニング
- 唯一の標識プローブを掘るための胚をインキュベートし、in situハイブリダイゼーション(ステップ3.7から6.5 9)に進みます。
- 撮影(ステップ8.2 9)と(ステップ8.3および8.4 9)切片を続行します。
代表的な結果
神経誘導アッセイの次の例では、donnorの移植片は組織を派生ホストからの尾の神経マーカーの発現を誘導示されている。この特定の例では、我々は通常、"主催者"の能力を持っていない胚の領域の神経誘導能の獲得を評価した:donnorの移植片は、"主催者"領域は外科的段階でdonnorの胚から除去された胚に由来する3 +。アブレーションに続いて、donnorの胚は、穴が治癒したとヘンゼンのノードに似た構造が形成されるまで、新しい文化の発展に許可されています。この構造はその後、DIIで標識donnorの胚から切り出し、ホスト胚の明域/暗域の境界にグラフトされています。新しい文化に続いて、ミニチュアの軸は、ホスト胚に隣接して形成される:このミニチュア軸は赤血球のロッド(donnorが由来)とヘッドのような構造(ホスト派生)で構成されています:(A)において、donnor由来DIIのラベル細胞は、FITC蛍光顕微鏡下に固定前に示されています。これらdonnor由来細胞は、赤血球の棒として表示されるミニチュア脊索を形成し、増殖している。 (B)DIIの次の光変換は、これらのdonnor由来細胞は茶色に表示されます。 donnorの移植片は、ホストからの神経組織の形成を誘発している:この組織は、脳のための前駆体で構成され、のようなin situハイブリダイゼーションマーカー尾のない以下のため、その発現によって明らかにされた[6から転載]。
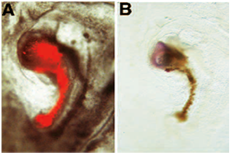
注:この手順では、我々は"神経"組織(青)由来のホストからの神経誘導donnor組織(赤/茶色)を区別するために、DII標識細胞を使用している。代わりに派生ひよこを使用する代わり、DIIはdonnorグラフトのラベルが、何人かの著者はまた、代わりにニワトリからウズラ胚に由来するdonnor組織[例6]を使用してください。この代替方法はまた、宿主組織からdonnorを区別することができます。このケースでは、移植片(donnorの組織)が代わりにニワトリの卵のウズラの卵に由来する。ステップ4.5に続いて、ホストが5.7に3.4および5.1に組織(QCP1)と手順3.1をウズラに特異抗体と全体のマウント免疫組織化学のために処理されているプロトコルから省略されます。 B、このケースでは、我々は同じ実験手順を使用し、しかし、我々はウズラ由来donnor組織を(QCPN抗体[茶色]の式で示される)を使用:この代替手順の例を以下に示す再生ウズラ胚から派生したノードは、ホストの汎神経マーカーSox2の発現を誘導している[6から再版さ]:

ディスカッション
このビデオでは、神経誘導のためのアッセイを行うことで、異なる手順を示し、このアッセイは、本質的にニワトリの推定神経誘導の分子の特性評価に使用されるため、発生学的micromanipulationsから1-4まで、幅広いアプリケーションのさまざまな、使用することができます。すべての脳と、残りの神経系の形成における初期段階の理解を目指す解明〜6の新しいシグナル...
謝辞
DPは、薬物乱用の国民の協会からルースキルシュシュタイン賞1F32 DA021977 - 01A1の受信者です。この作品は、RHFへマーガレットM. Alkek財団によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | Fertilized, HH3+ (14 hr) |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Hybridization Incubator | Equipment | Robbins Scientific, SciGene | M1000 | Use with inverted Pyrex dish and 500 ml ddH2O beaker |
| Marsh Automatic Incubator | Equipment | Lyon | RX | |
| Pyrex dish | ||||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| DiI | Reagent | Invitrogen | D-282 | |
| Aspirator tube assembly | Tool | Sigma-Aldrich | A5177-5EA | |
| Micr–lectrode puller | Equipment | Sutter Instrument Co. | Sutter InstrumentsP-97 Flaming/Brown Micropipette | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Culture chamber | Tool | Pioneer Plastics | 030C | |
| Microcapillary tube | Tool | Sigma-Aldrich | P1049-1PAK | |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Tool | Fine Science Tools | 26002-20 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Electron Microscopy Sciences | 15710 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C | |
| Diethylpyrocarbonate (depc) | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave | |
| 16% PFA | Electron Microscopy Sciences | 15710 |
参考文献
- Waddington, C. H. Experiments on the development of chick and duck embryos, cultivated in vitro. Phil. Trans. R. Soc. Lond. B. 221, 179-230 (1932).
- Waddington, C. H. Induction by the primitive streak and its derivatives in the chick. J. Exp. Biol. 10, 38-46 (1933).
- Gallera, J. Excision et transplantation des différentes régions de la ligne primitive chez le poulet. C. R. Ass. Anat. 49, 632-639 (1964).
- Gallera, J. Primary induction in birds. Adv. Morph. 9. , 149-180 (1971).
- Serbedzija, G. N., Fraser, S. E., Bronner-Fraser, M. Pathways of neural crest cell migration in the mouse embryo as revealed by vital dye labeling. Development 108. , 605-612 (1990).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development 122. , 3263-3273 (1996).
- Joubin, K., Stern, C. D. Molecular interactions continuously define the organizer during the cell movements of gastrulation. Cell. 98, 559-571 (1999).
- Streit, A., Berliner, A. J., Papanayotou, C., Sirulnik, A., Stern, C. D. Initiation of neural induction by FGF signaling before gastrulation. Nature. , 406-474 (2000).
- Psychoyos, D., Finnell, R. Method for Culture of Early Chick Embryos ex vivo (New Culture. JoVE. 20, 10-3791 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved