Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Assay für Neural Induction im Hühnerembryo
In diesem Artikel
Zusammenfassung
Neuronale Induktion ist der erste Schritt bei der Bildung des Gehirns. Es ist ein Mechanismus, durch den Hensen den Knoten (Veranstalter), weist benachbartes Gewebe ein neuronales Schicksal anzunehmen, dh zu steigen, um das Nervensystem zu geben. Dieses Video zeigt ein Test für neuronale Induktion in Hühnerembryo.
Zusammenfassung
Der Hühnerembryo ist ein wertvolles Werkzeug in der Studie der frühen Embryonalentwicklung. Seine Transparenz, Zugänglichkeit und einfache Handhabung machen ihn zu einem idealen Werkzeug für die Erforschung der Entstehung und ersten Strukturierung des Nervensystems. Dieses Video zeigt, wie Graft Veranstalter Gewebe in einen Wirt, ein Verfahren, mit dem Hensen s Knoten (der Veranstalter im Hühnerembryo) an einen Host zuständige Ektoderm aufgepfropft wird. Der Veranstalter Transplantat weist darüber liegenden na Gewebe bereits in ein neuronales Schicksal über neurale Induktion Signale anzunehmen. Dieser Mechanismus wird als neuronale Induktion bezeichnet und stellt den ersten Schritt in die Bildung von Gehirn und Rückenmark in Amnioten. Diese Methode ist wesentlich für die Charakterisierung von putativen neuralen Induktion Moleküle in chick verwendet. Dieses Video zeigt die verschiedenen Schritte in der Assay für neuronale Induktion; Erste, der donnor Embryo explantiert und merken sich auf einem Teller. Dann wird die Host-Embryo für Neue Kultur vorbereitet. Das Transplantat wird herausgeschnitten und transplantiert werden, um den Host-Bereich pellucida Marge. Der Gastgeber ist für 18-22 Stunden kultiviert. Die Montage ist fixiert und für weitere Anwendungen (zB in-situ-Hybridisierung). Diese Methode wurde ursprünglich von Waddington entwickelt
Protokoll
I. Schematische Übersicht:

Dieses Video zeigt die verschiedenen Schritte in Assay für neuronale Induktion in Hühnerembryo. Zuerst wird der Host-Embryo in New Kultur explantierten [NI1]. Dann wird die donnor Embryo ist in Kochsalzlösung und Hensen den Knoten (der "Veranstalter" in chick) explantiert wird mit einem Fluoreszenzfarbstoff DiI markierten [Ni2]. Hensen den Knoten aus der donnor Embryo herausgeschnitten [NI3] und transplantiert werden, um den Host-Embryo [NI4, Ni5]. Der Host-Embryo wird dann für bis zu 22 Stunden, kultiviert nach welchem Zeitraum die donnor Gewebe hat eine ektopische Achse in den Host-Bereich induziert opaca [Ni6]. Nach Kultur, ist der Host-Embryo fixiert und für die Photooxidation in Gegenwart von DAB: Mit dieser chemischen Reaktion, donnor abgeleiteten Zellen, die rot erscheinen unter FITC Fluoreszenz vor Photooxidation [Ni7], braun folgende Reaktion mit DAB geworden [NI8]. Der Embryo wird dann in situ Hybridisierung verarbeitet mit einem neuronalen Marker [NI8]; Host abgeleitete Gewebe Nervengewebe in die Gegenwart des donnor Transplantat gebildet. Dieses Gewebe blau erscheint.
1: Vorbereiten des Host-Embryo für Neue Kultur
- Diese neuronale Induktion Assay-Protokoll beginnt mit Eiern, die Hamburger und Hamilton Stufe 3 inkubiert wurden + (oder HH3 +). Diese Eier wurden bebrütet legte auf ihrer Seite in einem feuchten Inkubator für 13 Stunden.
- Bereiten Sie den Host-Embryo für Neue Kultur (Schritte 3.1. Bis 5,5 9).
- Bedecken Sie die Oberfläche des Host Embryo mit 200 ul Kochsalzlösung. Dies erleichtert die spätere Übertragung und die Positionierung der donnor Transplantats.
- Schließlich decken die Montage mit einer invertierten Falcon 35 mm Kulturschale.
2: Explantation der donnor Embryo in Kochsalzlösung
- Öffnen Sie das Ei, indem Sie auf die Schale mit einer Pinzette und Entfernen von Teilen der Schale, rund um die Schale. Entfernen Sie die obere von Shell und entsorgen.
- Entfernen Sie die dicken Albumin mit einer Pinzette, und kippen Sie den Dottersack mit groben Pinzette so, dass der Embryo nach oben zeigt.
- Mit einer feinen Schere, schneiden Sie ein Quadrat der Dottersack rund um den Embryo. Entfernen Sie den Embryo aus dem Eigelb mit einem Löffel, und in eine Schale mit PBS.
- Mit einer Pinzette, nehmen Sie den donnor Embryo aus dem Bereich pellucida.
- Transfer donnor Embryo zu einem Sylgard abgedeckt Schale mit PBS.
3: Labeling, Ausschneiden und Transplantation der donnor graft
- Mit einer Mikroelektrode Abzieher, ziehen 50 pl Glas Mikrokapillare Pipetten. Unter dem Mikroskop, schneiden Sie die Spitze der Mikropipette mit feinen Pinzetten. Legen Sie Mikropipette in eine Petrischale ausgekleidet mit einem Band von Plastilin.
- Bereiten Sie die Farbstofflösung, die verwendet werden, um das Transplantat vor der Transplantation Label werden: Carbocyanin Farbstoff DiI (1,1 '-Dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine Perchlorat): Zuerst bereiten einen Bestand von DiI in 1ml absolutem Ethanol bei 0,5%. Diese Aktie kann bei -20 ° C im Dunkeln gelagert werden. In einem Wasserbad bei 42 ° C eingestellt, vorgewärmte Mischung 40 ul DiI Lager zu 360μl 0,3 M Saccharose. Das Wasserbad Temperatur ist erforderlich, um Niederschläge von DiI und Bildung unlöslicher Kristalle zu verhindern. Kurz Spin die Lösung auf einer Mini-Spectrafuge (5-10 Sekunden). Die DiI-Lösung ist jetzt einsatzbereit.
- Mit Insektennadeln, sichern Sie die donnor Embryo auf der Unterseite des Sylgard bedeckten Teller.
- Back-füllen die Mikropipette mit DiI. Mit leichtem Druck mit einem Ansaugrohr Montage, wenden Sie einen kleinen Bolus DiI zu Hensen den Knoten. Achten Sie darauf, die gesamte Hensen den Knoten beschriftet ist.
- Mit einem Mikrokapillare Pipette oder einer microdissecting Messer, schnitt Hensen den Knoten ("Veranstalter", donnor graft).
- Mark der Bauchseite und hinteren Ende des Transplantats mit Carmin. Dadurch wird sichergestellt, dass das Transplantat mit der richtigen dorso-ventrale Orientierung in Schritt 4.3 positioniert ist.
- Mit einem 200 ul Gilson Pipette das Transplantat an den Host-Embryo.
4: Sicherung des Transplantats und die Kultivierung der Host-Embryo
- Entfernen Kochsalzlösung vom Host Embryo, so dass Sie sicher, dass das Transplantat positioniert bleibt in der Nähe mit dem Gastgeber vor Ort.
- Mit einem Mikrokapillare Pipette oder einer microdissecting Messer einen kleinen Einschnitt (80-100 um) im Bereich pellucida / Bereich opaca Grenzbereich, auf der Ebene der Hensen den Knoten von Host-Embryo.
- Mit einem Mikrokapillare Pipette oder einer microdissecting Messer, Position der Prothese, so dass Bauchseite zugewandt Ihnen und dem hinteren Ende ist parallel zur entsprechenden Region in Host-Embryo.
- Entfernen Sie verbleibende Salzlösung, und verarbeiten die Host-Embryo für New Kultur für 81-22 h (Schritte von 6,1 bis 6,6 9).
- Der Host-Embryo wird dann über Nacht bei 4 ° C (Schritte von 7,1 bis 7,7 9) fixiert.
- Unter Abzug, bereiten Sie einen DAB funktionierende Lösung in Tris-Puffer: Lösen DAB Substrat (3,3 '-Diaminobenzidintetrahydrochlorid) in Tris-Puffer (100 mM Tris-HCl, pH 7,4) bei 500μg/ml; halten Lösung in dunklen, auf Eis.
- Waschen Sie den Embryo zweimal in PBS für 5 Minuten jeder und einmal in Tris-Puffer für 5 Minuten.
- Übertragung des Embryos zu einem Glas Hohlraum Folie mit 1 ml Tris-Puffer.
- Ersetzen Sie die Tris-Puffer-Lösung mit 1,5 ml DAB-Lösung. Entsorgen Eppendorfspitze in Eimer mit einer 10% igen Bleichlösung um DAB zu dekontaminieren. Legen Sie ein Deckglas auf der Hohlraum schieben.
- Unter FITC (Fluoresceinisothiocyanat) Fluoreszenz, Schwerpunkt das Ziel des Mikroskops auf dem Transplantat (donnor Zellen fluoreszierend rot erscheinen) und aussetzen FITC Fluoreszenz, bis alle rot-fluoreszierenden Zellen geworden sind braun (in diesem Fall als Ergebnis der DiI Fluorochrom wird photokonvertiertem zu unlöslichen braunen Kristallen, durch Bestrahlung mit FITC Anregungswellenlänge (488 nm) in Gegenwart von DAB. Dieser Vorgang dauert zwischen 20 Minuten und 2 Stunden.
- Nach Abschluss der Photooxidation Reaktion, entfernen Sie das Deckglas mit feinen Pinzetten. Transfer-Embryo zu Glas eine 20 ml Szintillations Fläschchen mit PBTw (oder PBS mit 0,1% Tween-20).
- Deaktivieren DAB von Deckglas und Glas Hohlraum slide durch Inkubation in 10% Bleichmittel-Lösung.
6: Prozess der Embryo in-situ-Hybridisierung, Fotografie und Schneiden
- Fahren Sie mit in-situ-Hybridisierung (Schritte von 3,7 bis 6,5 9), Inkubation der Embryonen nur für DIG markierten Sonde.
- Fahren Sie mit dem Fotografieren (Schritt 8.2 9) und Schneiden (Schritte 8.3 und 8.4 9).
Repräsentative Ergebnisse
Im folgenden Beispiel der neuralen Induktion Assay wird die donnor Transplantat gezeigt induzieren die Expression des neuronalen Marker Schwanzlosigkeit vom Host abgeleitete Gewebe. In diesem Beispiel untersuchten wir die Akquisition von neuralen Induktion Fähigkeit embryonaler Regionen, die normalerweise nicht über "Veranstalter" Fähigkeiten: die donnor Transplantat stammt aus einem Embryo, in denen die "Veranstalter" Region operativ aus dem donnor Embryo im Stadium entfernt 3 +. Nach Ablation ist die donnor Embryo darf in New Kultur zu entwickeln, bis das Loch verheilt ist und eine Struktur ähnlich Hensen den Knoten gebildet hat. Diese Struktur wird dann mit DiI markiert, ausgeschnitten aus der donnor Embryo und gepfropft Bereich pellucida / Bereich opaca Grenze eines Host-Embryo. Nach New Kultur, ist ein Miniatur-Achse angrenzend an den Host-Embryo: das Miniatur-Achse besteht aus einem Stab von roten Blutkörperchen (donnor abgeleitet) und einem Kopf-artige Struktur (Host abgeleitet): In (A), donnor-derived DiI markierten Zellen vor der Fixierung unter FITC Fluoreszenz-Mikroskopie gezeigt. Diese donnor-abgeleiteten Zellen haben vermehrt auf eine Miniatur Chorda, die als Stab der roten Blutkörperchen scheint zu bilden. (B) Nach Photokonversion DiI erscheinen diese donnor-abgeleiteten Zellen braun. Die donnor Transplantat hat die Bildung von Nervengewebe aus dem Host-induzierte: dieses Gewebe besteht aus Vorstufen für Gehirn, wie sie ihren Ausdruck für den Marker Schwanzlosigkeit folgenden in situ Hybridisierung zeigte [ab 6 abgedruckt].
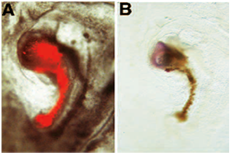
Hinweis: In diesem Verfahren haben wir DiI markierten Zellen verwendet werden, um neuronale Induktion donnor Gewebe (rot / braun) von Host-derived "neuronalen" Gewebe (blau) unterscheiden. Anstelle der Verwendung eines chick abgeleitet, DiI markierten donnor Transplantat, einige Autoren auch donnor Gewebe von Embryonen Wachtel statt chick abgeleitet [zB 6]. Diese alternative Methode ermöglicht es auch, um donnor aus Wirtsgewebe zu unterscheiden. In diesem Fall stammt das Transplantat (donnor Gewebe) aus Wachteleier statt Hühnereiern. Nach dem Schritt 4.5, der Host für ganze Berg Immunhistochemie mit einem Antikörper spezifisch für Gewebe (QCP1) und Schritte von 3,1 bis 3,4 und von 5,1 bis 5,7 Wachteln verarbeitet werden vom Protokoll weggelassen. Ein Beispiel für diese alternative Vorgehensweise ist wie folgt dar: In diesem Fall haben wir die gleichen Versuchsanordnung wie in A, B, aber wir werden Wachtel-derived donnor Gewebe (wie durch die Expression von QCPN Antikörper [braun] dargestellt): Das regenerierte Knoten aus Wachtel Embryo abgeleitet hat der Ausdruck pan-neuronalen Marker Sox2 in den Host-induzierte [nachgedruckt von 6]:

Diskussion
Dieses Video zeigt die verschiedenen Schritte bei der Durchführung eines Assays für neuronale Induktion; Dieser Test ist im Wesentlichen für die Charakterisierung von putativen neuralen Induktion Moleküle in chick verwendet, und kann somit für eine Vielzahl von Anwendungen, angefangen von embryonalen Mikromanipulationen 1-4 verwendet werden; 6 bis entwirren neue Signalkaskaden 7,8, alle mit dem Ziel, das Verständnis der erste Schritt bei der Bildung des Gehirns und des restlichen N...
Danksagungen
DP ist Empfänger von Ruth Kirschstein-Award 1F32 DA021977-01A1 aus dem National Institute on Drug Abuse. Diese Arbeit wurde von der Margaret M. Alkek Stiftung RHF unterstützt.
Materialien
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | Fertilized, HH3+ (14 hr) |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Hybridization Incubator | Equipment | Robbins Scientific, SciGene | M1000 | Use with inverted Pyrex dish and 500 ml ddH2O beaker |
| Marsh Automatic Incubator | Equipment | Lyon | RX | |
| Pyrex dish | ||||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| DiI | Reagent | Invitrogen | D-282 | |
| Aspirator tube assembly | Tool | Sigma-Aldrich | A5177-5EA | |
| Micr–lectrode puller | Equipment | Sutter Instrument Co. | Sutter InstrumentsP-97 Flaming/Brown Micropipette | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Culture chamber | Tool | Pioneer Plastics | 030C | |
| Microcapillary tube | Tool | Sigma-Aldrich | P1049-1PAK | |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Tool | Fine Science Tools | 26002-20 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Electron Microscopy Sciences | 15710 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C | |
| Diethylpyrocarbonate (depc) | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave | |
| 16% PFA | Electron Microscopy Sciences | 15710 |
Referenzen
- Waddington, C. H. Experiments on the development of chick and duck embryos, cultivated in vitro. Phil. Trans. R. Soc. Lond. B. 221, 179-230 (1932).
- Waddington, C. H. Induction by the primitive streak and its derivatives in the chick. J. Exp. Biol. 10, 38-46 (1933).
- Gallera, J. Excision et transplantation des différentes régions de la ligne primitive chez le poulet. C. R. Ass. Anat. 49, 632-639 (1964).
- Gallera, J. Primary induction in birds. Adv. Morph. 9. , 149-180 (1971).
- Serbedzija, G. N., Fraser, S. E., Bronner-Fraser, M. Pathways of neural crest cell migration in the mouse embryo as revealed by vital dye labeling. Development 108. , 605-612 (1990).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development 122. , 3263-3273 (1996).
- Joubin, K., Stern, C. D. Molecular interactions continuously define the organizer during the cell movements of gastrulation. Cell. 98, 559-571 (1999).
- Streit, A., Berliner, A. J., Papanayotou, C., Sirulnik, A., Stern, C. D. Initiation of neural induction by FGF signaling before gastrulation. Nature. , 406-474 (2000).
- Psychoyos, D., Finnell, R. Method for Culture of Early Chick Embryos ex vivo (New Culture. JoVE. 20, 10-3791 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten