Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensayo de inducción neural en el embrión de pollo
En este artículo
Resumen
Inducción neural es el primer paso en la formación del cerebro. Se trata de un mecanismo por el cual el nodo de Hensen (organizador), instruye a los tejidos adyacentes a la adopción de un destino neuronal, es decir, para dar lugar al sistema nervioso. Este video muestra un ensayo de inducción neural en el embrión de pollo.
Resumen
El embrión de pollo es una herramienta valiosa en el estudio del desarrollo embrionario temprano. Su transparencia, accesibilidad y facilidad de manipulación, lo convierten en una herramienta ideal para el estudio de la formación inicial y los patrones del sistema nervioso. Este video muestra la forma de tejido organizador del injerto en un huésped, un método por el cual nódulo de Hensen s (el organizador en el embrión de pollo) se injerta a un ectodermo competente de acogida. El injerto organizador instruye cubre na he tejido para adoptar un destino neuronal a través de señales de inducción neural. Este mecanismo se conoce como inducción neural, y constituye el paso inicial en la formación del cerebro y la médula espinal en amniotas. Este método se utiliza esencialmente para la caracterización de las moléculas de supuesta inducción neural en el pollo. Este video muestra los diferentes pasos en el ensayo de inducción neural; En primer lugar, el embrión es donnor explantados y puestas en un plato. Luego, el embrión de acogida se prepara para la nueva cultura. El injerto se extirpa y se trasplanta a la zona pelúcida margen de acogida. El anfitrión se cultiva durante 18-22 horas. El conjunto se fija y se procesaron para otras aplicaciones (por ejemplo, hibridación in situ). Este método fue concebido originalmente por Waddington
Protocolo
I. Esquema general:

Este video muestra las diferentes etapas de ensayo para la inducción neural en el embrión de pollo. En primer lugar, el embrión de acogida es explantados en la cultura de Nuevo [NI1]. Luego, el embrión es donnor explantados en solución salina y el nodo de Hensen (el "organizador" de pollo) está marcada con fluorescente DII colorante [NI2]. Nodo de Hensen se extirpa el embrión a partir de donnor [NI3] y se trasplantan en el embrión de acogida [NI4, NI5]. El embrión de acogida luego se cultiva durante un máximo de 22 horas, después de los cuales el tejido donnor ha inducido a un eje ectópico en la zona de acogida opaca [NI6]. A raíz de la cultura, el embrión de acogida se fija y se procesaron para fotooxidación en presencia de DAB: En esta reacción química, las células donnor derivados, que aparecen de color rojo con fluorescencia FITC antes de la fotooxidación [NI7], se convierten en reacción marrón siguiente con DAB [NI8]. El embrión es luego procesada por hibridación in situ con un marcador neural [NI8]; tejido del huésped derivados se ha formado el tejido nervioso en presencia del injerto donnor. Este tejido se ve azul.
1: Preparar el embrión de acogida para la cultura de Nueva
- Este protocolo de inducción neural ensayo comienza con los huevos que se incuban en Hamburger y Hamilton etapa 3 + (o HH3 +). Estos huevos han sido incubados establecidas a su favor en una incubadora húmeda durante 13 horas.
- Preparar el embrión de acogida para la cultura de Nueva (medidas 3.1. A 5.5 9).
- Cubra la superficie del embrión anfitrión con 200 l de solución salina. Esto facilitará la posterior traslado y colocación del injerto donnor.
- Por último, cubrir el conjunto con un invertido Falcon 35 mm placa de cultivo.
2: explantar el embrión donnor en solución salina
- Abrir el huevo tocando en la cubierta con unas pinzas y la eliminación de piezas de la cáscara, de todo el shell. Retire la parte superior de la concha y el descarte.
- Eliminar la albúmina de espesor con pinzas, y la inclinación del saco vitelino con pinzas gruesas para que el embrión hacia arriba.
- Con la tijera fina, cortar un cuadrado de alrededor del saco vitelino del embrión. Extraer el embrión de la yema de huevo con una cuchara, y colocar en un recipiente lleno de PBS.
- Con unas pinzas, separar el embrión de la zona pelúcida donnor.
- La transferencia de embriones donnor a un plato cubierto Sylgard contiene PBS.
3: El etiquetado, la escisión y el trasplante del injerto donnor
- El uso de un extractor de microelectrodos, tire 50 pipetas de vidrio microcapilar l. Bajo el microscopio, cortar la punta de la micropipeta con unas pinzas finas. Micropipeta lugar en una placa de Petri llenas de una cinta de plasteline.
- Prepare la solución de colorante que se utiliza para etiquetar el injerto antes del trasplante: carbocyanine tinte DII (1,1 '-dioctadecil-3, 3,3', 3'-tetramethylindocarbocyanine perclorato): En primer lugar, preparar un inventario de DII en 1 ml etanol absoluto en un 0,5%. Este archivo puede ser almacenado a-20C en la oscuridad. En un baño de agua a 42 ° C, mezclar 40 ml precalentado acciones DII a 360μl 0,3 M de sacarosa. La temperatura del agua es necesaria para prevenir la precipitación de DII y la formación de cristales insolubles. En pocas palabras girar la solución en un spectrafuge mini (5-10 segundos). La solución DII ya está listo para su uso.
- El uso de clavos de insectos, seguro que el embrión donnor en la parte inferior del plato Sylgard cubiertos.
- Volver a llenar la micropipeta con DII. Aplicando una presión suave con un conjunto de tubo aspirador, aplicar un pequeño bolo de DII en el nodo de Hensen. Asegúrese de que todo el nodo de Hensen está etiquetado.
- Con una pipeta microcapilar o un cuchillo microdissecting, corte nodo de Hensen ("organizador", injerto donnor).
- Marque la parte ventral y el extremo posterior del injerto con carmín. Esto asegurará que el injerto se coloca con una adecuada orientación dorso-ventral en el paso 4.3.
- Usando una pipeta Gilson 200μl, la transferencia del injerto al embrión de acogida.
4: Asegurar el injerto y el cultivo de los embriones de acogida
- Quitar salina de embrión de acogida, asegurándose de que el injerto se mantiene posicionado en las proximidades de un sitio de acogida.
- Con una pipeta microcapilar o un cuchillo microdissecting, hacer una pequeña incisión (80-100μm) en la zona pelúcida / área región de la frontera opaca, a nivel del nodo de Hensen del embrión huésped.
- Con una pipeta microcapilar o posición de la cuchilla microdissecting, el injerto de modo que la parte ventral está orientada hacia usted y el extremo posterior es paralela a la región equivalente en el embrión de acogida.
- Quitar salina restantes, y el proceso de acogida para el embrión nueva cultura de 81-22 h (6,1 a 6,6 pasos 9).
- El embrión de acogida se fija la noche a 4 ° C (7,1 a 7,7 pasos 9).
- Bajo campana extractora de humos, preparar una solución de trabajo DAB en tampón Tris: Disolver sustrato DAB (3,3 '-diaminobenzidina tetrahidrocloruro) en tampón Tris (100 mM Tris-HCl, pH 7,4) en 500μg/ml; mantener la solución en la oscuridad, en el hielo.
- Lavar el embrión dos veces en PBS durante 5 minutos cada uno y una vez en tampón Tris de 5 minutos.
- Transferencia del embrión a la cavidad de una diapositiva de vidrio que contiene 1 ml de tampón Tris.
- Vuelva a colocar la solución tampón Tris con 1,5 ml de solución de DAB. Disponer de Eppendorf punta en un cubo que contiene una solución de lejía al 10% con el fin de descontaminar el DAB. Coloque un cubreobjetos en la parte superior de la cavidad de diapositivas.
- Bajo FITC (isotiocianato de fluoresceína) de fluorescencia, el enfoque del objetivo del microscopio en el injerto (células donnor aparecerá de color rojo fluorescente) y exponer a la fluorescencia FITC hasta que todas las células teñidas de rojo fluorescente se han convertido en marrón (esto ocurre como resultado de la DII fluorocromo se photoconverted insoluble para cristales de color marrón, por la exposición a la longitud de onda de excitación FITC (488 nm) en presencia de DAB. Este proceso tarda entre 20 minutos y 2 horas.
- Tras la finalización de la reacción de fotooxidación, quitar el cubreobjetos con unas pinzas finas. La transferencia del embrión a un vial de centelleo de vidrio de 20 ml que contiene PBTw (o PBS con 0,1% de Tween-20).
- Desactivar DAB de cubreobjetos y portaobjetos de vidrio mediante la incubación de la cavidad en la solución de lejía al 10%.
6: Proceso de embrión de hibridación in situ con la fotografía, y la sección
- Proceder a la hibridación in situ (3,7 a 6,5 pasos 9), la incubación del embrión sólo DIG sonda marcada.
- Proceder con fotografía (paso 8.2 9) y la sección (medidas 8.3 y 9 8.4).
Resultados representante
En el siguiente ejemplo de ensayo de inducción neural, el injerto se muestra donnor inducir la expresión del marcador neuronal sin cola a partir de tejido del huésped derivados. En este ejemplo particular, se evaluó la adquisición de la capacidad de inducir neural de las regiones de embriones que normalmente no tienen "organizador" habilidades: el injerto donnor se origina a partir de un embrión en el que ha sido el "organizador" región de la extirpación quirúrgica del embrión en la etapa de donnor 3 +. Después de la ablación, el embrión donnor se le permite desarrollarse en la cultura nueva, hasta que el agujero se ha curado y una estructura parecida a nodo de Hensen se ha formado. Esta estructura se denominan entonces con DII, eliminado del embrión donnor y se injerta a la zona pelúcida / zona de la frontera opaca de un embrión de acogida. A raíz de la nueva cultura, un eje en miniatura se forma adyacente a la sede de embriones: este eje en miniatura consiste en una varilla de glóbulos rojos (donnor derivados) y una estructura similar a la cabeza (host derivados): En (A), donnor derivados DII etiquetado las células se muestran antes de la fijación bajo microscopía de fluorescencia FITC. Estas células donnor derivados se han multiplicado para formar una miniatura notocorda, que aparece como barra de glóbulos rojos. (B) fotoconversión Después de DII, estas células donnor derivados de un color marrón. El injerto donnor ha inducido la formación de tejido nervioso desde el host: este tejido se compone de los precursores para el cerebro, según lo revelado por su expresión para los siguientes marcadores sin cola de hibridación in situ [reproducido a partir de 6].
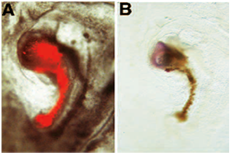
Nota: En este procedimiento, se han utilizado células DII etiquetados con el fin de diferenciar los tejidos induciendo neural donnor (rojo / marrón) del host derivados "neural" del tejido (azul). En lugar de utilizar una chica derivados, injerto DII etiquetados donnor, algunos autores también utilizan tejidos donnor derivadas de embriones de codorniz en vez de pollo [por ejemplo, 6]. Este método alternativo también permite diferenciar donnor de tejido del huésped. En este caso, el injerto (tejido donnor) se origina a partir de huevos de codorniz en vez de huevos de gallina. Siguiendo el paso 4.5, el anfitrión es procesadas para inmunohistoquímica montar todo con un anticuerpo específico para el tejido de codorniz (QCP1) y los pasos 3,1 a 3,4 y 5,1 a 5,7 se omiten en el protocolo. Un ejemplo de este procedimiento alternativo es el siguiente: En este caso, se utilizó el mismo procedimiento experimental como en A, B, pero usamos la codorniz tejido derivado donnor (como se muestra en la expresión de anticuerpos QCPN [negro]): La regeneración nodo derivadas de embriones de codorniz ha inducido la expresión de la pan-neuronal marcador Sox2 en el host [reproducido a partir de 6]:

Discusión
Este video muestra los diferentes pasos en la realización de un ensayo para la inducción neural; Este ensayo se utiliza esencialmente para la caracterización de las moléculas de supuesta inducción neural en el pollo, y por lo tanto puede ser utilizado para una amplia variedad de aplicaciones, que van desde micromanipulaciones embriológico 1-4; 6 para desentrañar nuevas cascadas de señalización 7,8, todos con el objetivo de la comprensión de la etapa inicial en la formación del cerebro y ...
Agradecimientos
DP es receptor de Ruth Premio Kirschstein DA021977 1F32-01A1 del Instituto Nacional sobre Abuso de Drogas. Este trabajo fue apoyado por la Fundación Margaret M. Alkek a RHF.
Materiales
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | Fertilized, HH3+ (14 hr) |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Hybridization Incubator | Equipment | Robbins Scientific, SciGene | M1000 | Use with inverted Pyrex dish and 500 ml ddH2O beaker |
| Marsh Automatic Incubator | Equipment | Lyon | RX | |
| Pyrex dish | ||||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| DiI | Reagent | Invitrogen | D-282 | |
| Aspirator tube assembly | Tool | Sigma-Aldrich | A5177-5EA | |
| Micr–lectrode puller | Equipment | Sutter Instrument Co. | Sutter InstrumentsP-97 Flaming/Brown Micropipette | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Culture chamber | Tool | Pioneer Plastics | 030C | |
| Microcapillary tube | Tool | Sigma-Aldrich | P1049-1PAK | |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Tool | Fine Science Tools | 26002-20 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Electron Microscopy Sciences | 15710 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C | |
| Diethylpyrocarbonate (depc) | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave | |
| 16% PFA | Electron Microscopy Sciences | 15710 |
Referencias
- Waddington, C. H. Experiments on the development of chick and duck embryos, cultivated in vitro. Phil. Trans. R. Soc. Lond. B. 221, 179-230 (1932).
- Waddington, C. H. Induction by the primitive streak and its derivatives in the chick. J. Exp. Biol. 10, 38-46 (1933).
- Gallera, J. Excision et transplantation des différentes régions de la ligne primitive chez le poulet. C. R. Ass. Anat. 49, 632-639 (1964).
- Gallera, J. Primary induction in birds. Adv. Morph. 9. , 149-180 (1971).
- Serbedzija, G. N., Fraser, S. E., Bronner-Fraser, M. Pathways of neural crest cell migration in the mouse embryo as revealed by vital dye labeling. Development 108. , 605-612 (1990).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development 122. , 3263-3273 (1996).
- Joubin, K., Stern, C. D. Molecular interactions continuously define the organizer during the cell movements of gastrulation. Cell. 98, 559-571 (1999).
- Streit, A., Berliner, A. J., Papanayotou, C., Sirulnik, A., Stern, C. D. Initiation of neural induction by FGF signaling before gastrulation. Nature. , 406-474 (2000).
- Psychoyos, D., Finnell, R. Method for Culture of Early Chick Embryos ex vivo (New Culture. JoVE. 20, 10-3791 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados