A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Assay עבור אינדוקציה עצבית בעובר צ'יק
In This Article
Summary
אינדוקציה עצבית היא הצעד הראשון ביצירת המוח. זהו המנגנון שבאמצעותו הצומת של Hensen (מארגן), מורה רקמות סמוכות לאמץ גורל עצביים, כלומר להצמיח מערכת העצבים. וידאו זה מדגים assay לזירוז העצבית בעובר האפרוח.
Abstract
עובר אפרוח הוא כלי רב ערך במחקר ההתפתחות העוברית המוקדמת. שקיפות, שלה נגישות וקלות מניפולציה, ולהפוך אותו כלי אידיאלי לחקר היווצרות דפוסים הראשונית של מערכת העצבים. סרט הווידאו הזה מדגים כיצד רקמה מארגן השתל לתוך לארח, שיטה שבאמצעותה הצומת s Hensen (מארגן בעובר האפרוח) היא מורכבים כדי האאקטודרם מארח המוסמכות. שתל מארגן מורה שמעל na יש רקמת לאמץ גורל אותות עצביים באמצעות גרימת עצביים. מנגנון זה נקרא אינדוקציה עצביים, ומהווה את השלב הראשוני להיווצרות של המוח וחוט השדרה ב אמניוטים. שיטה זו משמשת בעיקר לאפיון המשוערת של מולקולות גרימת עצבית חומוס. סרט הווידאו הזה מדגים את השלבים השונים assay לזירוז עצביים; ראשית, העובר donnor הוא explanted והצמיד על צלחת. ואז, העובר מארח מוכן תרבות חדשה. השתל הוא נכרת ו להשתיל את השוליים באזור המארח pellucida. המארח הוא תרבותי עבור 18-22 שעות. הרכבה הוא קבוע מעובד עבור יישומים נוספים (למשל הכלאה באתרו). שיטה זו פותחה במקור על ידי וודינגטון
Protocol
I. סקירה סכמטית:

סרט הווידאו הזה מדגים את השלבים השונים assay לזירוז העצבית בעובר האפרוח. ראשית, העובר המארח explanted בתרבות חדשות [NI1]. לאחר מכן, הוא עובר donnor explanted ב מליחים הצומת של Hensen (להלן: "המארגן" של חומוס) מסומן עם פלורסנט DiI לצבוע [NI2]. הצומת של Hensen הוא נכרת מן העובר donnor [NI3] ו המושתלים לעובר לארח [NI4, NI5]. העובר המארח הוא תרבותי אז עד 22 שעות, לאחר תקופת רקמות donnor יש המושרה ציר חוץ רחמי באזור המארח opaca [NI6]. בעקבות התרבות, העובר מארח קבוע ומעובד photooxidation בנוכחות DAB: לפי התגובה הכימית, תאים donnor הנגזרים, אשר מופיעים תחת אדום פלואורסצנטי FITC לפני photooxidation [NI7], להיות עם חום התגובה הבאה DAB [NI8]. העובר מעובד ואז ב הכלאה באתרו בטוש עצביים [NI8]; רקמות מארח נגזר יצרה רקמה עצבית בנוכחות השתל donnor. רקמה זו מופיעה כחול.
1: הכנת העובר מארח לתרבות חדש
- זה פרוטוקול עצביים assay אינדוקציה מתחיל עם ביצים, כי כבר מודגרות כדי המבורגר & שלב המילטון 3 + (או HH3 +). ביצים אלה היו מודגרות הניח בצד שלהם בתוך חממה ולח במשך 13 שעות.
- הכן את העובר מארח לתרבות החדשה (3.1 צעדים. ל 5.5 9).
- מכסים את פני השטח של העובר לארח עם מלח 200 μl. זה יקל על העברת מאוחר יותר והמיקום של השתל donnor.
- לבסוף, לכסות את הרכבה עם צלחת הפוכה פלקון 35 מ"מ תרבות.
2: Explanting העובר donnor ב מלוחים
- פתח את הביצה על ידי הקשה על הקליפה עם מלקחיים והסרת חתיכות של הקליפה, סביב הקליפה. הסרת החלק העליון של הקליפה וזורקים.
- הסר את אלבומין עבה עם מלקחיים, ו להטות את שק החלמון עם מלקחיים גס כל כך עובר את פניהם כלפי מעלה.
- בעזרת מספריים בסדר, לחתוך ריבוע של שק חלמון סביב העובר. מוציאים את העובר מן החלמון עם כפית, ומניחים צלחת ובה PBS.
- בעזרת מלקחיים, לנתק את העובר donnor מאזור pellucida.
- העברת donnor עובר לצלחת מכוסה Sylgard המכיל PBS.
3: תיוג, גוזמות ואת השתלת שתל donnor
- בעזרת חולץ microelectrode, למשוך 50 pipettes זכוכית μl microcapillary. מתחת למיקרוסקופ, לחתוך את קצה micropipette באמצעות מלקחיים בסדר. Micropipette מקום בצלחת פטרי מרופדת עם סרט של הפלסטלינה.
- הכן את פתרון צבע אשר ישמש את התווית לפני השתלת שתל: carbocyanine לצבוע DiI (1,1 '-dioctadecyl-3, 3,3 ", 3'-tetramethylindocarbocyanine פרכלורט): ראשית, להכין מלאי של DiI ב 1ml אתנול מוחלט על 0.5%. מלאי זה יכול להיות מאוחסן על 20C-בחושך. באמבט מים נקבע על 42 ° C, prewarmed לערבב 40 μl מניות DiI כדי סוכרוז 0.3M 360μl. טמפרטורת המים באמבטיה הוא הכרחי על מנת למנוע משקעים של DiI היווצרות של גבישים לא מסיסים. בקצרה ספין פתרון spectrafuge מיני (שניות 50-10). הפתרון DiI עכשיו הוא מוכן לשימוש.
- באמצעות סיכות חרקים, לאבטח את העובר donnor בתחתית צלחת מכוסה Sylgard.
- גב למלא את micropipette עם DiI. על ידי הפעלת לחץ עדין באמצעות הרכבה צינור aspirator, להחיל בולוס קטן DiI לצומת של Hensen. ודא את הצומת כולו של Hensen מסומן.
- בעזרת פיפטה microcapillary או סכין microdissecting, לחתוך הצומת של Hensen ("מארגן", שתל donnor).
- סמן את הצד הגחוני ולסיים האחורי של השתל עם ארגמן. פעולה זו תבטיח כי השתל ממוקם עם אוריינטציה dorso-הגחון ראוי בשלב 4.3.
- שימוש 200μl Gilson פיפטה, העברת שתל לעובר המארח.
4: אבטחת שוחד culturing העובר מארח
- הסר מלוחים מעובר המארח, מוודא שתל נשאר מיקומו בסמיכות עם האתר המארח.
- בעזרת פיפטה microcapillary או סכין microdissecting, לעשות חתך קטן (80-100μm) באזור pellucida / אזור אזור opaca הגבול, ברמה של הצומת של Hensen של העובר המארח.
- בעזרת פיפטה microcapillary או microdissecting, מיקום הסכין, כך שתל בצד הגחון פנים כלפיכם, ואת הקצה האחורי מקביל לאזור המקבילה העובר המארח.
- הסר מלוחים הנותרים, והתהליך העובר מארח לתרבות חדשה עבור שעות 81-22 (6.1-6.6 צעדים 9).
- העובר מארח קבוע אז לילה ב 4 ° C (7.1-7.7 צעדים 9).
- מתחת למכסה המנוע קטר, להכין פתרון DAB עובד טריס חיץ: ממיסים מצע DAB (3,3 '-diaminobenzidine tetrahydrochloride) ב טריס חיץ (100mm טריס-HCl, pH 7.4) בשעה 500μg/ml; לשמור על פתרון בחושך, על הקרח.
- לשטוף את העובר פעמיים PBS עבור 5 mn כל פעם טריס חיץ במשך 5 mn.
- העברת העובר לשקופית זכוכית חלל המכיל 1 חיץ מ"ל טריס.
- החלף את הפתרון למאגר טריס עם פתרון DAB 1.5 מ"ל. השלך Eppendorf קצה בדלי המכיל פתרון אקונומיקה 10% על מנת לטהר DAB. מניחים coverslip על גבי השקופית חלל.
- תחת פלואורסצנטי (isothiocyanate והעמסת) FITC, למקד את המטרה של המיקרוסקופ על השתל (תאים donnor יופיעו אדום ניאון) ולחשוף את הקרינה FITC עד שכל התאים האדומים פלורסנט הפכו חום (זה קורה כתוצאה של DiI fluorochrome להיות photoconverted כדי גבישים חומים מסיסים, על ידי חשיפה גל עירור FITC (488nm) בנוכחות DAB. תהליך זה לוקח בין 20 mn ו 2 שעות.
- לאחר השלמת התגובה photooxidation, להסיר את coverslip באמצעות מלקחיים בסדר. העברת העובר על זכוכית בקבוקון המכיל 20 מ"ל scintillation PBTw (או PBS עם 0.1% Tween-20).
- בטל DAB מ coverslip והחלק זכוכית חלל על ידי דוגרים בפתרון אקונומיקה 10%.
6: תהליך העובר על בצילום באתרו הכלאה, וכן חתך
- המשך ב הכלאה באתרו (3.7-6.5 צעדים 9), דוגרים העובר רק DIG בדיקה שכותרתו.
- המשך לצלם (שלב 8.2 9) חתך (צעדים 8.3 ו 8.4 9).
נציג תוצאות
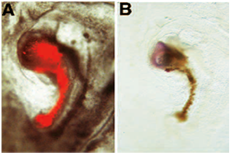
בדוגמה הבאה של assay השראה עצבית, השתל donnor מוצג להשרות את הביטוי של חסרי זנב את הסמן מן הרקמה העצבית מארח נגזר. בדוגמה זו בפרט, אנו העריכו את רכישת יכולת גרימת העצבית של אזורים עובריים אשר בדרך כלל אין את היכולות "מארגן": השתל donnor שמקורו בעובר שבו האזור "מארגן" הוסר בניתוח בשלב מן העובר donnor 3 +. בעקבות אבלציה, העובר donnor מותר לפתח תרבות חדשה, עד החור הגליד ואת מבנה הדומה הצומת של Hensen יצרה. מבנה זה מסומן אז עם DiI, נכרת מן העובר donnor ו מורכבים לגבול pellucida / אזור אזור opaca של העובר שורה. בעקבות התרבות החדשה, ציר מיניאטורי נוצר העובר בסמוך המארח: זה ציר מיניאטורי כולל מוט של תאים אדומים (donnor נגזר) ומבנה הראש כמו (המארח נגזר): ב (א), donnor הנגזרות DiI שכותרתו תאים מוצגים לפני קיבוע תחת מיקרוסקופ פלואורסצנטי FITC. אלה donnor הנגזרות התאים התרבו כדי ליצור notochord מיניאטורי, המופיע כמו מוט של תאים אדומים. (ב) בעקבות photoconversion של DiI, אלה donnor הנגזרות תאים להופיע חום. שתל donnor יש המושרה היווצרות של רקמה עצבית מהמחשב המארח: רקמה זו מורכבת מבשרי עבור המוח, כפי שמתגלה למטרות הבאות סמן חסרי זנב של הכלאה באתרו על ידי הביטוי שלהם [נדפס מתוך 6].
הערה: הליך זה, השתמשנו בתאי DiI שכותרתו כדי לבדל עצביים וגורם donnor רקמות (אדום / חום) של המחשב המארח נגזר רקמות "עצבית" (כחול). במקום להשתמש חומוס נגזר, DiI שכותרתו שתל donnor, חלק מחברי להשתמש גם רקמות donnor שמקורם בעוברים שליו במקום חומוס [למשל 6]. זו שיטה חלופית גם מאפשר לבדל donnor מרקמות המארח. במקרה זה, את השתל (רקמה donnor) מקורו ביצי שליו במקום ביצי תרנגולת. בעקבות צעד 4.5, המארח מעובד עבור אימונוהיסטוכימיה הר שלם עם נוגדן ספציפי שליו רקמות (QCP1) וצעדים 3.1-3.4 ו 5.1-5.7 מושמטות מן הפרוטוקול. דוגמה של הליך זה אלטרנטיבה מוצג להלן: במקרה זה, השתמשנו בהליך ניסיוני זהה A, B, אבל השתמשנו שליו שמקורם ברקמה donnor (כפי שמוצג על ידי ביטוי של נוגדן QCPN [חום]): מחדש צומת שמקורם בעובר שליו מושרה יש את הביטוי של פאן עצביים סמן Sox2 ב לארח את [נדפס מתוך 6]:

Discussion
סרט הווידאו הזה מדגים את השלבים השונים בביצוע assay לזירוז עצביים; זה assay משמש בעיקרו על אפיון של המשוערת מולקולות גרימת עצבית חומוס, וכך ניתן להשתמש במגוון רחב של יישומים, החל micromanipulations העוברית 1-4; 6 אל מפלי נפרמים חדש איתות 7,8, כולם במטרה להבין את השלב הראשונ?...
Acknowledgements
DP הוא חתן פרס רות Kirschstein DA021977 1F32-01A1 מן המכון הלאומי האמריקני לשימוש בסמים. עבודה זו נתמכה על ידי מ 'מרגרט Alkek קרן אל RHF.
Materials
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | Fertilized, HH3+ (14 hr) |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Hybridization Incubator | Equipment | Robbins Scientific, SciGene | M1000 | Use with inverted Pyrex dish and 500 ml ddH2O beaker |
| Marsh Automatic Incubator | Equipment | Lyon | RX | |
| Pyrex dish | ||||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| DiI | Reagent | Invitrogen | D-282 | |
| Aspirator tube assembly | Tool | Sigma-Aldrich | A5177-5EA | |
| Micr–lectrode puller | Equipment | Sutter Instrument Co. | Sutter InstrumentsP-97 Flaming/Brown Micropipette | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Culture chamber | Tool | Pioneer Plastics | 030C | |
| Microcapillary tube | Tool | Sigma-Aldrich | P1049-1PAK | |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Tool | Fine Science Tools | 26002-20 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Electron Microscopy Sciences | 15710 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C | |
| Diethylpyrocarbonate (depc) | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave | |
| 16% PFA | Electron Microscopy Sciences | 15710 |
References
- Waddington, C. H. Experiments on the development of chick and duck embryos, cultivated in vitro. Phil. Trans. R. Soc. Lond. B. 221, 179-230 (1932).
- Waddington, C. H. Induction by the primitive streak and its derivatives in the chick. J. Exp. Biol. 10, 38-46 (1933).
- Gallera, J. Excision et transplantation des différentes régions de la ligne primitive chez le poulet. C. R. Ass. Anat. 49, 632-639 (1964).
- Gallera, J. Primary induction in birds. Adv. Morph. 9. , 149-180 (1971).
- Serbedzija, G. N., Fraser, S. E., Bronner-Fraser, M. Pathways of neural crest cell migration in the mouse embryo as revealed by vital dye labeling. Development 108. , 605-612 (1990).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development 122. , 3263-3273 (1996).
- Joubin, K., Stern, C. D. Molecular interactions continuously define the organizer during the cell movements of gastrulation. Cell. 98, 559-571 (1999).
- Streit, A., Berliner, A. J., Papanayotou, C., Sirulnik, A., Stern, C. D. Initiation of neural induction by FGF signaling before gastrulation. Nature. , 406-474 (2000).
- Psychoyos, D., Finnell, R. Method for Culture of Early Chick Embryos ex vivo (New Culture. JoVE. 20, 10-3791 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved