Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Civciv Embriyo Sinir İndüksiyon için Testi
Özet
Sinir indüksiyon beyin oluşumunda ilk adımdır. Hensen düğüm (düzenleyen), sinir kaderi kabul komşu doku talimatını hangi bir mekanizma, yani sinir sistemi yol açmaları. Bu video civciv embriyo sinir indüksiyonu için bir test göstermektedir.
Özet
Civciv embriyo erken embriyonik gelişim çalışmaya değerli bir araçtır. Şeffaflık, erişilebilirlik ve manipülasyon kolaylığı, sinir sisteminin oluşumu ve ilk desenlendirme çalışmak için ideal bir araçtır. Bu video bir konak içine greft düzenleyen doku Hensen s düğümü (civciv embriyo düzenleyen) bir yöntem olan bir ana yetkili ektoderm aşılı nasıl gösteriyor. Organizatörü greft dokusu, sinir indükleyici sinyalleri aracılığıyla bir sinir kaderi kabul ettik na örten bildirir. Bu mekanizma nöral indüksiyon olarak adlandırılır ve amniotları beyin ve omurilik oluşumunda ilk adım teşkil etmektedir. Bu yöntem aslında piliç varsayılan sinir indükleyici moleküllerin karakterizasyonu için kullanılır. Bu video tayininde sinir indüksiyonu için farklı adımları gösteriyor; İlk olarak, donnor embriyo eksplante ve bir çanak üzerine tutturulmuş. Sonra, ev sahibi embriyo Yeni kültür için hazırlanmıştır. Greft eksize ve ev sahibi pellusida marjı nakledilen. Ev sahibi 18-22 saat kültüre. Montaj sabit ve başka uygulamalar (örneğin in situ hibridizasyon) işlenir. Bu yöntem başlangıçta Waddington icat edildi
Protokol
I. Şematik Bakış:

Bu video civciv embriyo sinir indüksiyonu için tahlil farklı adımları gösteriyor. İlk olarak, ana embriyo Yeni kültür eksplante [NI1]. Sonra, donnor embriyo tuzlu ve Hensen düğüm (civciv "organizatör") eksplante, floresan boya DII ile etiketlenmiş [NI2]. Hensen düğümünden donnor embriyo eksize [NI3] ve [NI4 konak embriyo nakledilen NI5]. Ana embriyo sonra donnor doku ana alanda bir ektopik ekseni indüklenen hangi süre sonra, 22 saat, kültüre opaca [NI6]. Kültür ardından, ev sahibi embriyo sabit ve DAB varlığında oksidasyona karşı savunma için işlenmiş: DAB kahverengi aşağıdaki reaksiyon haline önce oksidasyona karşı savunma mekanizmalarını [NI7] FITC floresanı altında kırmızı görünen bu kimyasal reaksiyon, donnor elde edilen hücreler, [NI8]. Embriyo daha sonra bir sinir marker [NI8] in situ hibridizasyon için işlenmiş; ev sahipliği elde edilen doku donnor greft varlığı, sinir doku oluşturmuştur. Bu doku mavi görünür.
1: Yeni kültür için ana embriyo hazırlanması
- Bu sinir indüksiyon tahlil protokolü, Hamburger ve Hamilton evre 3 inkübe edilmiştir yumurta ile başlar (veya HH3 +) . Bu yumurtalar, 13 saat boyunca nemli bir inkübatör kendi tarafında belirtilen inkübe edilmiştir.
- Yeni kültür (adımları 3.1 5.5 9) ev sahipliği embriyo hazırlayın .
- 200 ul salin ile ev sahibi embriyo yüzeyini kaplayan. Bu, daha sonra transfer ve donnor greft konumlandırma kolaylaştıracaktır.
- Son olarak, ters bir Falcon 35 mm kültür çanak montaj kapsar.
2: donnor embriyo tuzlu Explanting
- Forseps ile kabuk dokunarak ve etrafında kabuk kabuk parçalarını kaldırarak yumurta açın. Kabuğun üst çıkarın ve atın.
- Forseps ile kalın albümin çıkarın ve embriyo yukarı bakacak şekilde kaba forseps ile yumurta sarısı kesesi eğin.
- Ince makas kullanarak, yolk kesesi embriyo etrafında bir kare kesti. Bir kaşık ile yumurta sarısı embriyonun çıkarın ve PBS içeren bir yemek yer.
- Forseps kullanarak, alan pellusida donnor embriyo ayırmak.
- PBS içeren bir Sylgard kapalı çanak donnor embriyo transfer.
3: Etiketleme, eksize ve donnor greft nakli
- Mikroelektrot çektirmenin kullanarak, 50 ul cam microcapillary pipetler çekin. Mikroskop altında, ince forseps kullanarak mikropipet ucu kesilir. Petri Yeri mikropipet plasteline bir kurdele ile kaplı.
- Greft nakli için önce etiketlemek için kullanılacak boya çözüm hazırlayın: carbocyanine boya DII (1,1 '-dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine perklorat): Birinci, 1ml DII bir stok hazırlamak % 0.5 'lik mutlak etanol. Bu stok-20C karanlıkta saklanabilir. Bir su banyosunda 42 ° C, mix 360μl 0.3M sakkaroz 40 ul DII stok prewarmed. Su banyosu sıcaklığı, yağış DII ve çözünmeyen kristalleri oluşumu önlemek için gerekli. Kısaca bir mini spectrafuge solüsyonu (5-10 saniye) dönerler. DII çözüm artık kullanıma hazırdır.
- Böcek pimleri kullanarak, Sylgard kaplı çanak alt donnor embriyo güvenli.
- Geri dolgu DII ile mikropipet. Bir aspiratör boru montaj kullanarak nazik bir basınç uygulayarak, Hensen düğümünden DII bir küçük bolus uygulanır. Tüm Hensen düğümü etiketli olduğundan emin olun.
- Microcapillary bir pipet veya microdissecting bıçak kullanarak, Hensen düğüm ("organizatör", donnor greft) kesti.
- Karmin ile greft ventral yan ve arka uç işaretleyin. Bu adım 4.3 'te uygun dorso-ventral yönlendirme ile greft yerleştirilmiş olmasını sağlayacaktır.
- 200μl Gilson pipet kullanarak, greft ev sahibi embriyo transferi.
4: greft ve kültür ev sahibi embriyo koruma
- Greft, ana sitesi ile yakın konumlandırılmış kalır emin olmak için, ev sahibi embriyo tuzlu çıkarın.
- Microcapillary bir pipet veya microdissecting bıçak kullanarak, ev sahibi embriyo, Hensen düğüm düzeyinde alanında pellusida / alan opaca sınır bölgesi, küçük bir kesi (80-100μm).
- Microcapillary pipet veya microdissecting bıçak, pozisyon greft kullanarak bu ventral yan ve arka sonuna doğru bakacak şekilde ev sahibi embriyo eşdeğer bölgeye paralel.
- Kalan tuzlu su çıkarın ve 81-22 saat (adım 6.1 6.6 9) Yeni kültür için ana embriyo süreci.
- Ana embriyo sonra 4 ° C (adım 7,1-7,7 9) geceleme sabittir.
- Davlumbaz altında, Tris tampon bir DAB çalışma çözeltisi hazırlayın: 500μg/ml Tris tampon (100 mM Tris-HCl, pH 7.4) (3,3 '-diaminobenzidin tetrahydrochloride) DAB substrat çözülür; buz üzerinde, koyu çözüm tutmak.
- Tris buffer her 5 dakikada bir kez 5 milyon için PBS içinde embriyo iki kez yıkayın.
- 1 ml Tris tamponu içeren bir cam boşluğuna slayt embriyo transferi.
- Tris tampon çözeltisi 1.5 ml DAB solüsyonu ile değiştirin. DAB dekontamine için% 10 çamaşır suyu çözeltisi içeren kova Eppendorf ucu atın. Lamel kavite slayt üstüne yerleştirin.
- FITC (fluorescein isothiocyanate) floresan mikroskop altında, greft (donnor hücreler floresan kırmızı görünecektir) objektif odak ve tüm floresan kırmızı kan hücrelerinin kahverengi (DII bir sonucu olarak gerçekleşir hale gelmiştir kadar FITC floresan maruz photoconverted olmak florokrom çözünmez kahverengi kristaller, DAB varlığında FITC eksitasyon dalga boyu (488nm) maruz Bu süreç, 20 milyon ve 2 saat arasında sürer.
- Oksidasyona karşı savunma reaksiyon tamamlanmasının ardından, ince forseps kullanarak lamel çıkarın. Cam PBTw (veya% 0.1 Tween 20 içeren PBS) içeren 20 ml sintilasyon flakon embriyo transferi.
- % 10 çamaşır suyu çözeltisi kuluçka lamel ve cam boşluğuna slayt DAB devre dışı bırakın.
6: in situ hibridizasyon, fotoğraf embriyo Süreci ve kesit
- Sadece etiketli prob DIG embriyo kuluçka, in situ hibridizasyon (adım 3.7 ve 6.5 9) ile devam edin .
- Fotoğrafını (8.2 9 basamak) ve kesit (adımları 8.3 ve 8.4 9) ile devam edin.
Temsilcisi Sonuçlar
Nöral indüksiyon testinin Aşağıdaki örnekte, donnor greft konak elde edilen doku sinir işaretleyici Kuyruksuz ifade neden gösterilir. Donnor greft "organizatörü" bölge cerrahi donnor embriyo aşamasında kaldırılmış olan bir embriyo kaynaklanır: bu özel örnekte, normalde "organizatör" yeteneklerine sahip değiliz embriyonik bölgelerin sinir indükleyici yeteneği kazanılması değerlendirdi 3 +. Ablasyon sonrasında, delik iyileştikten ve Hensen düğümünden benzeri bir yapı oluşana kadar donnor embriyo, Yeni kültür geliştirmek için izin verilir. Bu yapı, daha sonra DII ile etiketli donnor embriyo eksize ve bir dizi embriyo alan pellusida / alan opaca sınır için aşılı. Yeni kültür ardından, minyatür bir eksen ev sahibi embriyo bitişik oluşur: Bu minyatür ekseni kırmızı hücrelerin (donnor türetilmiş) bir çubuk ve bir kafa gibi bir yapı (host edilen) oluşur: (A), donnor elde edilen DII etiketli hücreleri önce fiksasyon FITC floresan mikroskobu altında gösterilmiştir. Bu donnor kökenli hücrelerin kırmızı hücrelerin çubuk gibi görünen bir minyatür notokord oluşturmak için çoğaldı. (B) DII ardından Fotoçevrim, bu donnor kökenli hücrelerin kahverengi görünür. Donnor greft konak sinir doku oluşumuna neden vardır: Bu doku, beyin öncüleri oluşur, in situ hibridizasyon marker Kuyruksuz aşağıdaki kendi ifadesi ile ortaya [6 yeniden basıldı.
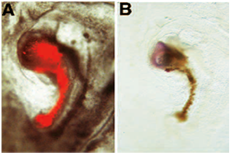
Not: Bu yöntemde, "sinir" doku (mavi) elde edilen konak sinir indükleyici donnor doku (kırmızı / kahverengi) ayırt etmek için DII etiketli hücreleri kullandık. Edilen bir civciv, DII etiketli donnor greft kullanarak yerine, bazı yazarlar da donnor yerine civciv bıldırcın embriyolar elde edilen doku [örneğin 6]. Bu alternatif bir yöntem de, konakçı doku donnor ayırt sağlar. Bu durumda, greft (donnor doku) bıldırcın yumurtası tavuk yumurtasına yerine kaynaklanır. Adım 4.5 ardından, ev sahibi doku (QCP1) ve adımları 3.1 5,7 - 3.4 ve 5.1 bıldırcınlar için özel bir antikor ile tüm montaj immünohistokimya işlenir protokol atlanmıştır. Bu alternatif prosedür bir örnek aşağıda gösterilmiştir: (QCPN antikor [kahverengi] ifadesi ile gösterildiği gibi) Bu durumda, A, B olarak aynı deneysel prosedür kullanılır, ama biz bıldırcın-türevli donnor doku rejenere bıldırcın embriyo elde edilen düğüm host pan-nöral işaretleyici Sox2 ifade indüklenen [6 yeniden basıldı]:

Tartışmalar
Bu video nöral indüksiyonu için bir test farklı adımları gösteriyor; Bu testte aslında piliç varsayılan sinir indükleyici moleküllerin karakterizasyonu için kullanılır ve böylece embriyolojik micromanipulations 1-4 arasında değişen çok çeşitli uygulamalar için kullanılabilir; 6 çözülüyor yeni sinyalizasyon kaskadlar 7,8, beyin oluşumu ve sinir sisteminin geri kalan ilk adım anlayışı hedefliyor.
Teşekkürler
DP Uyuşturucu İstismarı Ulusal Enstitüsü Ruth Kirschstein Ödülü 1F32 DA021977-01A1 alıcı. Bu çalışma, Margaret M. RHF Alkek Vakfı tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | Fertilized, HH3+ (14 hr) |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Hybridization Incubator | Equipment | Robbins Scientific, SciGene | M1000 | Use with inverted Pyrex dish and 500 ml ddH2O beaker |
| Marsh Automatic Incubator | Equipment | Lyon | RX | |
| Pyrex dish | ||||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| DiI | Reagent | Invitrogen | D-282 | |
| Aspirator tube assembly | Tool | Sigma-Aldrich | A5177-5EA | |
| Micr–lectrode puller | Equipment | Sutter Instrument Co. | Sutter InstrumentsP-97 Flaming/Brown Micropipette | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Culture chamber | Tool | Pioneer Plastics | 030C | |
| Microcapillary tube | Tool | Sigma-Aldrich | P1049-1PAK | |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Tool | Fine Science Tools | 26002-20 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Electron Microscopy Sciences | 15710 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C | |
| Diethylpyrocarbonate (depc) | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave | |
| 16% PFA | Electron Microscopy Sciences | 15710 |
Referanslar
- Waddington, C. H. Experiments on the development of chick and duck embryos, cultivated in vitro. Phil. Trans. R. Soc. Lond. B. 221, 179-230 (1932).
- Waddington, C. H. Induction by the primitive streak and its derivatives in the chick. J. Exp. Biol. 10, 38-46 (1933).
- Gallera, J. Excision et transplantation des différentes régions de la ligne primitive chez le poulet. C. R. Ass. Anat. 49, 632-639 (1964).
- Gallera, J. Primary induction in birds. Adv. Morph. 9. , 149-180 (1971).
- Serbedzija, G. N., Fraser, S. E., Bronner-Fraser, M. Pathways of neural crest cell migration in the mouse embryo as revealed by vital dye labeling. Development 108. , 605-612 (1990).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development 122. , 3263-3273 (1996).
- Joubin, K., Stern, C. D. Molecular interactions continuously define the organizer during the cell movements of gastrulation. Cell. 98, 559-571 (1999).
- Streit, A., Berliner, A. J., Papanayotou, C., Sirulnik, A., Stern, C. D. Initiation of neural induction by FGF signaling before gastrulation. Nature. , 406-474 (2000).
- Psychoyos, D., Finnell, R. Method for Culture of Early Chick Embryos ex vivo (New Culture. JoVE. 20, 10-3791 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır