É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ensaio para Indução Neural no embrião de galinha
Neste Artigo
Resumo
Indução neural é o primeiro passo na formação do cérebro. É um mecanismo pelo qual o nó de Hensen (organizador), instrui tecido adjacente a adotar um destino neural, ou seja, dar origem ao sistema nervoso. Este vídeo demonstra um ensaio para a indução neural no embrião de galinha.
Resumo
O embrião de galinha é uma ferramenta valiosa no estudo do desenvolvimento embrionário precoce. Sua transparência, acessibilidade e facilidade de manipulação, torná-lo uma ferramenta ideal para estudar a formação inicial e padronização do sistema nervoso. Este vídeo demonstra como organizador do enxerto de tecido em um host, um método pelo qual nó s Hensen (o organizador do embrião de galinha) é enxertado em um ectoderma competente de acolhimento. O enxerto organizador instrui sobrejacente nd ve tecido de adotar um destino através de sinais neurais indução neural. Esse mecanismo é conhecido como indução neural, e constitui o passo inicial na formação do cérebro e da medula espinhal em amniotas. Este método é essencialmente utilizado para a caracterização de moléculas indução neural putativo no pinto. Este vídeo demonstra as diferentes etapas no ensaio para a indução neural; Primeiro, o embrião é Donnor explantado e colocou em um prato. Então, o embrião hospedeiro está preparado para a nova cultura. O enxerto é retirado e transplantado para o host margem área pelúcida. O host é cultivado para 18-22 hrs. A montagem é fixa e processados para outras aplicações (por exemplo, hibridização in situ). Este método foi originalmente concebido por Waddington
Protocolo
I. Visão geral esquemática:

Este vídeo demonstra as diferentes etapas no ensaio para a indução neural no embrião de galinha. Primeiro, o embrião hospedeiro é explantado na cultura New [NI1]. Então, o embrião é Donnor explantado em solução salina e do nó de Hensen (o "organizador" no bico) é marcado com corante fluorescente DII [NI2]. Nó de Hensen é retirado do embrião Donnor [NI3] e transplantadas para o embrião hospedeiro [NI4, NI5]. O embrião hospedeiro é então cultivadas por até 22 horas, período após o qual o tecido Donnor induziu um eixo ectópica na área de acolhimento opaca [NI6]. Após a cultura, o embrião hospedeiro é fixo e processados para fotooxidação na presença de DAB: Por esta reação química, as células derivadas Donnor, que aparecem em vermelho sob fluorescência FITC antes fotooxidação [NI7], tornar-se seguinte reação marrom com DAB [NI8]. O embrião é então processada por hibridização in situ com um marcador neural [NI8]; tecido hospedeiro derivados formou tecido neural na presença do enxerto Donnor. Este tecido aparece em azul.
1: Preparando o embrião hospedeiro para a cultura de Nova
- Este protocolo de ensaio de indução neural começa com os ovos que foram incubados a Hamburger & Hamilton estágio 3 + (ou hh3 +). Estes ovos foram incubados estabelecidas em seu lado em uma incubadora úmida por 13 horas.
- Prepare o embrião hospedeiro para a cultura Novo (passos 3.1. A 5.5 9).
- Cubra a superfície do embrião hospedeiro com 200 mL solução salina. Isto irá facilitar a transferência mais tarde e posicionamento do enxerto Donnor.
- Finalmente, cobrir o conjunto com uma placa de cultura invertida Falcon 35 mm.
2: Explanting o embrião Donnor em solução salina
- Abra o ovo batendo na casca com uma pinça e retirar pedaços da casca, em todo o shell. Remover topo da casca e descarte.
- Remova a albumina espessa com uma pinça, e incline o saco vitelino com uma pinça grossa para que o embrião voltado para cima.
- Com uma tesoura fina, corte um quadrado de saco vitelino em torno do embrião. Remover o embrião da gema com uma colher e coloque em um prato contendo PBS.
- Utilizando uma pinça, retire o embrião Donnor da área pelúcida.
- Transferência de embriões Donnor a um prato coberto Sylgard contendo PBS.
3: Rotulagem, excisão e transplante de enxerto Donnor
- Utilizando um extrator de microeletrodos, puxar 50 pipetas de vidro mL microcapilar. Sob o microscópio, corte a ponta da micropipeta usando uma pinça fina. Micropipeta lugar numa placa de Petri forrada com uma fita de plasteline.
- Preparar a solução corante que será usado para rotular o enxerto antes do transplante: DII carbocyanine corante (1,1 '-dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine perclorato): Primeiro, prepare um estoque de DII em 1ml etanol absoluto em 0,5%. Este material pode ser armazenado a-20C no escuro. Em um banho-maria regulado a 42 ° C, pré-aquecido 40 mix de ações DII mL de 360μl sacarose 0.3M. A temperatura do banho de água é necessário para evitar a precipitação de DII e formação de cristais insolúveis. Brevemente girar a solução em um Spectrafuge mini (por 5-10 segundos). A solução DII está pronto para usar.
- Utilizando os pinos de insetos, segura o embrião Donnor no fundo do prato Sylgard coberto.
- Back-preencher a micropipeta com DII. Aplicando uma pressão suave usando um conjunto de tubos de aspiração, aplicar um bolo pequeno de DII para o nó de Hensen. Certifique-se o nó de Hensen inteiro é rotulado.
- Com uma pipeta microcapilar ou uma faca microdissecting, corte do nó de Hensen ("organizador", enxerto Donnor).
- Marcar o lado ventral e extremidade posterior do enxerto com carmim. Isso irá garantir que o enxerto é posicionado com a orientação dorso-ventral apropriada no passo 4.3.
- Usando um 200μl Gilson pipeta, transferir o enxerto para o embrião hospedeiro.
4: Protegendo o enxerto e de cultura do embrião hospedeiro
- Remover salina de embrião hospedeiro, certificando-se o enxerto permanece posicionada na proximidade com o local host.
- Com uma pipeta microcapilar ou uma faca microdissecting, fazer uma pequena incisão (80-100μm) na área pelúcida / área opaca região de fronteira, ao nível do nó de Hensen embrião hospedeiro.
- Utilizando uma pipeta ou uma microcapilar microdissecting faca posição, o enxerto para que lado ventral voltado para você e na extremidade posterior é paralela à região equivalente em embrião hospedeiro.
- Remover salina restantes, e processar o embrião hospedeiro para nova cultura de 81-22 hr (passos 6,1-6,6 9).
- O embrião hospedeiro é então fixado durante a noite a 4 ° C (7,1-7,7 passos 9).
- De acordo com exaustor, preparar uma solução DAB trabalhando em tampão Tris: Dissolver substrato DAB (3,3 tetrahidrocloreto 'diaminobenzidina) em tampão Tris (100mM Tris-HCl, pH 7,4) em 500μg/ml; manter solução no escuro, sobre o gelo.
- Lavar o embrião duas vezes em PBS por 5 min cada um e de vez em tampão Tris durante 5 mn.
- Transferência do embrião para uma lâmina de vidro contendo uma cavidade ml de tampão Tris.
- Substituir a solução tampão Tris com 1,5 ml solução DAB. Dispor de Eppendorf ponta em balde contendo uma solução de lixívia a 10%, a fim de descontaminar DAB. Coloque uma lamela em cima do deslize da cavidade.
- De acordo com FITC fluorescência (isotiocianato de fluoresceína), o foco do objetivo do microscópio sobre o enxerto (células Donnor aparecerá vermelha fluorescente) e expor a fluorescência FITC até todas as células fluorescentes vermelhas tornaram-se marrom (isso acontece como resultado da DII fluorocromo sendo photoconverted a insolúvel cristais marrom, pela exposição ao comprimento de onda de excitação FITC (488nm) na presença de DAB. Este processo leva entre 20 minutos e 2 horas.
- Após a conclusão da reação de fotooxidação, retire a lamínula usando uma pinça fina. Transferência de embriões para um frasco de vidro de cintilação contendo 20 ml PBTw (ou PBS com 0,1% Tween-20).
- Desativar DAB de lamela e deslize cavidade de vidro através da incubação em solução de água sanitária a 10%.
6: Processo para o embrião in situ hybridization, fotografia e corte
- Prosseguir com a hibridização in situ (passos 3,7-6,5 9), incubando o embrião para somente DIG sonda marcada.
- Prosseguir com a fotografar (passo 8,2 9) e secção (passos 8.3 e 8.4 9).
Resultados representante
No exemplo a seguir de ensaio a indução neural, o enxerto Donnor é mostrado induzir a expressão do marcador neural sem cauda de tecido do hospedeiro derivadas. Neste exemplo em particular, foi avaliada a aquisição de capacidade de indução neural das regiões embrionárias que normalmente não têm "organizer" habilidades: o enxerto Donnor origina de um embrião em que o "organizador" da região foi removido cirurgicamente do embrião na fase Donnor 3 +. Após a ablação, o embrião Donnor é permitido desenvolver-se em nova cultura, até que o buraco tem curado e uma estrutura semelhante a do nó de Hensen formou. Esta estrutura é, então, marcado com DII, retirado do embrião Donnor e enxertadas para a área de fronteira opaca pelúcida / área de um embrião hospedeiro. Após nova cultura, um eixo em miniatura é formado adjacente ao embrião hospedeiro: este eixo miniatura consiste de uma haste de glóbulos vermelhos (Donnor derivados) e uma estrutura de cabeça-like (host derivados): Em (A), Donnor derivados DII rotulados células são mostrados antes da fixação sob microscopia de fluorescência FITC. Estas células Donnor derivados têm proliferado para formar uma notocorda em miniatura, que aparece como vara de glóbulos vermelhos. (B) fotoconversão Depois de DII, essas células Donnor derivados aparecem marrom. O enxerto Donnor induziu a formação de tecido neural a partir do host: este tecido consiste de precursores para o cérebro, como revelado pela sua expressão para o seguinte marcador sem cauda de hibridização in situ [reimpressão da 6].
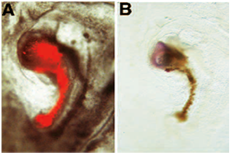
Nota: Neste procedimento, usamos células DII rotulados, a fim de diferenciar tecido neural induzindo Donnor (vermelho / marrom) do host derivadas de tecido "neural" (azul). Em vez de usar uma garota derivada, DII enxerto Donnor rotulados, alguns autores também utilizam Donnor tecido derivadas de embriões de codorna, em vez de pinto [eg 6]. Este método alternativo também permite diferenciar Donnor do tecido hospedeiro. Neste caso, o enxerto (tecido Donnor) se origina a partir de ovos de codorna, em vez de ovos de galinha. Seguinte passo 4.5, o host é processado para imunohistoquímica montagem inteira com um anticorpo específico para codorna tecido (QCP1) e as etapas 3,1-3,4 e 5,1-5,7 são omitidos do protocolo. Um exemplo deste procedimento alternativo é mostrado abaixo: Nesse caso, usamos o mesmo procedimento experimental como em A, B, mas nós usamos codorna derivadas do tecido Donnor (como mostrado pela expressão de anticorpos QCPN [marrom]): O regenerado nó derivado de embrião de codorna tem induzido a expressão de pan-neural marcador Sox2 no hospedeiro [reimpresso de 6]:

Discussão
Este vídeo demonstra as diferentes etapas na realização de um ensaio para a indução neural; Este ensaio é essencialmente usado para a caracterização da suposta indução neural em moléculas de bico, e, portanto, pode ser usado para uma ampla variedade de aplicações, que vão desde micromanipulations embriológico 1-4; 6 a desvendar novas cascatas de sinalização 7,8, todas visando a compreensão da etapa inicial na formação do cérebro e restante do sistema nervoso.
Agradecimentos
DP é destinatário de Ruth Award Kirschstein DA021977 1F32-01A1 do Instituto Nacional sobre Abuso de Drogas. Este trabalho foi financiado pela M. Margaret Alkek Fundação RHF.
Materiais
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | Fertilized, HH3+ (14 hr) |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Hybridization Incubator | Equipment | Robbins Scientific, SciGene | M1000 | Use with inverted Pyrex dish and 500 ml ddH2O beaker |
| Marsh Automatic Incubator | Equipment | Lyon | RX | |
| Pyrex dish | ||||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| DiI | Reagent | Invitrogen | D-282 | |
| Aspirator tube assembly | Tool | Sigma-Aldrich | A5177-5EA | |
| Micr–lectrode puller | Equipment | Sutter Instrument Co. | Sutter InstrumentsP-97 Flaming/Brown Micropipette | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Culture chamber | Tool | Pioneer Plastics | 030C | |
| Microcapillary tube | Tool | Sigma-Aldrich | P1049-1PAK | |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Tool | Fine Science Tools | 26002-20 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Electron Microscopy Sciences | 15710 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C | |
| Diethylpyrocarbonate (depc) | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave | |
| 16% PFA | Electron Microscopy Sciences | 15710 |
Referências
- Waddington, C. H. Experiments on the development of chick and duck embryos, cultivated in vitro. Phil. Trans. R. Soc. Lond. B. 221, 179-230 (1932).
- Waddington, C. H. Induction by the primitive streak and its derivatives in the chick. J. Exp. Biol. 10, 38-46 (1933).
- Gallera, J. Excision et transplantation des différentes régions de la ligne primitive chez le poulet. C. R. Ass. Anat. 49, 632-639 (1964).
- Gallera, J. Primary induction in birds. Adv. Morph. 9. , 149-180 (1971).
- Serbedzija, G. N., Fraser, S. E., Bronner-Fraser, M. Pathways of neural crest cell migration in the mouse embryo as revealed by vital dye labeling. Development 108. , 605-612 (1990).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development 122. , 3263-3273 (1996).
- Joubin, K., Stern, C. D. Molecular interactions continuously define the organizer during the cell movements of gastrulation. Cell. 98, 559-571 (1999).
- Streit, A., Berliner, A. J., Papanayotou, C., Sirulnik, A., Stern, C. D. Initiation of neural induction by FGF signaling before gastrulation. Nature. , 406-474 (2000).
- Psychoyos, D., Finnell, R. Method for Culture of Early Chick Embryos ex vivo (New Culture. JoVE. 20, 10-3791 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados