需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
X射线晶体学的蛋白质结晶
摘要
一个分子的三维结构的分子的功能提供了一个独特的理解。在近原子分辨率的结构测定的主要方法是X射线晶体学。在这里,我们展示了取得任何给定的高分子三维晶体,通过X射线晶体结构的决心适合的电流的方法。
摘要
使用生物大分子的三维结构来推断它们如何运作,是现代生物学的最重要领域之一。原子分辨率结构的可用性提供了一个深刻和独特的理解蛋白质的功能,并有助于揭示活细胞的内部工作。迄今为止,86%的蛋白质数据银行(RCSB PDB)项的确定,采用X射线晶体学的大分子结构。
为了获得适合晶体,晶体学研究,大分子(如蛋白质,核酸,蛋白质 - 蛋白质复合物或蛋白质 - 核酸复合物)必须得到净化同质化,或尽可能接近同质化。同质化的准备是获得晶体衍射高分辨率(Bergfors,1999年;麦弗逊,1999年)的一个关键因素。
到过饱和的高分子结晶需要。样本,因此,应集中到尽可能高的浓度,而不会造成聚集或沉淀的高分子(通常为2-50毫克/毫升)。样品引入沉淀剂,能促进蛋白质晶体的成核的解决方案,这可能会导致大从溶液中的三维晶体生长。获得晶体主要有两种技术:气相扩散和间歇结晶。一滴含有沉淀和蛋白质溶液的混合物蒸气扩散,是密封在一个纯粹的沉淀室。水蒸汽,然后扩散的下降,直到渗透压下降,沉淀的是平等的(图1A)。脱水下降导致蛋白质和沉淀缓慢的浓度,直到实现平衡,坐落在相图的晶体核区。批处理的方法依赖于使混合蛋白的蛋白质直接进入核区与适量的沉淀(图1B)。这种方法通常是下一个石蜡/矿物油混合,以防止下拉水的扩散。
在这里,我们将演示两种蒸汽扩散实验装置,挂在下降,坐滴,除了批量下油的结晶。
研究方案
材料:
- 蛋白质样品 - 溶菌酶(50毫克/毫升)
- 悬滴24井托盘
- 坐滴24井托盘
- Microbatch结晶96以及托盘
- 结晶解决方案(无论是商业用或自制)
- 硅脂
- 5 mL注射器无鲁尔锁
- 硅化盖幻灯片
- 光封箱胶带
- 石蜡
- 0.1-2微升微量低保留提示
- 镊子
- 专业湿巾
1。悬/坐在DROP PROCEDURE:
- 对于一个初始画面,可以使用市售的屏幕,利用稀疏矩阵,不完整的试验条件的阶乘方法。稀疏矩阵的不完整的阶乘方法是有失偏颇和选择知名的大分子结晶条件(卡特和卡特,1979年; Cudney等,1994; Jancarik和Kim,1991; Jancarik等,1991) 。如果是已知的结晶条件,可以组装一个狭窄的屏幕,不同的沉淀剂的浓度和pH值周围的原始命中。最常用的沉淀剂是聚乙二醇(PEG),硫酸铵。总之,这两个沉淀结晶(吉利兰等,1994;伯等,2003;。Page等人 ,2003年)所使用的所有记录的大分子沉淀约60 %的帐户。
- 准备好您的结晶解决方案。通常情况下,这些条件相结合,从沉淀剂,盐某种设置pH值和一个缓冲。在某些情况下的添加剂可能会增加特别感兴趣的蛋白质。所有股票的解决方案应使用0.22微米过滤器过滤。原液的一些人可能会非常粘稠(50%聚乙二醇,甘油,PEG - MME等)。
- 准备1.5 mL的0.6,0.8,1.0,1.2,1.4,1.6 M氯化钠0.1 M NaOAc pH值4.0,4.3,4.6和4.9(共24解决方案)
- 解冻蛋白质样品,并置于冰上。蛋白质股票应存放于-80 ° C,除非感兴趣的蛋白质是敏感的,冻结/解冻循环(若有,储存在4 ° C)。典型的蛋白质浓度范围在5-50毫克/毫升,具有较高的浓度通常提供更好的结果。
- 旋转样品15min/18 000xg / 4 ° C - 一些蛋白质往往部分聚合和沉淀后解冻步骤。这些聚集体,可促进蛋白质分子的其余部分无定形沉淀,因此彻底的降速将确保你只在你的样品的可溶性分子。保存,直到成立托盘上冰蛋白。
- 使用紫外分光光度计在280 nm处的吸光度确定蛋白浓度。吸光度读数和蛋白质的消光系数,可以计算出蛋白浓度。消光系数,可以计算出与ProtParam工具Expasy网站: http://ca.expasy.org/tools/protparam.html
- 24挂/ 500μL沉淀的解决方案,根据托盘设置方案(图2B)坐在下降托盘填写井。创建硅脂环周围以及边缘。环应该有一个小的差距,以防止空气井是密封的压力恢复。坐在滴,有没有油脂的需要,因为该井是用胶带密封(图2A)。
- 以封面幻灯片和压缩空气喷雾,或专业擦拭干净 - 避免灰尘会缓解结晶下降的解释和消除污染。报考滴,不使用封面幻灯片。相反,以及包含其中的蛋白质和沉淀剂混合货架。
- 将等量的蛋白质样品和水库的解决方案,封面上的幻灯片。作为优化过程的一部分,可能会尝试不同的卷的蛋白质和沉淀。使用更多的蛋白质比在蛋白质平衡后下降,稀蛋白质样品,是可取的和缓慢的晶体核或增长的净含量沉淀的结果。任何其他非易失性物质下降的解决方案也将集中由相同的因素。吹打到封面幻灯片的蛋白质和水库解决方案时,要非常小心,以避免泡沫的形成。这往往发生时空气吹吸管。
- 悬滴:0.02 M NaOAc pH值4.9负载为50毫克/毫升溶菌酶2μL,封面幻灯片的中心,以及加入2μL水库的解决方案。
- 坐在下降:负载2μL50 mg / mL的溶菌酶溶液的货架的中心,以及加入2μL水库解决方案。
- 轻轻地翻转盖幻灯片,以及顶部的油脂环奠定下来。油脂轻轻向下按,使空气可以通过缺口从井逃脱公关事件的空气在井压力恢复和保持密封良好。以及在空气压力积聚可提高盖滑动,影响密封性好。在坐滴法,光学透明胶带是用来盖井。因此,在此方法密封将每行/列。
- 可移动的未来以及,直到托盘完成。
- 检查安装后的托盘 - 消除灰尘颗粒和其他污染物,可减少蛋白质晶体的积极识别假。
- 使用评分表,记录自己的实验。
- 托盘放置在所需的孵化温度,一般在4 ° C和室温。 20℃是最常用的成功。小心轻轻地来处理托盘,并避免任何晃动。要小心,而开幕式和闭幕式孵化器的门。振动或转让或孵化期间温度变化可以防止晶体生长的晶体质量产生负面影响。冲击吸收材料(如包装泡沫),可以用来作为填充下,水晶托盘。
- 检查水晶托盘翌日,然后每隔几天,总是小心处理的托盘。文件中的任何一个托盘具体的评分表中的结果和下降形态。晶体通常需要2-5天出现,但晶体偶尔会出现更快(几乎立即)或更高(可达数月!)。一旦结晶条件已经确定,晶体的生长速率是已知的,最好是离开的托盘不受干扰,直到晶体的出现和成长至少他们的最终大小的一半。 ,托盘不受干扰,可以减少晶体的成核事件的数量,从而产生更大的晶体更小的数字。
2。 Microbatch程序:
- 蛋白质样品和沉淀剂制备如上所述。
- 空气喷涂一个新的microbatch托盘,以避免灰尘和其他大颗粒。
- 在microbatch托盘,填补石蜡油3毫米高(只够盖井)。卸下石油的访问。
- 装入石油预填充以及1μL蛋白质溶液(50毫克/毫升溶菌酶) - 确保移液器的解决方案,直接到井底(图2A)。
- 根据托盘设置方案(图2B)装入1μL沉淀的解决方案 - 确保下拉汇以及和保险丝的底部与蛋白质液滴。
- 移动到下一个井,直到完成托盘。
- 按照步骤悬/坐滴程序11-14。
3。代表性的成果:
结晶通常被称为X射线晶体学的瓶颈。一个稀疏矩阵的不完整的沉淀条件的阶乘屏幕上通常会产生许多不同类型的蛋白质聚集和沉淀,其中大单晶。如果蛋白质或沉淀剂的浓度过高,人们可以看到褐色的问题,没有独特的形状和尺寸(无定形沉淀)。下降的解决方案是欠当,往往会被彻底清除,没有任何一种沉淀。图3显示了沉淀现象和晶体(德绍等人 ,2006年)的几个例子。更详细的解释更多的沉淀现象,可以发现在http://xray.bmc.uu.se/terese/tutorials.html。
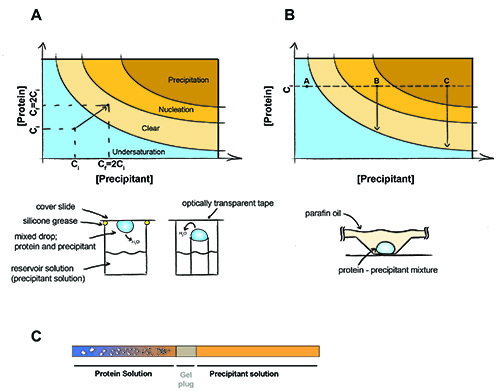
图1。蛋白质结晶的原则 。
蛋白质结晶的原则。在气相扩散实验(一)平等的沉淀和蛋白质的数量在下降。水漫出的沉淀和蛋白质浓度将增加一倍,直到下降,水库的解决方案之间实现平衡。 (二)在间歇结晶沉淀和蛋白浓度在实验过程中不改变。 A点 - 蛋白质停留欠无晶体才能形成,B点 - 蛋白质核发生,晶体开始形成和蛋白质在溶液中的浓度下降到饱和。 C点 - 蛋白质沉淀,但晶体可能继续增长。 (三)透析结晶用凝胶堵塞毛细血管。晶体出现盐扩散出的蛋白质样品,整个凝胶插件(和/或沉淀扩散的蛋白质样品)。
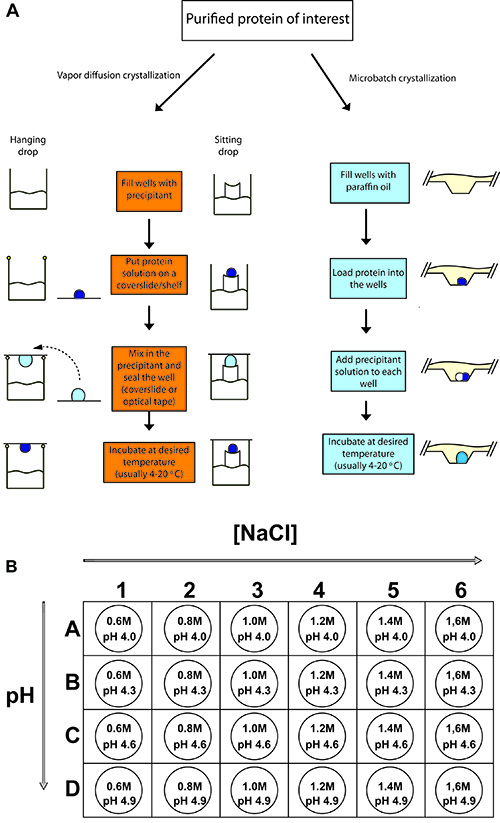
图2。典型的蛋白质结晶实验大纲 。
(一)悬滴气相扩散,坐滴气相扩散和microbatch蛋白质结晶过程。在每一种情况下,一个浓缩的蛋白质样品的体积小的precipitan相同或更小的体积混合T解决方案,并允许以平衡。 (二)设置鸡溶菌酶,24孔托盘的结晶,是与不同浓度的氯化钠(沉淀)和0.1 M为在不同pH值的缓冲醋酸钠(4.0 - 4.9)。

图3。蛋白质结晶实验的典型结果 。
(一)无定形沉淀。当蛋白质或沉淀(或两者)在高浓度。 (二)相分离。蛋白质或清洁剂可能分开到不同阶段时,在高浓度的某些沉淀混合。 (三)杆形蛋白质晶体的AtCSN7获得聚乙二醇8000和醋酸镁(德绍等,2006)。 (四)在1.0 M氯化钠和醋酸钠的pH值4.9溶菌酶晶体获得。 (e)根据饱和滴通常保持清醒。摄影卡察夫德绍。
结果
Crystallization is usually referred to as the bottleneck of X-ray crystallography. A sparse matrix incomplete factorial screen of precipitating conditions typically produces many different types of protein aggregation and precipitation, among them large single crystals. If the protein or precipitant concentrations are too high one can see brown matter with no distinct shape and size (amorphous precipitation). When the solution is undersaturated, the drop will often be completely clear and devoid of any kind of precipitat...
讨论
在这篇文章中我们将介绍和演示蛋白质结晶当前的协议。自一个多步骤的过程中有几个注意事项要注意的一个需要。当工作与极少量(0.5-2μL)下拉由于蒸发干燥,是一个主要问题。因此,建议工作在良好的控制环境低的空气流动性,高湿度和严格的温度控制,并采取了一种技术,最大限度地减少暴露露天下降。出于这个原因,它运行在一个组织良好的的工作环境是必不可少的。所有试剂应准备?...
披露声明
致谢
这项工作是由宝来惠康研究者奖,以YM和布朗Coxe从美国耶鲁大学博士后奖学金到MD的支持。
材料
| Name | Company | Catalog Number | Comments |
| Lysozyme | Sigma-aldrich | L6876-1G | |
| 24 well VDX Plate | Hampton research | HR3-142 | |
| 24 well Cryschem Plate | Hampton research | HR3-158 | |
| Dow Corning Vacuum Grease | Hampton research | HR3-510 | |
| Siliconized glass circle coverslides | Hampton research | HR3-231 | |
| 100% paraffin oil | Hampton research | HR3-411 | |
| 1.88 inch wide Crystal Clear Sealing Tape | Hampton research | HR3-511 | |
| 96 Well Imp@ct Plate (Microbatch plate) | Hampton research | HR3-098 |
参考文献
- Bergfors, T. M. . Protein crystallization : techniques, strategies, and tips : a laboratory manual. , (1999).
- Carter, C. W., Carter, C. W. Protein crystallization using incomplete factorial experiments. J Biol Chem. 254, 12219-12223 (1979).
- Cudney, R., Patel, S., Weisgraber, K., Newhouse, Y., McPherson, A. Screening and optimization strategies for macromolecular crystal growth. Acta Crystallogr D Biol Crystallogr. 50, 414-423 (1994).
- Dessau, M., Chamovitz, D. A., Hirsch, J. A. Expression, purification and crystallization of a PCI domain from the COP9 signalosome subunit 7 (CSN7). Acta Crystallogr Sect F Struct Biol Cryst Commun. 62, 1138-1140 (2006).
- Gilliland, G. L., Tung, M., Blakeslee, D. M., Ladner, J. E. Biological Macromolecule Crystallization Database, Version 3.0: new features, data and the NASA archive for protein crystal growth data. Acta Crystallogr D Biol Crystallogr. 50, 408-413 (1994).
- Jancarik, J., Kim, S. H. Sparse matrix sampling: a screening method for crystallization of proteins. J Appl Cryst. 23, 409-411 (1991).
- Jancarik, J., Scott, W. G., Milligan, D. L., Koshland, D. E., Kim, S. H. Crystallization and preliminary X-ray diffraction study of the ligand-binding domain of the bacterial chemotaxis-mediating aspartate receptor of Salmonella typhimurium. J Mol Biol. 221, 31-34 (1991).
- Kimber, M. S., Vallee, F., Houston, S., Necakov, A., Skarina, T., Evdokimova, E., Beasley, S., Christendat, D., Savchenko, A., Arrowsmith, C. H. Data mining crystallization databases: knowledge-based approaches to optimize protein crystal screens. Proteins. 51, 562-568 (2003).
- Lorber, B., Sauter, C., Theobald-Dietrich, A., Moreno, A., Schellenberger, P., Robert, M. C., Capelle, B., Sanglier, S., Potier, N., Giege, R. Crystal growth of proteins, nucleic acids, and viruses in gels. Prog Biophys Mol Biol. 101, 13-25 (2009).
- McPherson, A. . Crystallization of biological macromolecules. , (1999).
- McPherson, A. Introduction to protein crystallization. Methods. 34, 254-265 (2004).
- Page, R., Grzechnik, S. K., Canaves, J. M., Spraggon, G., Kreusch, A., Kuhn, P., Stevens, R. C., Lesley, S. A. Shotgun crystallization strategy for structural genomics: an optimized two-tiered crystallization screen against the Thermotoga maritima proteome. Acta Crystallogr D Biol Crystallogr. 59, 1028-1037 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。