É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cristalização de proteínas para cristalografia de raios X
Neste Artigo
Resumo
A estrutura 3-D de uma molécula fornece um entendimento único de como as funções molécula. O principal método para determinação da estrutura de quase-atômica resolução é cristalografia de raios X. Aqui, demonstramos os métodos atuais de obtenção de cristais tridimensionais de qualquer macromolécula, uma vez que são adequados para determinação de estrutura por cristalografia de raios X.
Resumo
Usando a estrutura tridimensional de macromoléculas biológicas para inferir como eles funcionam é uma das áreas mais importantes da biologia moderna. A disponibilidade de estruturas de resolução atômica fornece uma compreensão profunda e única da função da proteína, e ajuda a desvendar o funcionamento interno da célula viva. Até o momento, 86% do Protein Data Bank (PDB-RCSB) as entradas são estruturas macromoleculares que foram determinados através de cristalografia de raios X.
Para obter cristais adequados para estudos cristalográficos, a macromolécula (proteína, por exemplo, ácidos nucléicos, proteína-proteína-proteína complexa ou complexo de ácido nucléico) deve ser purificada à homogeneidade, ou o mais próximo possível à homogeneidade. A homogeneidade da preparação é um fator chave na obtenção de cristais que difratar de alta resolução (Bergfors, 1999; McPherson, 1999).
Cristalização requer trazendo a macromolécula de supersaturação. A amostra deve ser concentrado para a concentração mais alta possível, sem causar agregação ou precipitação da macromolécula (geralmente 20-50 mg / mL). Introduzir a amostra para agente de precipitação pode promover a nucleação de cristais de proteínas na solução, que pode resultar em grandes tridimensional crescimento de cristais da solução. Existem duas técnicas principais para obter cristais: vapor de difusão e cristalização lote. Na difusão de vapor, uma gota contendo uma mistura de soluções precipitantes e de proteínas é selada em uma câmara com precipitante puro. O vapor de água, em seguida, difunde para fora da gota até a osmolaridade da queda e do precipitante são iguais (Figura 1A). A desidratação da gota provoca uma concentração de ambas as proteínas lenta e precipitante até que o equilíbrio é alcançado, de preferência na zona de nucleação de cristal do diagrama de fases. O método se baseia em lote trazendo a proteína diretamente para a zona de nucleação pela proteína mistura com a quantidade adequada de precipitante (Figura 1B). Este método é geralmente realizado sob uma parafina / mistura de óleo mineral para evitar a difusão de água para fora da gota.
Aqui vamos demonstrar dois tipos de configuração experimental para difusão de vapor, pendurado cair e cair sentado, além de cristalização lote sob óleo.
Protocolo
Materiais:
- Amostra de proteína - lisozima (50 mg / mL)
- Hanging bandeja queda de 24 bem-
- Sentando queda de 24 bem-bandeja
- Microbatch cristalização 96 bandeja bem
- Soluções de cristalização (tanto comerciais disponíveis ou home made)
- Graxa de silicone
- Seringa de 5 mL sem Luer-lock
- Siliconizado slides cobrir
- Fita de vedação óptica
- Parafina
- 0,1-2 mL micropipeta com retenção de baixa dicas
- Pinça
- Wipes profissional
1. Hanging / sentado Procedimento Drop:
- Para uma tela inicial pode-se usar telas disponíveis comercialmente que exploram a matriz esparsa método fatorial incompleta de condições de julgamento. A matriz esparsa método fatorial incompleta é enviesada por e selecionados a partir de condições de cristalização conhecido por macromoléculas (Carter e Carter, 1979; Cudney et al, 1994;. Jancarik e Kim, 1991;. Jancarik et al, 1991). Se a condição de cristalização já é conhecido, uma tela estreita pode ser montada, variando a concentração precipitante e pH em torno do hit original. O precipitante mais bem sucedido é polietileno glicol (PEG), seguido pelo sulfato de amônio. Juntas, essas duas conta precipitantes por cerca de 60% de todos os precipitantes macromolecular registrados usados para a cristalização (Gilliland et al, 1994;. Kimber et al, 2003;.. Page et al, 2003).
- Prepare as suas soluções de cristalização. Normalmente, estas condições são combinadas a partir de um agente de precipitação, o sal de algum tipo e um tampão para ajustar o pH. Em alguns casos, os aditivos podem ser adicionados especificamente para a proteína de interesse. Todos solução de reserva deve ser filtrada através de filtro 0,22 mM. Alguns da solução-mãe pode ser muito viscoso (50 PEGs%, glicerol, PEG-MME, etc).
- Prepare 1,5 mL de 0,6, 0,8, 1,0, 1,2, 1,4, 1,6 M NaCl 0,1 M em cada NaOAc pH 4.0, 4.3, 4.6 e 4.9 (total de 24 soluções)
- Descongele a sua amostra de proteína e manter em gelo. Estoques de proteína deve ser armazenado a -80 ° C a menos que a proteína de interesse é sensível ao congelamento / degelo (se assim, armazenar a 4 ° C). Concentrações de proteínas típicos estão na faixa de 50-50 mg / mL, com maiores concentrações geralmente dando os melhores resultados.
- Rotação da amostra 15min/18, 000xg / 4 ° C - algumas proteínas tendem a agregar e precipitar parcialmente depois de uma etapa descongelar. Estes agregados podem promover a precipitação amorfa do resto das moléculas de proteína, portanto, girar completa para baixo vai garantir que você tenha apenas moléculas solúveis na sua amostra. Guardar a proteína no gelo até a criação de bandeja.
- Determinar a concentração de proteína a partir de sua absorbância a 280 nm usando um espectrofotômetro UV. A concentração de proteína pode ser calculado a partir da leitura de absorbância e coeficiente da proteína extinção. O coeficiente de extinção podem ser calculados com a ferramenta ProtParam no site ExPASy: http://ca.expasy.org/tools/protparam.html
- Preencha poços do enforcamento de 24 poços / sentado bandeja cair com 500 mL de solução precipitante de acordo com o esquema de configuração da bandeja (Figura 2B). Criar um anel de graxa de silicone em torno da borda do poço. O anel deve ter um pequeno espaço para evitar o acúmulo de pressão de ar como o bem está selado. Em gotas sentado, não há necessidade de graxa já que o bem é selada com fita adesiva (Figura 2A).
- Tome um slide tampa e limpe-a com spray de ar condensado, ou um profissional wipe - evitando a poeira vai facilitar a interpretação da queda de cristalização e eliminar contaminações. Para sentar-gotas, cobertura deslizante não são usados. Em vez disso, o poço contém uma prateleira em que a proteína e precipitante são misturados.
- Coloque volumes iguais da amostra de proteínas e solução de reservatório no slide tampa. Volumes diferentes de proteínas e precipitante pode ser julgado como parte do processo de otimização. Usando mais proteína do que resultados precipitante em uma concentração líquida da proteína na queda após atingir o equilíbrio, que pode ser desejável para diluir amostras de proteínas, e para retardar a nucleação de cristal ou de crescimento. Qualquer outra substância não-volátil na solução de queda também será concentrado pelo mesmo fator. Quando a proteína de pipetagem e soluções reservatório para o slide tampa, ser extremamente cuidadoso para evitar a formação de bolhas. Isso geralmente ocorre quando o ar é soprado para fora da pipeta.
- Hanging drop: 2 mL de carga de 50 mg / mL de lisozima em pH 0,02 NaOAc M 4,9 para o centro do slide tampa e adicionar-lhe 2 mL da solução do reservatório.
- Sentando queda: Load 2 mL de solução de lisozima 50 mg / mL para o centro da plataforma e adicionar-lhe 2 mL da solução do reservatório.
- Virar a cobertura deslizante suave e colocá-lo sobre o anel de graxa na parte superior do poço. Pressione suavemente para que o ar pode escapar do poço através do entalhe na graxa para prevento acúmulo de pressão de ar no poço e manter o bem fechados. Air acúmulo de pressão no poço pode aumentar a cobertura deslizante, comprometendo o selo também. No método de queda sentado, opticamente clara fita transparente é usada para cobrir os poços. Assim, neste método de selagem terá lugar cada linha / coluna.
- Passar para a próxima bem até bandeja está completa.
- Verifique a bandeja na configuração - eliminando as partículas de poeira e outras contaminações pode reduzir a identificação de falsos positivos de cristais de proteínas.
- Use uma folha de pontuação para documentar a sua experiência.
- Coloque a bandeja na temperatura de incubação desejado, geralmente entre 4 C de temperatura e sala °. 20 ° C é mais comumente sucesso. Tome cuidado para lidar com a bandeja com cuidado e evitar qualquer agitação. Ter cuidado ao abrir e fechar a porta da incubadora. Vibrações ou mudanças de temperatura durante a transferência ou a incubação pode impedir o crescimento de cristal ou afetar negativamente a qualidade de cristal. A absorção de choque material (espuma de embalagem, por exemplo) pode ser usado como estofamento sob os tabuleiros de cristal.
- Verifique a bandeja de cristais no dia seguinte, e depois todos os dias, sempre manuseio das bandejas com cuidado. Documento as conclusões e as morfologias queda de uma folha de pontuação bandeja específica. Cristais geralmente levam 2-5 dias para aparecer, embora ocasionalmente aparecem cristais muito mais cedo (quase imediatamente) ou posterior (até vários meses!). Uma vez que as condições de cristalização foram identificados ea taxa de crescimento dos cristais é conhecida, o melhor é deixar as bandejas repousar até cristais apareceram e cresceu para pelo menos metade do seu tamanho final. Deixando intacta as bandejas pode reduzir o número de eventos de nucleação de cristal, portanto, produzindo um número menor de cristais maiores.
2. Microbatch procedimento:
- Amostra de proteínas e preparação precipitantes são como descrito acima.
- Pistola uma bandeja microbatch novo para evitar poeira e outras partículas grandes.
- Na bandeja microbatch, abastecimento de óleo de parafina até 3 mm de altura (apenas o suficiente para cobrir os poços). Remover o acesso de petróleo.
- Carga 1 mL de solução de proteína (50 mg / mL de lisozima) no óleo pré-cheia bem - certifique-se de pipeta a solução diretamente para o fundo do poço (Figura 2A).
- Carga 1 mL de solução precipitante no acordo bem ao esquema de configuração da bandeja (Figura 2B) - certifique-se a queda se deposita no fundo do poço e se funde com a gota de proteína.
- Mover-se para o bem próximos até bandeja está completa.
- Siga os passos 11-14 do enforcamento / sentado procedimento queda.
3. Resultados representativos:
A cristalização é normalmente referido como o gargalo da cristalografia de raios X. A matriz esparsa tela incompleta fatorial de condições precipitantes normalmente produz muitos tipos diferentes de agregação de proteínas e precipitação, entre eles grandes monocristais. Se a proteína ou concentrações precipitante são demasiado elevados pode-se ver a matéria marrom com nenhuma forma e tamanho distintos (precipitação amorfa). Quando a solução é undersaturated, a queda será muitas vezes completamente clara e desprovida de qualquer tipo de precipitação. A Figura 3 mostra vários exemplos de fenômenos de precipitação e cristais (Dessau et al., 2006). Fenômenos mais precipitação com mais interpretação detalhada pode ser encontrada em http://xray.bmc.uu.se/terese/tutorials.html .
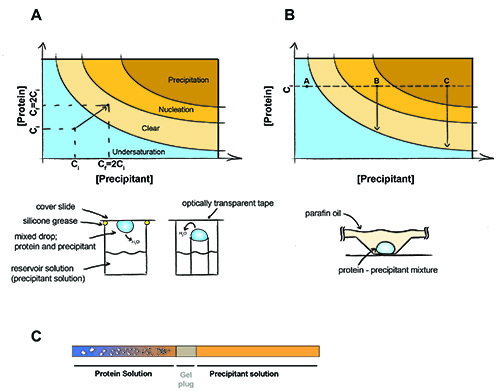
Figura 1. O princípio da cristalização de proteínas.
O princípio da cristalização de proteínas. Em um experimento de difusão de vapor (A) volumes iguais de precipitantes e de proteínas estão presentes no drop. Água difundem para fora e ambos precipitante ea concentração de proteína será duplicada até que o equilíbrio é alcançado entre a queda ea solução do reservatório. Em cristalização lote (B) o precipitante ea concentração de proteínas não se alteram durante o experimento. Ponto A - Proteína permanece undersaturated sem cristais podem ser formados, B Point - nucleação de proteínas ocorre, os cristais começaram a se formar ea concentração de proteína em solução cai para a saturação. C Point - Proteína precipitados, mas ainda podem crescer os cristais. (C) cristalização Diálise usando um gel-conectado capilar. Cristais aparecem como o sal se difunde para fora da amostra de proteínas (e / ou difunde precipitante de proteína na amostra) através da ficha gel.
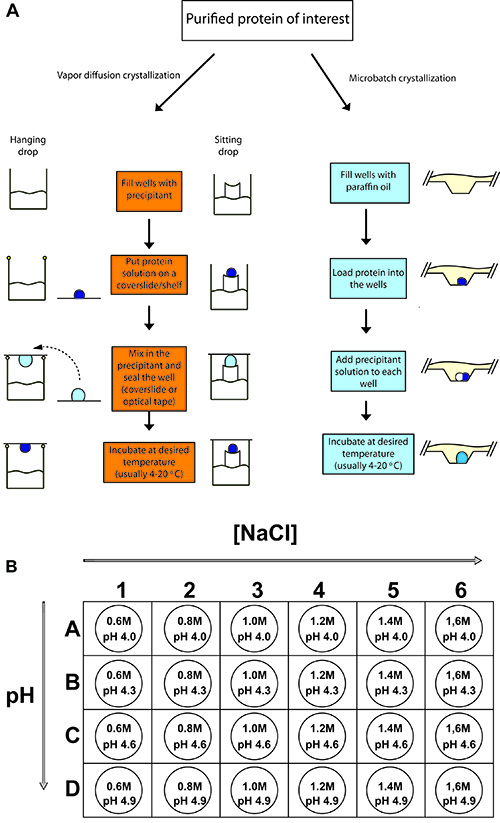
Figura 2. Esboço de experimentos de cristalização de proteínas típicas.
(A) Procedimentos para pendurar difusão queda vapor, sentado difusão queda de vapor, e cristalização de proteínas microbatch. Em cada caso, um pequeno volume de amostra de proteína concentrado é misturado com um volume igual ou menor de precipitant solução e permitiu equilibrar. (B) Para a cristalização de frango lisozima, uma bandeja de 24 poços é configurado com diferentes concentrações de cloreto de sódio (o precipitante) e com 0,1 M de acetato de sódio como tampão com pHs diferentes (4,0-4,9).

Figura 3. Resultados típicos de um experimento de cristalização de proteínas.
(A) precipitação amorfo. Quando a proteína ou precipitante (ou ambos) estão em alta concentração. (B) a separação de fase. Proteína ou detergente pode separar a uma fase diferente, quando misturado com certos precipitantes em alta concentração. (C) cristais de proteínas em forma de Rod AtCSN7 obtidos em polietileno glicol 8000 e acetato de magnésio (Dessau et al., 2006). (D) Os cristais de lisozima obtidos em 1,0 M NaCl e acetato de sódio pH 4,9. (E) De acordo com gotas saturadas geralmente permanecem claros. Fotografia por Moshe Dessau.
Resultados
Crystallization is usually referred to as the bottleneck of X-ray crystallography. A sparse matrix incomplete factorial screen of precipitating conditions typically produces many different types of protein aggregation and precipitation, among them large single crystals. If the protein or precipitant concentrations are too high one can see brown matter with no distinct shape and size (amorphous precipitation). When the solution is undersaturated, the drop will often be completely clear and devoid of any kind of precipitat...
Discussão
Neste artigo vamos descrever e demonstrar geral protocolos atuais para a cristalização de proteínas. Uma vez que um procedimento multi-passo, há algumas considerações a pessoa precisa estar ciente. Ao trabalhar com volumes muito pequenos (0,5-2 mL), secagem da gota devido à evaporação é uma grande preocupação. Assim, recomenda-se a trabalhar em um ambiente bem controlado (com baixo fluxo de ar, alta umidade e controle de temperatura apertado) e adotar uma técnica que minimiza a exposição da queda para o a...
Divulgações
Agradecimentos
Este trabalho foi financiado por um Investigator Award Burroughs Wellcome para YM e por uma bolsa de pós-doutorado Brown-Coxe da Universidade de Yale para MD.
Materiais
| Name | Company | Catalog Number | Comments |
| Lysozyme | Sigma-aldrich | L6876-1G | |
| 24 well VDX Plate | Hampton research | HR3-142 | |
| 24 well Cryschem Plate | Hampton research | HR3-158 | |
| Dow Corning Vacuum Grease | Hampton research | HR3-510 | |
| Siliconized glass circle coverslides | Hampton research | HR3-231 | |
| 100% paraffin oil | Hampton research | HR3-411 | |
| 1.88 inch wide Crystal Clear Sealing Tape | Hampton research | HR3-511 | |
| 96 Well Imp@ct Plate (Microbatch plate) | Hampton research | HR3-098 |
Referências
- Bergfors, T. M. . Protein crystallization : techniques, strategies, and tips : a laboratory manual. , (1999).
- Carter, C. W., Carter, C. W. Protein crystallization using incomplete factorial experiments. J Biol Chem. 254, 12219-12223 (1979).
- Cudney, R., Patel, S., Weisgraber, K., Newhouse, Y., McPherson, A. Screening and optimization strategies for macromolecular crystal growth. Acta Crystallogr D Biol Crystallogr. 50, 414-423 (1994).
- Dessau, M., Chamovitz, D. A., Hirsch, J. A. Expression, purification and crystallization of a PCI domain from the COP9 signalosome subunit 7 (CSN7). Acta Crystallogr Sect F Struct Biol Cryst Commun. 62, 1138-1140 (2006).
- Gilliland, G. L., Tung, M., Blakeslee, D. M., Ladner, J. E. Biological Macromolecule Crystallization Database, Version 3.0: new features, data and the NASA archive for protein crystal growth data. Acta Crystallogr D Biol Crystallogr. 50, 408-413 (1994).
- Jancarik, J., Kim, S. H. Sparse matrix sampling: a screening method for crystallization of proteins. J Appl Cryst. 23, 409-411 (1991).
- Jancarik, J., Scott, W. G., Milligan, D. L., Koshland, D. E., Kim, S. H. Crystallization and preliminary X-ray diffraction study of the ligand-binding domain of the bacterial chemotaxis-mediating aspartate receptor of Salmonella typhimurium. J Mol Biol. 221, 31-34 (1991).
- Kimber, M. S., Vallee, F., Houston, S., Necakov, A., Skarina, T., Evdokimova, E., Beasley, S., Christendat, D., Savchenko, A., Arrowsmith, C. H. Data mining crystallization databases: knowledge-based approaches to optimize protein crystal screens. Proteins. 51, 562-568 (2003).
- Lorber, B., Sauter, C., Theobald-Dietrich, A., Moreno, A., Schellenberger, P., Robert, M. C., Capelle, B., Sanglier, S., Potier, N., Giege, R. Crystal growth of proteins, nucleic acids, and viruses in gels. Prog Biophys Mol Biol. 101, 13-25 (2009).
- McPherson, A. . Crystallization of biological macromolecules. , (1999).
- McPherson, A. Introduction to protein crystallization. Methods. 34, 254-265 (2004).
- Page, R., Grzechnik, S. K., Canaves, J. M., Spraggon, G., Kreusch, A., Kuhn, P., Stevens, R. C., Lesley, S. A. Shotgun crystallization strategy for structural genomics: an optimized two-tiered crystallization screen against the Thermotoga maritima proteome. Acta Crystallogr D Biol Crystallogr. 59, 1028-1037 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados