Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
De cristalización de proteínas para la cristalografía de rayos X
En este artículo
Resumen
La estructura 3-D de una molécula proporciona un conocimiento único de cómo funciona la molécula. El principal método para la determinación de la estructura en casi atómica resolución cristalografía de rayos X. En este sentido, demostrar los métodos actuales de obtención de cristales tridimensionales de cualquier macromolécula, dado que son adecuados para la determinación de la estructura por cristalografía de rayos X.
Resumen
Usando la estructura tridimensional de macromoléculas biológicas para deducir su funcionamiento es uno de los campos más importantes de la biología moderna. La disponibilidad de las estructuras de resolución atómica proporciona una comprensión profunda y única de la función de proteínas, y ayuda a desentrañar el funcionamiento interno de la célula viva. Hasta la fecha, el 86% de la Protein Data Bank (PDB-RCSB) las entradas son estructuras macromoleculares que se determinaron utilizando cristalografía de rayos X.
Para obtener cristales adecuados para los estudios de cristalografía, la macromolécula (por ejemplo, proteínas, ácidos nucleicos y complejos proteína-proteína o proteína-ácido nucleico complejo) debe ser purificado a homogeneidad, o lo más cerca posible a la homogeneidad. La homogeneidad de la preparación es un factor clave en la obtención de cristales que se difractan a alta resolución (Bergfors, 1999; McPherson, 1999).
La cristalización requiere llevar la macromolécula a la sobresaturación. La muestra, por tanto, concentra a la mayor concentración posible, sin causar la agregación o precipitación de la macromolécula (generalmente 20-50 mg / ml). La introducción de la muestra a un agente precipitante no puede promover la nucleación de cristales de proteínas en la solución, lo cual puede resultar en grandes cristales tridimensionales de crecimiento de la solución. Existen dos técnicas principales para obtener cristales: la difusión del vapor y la cristalización por lotes. En la difusión del vapor, una gota que contiene una mezcla de soluciones de precipitación y de la proteína se encuentra sellado en una cámara con precipitación puro. El vapor de agua se difunde fuera de la gota hasta que la osmolaridad de la gota y la precipitación son iguales (fig. 1A). La deshidratación de la caída provoca una lenta concentración de proteínas y precipitación hasta que se alcanza el equilibrio, a ser posible en la zona de la nucleación de cristales del diagrama de fase. El método se basa en lotes con lo que el de proteínas directamente en la zona de la nucleación de la proteína se mezcla con la cantidad apropiada de precipitación (fig. 1B). Este método se realiza generalmente bajo una parafina / mezcla de aceite mineral para evitar la difusión de agua de la gota.
Aquí se muestran dos tipos de montaje experimental para la difusión del vapor, colgando caer y caer sentado, además de la cristalización por lotes en el aceite.
Protocolo
Materiales:
- Muestra de la proteína - lisozima (50 mg / mL)
- Colgando caída de 24 y la bandeja
- Sentado caída de 24 y la bandeja
- Batch de cristalización 96 bandeja y
- Soluciones de cristalización (ya sea comercial, o de fabricación casera)
- Grasa de silicona
- 5 ml jeringa sin Luer-lock
- Diapositivas con silicona cubrir
- Cinta aislante óptico
- Parafina
- 0.1-2 l micropipeta con puntas de baja retención
- Pinzas
- Toallitas profesional
1. Colgando de estar / Procedimiento de caída:
- Para una pantalla inicial se puede utilizar pantallas disponibles en el mercado que aprovechan la matriz dispersa incompleta método factorial de las condiciones de ensayo. La matriz dispersa incompleta método factorial está sesgada por y seleccionados de las condiciones de cristalización de macromoléculas conocido (Carter y Carter, 1979; Cudney et al, 1994;. Jancarik y Kim, 1991;. Jancarik et al, 1991). Si la condición de cristalización que ya se sabe, una pantalla estrecha se puede montar, la variación de la concentración y el pH de precipitación de todo el éxito original. El precipitante más exitoso es el polietilenglicol (PEG), seguido de sulfato de amonio. En conjunto, estos dos factores precipitantes cuenta de aproximadamente el 60% de todos los factores precipitantes macromoleculares registrado utilizados para la cristalización (Gilliland et al, 1994;. Kimber et al, 2003;.. Page et al, 2003).
- Prepare las soluciones de cristalización. Por lo general, estas condiciones se combinan de un agente de precipitación, la sal de algún tipo y un tampón para ajustar el pH. En algunos casos se pueden añadir aditivos específicamente para la proteína de interés. Todas solución madre debe ser filtrado con filtro de 0,22 micras. Algunas de la solución podría ser muy viscoso (50% PEG, glicerina, PEG-MME, etc.)
- Preparar 1.5 mL de 0.6, 0.8, 1.0, 1.2, 1.4, 1.6 M NaCl en cada una de 0,1 M pH 4,0 NaOAc, 4.3, 4.6 y 4.9 (un total de 24 soluciones)
- Descongele la muestra proteínas y mantener en hielo. Reservas de proteínas debe ser almacenadas a -80 ° C a menos que la proteína de interés es sensible a la congelación / descongelación (si es así, se almacenan a 4 ° C). Las concentraciones típicas de proteínas están en el rango de 50-50 mg / mL, con concentraciones más altas suelen dar mejores resultados.
- Girar la muestra 15min/18, 000xg / 4 ° C - algunas proteínas tienden a parcialmente agregan y precipitan tras un paso deshielo. Estos agregados pueden promover la precipitación amorfa del resto de las moléculas de proteína por lo tanto, giro completo hacia abajo se asegurará de que sólo las moléculas solubles en la muestra. Impiden que la proteína en hielo hasta la creación de la bandeja.
- Determinar la concentración de proteínas a partir de su absorbancia a 280 nm utilizando un espectrofotómetro UV. La concentración de proteína puede ser calculada a partir de la lectura y el coeficiente de absorción de la proteína extinción. El coeficiente de extinción puede ser calculado con la herramienta ProtParam en el sitio web Expasy: http://ca.expasy.org/tools/protparam.html
- Llenar los pozos de los colgantes de 24 y / sala bandeja de caída con 500 l de la solución precipitante de acuerdo con el esquema de configuración de la bandeja (Figura 2B). Crear un anillo de grasa de silicona alrededor del borde del pozo. El anillo debe tener un pequeño espacio para evitar la acumulación de presión de aire en el pozo está sellado. En forma de gotas de estar, no hay necesidad de grasa ya que el pozo está sellado con cinta adhesiva (Figura 2A).
- Tome una tapa deslizante y limpia con spray de aire condensado, o un profesional limpiar - el polvo para evitar facilitará la interpretación de la caída de la cristalización y eliminar la contaminación. Para sentarse gotas, deslice la cubierta no se utilizan. En cambio, el pozo tiene una estantería en la que se mezclan la proteína y precipitante.
- Ponga volúmenes iguales de la muestra de la proteína y la solución de reserva de la tapa deslizante. Diferentes volúmenes de la proteína y precipitante puede ser tratado como parte del proceso de optimización. El uso de más proteína que los resultados de precipitación en una concentración neta de la proteína en la caída después del equilibrio, que puede ser deseable para diluir las muestras de proteínas, y para frenar la nucleación de cristales o de crecimiento. Cualquier otra sustancia volátil en la solución de colocar también se concentrará en el mismo factor. Cuando la proteína de pipeteo y soluciones de depósito en la tapa deslizante, extremar las precauciones para evitar la formación de burbujas. A menudo, esto ocurre cuando el aire es expulsado de la pipeta.
- Colgando caída: 2 l de carga de 50 mg / ml lisozima en 0,02 M de pH 4,9 a NaOAc el centro de la tapa deslizante y añadir a 2 l de la solución de reserva.
- Sentado gota: 2 l de carga de 50 mg / ml de solución de lisozima en el centro de la plataforma y agregar a ella 2 l de solución de reserva.
- Voltear la tapa deslizante con cuidado y ponerla en el anillo de grasa en la parte superior del pozo. Presione con suavidad para que el aire puede escapar del pozo a través de la muesca de la grasa para prcaso de la acumulación de presión de aire en el pozo y mantener el bien cerrados. Acumulación de presión de aire en el pozo puede aumentar la tapa deslizante, lo que compromete el sello también. En el método de la gota sentada, cinta adhesiva transparente ópticamente transparente se utiliza para cubrir los pozos. Por lo tanto, en este método de sellado se llevará a cabo todas las filas / columnas.
- Pasar a la siguiente, así hasta que la bandeja está completa.
- Compruebe la bandeja de la configuración del - la eliminación de partículas de polvo y otros contaminantes puede reducir la identificación de falsos positivos de cristales de proteínas.
- Use una hoja de puntuación para documentar su experiencia.
- Coloque la bandeja en la temperatura de incubación deseado, por lo general entre 4 ° C y la temperatura ambiente. 20 ° C es el más exitoso. Tenga cuidado al manejar la bandeja con cuidado y evitar cualquier agitación. Tenga cuidado al abrir y cerrar la puerta de la incubadora. Vibraciones o cambios de temperatura durante el traslado o la incubación puede prevenir el crecimiento de cristales o afectar negativamente a la calidad del cristal. Un shock de material absorbente (espuma de empaque, por ejemplo) puede ser utilizado como relleno en las bandejas de cristal.
- Compruebe la bandeja de cristales al día siguiente, y luego cada pocos días, siempre el manejo de las bandejas con cuidado. Documento las conclusiones y morfologías caída de una hoja de la bandeja de puntuación específica. Los cristales suelen tardar 2-5 días en aparecer, aunque en ocasiones aparecen cristales mucho antes (casi de inmediato) o posterior (hasta varios meses!). Una vez que las condiciones de cristalización se han identificado y la tasa de crecimiento de los cristales es conocida, lo mejor es dejar las bandejas tranquilo hasta que los cristales han aparecido y crecido por lo menos a la mitad de su tamaño final. Dejando las bandejas sin perturbaciones pueden reducir el número de eventos de nucleación de cristales, por lo tanto, producir un número menor de grandes cristales.
2. Batch de procedimiento:
- Muestra de la proteína y la preparación de precipitación son como se describió anteriormente.
- Pistola de aire una bandeja batch nuevo para evitar el polvo y otras partículas grandes.
- En la bandeja de batch, llenado de aceite de parafina hasta 3 mm de alto (lo suficiente para cubrir los pozos). Eliminar el acceso de petróleo.
- Cargar una L de solución de proteína (50 mg / ml lisozima) en el aceite precargada así - asegúrese de que la solución de pipeta directamente al fondo del pozo (Figura 2).
- Cargar una L de solución precipitante en el acuerdo, así que el esquema de configuración de la bandeja (Figura 2B) - asegúrese de que la caída se hunde hasta el fondo del pozo y se funde con la gota de proteínas.
- Pasar a la siguiente, así hasta que la bandeja está completa.
- Siga los pasos 11-14 de la cortina de estar / drop procedure.
3. Los resultados representativos:
La cristalización es generalmente conocido como el cuello de botella de la cristalografía de rayos X. Una matriz dispersa incompleta pantalla factorial de las condiciones de precipitación suele producir muchos tipos diferentes de agregación de la proteína y las precipitaciones, entre ellos grandes monocristales. Si la proteína o las concentraciones de precipitación son muy altos se puede ver la materia de color marrón con forma distinta y no el tamaño (precipitación amorfa). Cuando la solución es insaturada, la caída suele ser del todo claro y carente de cualquier tipo de precipitación. La Figura 3 muestra varios ejemplos de los fenómenos de precipitación y cristales (Dessau et al., 2006). Más fenómenos de precipitación con una interpretación más detallada se puede encontrar en http://xray.bmc.uu.se/terese/tutorials.html .
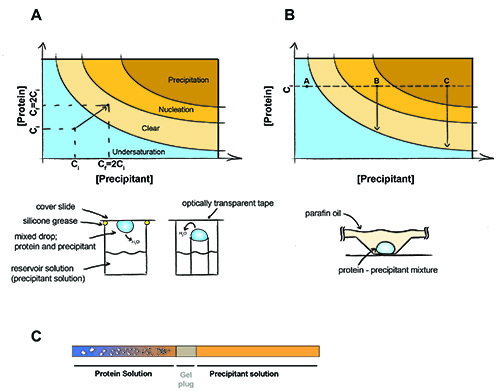
Figura 1. El principio de la cristalización de proteínas.
El principio de la cristalización de proteínas. En un experimento de difusión de vapor (A) volúmenes iguales de precipitación y las proteínas están presentes en la caída. El agua se difundirá a cabo y tanto la precipitación y la concentración de proteínas se duplicará hasta que se alcanza el equilibrio entre la gota y la solución de reserva. En la cristalización por lotes (B) de la precipitación y la concentración de proteínas no cambian durante el experimento. Punto A - proteína permanece undersaturated cristales no se pueden formar, punto B - nucleación de proteínas se producen, los cristales comenzaron a formarse y la concentración de proteínas en solución se reduce a la saturación. El punto C - proteína se precipita, pero los cristales pueden crecer todavía. (C) la cristalización de diálisis con un gel capilar conectado. Empiezan a aparecer cristales de la sal se difunde fuera de la muestra de proteína (y / o precipitante difunde en la muestra de proteína) a través del tapón de gel.
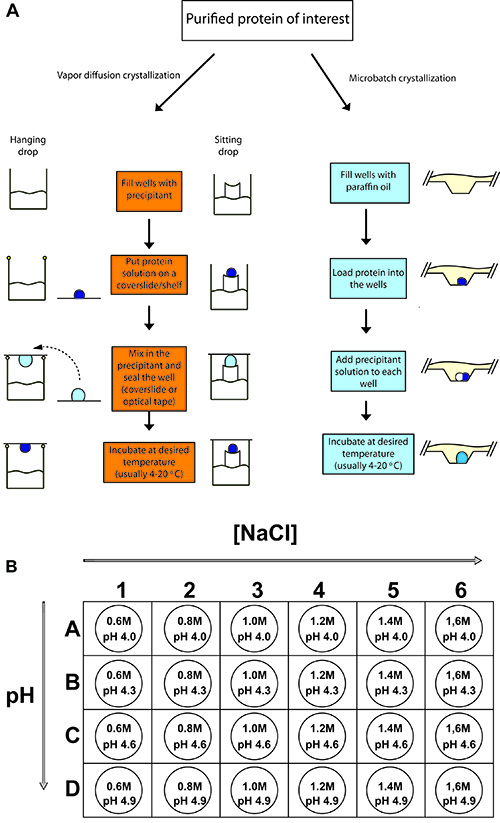
Figura 2. Esquema típico de experimentos de cristalización de proteínas.
(A) Procedimientos para colgar caída de la difusión del vapor, sentado caída de la difusión del vapor, y la cristalización de proteínas batch. En cada caso, un pequeño volumen de muestra de proteína concentrada se mezcla con un volumen igual o menor de precipitant solución y se dejó equilibrar. (B) Para la cristalización de la lisozima de pollo, una bandeja de 24 pocillos se configura con diferentes concentraciones de cloruro de sodio (la precipitación) y con 0,1 M de acetato de sodio como el tampón a pH diferentes (4,0 a 4,9).

Figura 3. Resultados típicos de un experimento de cristalización de proteínas.
(A) la precipitación amorfo. Cuando la proteína o factor precipitante (o ambos) se encuentran en alta concentración. (B) La separación de fases. Proteínas o detergentes pueden separar a una fase diferente cuando se mezcla con ciertos factores precipitantes en alta concentración. (C) los cristales en forma de barra de proteínas de AtCSN7 obtenidos en polietilenglicol 8000 y el acetato de magnesio (Dessau et al., 2006). (D) lisozima cristales obtenidos en 1,0 M NaCl y el pH de acetato de sodio 4.9. (E) En virtud de las gotas saturadas por lo general siguen siendo claras. Fotografía por Moshe Dessau.
Access restricted. Please log in or start a trial to view this content.
Resultados
Crystallization is usually referred to as the bottleneck of X-ray crystallography. A sparse matrix incomplete factorial screen of precipitating conditions typically produces many different types of protein aggregation and precipitation, among them large single crystals. If the protein or precipitant concentrations are too high one can see brown matter with no distinct shape and size (amorphous precipitation). When the solution is undersaturated, the drop will often be completely clear and devoid of any kind of precipitat...
Access restricted. Please log in or start a trial to view this content.
Discusión
En este artículo se describen y demuestran en general los protocolos actuales para la cristalización de proteínas. Ya que un procedimiento de múltiples pasos que hay algunas consideraciones hay que tener en cuenta. Cuando se trabaja con volúmenes muy pequeños (0.5-2 l), el secado de la caída debido a la evaporación es una preocupación importante. Por lo tanto, se recomienda trabajar en un entorno bien controlado (con flujo de aire de baja, alta humedad y control de la temperatura ajustada) y la adopción de una...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por un Premio al Investigador Burroughs Wellcome para YM y por una beca postdoctoral de Brown-Coxe de la Universidad de Yale a MD.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Lysozyme | Sigma-aldrich | L6876-1G | |
| 24 well VDX Plate | Hampton research | HR3-142 | |
| 24 well Cryschem Plate | Hampton research | HR3-158 | |
| Dow Corning Vacuum Grease | Hampton research | HR3-510 | |
| Siliconized glass circle coverslides | Hampton research | HR3-231 | |
| 100% paraffin oil | Hampton research | HR3-411 | |
| 1.88 inch wide Crystal Clear Sealing Tape | Hampton research | HR3-511 | |
| 96 Well Imp@ct Plate (Microbatch plate) | Hampton research | HR3-098 |
Referencias
- Bergfors, T. M. Protein crystallization : techniques, strategies, and tips : a laboratory manual. , International University Line. La Jolla, Calif. (1999).
- Carter, C. W., Carter, C. W. Protein crystallization using incomplete factorial experiments. J Biol Chem. 254, 12219-12223 (1979).
- Cudney, R., Patel, S., Weisgraber, K., Newhouse, Y., McPherson, A. Screening and optimization strategies for macromolecular crystal growth. Acta Crystallogr D Biol Crystallogr. 50, 414-423 (1994).
- Dessau, M., Chamovitz, D. A., Hirsch, J. A. Expression, purification and crystallization of a PCI domain from the COP9 signalosome subunit 7 (CSN7). Acta Crystallogr Sect F Struct Biol Cryst Commun. 62, 1138-1140 (2006).
- Gilliland, G. L., Tung, M., Blakeslee, D. M., Ladner, J. E. Biological Macromolecule Crystallization Database, Version 3.0: new features, data and the NASA archive for protein crystal growth data. Acta Crystallogr D Biol Crystallogr. 50, 408-413 (1994).
- Jancarik, J., Kim, S. H. Sparse matrix sampling: a screening method for crystallization of proteins. J Appl Cryst. 23, 409-411 (1991).
- Jancarik, J., Scott, W. G., Milligan, D. L., Koshland, D. E., Kim, S. H. Crystallization and preliminary X-ray diffraction study of the ligand-binding domain of the bacterial chemotaxis-mediating aspartate receptor of Salmonella typhimurium. J Mol Biol. 221, 31-34 (1991).
- Kimber, M. S., Vallee, F., Houston, S., Necakov, A., Skarina, T., Evdokimova, E., Beasley, S., Christendat, D., Savchenko, A., Arrowsmith, C. H. Data mining crystallization databases: knowledge-based approaches to optimize protein crystal screens. Proteins. 51, 562-568 (2003).
- Lorber, B., Sauter, C., Theobald-Dietrich, A., Moreno, A., Schellenberger, P., Robert, M. C., Capelle, B., Sanglier, S., Potier, N., Giege, R. Crystal growth of proteins, nucleic acids, and viruses in gels. Prog Biophys Mol Biol. 101, 13-25 (2009).
- McPherson, A. Crystallization of biological macromolecules. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY. (1999).
- McPherson, A. Introduction to protein crystallization. Methods. 34, 254-265 (2004).
- Page, R., Grzechnik, S. K., Canaves, J. M., Spraggon, G., Kreusch, A., Kuhn, P., Stevens, R. C., Lesley, S. A. Shotgun crystallization strategy for structural genomics: an optimized two-tiered crystallization screen against the Thermotoga maritima proteome. Acta Crystallogr D Biol Crystallogr. 59, 1028-1037 (2003).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados