È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Cristallizzazione delle proteine per la cristallografia a raggi X
In questo articolo
Riepilogo
La struttura 3-D di una molecola fornisce una comprensione unica del funzionamento molecola. Il metodo principale per la determinazione della struttura a quasi atomico risoluzione è cristallografia a raggi X. Qui, dimostra i metodi attuali per ottenere cristalli tridimensionali di qualunque macromolecola dato che sono adatti per la determinazione della struttura di cristallografia a raggi X.
Abstract
Utilizzando la struttura tridimensionale delle macromolecole biologiche di dedurre il loro funzionamento è uno dei più importanti campi della biologia moderna. La disponibilità di strutture risoluzione atomica fornisce una comprensione profonda e unica funzione della proteina, e aiuta a svelare i meccanismi interni della cellula vivente. Ad oggi, l'86% del Protein Data Bank (rcsb-PDB) le voci sono strutture macromolecolari che sono stati determinati con cristallografia a raggi X.
Per ottenere cristalli adatti per studi cristallografici, la macromolecola (ad esempio proteine, acidi nucleici, proteine-proteine o complessi di proteine-acidi nucleici complesso) deve essere purificato all'omogeneità, o il più vicino possibile alla omogeneità. L'omogeneità della preparazione è un fattore chiave per ottenere cristalli che diffrangere ad alta risoluzione (Bergfors, 1999; McPherson, 1999).
Cristallizzazione richiede portando la macromolecola di sovrasaturazione. Il campione deve quindi essere concentrati per la massima concentrazione possibile, senza causare aggregazione o precipitazione della macromolecola (di solito 2-50 mg / mL). Presentazione del campione di agente precipitante in grado di promuovere la nucleazione dei cristalli di proteine nella soluzione, che può portare a grandi tridimensionali cristalli crescente dalla soluzione. Esistono due tecniche principali per ottenere cristalli: diffusione del vapore acqueo e cristallizzazione batch. Nella diffusione del vapore, una goccia contenente una miscela di soluzioni precipitante e proteine è sigillato in una camera con precipitante puro. Il vapore acqueo diffonde poi fuori della goccia fino alla osmolarità della goccia e il precipitante sono uguali (Figura 1A). La disidratazione della goccia provoca una lenta concentrazione di proteine e precipitante fino a quando l'equilibrio è raggiunto, idealmente nella zona di nucleazione cristallina del diagramma di fase. Il metodo si basa sul lotto portando la proteina direttamente nella zona di nucleazione da proteica con la giusta quantità di precipitante (Figura 1B). Questo metodo è di solito eseguita in una paraffina / miscela olio minerale per prevenire la diffusione di acqua dalla caduta.
Qui ci dimostrano due tipi di apparato sperimentale per la diffusione del vapore, appeso goccia e goccia seduti, oltre a cristallizzazione lotto sott'olio.
Protocollo
Materiali:
- Campione di proteine - lisozima (50 mg / ml)
- Hanging goccia 24-ben vassoio
- Seduto goccia 24-ben vassoio
- Microbatch cristallizzazione 96 vassoio bene
- Soluzioni di cristallizzazione (sia commerciale disponibile o fatti in casa)
- Silicon grasso
- Siringa da 5 ml senza Luer-Lock
- Diapositive copertura siliconato
- Nastro di tenuta ottico
- Paraffina
- 0,1-2 micropipetta microlitri con bassa ritenzione suggerimenti
- Pinzetta
- Salviette professionale
1. Hanging / seduta procedura Drop:
- Per una schermata iniziale si può usare schermi disponibili in commercio che sfruttano il metodo sparse incompleta matrice fattoriale delle condizioni di prova. Il metodo sparse matrice incompleta fattoriale è distorto da e selezionati da condizioni di cristallizzazione noto per macromolecole (Carter e Carter, 1979; Cudney et al, 1994;. Jancarik e Kim, 1991;. Jancarik et al, 1991). Se la condizione cristallizzazione è già noto, un sottile schermo può essere montato, variando la concentrazione precipitante e il pH intorno al colpo originale. Il precipitante più comunemente successo è polietilene glicole (PEG), seguito da solfato di ammonio. Insieme, questi due fattori precipitanti per conto di circa il 60% di tutti i fattori precipitanti macromolecolari registrato utilizzato per la cristallizzazione (Gilliland et al, 1994;. Kimber et al, 2003;.. Page et al, 2003).
- Preparare le soluzioni di cristallizzazione. Di solito queste condizioni sono combinate da un agente precipitante, sale di qualche tipo e un buffer per impostare il pH. In alcuni casi gli additivi possono essere aggiunti specificatamente per la proteina di interesse. Tutti soluzione di riserva deve essere filtrata con filtro 0,22 micron. Alcuni della soluzione di riserva potrebbe essere molto viscoso (50% PEG, glicerolo, PEG-MME, ecc.)
- Preparare 1,5 mL di 0,6, 0,8, 1.0, 1.2, 1.4, 1.6 M NaCl ognuno a 0,1 M NaOAc pH 4.0, 4.3, 4.6 e 4.9 (totale di 24 soluzioni)
- Scongelare il campione di proteine e tenere in ghiaccio. Scorte di proteine deve essere conservato a -80 ° C, purché la proteina di interesse è sensibile a cicli di gelo / disgelo (in tal caso, conservare a 4 ° C). Concentrazioni di proteine tipiche sono nel range di 5-50 mg / ml, con concentrazioni più elevate di solito dà risultati migliori.
- Spin il campione 15min/18, 000xg / 4 ° C - alcune proteine tendono ad aggregare e precipitare in parte dopo un passo disgelo. Questi aggregati possono promuovere precipitazione amorfo del resto delle molecole proteiche, pertanto rotazione completa in basso vi assicurerà solo le molecole solubili nel campione. Tenere proteine in ghiaccio fino configurazione del vassoio.
- Determinare la concentrazione di proteine dalla sua assorbanza a 280 nm usando uno spettrofotometro UV. La concentrazione delle proteine può essere calcolato dalla lettura di assorbanza e coefficiente di estinzione della proteina. Il coefficiente di estinzione può essere calcolato con lo strumento ProtParam ExPASy sul sito: http://ca.expasy.org/tools/protparam.html
- Riempire i pozzi del 24-ben appeso / seduto vassoio goccia con 500 ml di soluzione precipitante secondo lo schema di impostazione vassoio (Figura 2B). Creare un anello di grasso al silicone intorno al bordo del pozzo. L'anello dovrebbe avere un piccolo spazio per evitare l'accumulo di pressione dell'aria, come il pozzo è sigillato. In gocce seduta, non c'è bisogno di grasso in quanto il bene è sigillato con nastro (Figura 2A).
- Prendere un vetrino coperchio e pulirlo con un getto d'aria condensata, o un professionista pulire - la polvere evitando faciliterà l'interpretazione della caduta di cristallizzazione ed eliminare contaminazioni. Per la seduta gocce, far scivolare il coperchio non vengono utilizzati. Invece, il bene contiene una mensola su cui si mescolano le proteine e precipitante.
- Mettere volumi uguali di campione proteine e soluzione serbatoio sul vetrino di copertura. Volumi diversi di proteine e precipitante può essere giudicato come parte del processo di ottimizzazione. L'utilizzo di più proteine di risultati precipitante in una netta concentrazione della proteina in calo dopo equilibrazione, che può essere auspicabile per diluire campioni di proteine, e di rallentare nucleazione cristallo o di crescita. Qualsiasi altra sostanza non volatili nella soluzione calo anche essere concentrati per lo stesso fattore. Quando la proteina pipettaggio e soluzioni serbatoio sul vetrino di copertura, essere estremamente attenti ad evitare la formazione di bolle. Ciò si verifica spesso quando l'aria è soffiata fuori della pipetta.
- Hanging goccia: Carico 2 ml di 50 mg / ml di lisozima a pH 0,02 M NaOAc 4,9 al centro della diapositiva coperchio e aggiungere a questa 2 microlitri della soluzione del serbatoio.
- Seduto goccia: Carico 2 ml di 50 mg / ml soluzione di lisozima al centro del ripiano e aggiungere it 2 ml di soluzione di riserva.
- Capovolgere il vetrino di copertura e adagiarla delicatamente verso il basso l'anello di grasso sulla parte superiore del pozzo. Premere delicatamente in modo che l'aria possa sfuggire al bene attraverso la tacca nel grasso di prcaso l'accumulo di pressione nel pozzo e mantenere il ben chiusi. L'accumulo di pressione dell'aria nel pozzo può aumentare il vetrino di copertura, compromettendo la tenuta bene. Nel metodo goccia seduta, otticamente chiaro nastro trasparente viene utilizzato per coprire i pozzi. Quindi, in questo metodo di tenuta si svolgeranno ogni riga / colonna.
- Passare al successivo e fino cassetto è completo.
- Controllare il vassoio al momento della configurazione - eliminando le particelle di polvere e altre contaminazioni in grado di ridurre l'identificazione falsi positivi dei cristalli proteici.
- Utilizzare un foglio di punteggio per documentare l'esperimento.
- Posizionare il vassoio alla temperatura di incubazione desiderata, generalmente tra i 4 ° C e temperatura ambiente. 20 ° C è più comunemente successo. Fare attenzione a maneggiare il vassoio con delicatezza ed evitare qualsiasi agitazione. Prestare attenzione durante l'apertura e la chiusura della porta dell'incubatore. Vibrazioni o variazioni di temperatura durante il trasferimento o l'incubazione, può impedire la crescita dei cristalli o incidere negativamente sulla qualità di cristallo. Una scossa materiale assorbente (ad esempio: imballaggio schiuma) possono essere utilizzati come imbottiture sotto i vassoi di cristallo.
- Controllare il vassoio per cristalli il giorno successivo, e poi ogni pochi giorni, sempre la movimentazione dei vassoi con cura. Documento tutte le risultanze e morfologie goccia in un foglio specifico punteggio vassoio. Cristalli di solito prendono 2-5 giorni a comparire, anche se a volte i cristalli appaiono molto prima (quasi immediatamente) o versione successiva (fino a diversi mesi!). Una volta che le condizioni di cristallizzazione sono stati identificati e il tasso di crescita dei cristalli è noto, è meglio lasciare i vassoi indisturbato fino a quando i cristalli sono apparsi e cresciuto ad almeno la metà della loro dimensione finale. Lasciando indisturbati i vassoi in grado di ridurre il numero di eventi di nucleazione cristallo, producendo quindi un numero inferiore di grandi cristalli.
2. Microbatch procedura:
- Campione di proteine e la preparazione sono precipitanti come descritto sopra.
- Air spruzzare un vassoio microbatch nuovo per evitare la polvere e altre particelle di grandi dimensioni.
- Nella barra delle applicazioni microbatch, riempire l'olio di paraffina fino a 3 mm di altezza (quanto basta per coprire i pozzi). Rimuovere l'accesso del petrolio.
- Carico di 1 ml di soluzione proteica (50 mg / mL lisozima) nell'olio pre-riempita bene - assicurarsi di pipetta la soluzione direttamente al fondo del pozzo (Figura 2A).
- Carico di 1 ml di soluzione precipitante nel pozzo secondo lo schema di impostazione vassoio (Figura 2B) - assicurarsi che la goccia scende sul fondo del pozzo e si fonde con la goccia proteine.
- Passare al successivo e fino cassetto è completo.
- Seguire i passi 11-14 del pensile / seduto procedura goccia.
3. Rappresentante dei risultati:
Cristallizzazione è generalmente indicato come il collo di bottiglia della cristallografia a raggi X. Un sparse schermo a matrice incompleta fattoriale delle condizioni precipitanti produce tipicamente diversi tipi di aggregazione delle proteine e delle precipitazioni, tra i quali grandi cristalli singoli. Se la proteina o precipitante concentrazioni troppo elevate si può vedere la materia marrone senza forma e dimensioni diverse (precipitazioni amorfo). Quando la soluzione è sottosaturato, il calo sarà spesso del tutto chiaro e privo di qualsiasi tipo di precipitazione. La Figura 3 mostra alcuni esempi di fenomeni di precipitazione e cristalli (Dessau et al., 2006). Fenomeni di precipitazione di più con l'interpretazione più dettagliate sono disponibili all'indirizzo http://xray.bmc.uu.se/terese/tutorials.html .
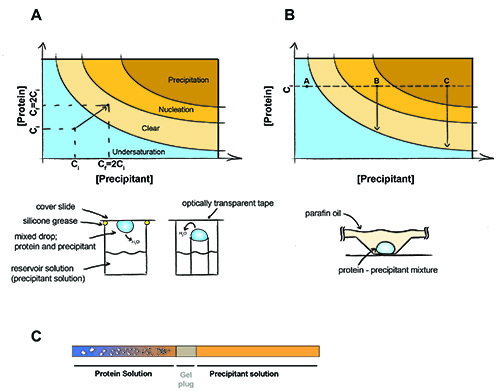
Figura 1. Il principio di cristallizzazione delle proteine.
Il principio di cristallizzazione delle proteine. In un esperimento di diffusione del vapore (A) volumi uguali di precipitante e proteine sono presenti nel menu. L'acqua si diffonderà fuori e sia il precipitante e la concentrazione delle proteine sarà raddoppiata fino a quando l'equilibrio è raggiunto tra la caduta e la soluzione serbatoio. In cristallizzazione batch (B) la concentrazione di proteine e precipitante non cambiano durante l'esperimento. Punto A - Proteine soggiorni sottosaturato non cristalli si possono formare, punto B - nucleazione proteine si verifica, cristalli iniziò a formarsi e la concentrazione di proteine in soluzione scende a saturazione. Punto C - proteina precipita, ma i cristalli può ancora crescere. (C) cristallizzazione dialisi utilizzando un gel inserito capillare. Di cristalli come il sale diffonde fuori il campione (e / o diffonde precipitante nel campione di proteine) attraverso la spina gel.
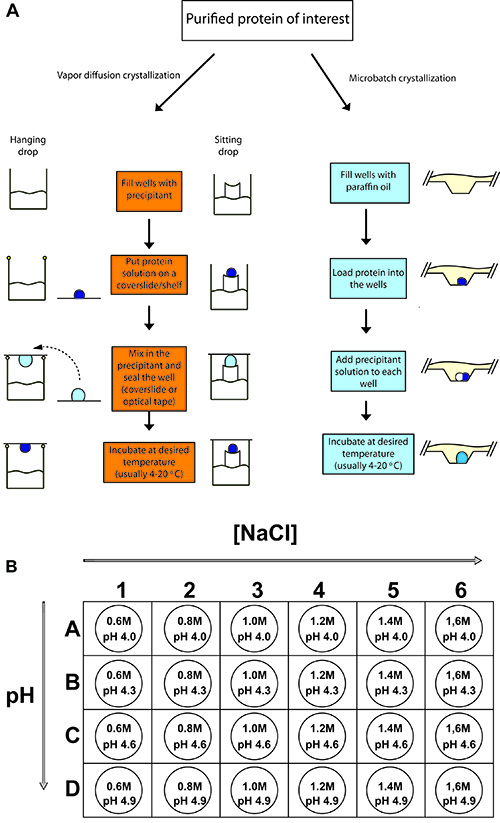
Figura 2. Schema di esperimenti tipici cristallizzazione delle proteine.
(A) Le procedure per la sospensione goccia diffusione del vapore, seduto goccia diffusione del vapore, e la cristallizzazione delle proteine microbatch. In ogni caso, un piccolo volume di campione di proteine concentrate viene mescolato con un volume uguale o minore di precipitant soluzione e lasciato equilibrare. (B) Per la cristallizzazione di pollo lisozima, un 24-ben vassoio è impostato con varie concentrazioni di cloruro di sodio (il precipitante) e con 0,1 M di acetato di sodio, come il buffer a pH diversi (4,0-4,9).

Figura 3. Risultati tipici di un esperimento di cristallizzazione delle proteine.
(A) precipitazione amorfo. Quando le proteine o precipitanti (o entrambi) sono in alta concentrazione. (B) separazione di fase. Proteine o di detersivo può separare ad una fase diversa quando mescolato con alcuni fattori precipitanti ad alta concentrazione. (C) i cristalli proteici Rod a forma di AtCSN7 ottenuto in polietilene glicole 8000 e acetato di magnesio (Dessau et al., 2006). (D) cristalli di lisozima ottenuto in 1,0 M di NaCl e sodio acetato pH 4.9. (E) In gocce saturi di solito rimangono chiare. Fotografia di Moshe Dessau.
Risultati
Crystallization is usually referred to as the bottleneck of X-ray crystallography. A sparse matrix incomplete factorial screen of precipitating conditions typically produces many different types of protein aggregation and precipitation, among them large single crystals. If the protein or precipitant concentrations are too high one can see brown matter with no distinct shape and size (amorphous precipitation). When the solution is undersaturated, the drop will often be completely clear and devoid of any kind of precipitat...
Discussione
In questo articolo descrivere e dimostrare generali attuali protocolli per la cristallizzazione della proteina. Dal momento che un multi-step procedura ci sono alcune considerazioni bisogna essere a conoscenza. Quando si lavora con volumi molto piccoli (0,5-2 mL), essiccazione della caduta a causa dell'evaporazione è una preoccupazione importante. Pertanto, si raccomanda di lavorare in un ambiente ben controllato (con flusso aria bassa, alta umidità e controllo della temperatura stretto) e di adottare una tecnica ...
Divulgazioni
Riconoscimenti
Questo lavoro è stato supportato da una Investigator Award Burroughs Wellcome a YM e da un Brown-Coxe borsa post-dottorato presso la Yale University a MD.
Materiali
| Name | Company | Catalog Number | Comments | |
| New Item | ||||
| Lysozyme | Sigma-aldrich | L6876-1G | ||
| 24 well VDX Plate | Hampton research | HR3-142 | ||
| 24 well Cryschem Plate | Hampton research | HR3-158 | ||
| Dow Corning Vacuum Grease | Hampton research | HR3-510 | ||
| Siliconized glass circle coverslides | Hampton research | HR3-231 | ||
| 100% paraffin oil | Hampton research | HR3-411 | ||
| 1.88 inch wide Crystal Clear Sealing Tape | Hampton research | HR3-511 | ||
| 96 Well Imp@ct Plate (Microbatch plate) | Hampton research | HR3-098 |
Riferimenti
- Bergfors, T. M. . Protein crystallization : techniques, strategies, and tips : a laboratory manual. , (1999).
- Carter, C. W., Carter, C. W. Protein crystallization using incomplete factorial experiments. J Biol Chem. 254, 12219-12223 (1979).
- Cudney, R., Patel, S., Weisgraber, K., Newhouse, Y., McPherson, A. Screening and optimization strategies for macromolecular crystal growth. Acta Crystallogr D Biol Crystallogr. 50, 414-423 (1994).
- Dessau, M., Chamovitz, D. A., Hirsch, J. A. Expression, purification and crystallization of a PCI domain from the COP9 signalosome subunit 7 (CSN7). Acta Crystallogr Sect F Struct Biol Cryst Commun. 62, 1138-1140 (2006).
- Gilliland, G. L., Tung, M., Blakeslee, D. M., Ladner, J. E. Biological Macromolecule Crystallization Database, Version 3.0: new features, data and the NASA archive for protein crystal growth data. Acta Crystallogr D Biol Crystallogr. 50, 408-413 (1994).
- Jancarik, J., Kim, S. H. Sparse matrix sampling: a screening method for crystallization of proteins. J Appl Cryst. 23, 409-411 (1991).
- Jancarik, J., Scott, W. G., Milligan, D. L., Koshland, D. E., Kim, S. H. Crystallization and preliminary X-ray diffraction study of the ligand-binding domain of the bacterial chemotaxis-mediating aspartate receptor of Salmonella typhimurium. J Mol Biol. 221, 31-34 (1991).
- Kimber, M. S., Vallee, F., Houston, S., Necakov, A., Skarina, T., Evdokimova, E., Beasley, S., Christendat, D., Savchenko, A., Arrowsmith, C. H. Data mining crystallization databases: knowledge-based approaches to optimize protein crystal screens. Proteins. 51, 562-568 (2003).
- Lorber, B., Sauter, C., Theobald-Dietrich, A., Moreno, A., Schellenberger, P., Robert, M. C., Capelle, B., Sanglier, S., Potier, N., Giege, R. Crystal growth of proteins, nucleic acids, and viruses in gels. Prog Biophys Mol Biol. 101, 13-25 (2009).
- McPherson, A. . Crystallization of biological macromolecules. , (1999).
- McPherson, A. Introduction to protein crystallization. Methods. 34, 254-265 (2004).
- Page, R., Grzechnik, S. K., Canaves, J. M., Spraggon, G., Kreusch, A., Kuhn, P., Stevens, R. C., Lesley, S. A. Shotgun crystallization strategy for structural genomics: an optimized two-tiered crystallization screen against the Thermotoga maritima proteome. Acta Crystallogr D Biol Crystallogr. 59, 1028-1037 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon