Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
X-ray Kristalografi Protein Kristalizasyon
Bu Makalede
Özet
3-D bir molekül yapısı molekül fonksiyonları nasıl eşsiz bir anlayış sağlar. Yakın atomik çözünürlükte yapı tespiti için temel yöntem, X-ışını kristalografisi. Burada, X-ışını kristalografisi yapı tayini için uygun olan herhangi bir makromolekül üç boyutlu kristaller elde etmek için mevcut yöntemler göstermektedir.
Özet
Nasıl işlediğini anlaması için biyolojik makromoleküllerin üç boyutlu yapısını kullanarak, modern biyolojinin en önemli alanlarından biridir. Atomik çözünürlükte yapıların durumu derin ve benzersiz bir protein fonksiyonunun anlaşılmasını sağlar ve canlı bir hücrenin iç işleyişini aydınlatmak için yardımcı olur. Bugüne kadar,% 86 Protein Data Bank (rcsb PDB) girişleri makromoleküler yapıları X-ışını kristalografisi kullanılarak belirlenmiştir.
Kristalografik çalışmalar için uygun kristaller elde etmek için, makromolekül (örneğin protein, nükleik asit, protein-protein kompleksi ya da protein, nükleik asit kompleksi) homojenlik arıtılmış olmalıdır, ya da mümkün olduğunca yakın homojenliği için. Hazırlık homojenliği (McPherson, 1999 Bergfors, 1999) yüksek çözünürlüklü metodla kristaller elde edilmesinde önemli bir faktördür.
Kristalizasyon doygunluk makromolekül getiren gerektirir. Bu nedenle, örnek makromolekül (genellikle 2-50 mg / ml) agregasyonu veya yağış neden olmadan, mümkün olan en yüksek konsantrasyon konsantre olmalıdır. Presipite ajan örnek Tanıtımı çözüm büyüyen büyük üç boyutlu kristaller neden olabilir çözüm, protein kristalleri çekirdeklenme teşvik edebilir. Buharı difüzyon ve toplu kristalizasyon: kristaller elde etmek için iki ana teknikleri vardır. Buharı difüzyon, yağışlı ve protein çözümleri bir karışımını içeren bir damla saf Yağışlı bir odaya kapatılır. Damla ve yağışlı ozmolarite (Şekil 1A) eşit oluncaya kadar su buharı sonra açılan yayılır. Denge sağlanana kadar açılan dehidratasyon faz diyagramı ideal kristal çekirdeklenme bölgesi, hem de protein ve yağışlı yavaş bir konsantrasyon neden olur. Yağışlı (Şekil 1B) uygun miktarda protein ile karıştırma protein tarafından doğrudan çekirdeklenme bölgeye getirerek toplu yöntemi dayanıyor. Bu yöntem genellikle, açılan suyun yayılmasını önlemek için bir parafin / mineral yağ karışımı altında yapılır.
Burada yağ altında toplu kristalizasyon ek olarak, damla ve oturma damla asılı buharı difüzyon için deney düzeneği iki türlü gösterecektir.
Protokol
Malzemeler:
- Protein örnek - Lizozim (50 mg / ml)
- Bırak 24-iyi tepsi Asma
- Oturma açılan 24 kuyu tepsisi
- Microbatch kristalizasyon 96 tepsi
- Kristalizasyon çözümler (ya ticari ya da ev yapımı)
- Silikon yağ
- Luer-lock olmadan 5 ml şırınga
- Silikonlu kapak kızakları
- Optik sızdırmazlık bantı
- Parafin
- 0,1-2 mcL mikropipet düşük tutma ipuçları
- Cımbız
- Profesyonel mendil
1. Asma / Bırak Prosedürü oturan:
- Bir başlangıç ekranı için bir deneme koşulları seyrek matris eksik faktöriyel yöntemi istismar piyasada bulunan ekranlar kullanabilirsiniz. Seyrek matris eksik faktöriyel yöntemi önyargılı ve makromoleküller için bilinen kristalizasyon koşulları (Carter ve Carter, 1979; Cudney ve ark, 1994; Jancarik ve Kim, 1991; Jancarik ve ark, 1991) seçilir. Kristalleşme durumu zaten bilinen ise, orijinal hit etrafında Yağışlı konsantrasyon ve pH değişen dar bir ekran monte edilebilir. En sık başarılı Yağışlı polietilen glikol (PEG), amonyum sülfat. Birlikte, kristalizasyon (Gilliland ve ark, 1994; Kimber ve ark, 2003; Page ve ark, 2003) için kullanılan tüm kaydedilen makromoleküler precipitants yaklaşık% 60 için bu iki precipitants hesap.
- Kristalizasyon çözümler hazırlayın. Genellikle bu koşulları presipite edici bir ajan, bir tür tuz ve pH ayarlamak için bir tampon birleştirilir. Bazı durumlarda katkı için özel ilgi protein eklenebilir. Tüm stok solüsyonu 0.22 mikron filtre kullanılarak filtre edilmelidir. Bazı stok solüsyonu (% 50 PEG, gliserol, PEG-MME, vb) çok viskoz olabilir.
- 1,5 mL 0.6, 0.8, 1.0, 1.2, 1.4, 1.6, 0.1 M NaOAc pH 4.0, 4.3, 4.6 ve 4.9 M NaCl (toplam 24 çözümleri) her hazırlayın
- Protein örnek çözülme ve buz üzerinde tutmak. Protein hisse senetleri, faiz protein (eğer böyleyse, mağaza, 4 ° C) donma / çözülme duyarlı sürece -80 ° C'de muhafaza edilmelidir. Tipik protein konsantrasyonları yüksek konsantrasyonlarda genellikle daha iyi sonuçlar veren, 5-50 mg / ml aralığında.
- Bazı proteinler kısmi bir çözülme adımdan sonra agrega ve çökelti eğilimindedir - 15min/18, 000xg / 4 ° C örnek Spin. Bu rakamlar, bu nedenle ayrıntılı bir dönüş örnek sadece çözünür moleküller sağlayacak protein molekülleri, geri kalanı amorf yağış teşvik edebilir. Tepsi kadar buz üzerinde protein tutun.
- UV spektrofotometre ile 280 nm dalga boyunda absorbans gelen protein konsantrasyonu belirleyin. Protein konsantrasyonu absorbans okuma ve protein yok katsayısı hesaplanabilir. : Yok katsayısı EXPASY web sitesinde ProtParam aracı ile hesaplanır. http://ca.expasy.org/tools/protparam.html
- 24-iyi asılı / damla tepsi tepsi kurulum şeması (Şekil 2B) göre Yağışlı çözüm 500 mcL oturan kuyu doldurun. Kuyunun kenarında bir silikon gres halka oluşturun. Halka iyi mühürlü olarak hava basıncı oluşumunu önlemek için küçük bir boşluk olmalıdır. Damla oturan, iyi (Şekil 2A) bandı ile mühürlenir beri gres gerek yoktur.
- Bir kapak slayt atın ve yoğun hava spreyi ya da silin profesyonel bir temiz kaçınarak toz kristalizasyon damla yorumlama kolaylığı ve kontaminasyonların ortadan kaldıracaktır. Damla oturma için, kapağını kaydırarak kullanılmaz. Bunun yerine, iyi bir protein ve yağışlı karışık olduğu bir raf bulunur.
- Kapak slayt örnek protein ve rezervuar çözümü eşit miktarda koyun. Farklı miktarda protein ve yağışlı optimizasyon sürecinin parçası olarak denenebilir. Seyreltik protein örneklerinin için arzu edilebilir, ve kristal çekirdeklenme veya büyüme yavaş dengeleme sonra açılan, protein net bir konsantrasyon Yağışlı sonuçlar daha fazla protein kullanılması. Açılan çözümü diğer herhangi bir kalıcı madde de aynı faktör tarafından konsantre olacaktır. Kapak slayt üzerine protein ve rezervuar çözümleri pipetleme, kabarcık oluşumunu önlemek için son derece dikkatli olun. Bu genellikle hava pipetin üflenir oluşur.
- 0.02 M NaOAc pH 4.9 50 mg / ml lizozim Yük 2 mcL kapak slayt merkezi ve rezervuar çözüm 2 mcL ekleyin: damla Hanging.
- Damla Oturma: Yük 2 raf merkezine 50 mg / ml lizozim çözüm mcL ve rezervuar çözüm 2 mcL ekleyin.
- Yavaşça kapağını kaydırarak çevirin ve kuyunun üstüne yağ halkası üzerine uzandı. Pr yağ içinde hafifçe hava yoluyla iyi çentik kaçabilir bastırınolay hava basıncı birikimi ve iyi tutmak iyi mühürlenir. Hava basıncı oluşumunu iyi, iyi mühür ödün, kapağı kaydırın artırabilirsiniz. Oturma bırak yöntemi, optik saydam bant kuyuları kapatmak için kullanılmaktadır. Bu nedenle, bu yöntem sızdırmazlık, her satır / sütun yer alacak.
- Tepsi tamamlanana kadar bir sonraki iyi geçin.
- Kurulum üzerine tepsisini kontrol edin, toz parçacıkları ve diğer kirlilikler ortadan kaldırarak protein kristalleri yanlış pozitif kimlik azaltabilir.
- Denemenizi belge için bir puanlama tablosu kullanın.
- Genellikle 4 ° C ve oda sıcaklığı arasında, istenen inkübasyon sıcaklığında tepsiye yerleştirin. 20 ° C, en sık başarılı. Tepsi hafifçe ele almak ve herhangi bir sallayarak önlemek için özen gösterin. Inkübatör kapı açılış ve kapanış ederken dikkatli olun. Transfer veya inkübasyon sırasında titreşim veya sıcaklık değişiklikleri, kristal büyümesini önlemek veya kristal kalitesini olumsuz etkileyebilir. Bir şok emici malzeme (örneğin ambalaj köpük) kristal tepsileri altında dolgu olarak kullanılabilir.
- Kristalleri için tepsi ertesi gün kontrol edin ve sonra her birkaç gün, her zaman dikkatli tepsileri taşıma. Bir tepsi özel puanlama sayfasında herhangi bir bulgu ve bırak morfolojileri Belge. Kristalleri bazen çok daha erken (hemen) veya sonra (birkaç ay kadar!) Görünmekle beraber Kristaller genellikle görünür, 2-5 gün sürebilir. Kristalizasyon koşulları tespit edilmiştir ve kristallerin büyüme oranı bilinmektedir sonra kristaller ortaya çıktı ve son boyutu en az yarısının büyüdü kadar, tepsiler rahatsız bırakmak en iyisidir. Tepsileri rahatsız bırakmak, dolayısıyla daha az sayıda daha büyük kristaller üreten, kristal çekirdeklenme olayların sayısını azaltabilir.
2. Prosedür Microbatch:
- Protein örnek ve yağışlı hazırlık yukarıda açıklandığı gibi.
- Hava püskürtme yeni bir microbatch tepsisi, toz ve diğer büyük parçacıklar önlemek için.
- Microbatch tepsi, 3 mm yüksekliğinde (kuyuları kapsayacak şekilde yeterli) parafin yağı doldurun. Petrol erişimi kaldırın.
- Önceden doldurulmuş, yağ, protein solüsyonu (50 mg / ml lizozim) 1 mcL Yük iyi alt (Şekil 2A) doğrudan çözüm pipetle emin olun.
- Açılan protein damlacık ile, iyi ve sigortalar alt lavabolar emin olun iyi tepsi kurulum şeması (Şekil 2B) göre 1 mcL Yağışlı çözüm yükleyin.
- Tepsi tamamlanana kadar yanında iyi gider.
- Asılı / bırak işlemi oturan 11-14 adımları.
3. Temsilcisi Sonuçlar:
Kristalizasyon, genellikle X-ışını kristalografisi darboğaz olarak adlandırılır. Presipite koşullar seyrek matris eksik faktöriyel ekran genellikle büyük tek kristalleri arasında, protein agregasyonu ve yağış, birçok farklı türde üretir. Protein veya Yağışlı konsantrasyonları çok yüksek bir hiç farklı şekil ve boyut (amorf yağış) ile kahverengi madde görebilirsiniz. Çözüm doymuş olduğunda, açılan genellikle yağış her türlü açık ve tamamen yoksun olacaktır. Şekil 3 yağış olayları ve kristaller (Dessau ve ark, 2006) için çeşitli örnekler gösterir. Daha detaylı yorumlanması ile ilgili daha fazla yağış fenomen http://xray.bmc.uu.se/terese/tutorials.html adresinde bulunabilir .
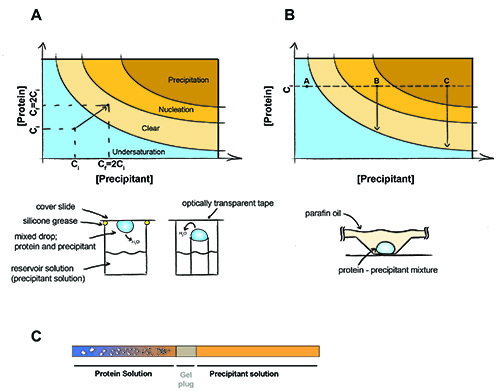
Şekil 1. Protein kristalizasyon ilkesi.
Protein kristalizasyon ilkesi. Buharı difüzyon deneyi (A), yağışlı ve protein eşit hacimlerde açılan bulunmaktadır. Su dışına dağılacaktır ve damla ve rezervuar çözüm arasındaki denge sağlanana kadar yağışlı ve protein konsantrasyonu iki katına çıkarılacaktır. Toplu kristalizasyon (B) Yağışlı ve deney sırasında protein konsantrasyonu değişmez. A Noktası - Protein kristalleri, B noktası oluşmuş olabilir doymuş kalır - Protein çekirdeklenme meydana gelen, kristaller oluşmaya başladı çözüm protein konsantrasyonu ve doygunluk düşer. Nokta C - Protein çökeltileri, ama kristalleri hala büyümek. (C) kullanarak Diyaliz kristalizasyon kapiller jel-takılı. Kristaller tuz jel fiş boyunca (ve / veya Yağışlı yayılır protein örnek içine) protein örnek yayılır gibi görünür.
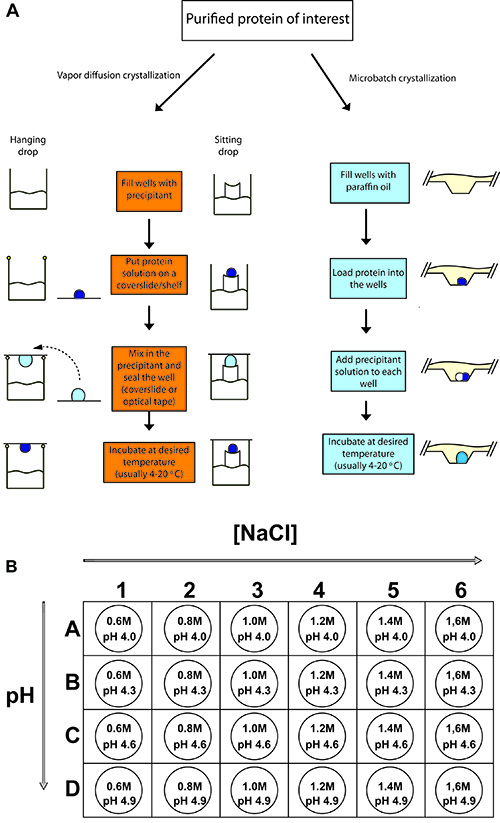
Şekil 2. Anahat tipik bir protein kristalizasyon deneyler.
(A), damla buharı difüzyon asılı damla buharı difüzyon oturan ve microbatch protein kristalizasyon Prosedürler. Her iki durumda da, konsantre protein örnek bir küçük hacimli precipitan eşit veya daha küçük hacmi ile karıştırılır.t çözüm ve denge sağlaması için izin. (B), 24-iyi bir tepsi tavuk lizozim kristalizasyon için değişik konsantrasyonlarda sodyum klorür (Yağışlı) ve çeşitli pH tampon olarak 0.1 M sodyum asetat (4.0 - 4.9) ile ayarlanır.

Şekil 3. Tipik bir protein kristalizasyon deney sonuçları.
(A) Amorf yağış. Protein veya yağışlı (veya her ikisi), yüksek konsantrasyonda olduğu zaman. (B) faz ayrılması. Protein veya deterjan yüksek konsantrasyonda bazı precipitants ile karıştırılarak farklı bir faz için ayrı olabilir. (C) AtCSN7 Rod şekilli protein kristalleri polietilen glikol 8000 ve elde edilen magnezyum asetat (Dessau ve ark, 2006). (D) Lizozim kristallerinin 1.0 M NaCl ve sodyum asetat pH 4.9 aldı. (E) doymuş damla altında genellikle açık kalır. Moşe Dessau Fotoğraf.
Sonuçlar
Crystallization is usually referred to as the bottleneck of X-ray crystallography. A sparse matrix incomplete factorial screen of precipitating conditions typically produces many different types of protein aggregation and precipitation, among them large single crystals. If the protein or precipitant concentrations are too high one can see brown matter with no distinct shape and size (amorphous precipitation). When the solution is undersaturated, the drop will often be completely clear and devoid of any kind of precipitat...
Tartışmalar
Bu yazıda, protein kristalizasyon için genel geçerli protokolleri anlatmak ve göstermek. Çok aşamalı bir prosedür bu yana birkaç düşünceler farkında olmak bir ihtiyacı vardır. Buharlaşma nedeniyle açılan kuruma (0.5-2 mcL), çok küçük hacimleri ile çalışırken, büyük bir endişe. Bu nedenle, iyi-kontrollü bir ortamda çalışmak (düşük hava akımı, yüksek nem ve sıkı sıcaklık kontrolü ile) ve açık havaya açılan maruz kalma en aza indiren bir tekniktir benimsemeye tavsiye edilir. ...
Açıklamalar
Teşekkürler
Bu çalışma bir Burroughs Wellcome YM Araştırmacı Ödülü ve MD, Yale Üniversitesi'nde Brown-Coxe Doktora Sonrası Araştırma Bursu ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Lysozyme | Sigma-aldrich | L6876-1G | |
| 24 well VDX Plate | Hampton research | HR3-142 | |
| 24 well Cryschem Plate | Hampton research | HR3-158 | |
| Dow Corning Vacuum Grease | Hampton research | HR3-510 | |
| Siliconized glass circle coverslides | Hampton research | HR3-231 | |
| 100% paraffin oil | Hampton research | HR3-411 | |
| 1.88 inch wide Crystal Clear Sealing Tape | Hampton research | HR3-511 | |
| 96 Well Imp@ct Plate (Microbatch plate) | Hampton research | HR3-098 |
Referanslar
- Bergfors, T. M. . Protein crystallization : techniques, strategies, and tips : a laboratory manual. , (1999).
- Carter, C. W., Carter, C. W. Protein crystallization using incomplete factorial experiments. J Biol Chem. 254, 12219-12223 (1979).
- Cudney, R., Patel, S., Weisgraber, K., Newhouse, Y., McPherson, A. Screening and optimization strategies for macromolecular crystal growth. Acta Crystallogr D Biol Crystallogr. 50, 414-423 (1994).
- Dessau, M., Chamovitz, D. A., Hirsch, J. A. Expression, purification and crystallization of a PCI domain from the COP9 signalosome subunit 7 (CSN7). Acta Crystallogr Sect F Struct Biol Cryst Commun. 62, 1138-1140 (2006).
- Gilliland, G. L., Tung, M., Blakeslee, D. M., Ladner, J. E. Biological Macromolecule Crystallization Database, Version 3.0: new features, data and the NASA archive for protein crystal growth data. Acta Crystallogr D Biol Crystallogr. 50, 408-413 (1994).
- Jancarik, J., Kim, S. H. Sparse matrix sampling: a screening method for crystallization of proteins. J Appl Cryst. 23, 409-411 (1991).
- Jancarik, J., Scott, W. G., Milligan, D. L., Koshland, D. E., Kim, S. H. Crystallization and preliminary X-ray diffraction study of the ligand-binding domain of the bacterial chemotaxis-mediating aspartate receptor of Salmonella typhimurium. J Mol Biol. 221, 31-34 (1991).
- Kimber, M. S., Vallee, F., Houston, S., Necakov, A., Skarina, T., Evdokimova, E., Beasley, S., Christendat, D., Savchenko, A., Arrowsmith, C. H. Data mining crystallization databases: knowledge-based approaches to optimize protein crystal screens. Proteins. 51, 562-568 (2003).
- Lorber, B., Sauter, C., Theobald-Dietrich, A., Moreno, A., Schellenberger, P., Robert, M. C., Capelle, B., Sanglier, S., Potier, N., Giege, R. Crystal growth of proteins, nucleic acids, and viruses in gels. Prog Biophys Mol Biol. 101, 13-25 (2009).
- McPherson, A. . Crystallization of biological macromolecules. , (1999).
- McPherson, A. Introduction to protein crystallization. Methods. 34, 254-265 (2004).
- Page, R., Grzechnik, S. K., Canaves, J. M., Spraggon, G., Kreusch, A., Kuhn, P., Stevens, R. C., Lesley, S. A. Shotgun crystallization strategy for structural genomics: an optimized two-tiered crystallization screen against the Thermotoga maritima proteome. Acta Crystallogr D Biol Crystallogr. 59, 1028-1037 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır