Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Cristallisation des protéines pour la cristallographie aux rayons X
Dans cet article
Résumé
La structure 3-D d'une molécule donne une compréhension unique de la façon dont les fonctions molécule. La principale méthode de détermination de la structure au quasi-atomique résolution est cristallographie aux rayons X. Ici, nous montrons les méthodes actuelles pour l'obtention de trois dimensions des cristaux de toute macromolécule donnée qui conviennent pour la détermination de structure par cristallographie aux rayons X.
Résumé
Utilisation de la structure tridimensionnelle des macromolécules biologiques de déduire comment ils fonctionnent est l'un des domaines les plus importants de la biologie moderne. La disponibilité des structures de résolution atomique fournit une compréhension profonde et unique de la fonction des protéines, et les aide à démêler les rouages internes de la cellule vivante. À ce jour, 86% de la Protein Data Bank (RCSB-PDB) sont entrées structures macromoléculaires qui ont été déterminés en utilisant cristallographie aux rayons X.
Pour obtenir des cristaux appropriés pour des études cristallographiques, la macromolécule (par exemple protéines, acides nucléiques, protéines-protéines complexes ou de protéines nucléiques complexes acide) doit être purifiée à l'homogénéité, ou aussi près que possible de l'homogénéité. L'homogénéité de la préparation est un facteur clé dans l'obtention de cristaux qui diffractent à haute résolution (Bergfors, 1999; McPherson, 1999).
Cristallisation nécessite apportant la macromolécule à la sursaturation. L'échantillon devrait donc être concentré à la concentration la plus élevée possible sans causer d'agrégation ou une précipitation de la macromolécule (généralement 20 à 50 mg / mL). Présentation de l'échantillon à l'agent de précipitation peut favoriser la nucléation des cristaux de protéines dans la solution, qui peut résulter en grande en trois dimensions la croissance de cristaux de la solution. Il existe deux techniques principales pour obtenir des cristaux: la diffusion de vapeur et de la cristallisation par lots. Dans la diffusion de vapeur, une goutte contenant un mélange de solutions précipitant et de protéine est scellé dans une chambre avec précipitant pur. La vapeur d'eau diffuse alors hors de la baisse jusqu'à ce que l'osmolarité de la goutte et le précipitant sont égaux (figure 1A). La déshydratation de la chute provoque une lente concentration de protéines et de précipitant jusqu'à ce qu'un équilibre soit atteint, idéalement dans la zone de nucléation des cristaux du diagramme de phase. La méthode repose sur lots portant les protéines directement dans la zone de nucléation par la protéine de mélange avec la quantité appropriée de précipitant (figure 1B). Cette méthode est généralement réalisée sous une paraffine / mélange d'huile minérale afin de prévenir la diffusion de l'eau hors de la goutte.
Ici, nous allons montrer deux types de montage expérimental pour la diffusion de vapeur, goutte suspendue et déposer assis, en plus de la cristallisation par lots dans l'huile.
Protocole
Matériaux:
- Échantillon de protéine - lysozyme (50 mg / ml)
- Goutte suspendue de 24 puits Bac
- Assis chute de 24 puits, Bac
- Cristallisation Microbatch 96 plateau bien
- Solutions de cristallisation (soit commerciales disponibles ou fait maison)
- Graisse silicone
- Seringue de 5 mL sans luer-lock
- Diapositives couvrent siliconé
- Ruban adhésif optique
- Paraffine
- 0,1 à 2 uL micropipette avec une faible rétention de conseils
- Pince à épiler
- Lingettes professionnel
1. Accrochage / assis procédure Drop:
- Pour un premier écran, on peut utiliser des écrans disponibles dans le commerce qui exploitent la matrice creuse incomplète méthode factorielle des conditions d'essai. La matrice creuse incomplète méthode factorielle est biaisée par et choisi parmi les conditions de cristallisation connus pour des macromolécules (Carter et Carter, 1979; Cudney et al, 1994;. Jancarik et Kim, 1991;. Jancarik et al, 1991). Si la condition de cristallisation est déjà connu, un écran étroites peuvent être assemblés, faisant varier la concentration et le pH de précipitation autour du hit original. Le facteur déclenchant le plus souvent réussie est le polyéthylène glycol (PEG), suivi par le sulfate d'ammonium. Ensemble, ces compte de deux facteurs déclenchants pour environ 60% de tous les facteurs déclenchants macromoléculaires enregistrés utilisés pour la cristallisation (Gilliland et al, 1994;. Kimber et al, 2003;.. Page et al, 2003).
- Préparez vos solutions de cristallisation. Habituellement, ces conditions sont combinées à partir d'un agent de précipitation, le sel d'une certaine sorte et un tampon pour régler le pH. Dans certains cas, des additifs peuvent être ajoutés spécifiquement pour la protéine d'intérêt. Toutes solution mère doit être filtrée à l'aide filtre de 0,22 um. Certains de la solution stock pourrait être très visqueux (50% PEG, le glycérol, le PEG-MME, etc.)
- Préparer 1,5 mL de 0,6, 0,8, 1,0, 1,2, 1,4, 1,6 M de NaCl dans chacune des 0,1 M pH 4,0 NaOAc, 4.3, 4.6 et 4.9 (total de 24 solutions)
- Décongeler votre échantillon de protéine et de garder sur la glace. Stocks de protéines doivent être conservés à -80 ° C à moins que la protéine d'intérêt est sensible au gel / dégel (si oui, conserver à 4 ° C). Les concentrations des protéines typiques sont de l'ordre de 5-50 mg / mL, avec des concentrations plus élevées donnant généralement de meilleurs résultats.
- Spin de l'échantillon 15min/18, 000xg / 4 ° C - certaines protéines ont tendance à partiellement agrégées et précipiter après une étape de dégel. Ces agrégats peuvent favoriser la précipitation amorphes du reste des molécules de protéines donc tour complet vers le bas vous assurera que les molécules solubles dans votre échantillon. Gardez la protéine dans la glace jusqu'à la mise en place du plateau.
- Déterminer la concentration de protéines à partir de son absorbance à 280 nm en utilisant un spectrophotomètre UV. La concentration en protéines peut être calculé à partir de la lecture d'absorbance et de coefficient d'extinction de la protéine. Le coefficient d'extinction peut être calculée avec l'outil ProtParam sur le site Expasy: http://ca.expasy.org/tools/protparam.html
- Remplir les puits de la pendaison de 24 puits / assis Bac goutte avec 500 ul de solution de précipitant selon le schéma de configuration de bac (figure 2B). Créer un anneau de graisse silicone sur le pourtour du puits. L'anneau doit avoir un petit écart pour éviter toute accumulation de pression d'air que le bien est scellé. En chute assis, il n'est pas nécessaire pour la graisse car le bien est scellé avec du ruban adhésif (figure 2A).
- Prenez une lame de couverture et nettoyez-le avec l'air condensé par pulvérisation, ou un professionnel essuyez - la poussière évitant facilitera l'interprétation de la chute de cristallisation et d'éliminer les contaminations. Pour s'asseoir gouttes, faites glisser la couverture ne sont pas utilisés. Au lieu de cela, le puits contient une étagère sur laquelle les protéines et les précipitants sont mélangés.
- Mettez des volumes égaux de l'échantillon de protéine et la solution retenue sur la lamelle. Différents volumes de protéines et de précipitants peuvent être jugés dans le cadre du processus d'optimisation. En utilisant plus de protéines que les résultats précipitant dans une concentration nette de la protéine dans la goutte après l'équilibration, qui peut être souhaitable pour les échantillons de protéines diluées, et de ralentir la nucléation des cristaux ou de croissance. Toute autre substance non volatile dans la solution baisse sera également concentré par le même facteur. Lorsque la protéine de pipetage et de solutions réservoir sur la lamelle, être extrêmement prudent afin d'éviter la formation de bulles. Cela se produit souvent lorsque l'air est soufflé hors de la pipette.
- Goutte suspendue: Charge 2 ul de 50 mg / ml de lysozyme dans 0,02 M pH 4,9 NaOAc au centre de la lamelle et ajouter à cela 2 ul de la solution retenue.
- Assis déposer: Charge 2 ul de 50 mg / ml solution de lysozyme au centre du plateau et y ajouter 2 ul de la solution retenue.
- Retournez délicatement la lamelle et il se coucha sur le ring de la graisse sur le dessus du puits. Appuyez doucement pour que l'air peut s'échapper du puits grâce à l'encoche de la graisse à praccumulation de pression d'air dans le cas bien et garder le bien scellée. Accumulation de pression d'air dans le puits peut soulever la lamelle, compromettre l'étanchéité du puits. Dans la méthode de la goutte assise, optiquement clair bande transparente est utilisée pour couvrir les puits. Ainsi, dans cette méthode de scellement aura lieu chaque ligne / colonne.
- Passez à la même suivant jusqu'à bac est complet.
- Vérifiez le bac lors de la configuration - en éliminant les particules de poussière et autres impuretés peuvent réduire l'identification de faux positifs de cristaux de protéines.
- Utiliser une feuille de pointage pour documenter votre expérience.
- Placez le plateau à la température d'incubation désirée, généralement entre 4 ° C et la température ambiante. 20 ° C est le plus souvent couronnée de succès. Prenez soin de manipuler le plateau doucement et éviter toute secousse. Soyez prudent lors de l'ouverture et la fermeture de la porte de l'incubateur. Des vibrations ou des variations de température pendant le transfert ou l'incubation peut empêcher la croissance des cristaux ou de nuire à la qualité de cristal. Un matériau absorbant les chocs (mousse d'emballage, par exemple) peut être utilisé comme rembourrage sous les plateaux de cristal.
- Vérifiez le bac pour les cristaux de la journée suivante, puis tous les quelques jours, toujours la manutention et les plateaux avec soin. Document de ses constatations et des morphologies déposer dans une feuille de pointage bac spécifique. Cristaux prennent habituellement 2-5 jours à apparaître, bien que des cristaux apparaissent parfois beaucoup plus tôt (presque immédiatement) ou plus tard (jusqu'à plusieurs mois!). Une fois les conditions de cristallisation ont été identifiés et le taux de croissance des cristaux est connu, il est préférable de laisser les bacs intact jusqu'à cristaux sont apparus et ont grandi à au moins la moitié de leur taille finale. Laissant les plateaux intactes peut réduire le nombre d'événements nucléation des cristaux, d'où la production de petits nombres de gros cristaux.
2. Microbatch procédure:
- Échantillon de la protéine et la préparation précipitants sont décrits ci-dessus.
- Air de pulvérisation d'un plateau microbatch nouvelles pour éviter la poussière et autres particules de grande taille.
- Dans le bac microbatch, remplir d'huile de paraffine jusqu'à 3 mm de haut (juste assez pour couvrir les puits). Supprimer l'accès de l'huile.
- Charge 1 uL de solution de protéines (50 mg / ml de lysozyme) dans l'huile pré-remplie ainsi - assurez-vous de la pipette la solution directement au fond du puits (figure 2A).
- Charge 1 ul de solution de précipitant dans la fonction ainsi au régime configuration de bac (figure 2B) - assurez-vous que la chute coule au fond du puits et fusionne avec la gouttelette de protéine.
- Déplacer vers le bien suivant jusqu'à bac est complet.
- Suivez les étapes 11-14 de la pendaison / assis drop procedure.
3. Les résultats représentatifs:
La cristallisation est généralement dénommé le goulot d'étranglement cristallographie aux rayons X. Une matrice creuse incomplète écran factorielle des conditions de précipitation de produit typiquement beaucoup de différents types d'agrégation des protéines et des précipitations, parmi eux de grands cristaux simples. Si les concentrations de la protéine ou précipitants sont trop élevés, on peut voir la matière brune avec aucune forme distincte et la taille (précipitations amorphe). Quand la solution est sous-, la baisse sera souvent complètement clair et dépourvu de tout type de précipitations. La figure 3 montre plusieurs exemples de phénomènes de précipitation et de cristaux (Dessau et al., 2006). Phénomènes de précipitation Plus à l'interprétation plus détaillées peuvent être trouvées au http://xray.bmc.uu.se/terese/tutorials.html .
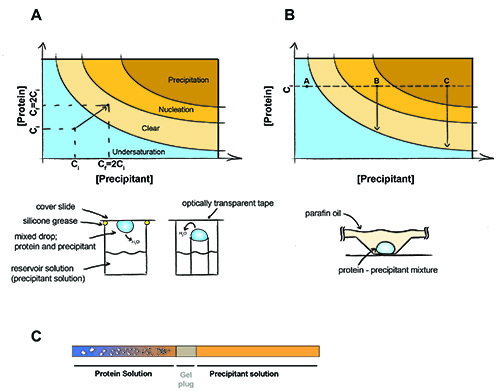
Figure 1. Le principe de la cristallisation des protéines.
Le principe de la cristallisation des protéines. Dans une expérience de diffusion de vapeur (A) des volumes égaux de précipitant et en protéines sont présentes dans la goutte. L'eau va diffuser à la fois et le précipitant et de la concentration de protéines sera doublé jusqu'à ce qu'un équilibre soit atteint entre la goutte et la solution retenue. Dans la cristallisation du lot (B) la concentration de protéines précipitant et ne changent pas pendant l'expérience. Point A - Protéines reste sous saturée pas de cristaux peuvent être formés, Point B - nucléation des protéines se produisent, des cristaux commencent à se former et la concentration de protéine en solution tombe à saturation. C Point - Protéines précipités, mais les cristaux peuvent encore croître. La cristallisation de dialyse (C) en utilisant un gel capillaire branchés. Cristaux apparaissent comme le sel se diffuse hors de l'échantillon de protéines (et / ou diffuse précipitant dans l'échantillon de protéines) à travers le bouchon de gel.
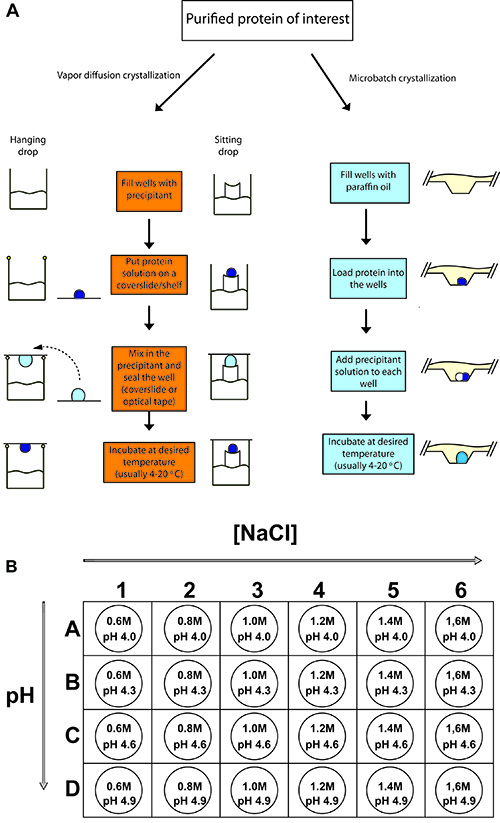
Figure 2. Aperçu des caractéristiques des expériences de cristallisation des protéines.
(A) les procédures pour suspendre la diffusion de vapeur chute, assis chute de la diffusion de vapeur, et la cristallisation des protéines microbatch. Dans chaque cas, un petit volume d'échantillon de protéine concentrée est mélangée avec un volume égal ou plus petit des precipitansolution de t et s'équilibrer. (B) pour la cristallisation du lysozyme de poulet, un plateau de 24 puits est mis en place avec diverses concentrations de chlorure de sodium (précipitant) et à 0,1 M acétate de sodium comme le tampon à différents pH (4.0 - 4.9).

Figure 3. Résultats typiques d'une expérience de cristallisation des protéines.
(A) précipitations Amorphe. Lorsque la protéine ou précipitants (ou les deux) sont en forte concentration. (B) La séparation de phase. Protéines ou de détergent peuvent se séparer d'une phase différente lorsqu'il est mélangé avec certains facteurs déclenchants à forte concentration. (C) des cristaux de protéines en forme de Rod AtCSN7 obtenus en polyéthylène glycol 8000 et l'acétate de magnésium (Dessau et al., 2006). (D) les cristaux obtenus dans lysozyme 1,0 M de NaCl et acétate de sodium pH 4,9. (E) Sous gouttes saturées restent généralement claire. Photographie par Moshe Dessau.
Résultats
Crystallization is usually referred to as the bottleneck of X-ray crystallography. A sparse matrix incomplete factorial screen of precipitating conditions typically produces many different types of protein aggregation and precipitation, among them large single crystals. If the protein or precipitant concentrations are too high one can see brown matter with no distinct shape and size (amorphous precipitation). When the solution is undersaturated, the drop will often be completely clear and devoid of any kind of precipitat...
Discussion
Dans cet article nous décrire et démontrer générale protocoles actuels pour la cristallisation des protéines. Comme il une procédure en plusieurs étapes il ya quelques considérations, il faut être conscient. Lorsque vous travaillez avec de très petits volumes (0.5-2 uL), le séchage de la baisse due à l'évaporation est une préoccupation majeure. Par conséquent, il est recommandé de travailler dans un environnement bien contrôlé (avec faible débit d'air, une humidité élevée et un contrôle ri...
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par une bourse de chercheur Burroughs Wellcome à YM et par une bourse de recherche postdoctorale Brown-Coxe de l'Université Yale à MD.
matériels
| Name | Company | Catalog Number | Comments | |
| New Item | ||||
| Lysozyme | Sigma-aldrich | L6876-1G | ||
| 24 well VDX Plate | Hampton research | HR3-142 | ||
| 24 well Cryschem Plate | Hampton research | HR3-158 | ||
| Dow Corning Vacuum Grease | Hampton research | HR3-510 | ||
| Siliconized glass circle coverslides | Hampton research | HR3-231 | ||
| 100% paraffin oil | Hampton research | HR3-411 | ||
| 1.88 inch wide Crystal Clear Sealing Tape | Hampton research | HR3-511 | ||
| 96 Well Imp@ct Plate (Microbatch plate) | Hampton research | HR3-098 |
Références
- Bergfors, T. M. . Protein crystallization : techniques, strategies, and tips : a laboratory manual. , (1999).
- Carter, C. W., Carter, C. W. Protein crystallization using incomplete factorial experiments. J Biol Chem. 254, 12219-12223 (1979).
- Cudney, R., Patel, S., Weisgraber, K., Newhouse, Y., McPherson, A. Screening and optimization strategies for macromolecular crystal growth. Acta Crystallogr D Biol Crystallogr. 50, 414-423 (1994).
- Dessau, M., Chamovitz, D. A., Hirsch, J. A. Expression, purification and crystallization of a PCI domain from the COP9 signalosome subunit 7 (CSN7). Acta Crystallogr Sect F Struct Biol Cryst Commun. 62, 1138-1140 (2006).
- Gilliland, G. L., Tung, M., Blakeslee, D. M., Ladner, J. E. Biological Macromolecule Crystallization Database, Version 3.0: new features, data and the NASA archive for protein crystal growth data. Acta Crystallogr D Biol Crystallogr. 50, 408-413 (1994).
- Jancarik, J., Kim, S. H. Sparse matrix sampling: a screening method for crystallization of proteins. J Appl Cryst. 23, 409-411 (1991).
- Jancarik, J., Scott, W. G., Milligan, D. L., Koshland, D. E., Kim, S. H. Crystallization and preliminary X-ray diffraction study of the ligand-binding domain of the bacterial chemotaxis-mediating aspartate receptor of Salmonella typhimurium. J Mol Biol. 221, 31-34 (1991).
- Kimber, M. S., Vallee, F., Houston, S., Necakov, A., Skarina, T., Evdokimova, E., Beasley, S., Christendat, D., Savchenko, A., Arrowsmith, C. H. Data mining crystallization databases: knowledge-based approaches to optimize protein crystal screens. Proteins. 51, 562-568 (2003).
- Lorber, B., Sauter, C., Theobald-Dietrich, A., Moreno, A., Schellenberger, P., Robert, M. C., Capelle, B., Sanglier, S., Potier, N., Giege, R. Crystal growth of proteins, nucleic acids, and viruses in gels. Prog Biophys Mol Biol. 101, 13-25 (2009).
- McPherson, A. . Crystallization of biological macromolecules. , (1999).
- McPherson, A. Introduction to protein crystallization. Methods. 34, 254-265 (2004).
- Page, R., Grzechnik, S. K., Canaves, J. M., Spraggon, G., Kreusch, A., Kuhn, P., Stevens, R. C., Lesley, S. A. Shotgun crystallization strategy for structural genomics: an optimized two-tiered crystallization screen against the Thermotoga maritima proteome. Acta Crystallogr D Biol Crystallogr. 59, 1028-1037 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon