Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Proteinkristallisation für X-ray Crystallography
In diesem Artikel
Zusammenfassung
Die 3-D-Struktur eines Moleküls liefert ein einzigartiges Verständnis dafür, wie das Molekül Funktionen. Die wichtigste Methode zur Strukturaufklärung in nahezu atomarer Auflösung ist Röntgenstrukturanalyse. Hier zeigen wir die aktuellen Methoden zur Gewinnung von dreidimensionalen Kristallen von jedem Makromolekül, die sich für die Strukturbestimmung mittels Röntgen-Kristallographie.
Zusammenfassung
Mit der dreidimensionalen Struktur von biologischen Makromolekülen zu folgern, wie sie funktionieren ist eine der wichtigsten Felder der modernen Biologie. Die Verfügbarkeit von atomarer Auflösung Strukturen bietet einen tiefen und einzigartigen Verständnis der Funktion von Proteinen und hilft, das Innenleben der lebenden Zelle zu entschlüsseln. Bis heute sind 86% der Protein Data Bank (RCSB-PDB) Einträge makromolekularen Strukturen, die mit Hilfe der Röntgenkristallographie waren.
Um geeignete Kristalle für kristallographische Untersuchungen, das Makromolekül (zB Protein, Nukleinsäure-, Protein-Protein-Komplex oder Protein-Nukleinsäure-Komplex) muss bis zur Homogenität gereinigt werden, oder so nah wie möglich an Homogenität. Die Homogenität der Zubereitung ist ein wesentlicher Faktor bei der Beschaffung von Kristallen, die eine hohe Auflösung beugen (Bergfors, 1999; McPherson, 1999).
Die Kristallisation erfordert bringen das Makromolekül zu Übersättigung. Die Probe sollte daher auf eine möglichst hohe Konzentration, ohne dass die Aggregation oder Fällung des Makromoleküls (in der Regel 2-50 mg / mL) konzentriert werden. Die Einführung der Probe zu Fällungsmittel kann die Keimbildung von Protein-Kristalle in der Lösung, die in großen dreidimensionalen Kristallen wachsen aus der Lösung führen kann fördern. Es gibt zwei Techniken, um Kristalle zu erhalten: Dampfdiffusion und Batch-Kristallisation. In Dampfdiffusion, ein Tropfen mit einer Mischung von Fällungsmittel und Protein-Lösungen ist in einer Kammer mit reinem Fällungsmittel versiegelt. Wasserdampf diffundiert dann aus der Drop bis die Osmolarität des Tropfens und das Fällungsmittel gleich (Abbildung 1A). Die Dehydratisierung des Tropfens bewirkt eine langsame Konzentration von sowohl Protein und Fällungsmittel, bis das Gleichgewicht erreicht ist, idealerweise in der Kristallkeimbildung Zone des Phasendiagramms. Die Batch-Verfahren beruht auf der bringt das Protein direkt in das Keimbildungszone durch Mischen Protein mit der entsprechenden Menge an Fällungsmittel (Abbildung 1B). Diese Methode ist in der Regel unter einem Paraffin / Mineralöl Mischung auf die Diffusion von Wasser aus dem Tropfen zu verhindern durchgeführt.
Hier zeigen wir Ihnen zwei Arten von experimentellen Aufbaus für die Dampfdiffusion, hängenden Tropfen und Sitzen fallen, zusätzlich zu Batch-Kristallisation unter Öl.
Protokoll
Materialien:
- Protein Probe - Lysozym (50 mg / mL)
- Hanging drop 24-Well-Schale
- Sitting Drop 24-Well-Schale
- Microbatch Kristallisation 96-Well-Schale
- Kristallisation Lösungen (entweder kommerziell verfügbar oder hausgemacht)
- Silikonfett
- 5 ml Spritze ohne Luer-Lock
- Silikonisierten Deckgläschen
- Optische Dichtband
- Paraffin
- 0,1-2 ul Mikropipette mit Low-Retention-Tipps
- Pinzette
- Professionelle Reinigungstücher
1. Hanging / Sitting Drop Vorgehen:
- Für eine erste Bildschirm kann man verwenden Sie handelsübliche Bildschirme, der Sparse-Matrix unvollständigen faktoriellen Methode von Versuch Bedingungen zu nutzen. Die Sparse Matrix unvollständige faktorielle Methode wird von voreingenommen sind und aus bekannten Kristallisationsbedingungen für Makromoleküle (Carter and Carter, 1979; Cudney et al, 1994;. Jancarik und Kim, 1991;. Jancarik et al, 1991). Wenn die Kristallisation Zustand bereits bekannt ist, kann eine schmale Bildschirm montiert werden, die Variation der Fällungsmittel-Konzentration und pH-Wert um den Original-Hit. Die am häufigsten erfolgreich Fällungsmittel ist Polyethylenglykol (PEG), gefolgt von Ammoniumsulfat gefolgt. Zusammen sind diese beiden Fällungsmittel machen etwa 60% aller erfassten makromolekularen Fällungsmittel für die Kristallisation (Gilliland et al, 1994.; Kimber et al, 2003;.. Page et al, 2003) verwendet.
- Bereiten Sie Ihre Kristallisation Lösungen. In der Regel sind diese Bedingungen von einem Fällungsmittel, Salz irgendeiner Art und einen Puffer, um den pH-Wert kombiniert. In einigen Fällen Zusatzstoffe können die speziell für das Protein von Interesse hinzugefügt werden. Alle Stammlösung sollte gefiltert werden mit 0,22 um Filter sein. Einige der Stammlösung kann sehr zähflüssig (50% PEG, Glycerin, PEG-MME, etc).
- Bereiten Sie 1,5 ml 0,6, 0,8, 1,0, 1,2, 1,4, 1,6 M NaCl jeweils in 0,1 M NaOAc pH 4,0, 4,3, 4,6 und 4,9 (insgesamt 24 Lösungen)
- Thaw Ihre Proteinprobe und halten auf dem Eis. Protein Aktien sollten bei -80 ° C gelagert werden, wenn das Protein von Interesse ist empfindlich gegen Frost / Tau-Zyklen (wenn ja, lagern bei 4 ° C). Typische Protein-Konzentrationen im Bereich von 5-50 mg / mL, mit höheren Konzentrationen in der Regel gibt bessere Ergebnisse.
- Spin der Probe 15min/18, 000xg / 4 ° C - einige Proteine neigen dazu, teilweise zu aggregieren und Niederschlag nach einem Tauwetter Schritt. Diese Aggregate fördern können amorphe Fällung von dem Rest der Proteinmoleküle daher gründliche Spin-Down garantiert Ihnen nur lösliche Moleküle in Ihrer Probe. Keep Protein auf Eis, bis die Einrichtung des Fachs.
- Bestimmen Sie die Protein-Konzentration von seiner Absorption bei 280 nm mit einem UV-Spektrophotometer. Die Proteinkonzentration kann aus der Extinktion und des Proteins Extinktionskoeffizienten berechnet werden. : Der Extinktionskoeffizient kann mit dem ProtParam Tool auf der Website ExPASy berechnet werden http://ca.expasy.org/tools/protparam.html
- Füllen Vertiefungen der 24-Well-hängenden / Sitting Drop-Fach mit 500 ul Fällungslösung nach dem Fachkonfiguration Schema (Abbildung 2B). Erstellen Sie ein Silikonfett Ring um den Rand des Brunnens. Der Ring sollte eine kleine Lücke, um Luft Druckaufbau zu verhindern, wie die gut verschlossen ist. Im Sitzen fällt, gibt es keine Notwendigkeit für Fett, da die gut mit Klebeband versiegelt ist (Abbildung 2A).
- Nehmen Sie einem Deckglas und reinigen Sie sie mit verdichteter Luft sprühen, oder eine professionelle wischen - Vermeidung von Staub wird die Interpretation der Kristallisation Drop und beseitigen Verunreinigungen. Zum Sitzen fällt, sind Deckglas nicht verwendet. Stattdessen enthält die gut ein Regal, auf dem die Protein-und Fällungsmittel vermischt werden.
- Setzen Sie gleiche Volumina der Proteinprobe und Reservoir-Lösung auf dem Deckglas. Unterschiedliche Mengen an Protein und Fällungsmittel kann als Teil des Optimierungsprozesses ausprobiert werden. Mit mehr Protein als Fällmittel ergibt sich ein Netto-Konzentration des Proteins in der Dropdown nach Erreichen des Gleichgewichts, was wünschenswert sein kann für verdünnte Protein-Proben und zur Keimbildung oder das Wachstum zu verlangsamen. Alle anderen nicht-flüchtigen Substanz in der Dropdown-Lösung wird auch durch den gleichen Faktor zu konzentrieren. Beim Pipettieren der Protein-und Reservoir-Lösungen auf den Deckel schieben, äußerst vorsichtig sein, um eine Blasenbildung zu vermeiden. Dies geschieht häufig, wenn Luft aus der Pipette ausgeblasen.
- Hanging drop: Load 2 ul 50 mg / ml Lysozym in 0,02 M NaOAc pH 4,9 bis der Mitte des Deckels schieben und fügen Sie 2 ul des Reservoirs Lösung.
- Sitting Drop: Load 2 ul 50 mg / mL Lysozym-Lösung in die Mitte des Regals und fügen Sie 2 ul der Reservoir-Lösung.
- Klappen Sie den Deckel gleiten sanft und legte sie auf den Fett-Ring an der Oberseite des Brunnens. Drücken Sie vorsichtig, so dass Luft aus dem Brunnen durch die Kerbe Flucht in das Fett zu prVeranstaltung Luft Druckaufbau in der gut und halten Sie die gut verschlossen. Air Druckaufbau in den Brunnen kann heben Sie den Deckel schieben, dabei die gut abdichten. In der Sitzung Drop-Methode ist optisch klar durchsichtige Klebeband verwendet werden, um die Brunnen zu decken. Daher wird in dieser Methode Abdichtung findet alle Zeilen / Spalten.
- Fahren Sie mit dem nächsten Brunnen, bis Fach ist abgeschlossen.
- Überprüfen Sie das Tablett auf Setup - Beseitigung von Staub und anderen Verunreinigungen können die falsch positiven Identifikation von Protein-Kristalle zu reduzieren.
- Verwenden Sie ein Scoring, um Ihr Experiment zu dokumentieren.
- Setzen Sie das Fach an der gewünschten Inkubationstemperatur, in der Regel zwischen 4 ° C und Raumtemperatur. 20 ° C wird am häufigsten erfolgreich. Achten Sie darauf, um das Fach vorsichtig umgehen und vermeiden Sie zu zittern. Seien Sie vorsichtig beim Öffnen und Schließen des Inkubators Tür. Vibrationen oder Temperaturschwankungen während des Transports oder der Inkubation kann verhindern das Kristallwachstum oder negativ beeinflussen Kristallqualität. Ein Schock absorbierendem Material (zB Verpackung Schaum) kann als Polsterung unter dem Kristall Schalen verwendet werden.
- Überprüfen Sie das Fach für die Kristalle des folgenden Tages, und dann alle paar Tage, immer Umgang mit den Tabletts mit Sorgfalt. Dokumentieren Sie alle Befunde und Drop Morphologien in einem Fach spezifische Auswertungsbogen. Kristalle in der Regel dauern 2-5 Tage zu erscheinen, obwohl Kristalle gelegentlich viel früher (fast sofort) oder später (bis zu mehreren Monaten!) Erscheinen. Sobald Kristallisationsbedingungen identifiziert wurden und die Wachstumsrate der Kristalle bekannt ist, ist es am besten, lassen Sie die Schalen ungestört, bis sich Kristalle erschienen sind und wuchs auf mindestens die Hälfte ihrer endgültigen Größe. Verlassen des Tabletts ungestört können die Anzahl der Kristallkeimbildung Ereignisse, es kommt zu einer kleineren Anzahl von größeren Kristallen.
2. Microbatch Vorgehen:
- Protein Probe und Fällungsmittel Vorbereitung sind, wie oben beschrieben.
- Luftspritzen eine neue Microbatch Tablett, um keinen Staub und andere große Partikel.
- In der Microbatch Tablett, füllen Paraffinöl bis zu 3 mm hoch (gerade genug, um den Brunnen abdecken). Entfernen Sie den Zugriff von Öl.
- Load 1 ul der Protein-Lösung (50 mg / ml Lysozym) in das Öl befüllt und - achten Sie darauf, die Lösung direkt Pipette auf den Grund des Brunnens (Abbildung 2A).
- Laden 1 ul Fällungslösung in den Brunnen nach dem Fachkonfiguration Schema (Abbildung 2B) - sicherstellen, dass die Tropfen sinkt auf den Grund des Brunnens und Sicherungen mit dem Protein Tröpfchen.
- Gehen Sie zum nächsten gut, bis Fach ist abgeschlossen.
- Befolgen Sie die Schritte 11-14 der hängenden / Sitting Drop Verfahren.
3. Repräsentative Ergebnisse:
Die Kristallisation ist in der Regel als der Flaschenhals Röntgenkristallographie bezeichnet. Ein Sparse Matrix unvollständigen faktoriellen Bildschirm des ausfallenden Bedingungen produziert typischerweise viele verschiedene Arten von Protein-Aggregation und Präzipitation, darunter große Einkristalle. Wenn das Protein oder Fällungsmittel zu hohen Konzentrationen kann man braunen Masse ohne bestimmte Form und Größe (amorphe Niederschlag) zu sehen. Wenn die Lösung untersättigt ist, werden die Tropfen oft völlig klar und frei von jeder Art von Niederschlag. Abbildung 3 zeigt einige Beispiele für die Fällung Phänomene und Kristalle (Dessau et al., 2006). Mehr Niederschläge Phänomene mit detaillierteren Interpretation finden Sie unter http://xray.bmc.uu.se/terese/tutorials.html .
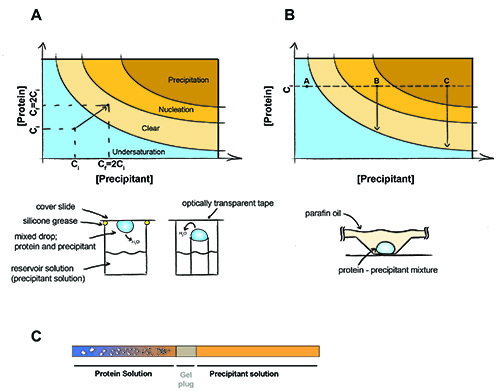
Abbildung 1. Das Prinzip der Kristallisation von Proteinen.
Das Prinzip der Kristallisation von Proteinen. In einer Dampfdiffusion Experiment (A) gleiche Volumina von Fällungsmittel und Protein sind in der Drop. Das Wasser wird heraus diffundieren und sowohl die Fällungs-und Protein-Konzentration verdoppelt, bis das Gleichgewicht zwischen dem Tropfen und dem Reservoir-Lösung erreicht wird. Im Batch-Kristallisation (B) das Fällungsmittel und Protein-Konzentration nicht während des Experiments zu ändern. Punkt A - Protein bleibt untersättigt keine Kristalle gebildet werden können, Point B - Protein Keimbildung auftreten, begannen die ersten Kristalle bilden und die Konzentration des Proteins in Lösung Tropfen bis zur Sättigung. Punkt C - Protein ausfällt, aber Kristalle können noch wachsen. (C) Dialyse Kristallisation mit einem Gel-plugged Kapillare. Kristalle erscheinen als Salz diffundiert aus der Proteinprobe (und / oder Fällungsmittel diffundiert in die Proteinprobe) über das Gel-Stecker.
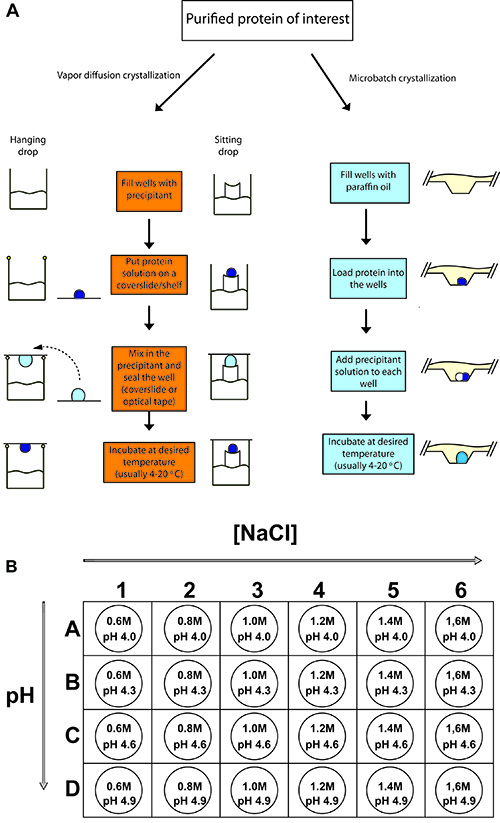
Abbildung 2. Outline of typisches Protein Kristallisation Experimente.
(A) Verfahren für die hängenden Tropfen Dampfdiffusion, Sitting Drop Dampfdiffusion und Microbatch Proteinkristallisation. In jedem Fall wird ein kleines Volumen konzentriert Proteinprobe mit einer gleichen oder kleineren Volumen von precipitan gemischtt-Lösung und erlaubt Gleichgewicht zu bringen. (B) Für die Kristallisation von Huhn Lysozym, ein 24-Loch-Tray ist mit verschiedenen Konzentrationen von Natriumchlorid (Fällungsmittel) und mit 0,1 M Natriumacetat als Puffer bei verschiedenen pH-Werten (- 4,9 4,0) eingestellt.

Abbildung 3. Typische Ergebnisse einer Proteinkristallisation Experiment.
(A) amorphe Niederschläge. Wenn Protein oder Fällungsmittel (oder beides) in hoher Konzentration. (B) Phasentrennung. Protein-oder Reinigungsmittel können zu einer anderen Phase zu trennen, wenn sie mit bestimmten Fällungsmittel in hoher Konzentration gemischt. (C) stabförmige Proteinkristallen von AtCSN7 in Polyethylenglykol 8000 und Magnesium-Acetat (Dessau et al., 2006) erhalten. (D) Lysozymkristalle in 1,0 M NaCl und Natriumacetat pH 4,9 erhalten. (E) Unter gesättigten Tropfen bleiben in der Regel klar. Fotografien von Moshe Dessau.
Ergebnisse
Crystallization is usually referred to as the bottleneck of X-ray crystallography. A sparse matrix incomplete factorial screen of precipitating conditions typically produces many different types of protein aggregation and precipitation, among them large single crystals. If the protein or precipitant concentrations are too high one can see brown matter with no distinct shape and size (amorphous precipitation). When the solution is undersaturated, the drop will often be completely clear and devoid of any kind of precipitat...
Diskussion
In diesem Artikel beschreiben wir und zeigen allgemein gängigen Protokolle für die Proteinkristallisation. Da es ein mehrstufiges Verfahren gibt es einige Überlegungen muss man sich bewusst sein. Bei der Arbeit mit sehr kleinen Volumina (0.5-2 mL), Trocknung des Tropfens durch Verdunstung ist ein wichtiges Anliegen. Daher empfiehlt es sich, in einer gut kontrollierten Umgebung arbeiten (mit geringen Luftstrom, hohe Luftfeuchtigkeit und genaue Temperatursteuerung) und eine Technik, die Exposition des Tropfens auf die ...
Offenlegungen
Danksagungen
Diese Arbeit wurde durch ein Burroughs Wellcome Investigator Award für YM und durch eine Brown-Coxe Postdoktoranden-Stipendium an der Yale University zu MD unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Lysozyme | Sigma-aldrich | L6876-1G | |
| 24 well VDX Plate | Hampton research | HR3-142 | |
| 24 well Cryschem Plate | Hampton research | HR3-158 | |
| Dow Corning Vacuum Grease | Hampton research | HR3-510 | |
| Siliconized glass circle coverslides | Hampton research | HR3-231 | |
| 100% paraffin oil | Hampton research | HR3-411 | |
| 1.88 inch wide Crystal Clear Sealing Tape | Hampton research | HR3-511 | |
| 96 Well Imp@ct Plate (Microbatch plate) | Hampton research | HR3-098 |
Referenzen
- Bergfors, T. M. . Protein crystallization : techniques, strategies, and tips : a laboratory manual. , (1999).
- Carter, C. W., Carter, C. W. Protein crystallization using incomplete factorial experiments. J Biol Chem. 254, 12219-12223 (1979).
- Cudney, R., Patel, S., Weisgraber, K., Newhouse, Y., McPherson, A. Screening and optimization strategies for macromolecular crystal growth. Acta Crystallogr D Biol Crystallogr. 50, 414-423 (1994).
- Dessau, M., Chamovitz, D. A., Hirsch, J. A. Expression, purification and crystallization of a PCI domain from the COP9 signalosome subunit 7 (CSN7). Acta Crystallogr Sect F Struct Biol Cryst Commun. 62, 1138-1140 (2006).
- Gilliland, G. L., Tung, M., Blakeslee, D. M., Ladner, J. E. Biological Macromolecule Crystallization Database, Version 3.0: new features, data and the NASA archive for protein crystal growth data. Acta Crystallogr D Biol Crystallogr. 50, 408-413 (1994).
- Jancarik, J., Kim, S. H. Sparse matrix sampling: a screening method for crystallization of proteins. J Appl Cryst. 23, 409-411 (1991).
- Jancarik, J., Scott, W. G., Milligan, D. L., Koshland, D. E., Kim, S. H. Crystallization and preliminary X-ray diffraction study of the ligand-binding domain of the bacterial chemotaxis-mediating aspartate receptor of Salmonella typhimurium. J Mol Biol. 221, 31-34 (1991).
- Kimber, M. S., Vallee, F., Houston, S., Necakov, A., Skarina, T., Evdokimova, E., Beasley, S., Christendat, D., Savchenko, A., Arrowsmith, C. H. Data mining crystallization databases: knowledge-based approaches to optimize protein crystal screens. Proteins. 51, 562-568 (2003).
- Lorber, B., Sauter, C., Theobald-Dietrich, A., Moreno, A., Schellenberger, P., Robert, M. C., Capelle, B., Sanglier, S., Potier, N., Giege, R. Crystal growth of proteins, nucleic acids, and viruses in gels. Prog Biophys Mol Biol. 101, 13-25 (2009).
- McPherson, A. . Crystallization of biological macromolecules. , (1999).
- McPherson, A. Introduction to protein crystallization. Methods. 34, 254-265 (2004).
- Page, R., Grzechnik, S. K., Canaves, J. M., Spraggon, G., Kreusch, A., Kuhn, P., Stevens, R. C., Lesley, S. A. Shotgun crystallization strategy for structural genomics: an optimized two-tiered crystallization screen against the Thermotoga maritima proteome. Acta Crystallogr D Biol Crystallogr. 59, 1028-1037 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten