需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
成人整装准备果蝇巨纤维染料注射腹侧神经索
摘要
一个在体内成人解剖果蝇腹神经索(VNC)是证明。这种特殊的解剖方法会导致损伤小到VNC允许的高分辨率成像的荧光染料的巨纤维神经元的后续标签。
摘要
为了分析神经元轴突和树突状的形态,这是必须获得准确的神经元结构的标签。准备以及标记的样品几乎没有组织损伤,使我们能够分析细胞形态和相互比较个别样品,从而使突变异常的识别。
在证明清扫方法的神经系统仍然主要是里面的成人飞。通过背侧切口,腹部和胸部开了,大部分内脏器官都将被删除。只有背侧,腹侧神经线(VNC)和宫颈结缔组织(CVC)的巨型纤维(GFS)1大轴突外露,而大脑含有的GF胞体和树突仍然完整的头2 。在这个准备,最神经的VNC应保持连接到他们的肌肉。
剥离后,细胞内的巨型纤维(GF)用荧光染料填充证明。 CVC GF轴突位于背表面,从而可以很容易地与微分干涉对比(DIC)的光学显微镜下可视化。这使得在此网站与染料的GF轴突注射标签VNC的轴突和他们的终端包括整个的GF。该方法结果可靠和强大的政府飞行服务队的允许填充啶显微镜后,立即进行成像神经元染色。另外,使用的标准的免疫组织化学程序 3适用于高分辨率的共聚焦显微镜,荧光信号可增强。
研究方案
1。腹神经索的剖析
可在室温下进行解剖和染料的GF灌装。对于所有清扫步骤冷(4℃)生理盐水应使用减慢细胞代谢和维持神经元存活更长的时间。
- 麻醉与CO 2成蝇(4天或以上),或阴寒他们,直到他们被固定在冰上。麻醉用冰块将需要更多的时间(最多30分钟),但将保持更长的时间固定的苍蝇。
- 放置一个飞在Sylgard涂层的培养皿。剥离需要使用高倍率(80 - 100X)夹层体视显微镜。
- Vannas剪刀,删除的腿,喙,和翅膀。
- 使用粗钳和罚款昆虫引脚(minutien引脚)到东方飞背侧Sylgard菜。第一脚的腹部,然后放在颈部两侧的两个引脚,后面的头部,使颈部轻微伸和访问(见图2)动物略有拉长。
- 淹没飞鲜,冷的果蝇生理盐水。最常用的果蝇salines足够的清扫,但是在这里我们使用谷和奥多德生理盐水,2006 年 4 。气泡环绕飞行。取出用注射器中的空气。
- 到腹部的背端短,外侧切口。在切口开始,沿背中线的腹部朝向胸部浅,直切。然后继续在胸部浅,尽可能准确的纵向切割,沿中线走向的结缔组织。这是至关重要的,使削减浅,以不损害VNC(图1)。
- 使用两个细虫针小心地打开胸廓。传播除了身体一半使用的引脚和地方引脚通过飞行肌(图2)。胸部不应该进一步开放,描绘在图2,以避免角质层翻录。为了确保直线方向的VNC引脚应放置在相同的前每边后位。
- 染料注射和适当的成像到VNC可能会妨碍内脏器官。因此,使用镊子和剪刀除去胃,肠,心脏,生殖器官。拉出的VNC双方唾液腺躺在。仔细去除浮动的组织和脂肪的新鲜生理盐水冲洗剥离。
- 删除从下面的宫颈结缔组织(CVC)脂肪体。肥胖的身体是最好的高倍率可见。用细镊子,要认真把握组织从侧面,并将其拉出。
5至10分钟内,可以进行剥离。通过使用新鲜,冷盐水的解剖,完好的神经系统将仍然活着的至少一个小时。
2。细胞内的绿表填写
这是推荐的夹层填充后尽快执行染料。
- Sylgard菜放在一个固定的阶段(图3)和10倍的空中目标的直立显微镜下解剖飞。中心对染料填充电极支架定位飞后结束的样品。使用的CVC微分干涉对比(DIC)的模式和重点。政府飞行服务队的大轴突应CVC背表面清晰可见。
- 在去离子水的浓度为1%稀释路西法黄河CH达丽星盐。拉硼硅玻璃电极丝电阻约。 60-80MΩ。玻璃电极的尖端,应该是长期的和尖锐的。电极尖端填充结束对面放置电极,电极尖端到路西法黄色溶液约1%路西法黄色溶液。 30-60秒。然后回填3M氯化锂与电极使用汉密尔顿注射器留下的染料和LiCl之间的气泡。连接染料填充电极头阶段。
- 氯涂层银线接地电极插入生理盐水和地方染料填充电极上面的飞并行使用3D液压显微到VNC。应连接到放大器,允许为了传递电流从电极释放消极或积极收取染料通过超极化电流,分别染料填充电极。
- 切换到40倍的水浸泡镜片和染料填充电极的尖端降低到政府飞行服务队之一。 GF轴突奠定接近的背水面的CVC。使用向前(向头部方向)运动的GF插入电极。
- 更改您的啶光的光源,并切换到路西法黄河滤波器。应用到染料填充电极极化与放大器注入了GF路西法黄河电流。染料注入量可以控制日E的电流的大小,以及通过的电流通过时间。为了防止蔓延的注射部位或损坏的GF染料,它是推荐使用超过1-5分钟,低电流(约3-5 NA)注入。
- 应用电流,直到在VNC的GF终端可以清楚地看到(图4A)。对于跨突触的突触后神经元的染色,继续传递,直到染料也可以看到在突触后神经元的电流。关闭当前和删除的染料填充电极。
3。代表性的成果:
代表染料之一玻纤填充路西法黄河如图4A所示。作为尼康Elements软件的形象堆栈使用现场摄像头安装在显微镜上的图像被收购。在此示例中电流通过电极约2分钟。彻底填补了GF,在胸部的大型玻纤终端以及标记(图4A,椭圆形)。没有突触后神经元可见,在这种情况下,尽管路西法黄河是小到足以通过缝隙连接。如果染料是没有注入足够长的GF然后跨突触的突触后神经元的填充可能不会被看到,因为被检测到的信号太弱。政府飞行服务队(图4B,箭头)神经元突触后可以可视化,更可靠的使用更小的神经示踪剂,如Neurobiotin。在2米,为2分钟的去极化电流的醋酸钾溶液注入的7%Neurobiotin,是足够标签突触后神经元的强烈。 Neurobiotin可以使用耦合到不同波长的染料的链霉亲和的共聚焦显微镜观察。由于Neurobiotin是不是一种荧光染料,罗丹明-葡聚糖或Alexa的肼在同一解决方案的合作注入,可用于监测一个成功的注入到GF(图4C,从Boerner和Godenschwege,2010年5月) 。
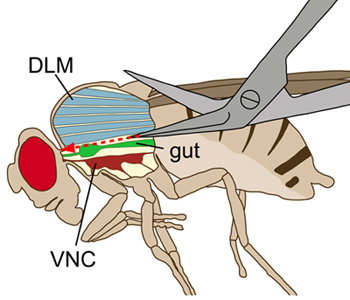
图1原理图绘制一只苍蝇横向观看。胸部是显示一纵形切口,以可视化的内部结构。在清扫,背纵向飞行肌(DLMS,蓝)不损害腹神经索(VNC,深红色),位于腹侧的飞行肌肉被切断。 (绿色)肠道在于上面的VNC。
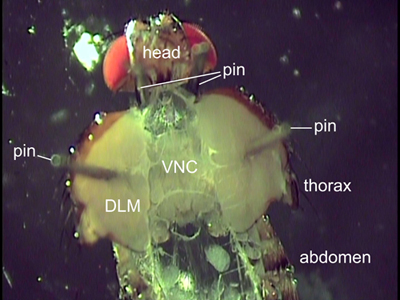
图2:一个解剖飞背视图。两个引脚放在头后面的位置飞。通过飞行肌(DLM),贴引脚按住胸部打开。内部器官被拆除,露出腹侧神经线(VNC)。

图3。染料填充设置。
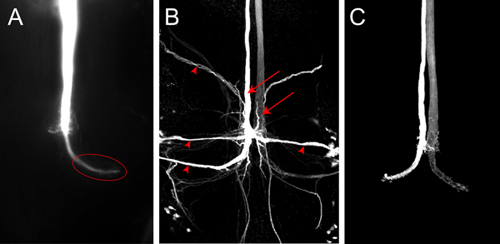
图4。)Z轴投影显示玻纤填充与路西法黄河的部分后的VNC 。图像被收购后,立即染料与现场摄像头灌装。在野生型动物的终端(椭圆)在胸部清晰可见。二)一个GF染料的共聚焦图像填充Neurobiotin在野生型飞。政府飞行服务队(箭头)和政府飞行服务队(箭头元首)的神经元突触后标记。 Neurobiotin是可视化与链霉亲和耦合,以Cy3标记。三)野生型政府飞行服务队共聚焦图像充满Alexa555。
讨论
没有从果蝇体内提取的神经系统,可以解剖。这有两个好处,第一,夹层导致神经系统的损害不大,并保持连接第二,大多数神经肌肉和感觉器官。表演解剖描述的那样,准备向前伸直政府飞行服务队的染料标记的样品。为方便起见,政府飞行服务队的运动神经元突触后留附着的肌肉。轴突,因此,没有损坏,保持神经元的存活更长的时间。此外,对神经系统的损害是可能扰乱间隙连接功能,从?...
披露声明
致谢
描述该项目是从国家儿童健康和人类发展研究所的支持标记的内容完全是作者的责任,并不一定代表的国家儿童健康和人类发展或研究所的官方意见,赠款数R01HD050725美国国立卫生研究院。我们感谢他们的手稿和视频输入Godenschwege实验室以及芭芭拉Schreader成员。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
|---|---|---|---|
| Sylgard 184有机硅弹性体套件 | 道康宁 | ||
| 解剖镜下 | AmScope | SM - 2TZ | |
| Vannas剪刀超细 | 学术仪器 | VS1023 | |
| 杜蒙钳Dumontstar 55 | 精细科学的工具 | 11295-51 | |
| 奥斯特利茨昆虫引脚 | 精细科学的工具 | 26002-10 | 直径0.1毫米 |
| 硼硅玻璃电极 | 世界精密仪器 | 1B100F - 4 | |
| 垂直移液器拖轮700C | 大卫Kopf仪器 | 型号700C | |
| 路西法黄河CH达丽星盐 | 西格玛 | L0259 | 1%H 2 O |
| 固定舞台直立显微镜和相机 | 尼康 | FN - 1和DS - U2的相机 | |
| 计划Fluor公司10X空气目的 | 尼康 | 原讼法庭计划Fluor公司10X NA 0.3的WD16毫米 | |
| 福陆公司40X水浸渍目的 | 尼康 | 原讼法庭福陆公司40X W NA 0.80的WD2.0毫米 | |
| 3D液压微操作机器人 | Narishige国际 | MW0 - 3型 | |
| 放大器 | 入门仪器公司 | 型号5A |
参考文献
- Power, M. E. The thoracico-abdominal nervous system of an adult insect Drosophila melanogaster. J. Comp. Neurol. 88, 347-409 (1948).
- Allen, M. J., Godenschwege, T. A., Tanouye, T. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Boerner, J., Duch, C. Average shape standard atlas for the adult Drosophila ventral nerve cord. J. Comp. Neurol. 518, 2437-2455 (2010).
- Gu, H., O'Dowd, D. K. Cholinergic synaptic transmission in adult Drosophila Kenyon cells in sity. J. Neurosci. 26, 265-272 (2006).
- Boerner, J., Godenschwege, T. A. Application for the Drosophila ventral nerve cord standard in neuronal circuit reconstruction and in-depth analysis of mutant morphology. J. Neurogent. 24, 158-1567 (2010).
- Godenschwege, T. A., Kristiansen, L. V., Uthaman, S. B., Hortsch, M., Murphey, R. K. A conderved role for Drosophila Neuroglian and human L1-CAM in central-synapse formation. Curr. Biol. 16, 12-23 (2006).
- Uthaman, S. B., Godenschwege, T. A., Murphey, R. K. A mechanism distinct from highwire for the Drosophila ubiquitin conjugase bendless in synaptic growth and maturation. J. Neurosci. 28, 8615-8623 (2008).
- Storkebaum, E. Dominant mutations in the tyrosyl-tRNA synthetase gene recapitulate in Drosophila features of human Charcot-Marie-Tooth neuropathy. Proc. Natl. Acad. Sci. USA. 106, 11782-11787 (2009).
- Allen, M. J., Godenschwege, T. A. Electrophysiological recordings from the Drosophila giant fiber system (GFS). Cold Spring Harb. Protoc. 2010, pdb.prot5453-pdb.prot5453 (2010).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. , (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。