È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Monte Preparazione tutto il Adulti Drosophila Cordone nervoso ventrale per iniezione Giant Dye Fibra
In questo articolo
Riepilogo
Un In vivo dell'adulto Drosophila ventrale (VNC) è dimostrata. Questo metodo di dissezione particolare provoca pochi danni alla VNC che permette l'etichettatura successivo dei neuroni fibra gigante con colorante fluorescente per l'imaging ad alta risoluzione.
Abstract
Per analizzare la morfologia assonali e dendritiche dei neuroni è essenziale per ottenere un'accurata etichettatura delle strutture neuronali. Preparazione dei campioni ben etichettati con poco o nessun danno ai tessuti ci permette di analizzare la morfologia cellulare e di confrontare singoli campioni l'uno all'altro, permettendo quindi l'identificazione di anomalie mutante.
Nel metodo dissezione dimostrato il sistema nervoso rimane per lo più all'interno della mosca adulta. Attraverso una incisione dorsale, l'addome e il torace sono aperti e la maggior parte degli organi interni vengono rimossi. Solo il lato dorsale del cordone nervoso ventrale (VNC) e il connettivo cervicale (CVC) contenente gli assoni grande delle fibre giganti (GF) 1 sono esposte, mentre il cervello che contiene il corpo cellulare GF e dendriti rimane 2 in testa intatta . In questa preparazione più nervi of the VNC dovrebbe rimanere attaccati alla loro muscoli.
Dopo la dissezione, il riempimento intracellulare della fibra gigante (GF) con un colorante fluorescente è dimostrata. Nel CVC gli assoni GF si trovano sulla superficie dorsale e quindi possono essere facilmente visualizzati al microscopio con contrasto di interferenza differenziale (DIC) ottica. Questo permette l'iniezione degli assoni GF con colorante in questo sito per etichettare il GF intero compreso gli assoni e la loro terminali nel VNC. Questo metodo si traduce in colorazione affidabile e forte del GF che permette ai neuroni di essere ripreso immediatamente dopo il riempimento con un microscopio epifluorescente. In alternativa, il segnale fluorescente può essere migliorata utilizzando procedure di immunoistochimica standard 3 adatto per la microscopia confocale ad alta risoluzione.
Protocollo
1. Dissezione del cordone nervoso ventrale
Dissezione e tintura di riempimento del GF può essere effettuata a temperatura ambiente. Per tutti dissezione steps freddo (4 ° C) soluzione salina dovrebbe essere usato per rallentare il metabolismo cellulare e mantenere in vita i neuroni più a lungo.
- Anestetizzare le mosche adulte (4 giorni o più) con CO 2 o freddo li su ghiaccio fino a che non sono immobilizzati. Anestesia con ghiaccio richiederà più tempo (fino a 30 min), ma non mancherà di tenere le mosche immobilizzato a lungo.
- Mettere una mosca in un piatto rivestito Sylgard Petri. Questa dissezione richiede l'uso di un alto ingrandimento (80-100X) stereomicroscopio dissezione.
- Con le forbici Vännäs, rimuovere le gambe, proboscide, e le ali.
- Utilizzare pinze grosse e fini perni insetti (pin minutien) per orientare il lato volare dorsale fino nel piatto Sylgard. Perno l'addome e poi allungare l'animale un po 'mettendo due perni su entrambi i lati del collo, dietro la testa, in modo che il collo è leggermente allungato e accessibile (vedi Figura 2).
- Immergere la mosca in acqua dolce, salina fredda Drosophila. Più comunemente usati saline Drosophila sono sufficienti per la dissezione, comunque in questo caso abbiamo utilizzato una soluzione salina descritto in Gu e O'Dowd, 2006 4. Una bolla d'aria che circonda la mosca. Rimuovere l'aria con una siringa.
- Fare una breve incisione laterale nel fine dorsale dell'addome. A partire l'incisione, fare un superficiale, taglio dritto lungo la linea mediana dorsale del torace verso l'addome. Si prosegue poi il superficiale, taglio longitudinale al torace il più precisamente possibile lungo la linea mediana verso il connettivo. È fondamentale per rendere i tagli superficiali per non danneggiare il VNC (Figura 1).
- Utilizzare due perni insetti multa per aprire con attenzione il torace. Diffondere la metà del corpo a parte con le spine e le spine luogo attraverso i muscoli del volo (Figura 2). Il torace non deve essere aperto ulteriormente come illustrato nella figura 2 per evitare lo strappo della cuticola. Per garantire un orientamento dritto of the VNC i pin devono essere collocati nella stessa posizione antero posteriore su ogni lato.
- L'accesso al VNC per l'iniezione tintura e di imaging corretta può essere ostacolato da organi interni. Pertanto, l'uso pinze e forbici per rimuovere lo stomaco, intestino, cuore e organi riproduttivi. Estrarre le ghiandole salivari sdraiata su entrambi i lati del VNC. Sciacquare con cura la dissezione con soluzione salina fresca per rimuovere il tessuto galleggiante e grasso.
- Togliere il grasso corporeo da sotto il connettivo cervicale (CVC). Il corpo grasso è meglio visibile con un ingrandimento elevato. Utilizzare una pinza sottile di cogliere con attenzione il tessuto dal lato ed estrarlo.
La dissezione può essere effettuato entro 5 o 10 minuti. Utilizzando fresco, la soluzione fisiologica fredda sezionato, sistema nervoso danneggiato rimarrà in vita per almeno un'ora.
2. Intracellulare GF riempire
Si raccomanda di eseguire la tintura riempire il più presto possibile dopo la dissezione.
- Porre la capsula Sylgard con la mosca sezionato al microscopio verticale con una fase fissa (Figura 3) e un obiettivo 10x aria. Centro il campione con la fine posteriore della mosca posizionati nei confronti del titolare colorante elettrodo di riempimento. Utilizzare l'interferenza differenziale contrasto (DIC) modalità e concentrarsi sul CVC. Gli assoni grande del GF deve essere chiaramente visibile sulla superficie dorsale del CVC.
- Diluire Lucifero Giallo CH sale dilitio in H2O deionizzata a una concentrazione di 1%. Tirare un elettrodo di vetro borosilicato con filamento di una resistenza di ca. 60-80 MW. La punta del elettrodo di vetro deve essere lungo e affilato. Riempire la punta dell'elettrodo con 1% di soluzione Lucifer Yellow ponendo l'elettrodo con l'estremità opposta della punta dell'elettrodo nella soluzione Lucifero Giallo per ca. 30-60 secondi. Poi l'elettrodo con riempimento 3M LiCl usando una siringa Hamilton lasciando una bolla d'aria tra il colorante e LiCl. Collegare l'elettrodo colorante per riempire lo stadio testa.
- Inserire un filo elettrodo rivestito di cloruro d'argento di terra in soluzione fisiologica e posizionare l'elettrodo colorante riempire al di sopra del parallelo volare verso il VNC utilizzando un micromanipolatore 3D idraulico. L'elettrodo tintura di riempimento dovrebbe essere collegato ad un amplificatore che consente il passaggio di corrente al fine di rilasciare negativamente o positivamente coloranti addebitato l'elettrodo passando iper-o depolarizzanti corrente, rispettivamente.
- Passare a una lente 40x immersione in acqua e abbassare la punta dell'elettrodo colorante riempire su una delle GFS. Gli assoni GF si trovava vicino alla superficie dorsale del CVC. Utilizzare un in avanti (verso la testa), movimento per inserire l'elettrodo nella GF.
- Cambia la tua fonte di luce in luce epifluorescente e passare a un filtro giallo Lucifero. Applicare una corrente iperpolarizzante all'elettrodo colorante riempire con l'amplificatore per iniettare il Giallo di Lucifero nel GF. La quantità di colorante iniettata può essere controllato da ªquantità di corrente e passato così come la durata è passata la corrente. Per evitare che il colorante dalla fuoriuscita del sito d'iniezione o danneggiare la GF, si raccomanda di iniettare con una corrente bassa (circa 3-5 nA) oltre 1-5 minuti.
- Applicare corrente fino a quando il terminale GF nel VNC si può vedere chiaramente (Figura 4A). Per trans-sinaptica dei neuroni postsinaptici colorazione, continuano a passare la corrente fino a colorante può essere visto anche nei neuroni postsinaptici. Spegnere la corrente e togliere l'elettrodo colorante riempimento.
3. Rappresentante dei risultati:
Un colorante rappresentante riempire per una GF con Lucifero giallo è mostrato nella figura 4A. L'immagine è stata acquisita come una serie di immagini nel software Nikon Elementi utilizzando una telecamera montata sul posto il microscopio. In questo campione in esame è stato passato attraverso l'elettrodo per circa 2 minuti. Il GF è completamente riempito e il terminale GF grande nel torace è ben marcato (4A, ellisse). Nessun neuroni postsinaptici sono visibili in questo caso, sebbene Lucifero giallo è abbastanza piccolo da passare attraverso giunzioni gap. Se il colorante non viene iniettato abbastanza a lungo nel GF poi trans-sinaptica riempie dei neuroni post-sinaptici non possono stata vista perché il segnale è troppo debole per essere rilevata. I neuroni postsinaptici al GF (Figura 4B, punte di frecce) possono essere visualizzati in modo più affidabile anche utilizzando traccianti neuronali più piccoli, come ad esempio Neurobiotin. L'iniezione di un Neurobiotin 7% in 2 soluzione di acetato di M di potassio con una corrente depolarizzante per 2 minuti è sufficiente per etichettare i neuroni postsinaptici fortemente. Neurobiotin possono essere visualizzati per la microscopia confocale utilizzando streptavidina accoppiato ai coloranti di diverse lunghezze d'onda. Perché Neurobiotin non è un colorante fluorescente, co-iniezione di Rhodamin-destrano o Idrazidi Alexa nella stessa soluzione, può essere utilizzato per monitorare una iniezione di successo nel GF (Figura 4C, da Boerner e Godenschwege, 2010 5).
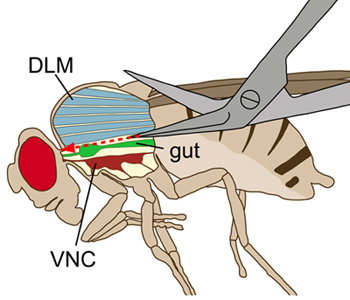
Figura 1. Disegno schematico di una mosca vista lateralmente. Il torace è visualizzato con una incisione longitudinale di visualizzare le strutture interne. Durante la dissezione, i muscoli dorsali volo longitudinale (DLMS, blu) sono stati tagliati senza danneggiare il midollo ventrale del nervo (VNC, profondo rosso), che si trova ventrale ai muscoli del volo. L'intestino (verde) si trova al di sopra del VNC.
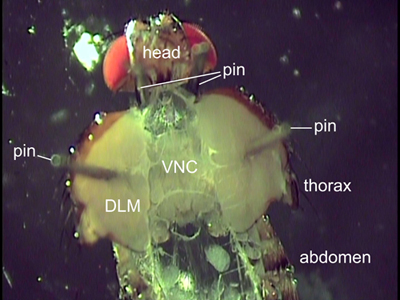
Figura 2. Vista dorsale di una mosca sezionato. Due perni sono posizionati dietro la testa per posizionare al volo. I perni apposta per i muscoli del volo (DLM) tenere il torace aperto. Organi interni sono stati rimossi per esporre il midollo ventrale del nervo (VNC).

Figura 3. Configurazione Dye riempimento.
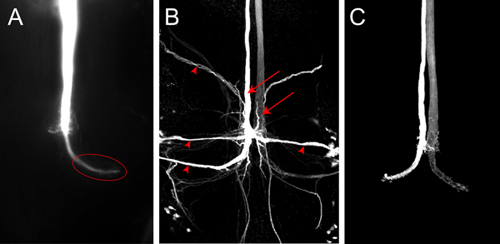
Figura 4. A) Z-proiezione della parte posteriore del VNC mostrando uno GF pieno con Lucifero Giallo. L'immagine è stata acquisita subito dopo la tintura di riempimento con una macchina fotografica posto. In wild-type animali terminale (ellisse) nel torace è ben visibile. B) Immagine confocale di un colorante GF si riempiono di Neurobiotin in una wild-type volare. Entrambi GF (frecce) e neuroni postsinaptici al GF (teste di freccia) sono etichettati. Neurobiotin è stata visualizzata con streptavidina accoppiato ad Cy3. C) Immagine confocale di wild-type GF pieno di Alexa555.
Discussione
Il sistema nervoso può essere sezionati senza estrarre dal corpo volare. Questo ha due vantaggi, in primo luogo, la dissezione provoca pochi danni al sistema nervoso, e la seconda, più i nervi per rimanere attaccati i muscoli e gli organi sensoriali. Esecuzione della dissezione, come descritto, si prepara il campione per dritto in avanti tintura di etichettatura del GF. Per comodità, i motoneuroni postsinaptica al GF rimanere attaccati ai muscoli. Assoni, quindi, non sono danneggiati, mantenendo in vita i neuroni pi?...
Divulgazioni
Riconoscimenti
Il progetto descritto è stato sostenuto dal Codice di Autorizzazione R01HD050725 dal National Institute of Child Health e lo Sviluppo Umano di TAG Il contenuto è di esclusiva responsabilità degli autori e non rappresentano necessariamente la posizione ufficiale del National Institute of Child Health e Sviluppo Umano o il National Institutes of Health. Ringraziamo i membri del laboratorio Godenschwege così come Barbara Schreader per il loro contributo al manoscritto e video.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| Sylgard 184 Kit silicone elastomero | Dow Corning | ||
| Dissezione Microscopio | AmScope | SM-2TZ | |
| Vännäs Forbici Superfine | Strumenti accademico | VS1023 | |
| Dumont Pinza Dumontstar 55 | Strumenti Scienza multa | 11295-51 | |
| Austerlitz insetti perni | Strumenti Scienza multa | 26002-10 | Ø 0,1 millimetri |
| Elettrodi di vetro borosilicato | Mondo Strumenti di precisione | 1B100F-4 | |
| Verticale Pipettare Puller 700c | David Kopf Instruments | Modello 700C | |
| Lucifero Giallo CH dilitio sale | Sigma | L0259 | 1% in H 2 O |
| Fase Microscopio fisso verticale & Camera | Nikon | FN-1 e DS-U2 Telecamera | |
| Piano Fluor Obiettivo Air 10X | Nikon | CFI Plan Fluor 10X NA 16 millimetri 0,3 WD | |
| Acqua Fluor 40X Obiettivo immersione | Nikon | CFI Fluor 40X W NA 0,80 WD 2,0 millimetri | |
| 3D Micromanipolatore idraulico | Narishige internazionale | Modello MW0-3 | |
| Amplificatore | Come Instruments, Inc. | Modello 5A |
Riferimenti
- Power, M. E. The thoracico-abdominal nervous system of an adult insect Drosophila melanogaster. J. Comp. Neurol. 88, 347-409 (1948).
- Allen, M. J., Godenschwege, T. A., Tanouye, T. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Boerner, J., Duch, C. Average shape standard atlas for the adult Drosophila ventral nerve cord. J. Comp. Neurol. 518, 2437-2455 (2010).
- Gu, H., O'Dowd, D. K. Cholinergic synaptic transmission in adult Drosophila Kenyon cells in sity. J. Neurosci. 26, 265-272 (2006).
- Boerner, J., Godenschwege, T. A. Application for the Drosophila ventral nerve cord standard in neuronal circuit reconstruction and in-depth analysis of mutant morphology. J. Neurogent. 24, 158-1567 (2010).
- Godenschwege, T. A., Kristiansen, L. V., Uthaman, S. B., Hortsch, M., Murphey, R. K. A conderved role for Drosophila Neuroglian and human L1-CAM in central-synapse formation. Curr. Biol. 16, 12-23 (2006).
- Uthaman, S. B., Godenschwege, T. A., Murphey, R. K. A mechanism distinct from highwire for the Drosophila ubiquitin conjugase bendless in synaptic growth and maturation. J. Neurosci. 28, 8615-8623 (2008).
- Storkebaum, E. Dominant mutations in the tyrosyl-tRNA synthetase gene recapitulate in Drosophila features of human Charcot-Marie-Tooth neuropathy. Proc. Natl. Acad. Sci. USA. 106, 11782-11787 (2009).
- Allen, M. J., Godenschwege, T. A. Electrophysiological recordings from the Drosophila giant fiber system (GFS). Cold Spring Harb. Protoc. 2010, pdb.prot5453-pdb.prot5453 (2010).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. , (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon