Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ganze Berge Vorbereitung des Adult Drosophila Bauchmark für Giant Fiber Injection Dye
In diesem Artikel
Zusammenfassung
Ein In vivo Dissektion der erwachsenen Drosophila Bauchmark (VNC) ist bewiesen. Diese besondere Dissektion Methode verursacht kaum Schäden an den VNC ermöglicht die spätere Kennzeichnung des riesigen Faser Neuronen mit Fluoreszenzfarbstoff für hochauflösende Bildgebung.
Zusammenfassung
Zur Analyse der axonalen und dendritischen Morphologie von Neuronen, ist es wichtig, die genaue Kennzeichnung von neuronalen Strukturen zu erhalten. Vorbereitung gut markierten Proben mit wenig bis gar keine Gewebeschäden ermöglicht es uns, Zellmorphologie zu analysieren und einzelne Proben miteinander zu vergleichen, so die Möglichkeit, die Identifizierung von Mutanten Anomalien.
In der Sektion zeigte Methode des Nervensystems bleibt meist im Inneren des Erwachsenen fliegen. Durch eine dorsale Inzision, sind der Bauch und Brustkorb geöffnet und die meisten der inneren Organe entfernt werden. Nur die Rückenseite des Bauchmark (VNC) und der Hals-Binde (CVC) mit den großen Axone der riesigen Fasern (GF) 1 ausgesetzt sind, während das Gehirn mit dem GF Zellkörper und Dendriten bleibt 2 in der intakten Kopf . In dieser Vorbereitung die meisten Nerven des VNC sollte, um ihre Muskeln verbunden bleiben.
Nach der Präparation wird die intrazelluläre Befüllung der riesigen Glasfaser (GF) mit einem fluoreszierenden Farbstoff nachgewiesen. In der CVC die GF Axone sind an der dorsalen Oberfläche liegt und somit können leicht sichtbar unter dem Mikroskop mit Differential-Interferenz-Kontrast (DIC) Optik. Dies ermöglicht die Injektion des GF Axone mit Farbstoff an dieser Stelle auf die gesamte GF einschließlich der Axone und ihre Terminals in den VNC-Label. Diese Methode führt zu zuverlässigen und starken Färbung der GF so dass die Neuronen, um sofort nach dem Befüllen mit einer epifluoreszenten Mikroskop abgebildet werden. Alternativ kann die Fluoreszenz-Signal verstärkt mit Standard-Immunhistochemie Verfahren 3 geeignet für hohe Auflösung der konfokalen Mikroskopie werden.
Protokoll
1. Präparation des Bauchmark
Dissection und Farbstoff Füllung des GF kann bei Raumtemperatur durchgeführt werden. Für alle Dissektion Schritte kaltem (4 ° C) Kochsalzlösung verwendet zu verlangsamen Zellstoffwechsel und halten Sie die Neuronen länger am Leben sein.
- Anesthetize erwachsenen Fliegen (4 Tage oder älter) mit CO 2 oder Chill sie auf Eis, bis sie immobilisiert sind. Betäubende mit Eis erfordert mehr Zeit (bis zu 30 min) wird aber die Fliegen länger immobilisiert halten.
- Legen Sie eine Fliege in einem Sylgard beschichtete Petrischale. Diese Zerlegung erfordert den Einsatz von hoher Vergrößerung (80-100X) Dissektion Stereomikroskop.
- Mit Vannas Schere, zu entfernen Beine, Rüssel und Flügel.
- Verwenden Sie groben und feinen Pinzette Insektennadeln (minutien Pins) zu orientieren the fly Dorsalseite in der Sylgard Gericht. Pin den Bauch und dann verlängern das Tier leicht, indem man zwei Pins auf jeder Seite des Halses, hinter dem Kopf, so dass der Hals etwas gestreckt und zugänglich (siehe Abbildung 2).
- Tauchen Sie die fliegen in frischem, kaltem Drosophila Kochsalzlösung. Die am häufigsten verwendeten Drosophila Salinen sind ausreichend für die Präparation, aber hier haben wir eine Kochsalzlösung in Gu und O'Dowd beschrieben, 2006 4 verwendet. Eine Luftblase wird Surround-the-fly. Entfernen Sie die Luft mit einer Spritze.
- Machen Sie eine kurze, seitliche Einschnitt in das dorsale Ende des Bauches. Ab dem Einschnitt, einen flachen, geraden Schnitt entlang der dorsalen Mittellinie des Bauches auf den Brustkorb. Dann weiter die flache, längs geschnitten in den Brustkorb so genau wie möglich entlang der Mittellinie in Richtung der Binde. Es ist entscheidend, um die Schnitte flach, um nicht zu Schäden am VNC (Abbildung 1).
- Verwenden Sie zwei schöne Insekten Pins vorsichtig öffnen den Brustkorb. Verbreiten Sie die Gehäusehälften auseinander mit den Stiften ab und stecken die Stifte durch die Flugmuskulatur (Abbildung 2). Der Brustkorb sollte nicht weiter geöffnet werden, wie in der Abbildung 2 zu vermeiden, Rippen der Kutikula dargestellt. Um eine gerade Ausrichtung der VNC die Stifte sollten in der gleichen vorderen hinteren Position auf jeder Seite platziert werden.
- Der Zugang zu den VNC für Farbstoff-Einspritzung und korrekte Bildgebung kann durch inneren Organe behindert werden. Verwenden Sie daher Pinzette und Schere, um den Magen, Darm, Herz und Fortpflanzungsorgane zu entfernen. Ziehen Sie die Speicheldrüsen liegen auf beiden Seiten des VNC. Spülen Sie die Dissektion sorgfältig mit frischen Kochsalzlösung zu schweben und Fettgewebe zu entfernen.
- Entfernen Sie die fetten Körper unterhalb der zervikalen Bindegewebe (CVC). Der Fettkörper ist am besten sichtbar bei hoher Vergrößerung. Verwenden feinen Pinzette vorsichtig fassen das Gewebe von der Seite und ziehen Sie ihn heraus.
Die Zerlegung kann innerhalb von 5 bis 10 Minuten durchgeführt werden. Durch die Verwendung von frischem, kaltem Kochsalzlösung der seziert, unbeschädigten Nervensystems bleibt für mindestens eine Stunde am Leben.
2. Intrazelluläre GF füllen
Es wird empfohlen, um den Farbstoff zu füllen, sobald wie möglich nach der Präparation durchführen.
- Legen Sie die Sylgard Schale mit dem seziert fliegen unter einem aufrechten Mikroskop mit einer festen Phase (Abbildung 3) und ein 10x Luft Ziel. Zentrum der Probe mit dem hinteren Ende der Fliege auf den Farbstoff zu füllen Elektrodenhalter positioniert. Verwenden Sie die Differential-Interferenz-Kontrast (DIC)-Modus und Fokus auf die CVC. Die großen Axone der GF muss deutlich sichtbar auf der dorsalen Oberfläche des CVC.
- Verdünnen Sie Lucifer Yellow CH Dilithiumsalz in deionisiertem H2O zu einer Konzentration von 1%. Ziehen Sie einen Borosilikatglas Elektrode mit Filament zu einem Widerstand von ca.. 60-80 MOhm. Die Spitze der Glaselektrode sollte lang und scharf. Füllen Sie die Spitze der Elektrode mit 1% Lucifer Yellow-Lösung, indem die Elektrode mit dem entgegengesetzten Ende der Elektrodenspitze in die Lucifer Yellow Lösung für ca.. 30-60 Sekunden. Dann Hinterfüllung der Elektrode mit 3M LiCl mit einer Hamilton-Spritze Verlassen einer Luftblase zwischen dem Farbstoff und LiCl. Verbinden Sie den Farbstoff zu füllen Elektrode an den Kopf der Bühne.
- Legen Sie ein Chlorid-beschichteten Silberdraht Masseelektrode in die Kochsalzlösung und Ort der Farbstoff füllen Elektrode über dem fliegen parallel zu den VNC mit einem 3D-hydraulischen Mikromanipulator. Der Farbstoff füllen Elektrode sollte an einen Verstärker, dass die Weitergabe Strom, um negativ oder positiv geladene Farbstoffe Entlassung aus der Elektrode, indem Hyper-oder depolarisierende Strom bzw. ermöglicht angeschlossen werden.
- Wechseln Sie zu einem 40x Wasser Immersionslinse und unteren Spitze des Farbstoffes füllen Elektrode auf einem der GFS. Die GF Axone legen nahe der dorsalen Oberfläche des CVC. Verwenden Sie eine nach vorne (in Richtung des Kopfes) Bewegung an der Elektrode in die GF einzufügen.
- Ändern Sie Ihre Lichtquelle epifluoreszenten Licht und wechseln Sie zu einem Lucifer Yellow-Filter. Tragen Sie eine Hyperpolarisation aktuellen, um den Farbstoff zu füllen Elektrode mit Verstärker zu den Lucifer Yellow in die GF zu injizieren. Die Menge an Farbstoff injiziert werden kann, indem th gesteuert werdene Menge an Strom bestanden sowie die Dauer der aktuellen übergeben wird. Um zu verhindern, der Farbstoff aus Verschütten aus der Injektionsstelle oder Beschädigung der GF, empfiehlt es sich, spritzen mit einem geringen Strom (ca. 3-5 nA) über 1-5 Minuten.
- Bewerben Strom, bis die GF-Terminal in der VNC deutlich zu erkennen ist (Abbildung 4A). Für trans-synaptische Färbung von postsynaptischen Neuronen, weiterhin passieren, bis Farbstoff kann auch in postsynaptischen Neuronen gesehen aktuell sein. Schalten Sie den Strom, und entfernen Sie die Farbe füllen Elektrode.
3. Repräsentative Ergebnisse:
Ein Vertreter Farbstoff füllen für einen GF mit Lucifer Yellow ist in Abbildung 4A gezeigt. Das Bild wurde als Bild-Stack in Nikon Elements-Software mit einem Spot-Kamera auf dem Mikroskop montiert erworben. In diesem Beispiel Strom durch die Elektrode für ca. 2 Minuten vergangen. Die GF wird gründlich gefüllt und die große GF-Terminal in den Brustkorb ist gut beschriftet (Abbildung 4A, Ellipse). Keine postsynaptischen Neuronen sichtbar sind in diesem Fall, obwohl Lucifer Yellow ist klein genug, um durch gap junctions passieren. Wenn der Farbstoff nicht lange genug in die GF injiziert dann trans-synaptische füllt der postsynaptischen Neuronen möglicherweise nicht gesehen worden, da das Signal zu schwach, um nachgewiesen werden. Neurons postsynaptischen der GFS (4B, Pfeilspitzen) mehr zuverlässig visualisiert werden mit noch kleineren neuronale Tracer wie Neurobiotin. Injektion einer 7% Neurobiotin in 2 M Kaliumacetat-Lösung mit einem depolarisierenden Strom für 2 Minuten ist ausreichend, um postsynaptische Neuronen stark Etikett. Neurobiotin visualisiert werden können für die konfokale Mikroskopie mit Streptavidin gekoppelten Farbstoffe mit unterschiedlichen Wellenlängen. Da Neurobiotin ist nicht ein fluoreszierender Farbstoff, Co-Injektion von Rhodamin-Dextran oder Alexa Hydrazide in der gleichen Lösung, können verwendet werden, um eine erfolgreiche Injektion in die GF (4C, von Boerner und Godenschwege, 2010 5) zu überwachen.
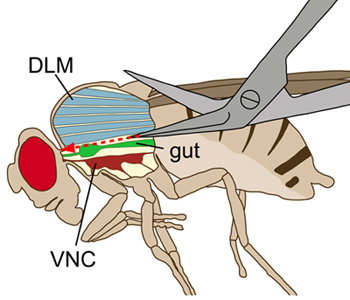
Abbildung 1. Schematische Darstellung einer Fliege von der Seite gesehen. Der Brustkorb wird mit einem Längsschnitt, um die internen Strukturen zu visualisieren angezeigt. Während der Dissektion wurden die dorsalen Längs Flugmuskulatur (DLMs, blau) ohne Beschädigung der Bauchmark (VNC, tief rot), die ventral der Flugmuskulatur liegt geschnitten. Der Darm (grün) liegt oberhalb des VNC.
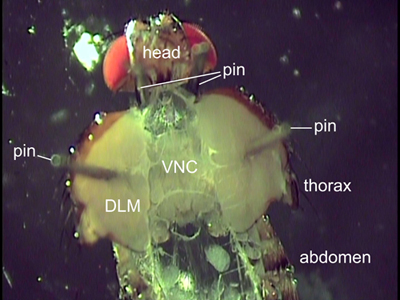
Abbildung 2. Dorsalansicht eines seziert fliegen. Zwei Stifte werden hinter dem Kopf platziert, um die Fliege Position. Die Stifte durch die Flugmuskeln (DLM) angebracht halten den Brustkorb zu öffnen. Innere Organe wurden entfernt, um das Bauchmark (VNC) aussetzen.

Abbildung 3. Dye füllen Setup.
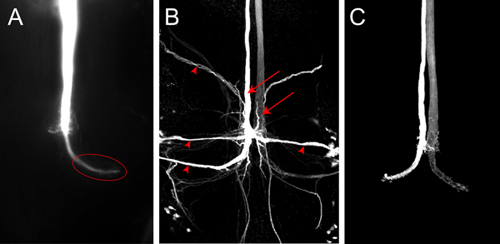
Abbildung 4. A) Z-Projektion der hintere Teil des VNC Darstellung eines GF mit Lucifer Yellow gefüllt. Das Bild wurde unmittelbar nach der Farbstoff Füllung mit einem Spot-Kamera erworben. In Wildtyp-Tieren das Terminal (Ellipse) in den Thorax ist deutlich sichtbar. B) Konfokale Aufnahme eines GF Farbstoff mit Neurobiotin füllen in einem Wildtyp-fly. Beide GFS (Pfeile) und Neuronen postsynaptischen der GFS (Pfeilspitzen) sind markiert. Neurobiotin visualisiert wurde mit Streptavidin an Cy3 gekoppelt. C) Die konfokale Bild von Wildtyp-GF gefüllt mit Alexa555.
Diskussion
Das Nervensystem kann ohne es zu extrahieren aus dem Körper fliegen seziert werden. Dies hat zwei Vorteile, erstens, bewirkt, dass die Zergliederung wenig Schaden für das Nervensystem, und zweitens, die meisten Nerven angeschlossen bleiben, um die Muskeln und Sinnesorgane. Durchführen der Dissektion, wie beschrieben, bereitet die Proben für geradlinig Farbstoff-Kennzeichnung der GFS. Günstig, bleiben die Motoneuronen postsynaptischen der GF an die Muskeln. Axone, also unbeschädigt sind, halten die Neuronen länger...
Offenlegungen
Danksagungen
Das beschriebene Projekt wurde von Grant Number R01HD050725 vom National Institute of Child Health and Human Development unterstützt, um TAG Der Inhalt ist ausschließlich in der Verantwortung der Autoren und stellen nicht notwendigerweise die offizielle Meinung des National Institute of Child Health and Human Development oder die National Institutes of Health. Wir danken Mitglieder der Godenschwege Labor sowie Barbara Schreader für ihren Input, um das Manuskript und Video.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| Sylgard 184 Silikon-Elastomer-Kit | Dow Corning | ||
| Dissektionsmikroskop | AmScope | SM-2TZ | |
| Vannas Scissors Superfine | Academic Instruments | VS1023 | |
| Dumont Pinzetten Dumontstar 55 | Feine Science Tools | 11295-51 | |
| Austerlitz Insect Pins | Feine Science Tools | 26002-10 | Ø 0,1 mm |
| Borosilikatglas Elektroden | World Precision Instruments | 1B100F-4 | |
| Vertical Pipette Puller 700c | David Kopf Instruments | Modell 700C | |
| Lucifer Yellow CH Dilithiumsalz | Sigma | L0259 | 1% in H 2 O |
| Fixed Stage aufrechten Mikroskop und Kamera | Nikon | FN-1 & DS-U2-Kamera | |
| Plan Fluor 10x Air Ziel | Nikon | CFI Plan Fluor 10x NA 0.3 WD 16mm | |
| Fluor 40x Wasser getaucht Ziel | Nikon | CFI Fluor 40x W NA 0,80 WD 2,0 mm | |
| 3D-hydraulischen Mikromanipulator | Narishige Internationalen | Modell MW0-3 | |
| Verstärker | Erste Instruments, Inc. | Modell 5A |
Referenzen
- Power, M. E. The thoracico-abdominal nervous system of an adult insect Drosophila melanogaster. J. Comp. Neurol. 88, 347-409 (1948).
- Allen, M. J., Godenschwege, T. A., Tanouye, T. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Boerner, J., Duch, C. Average shape standard atlas for the adult Drosophila ventral nerve cord. J. Comp. Neurol. 518, 2437-2455 (2010).
- Gu, H., O'Dowd, D. K. Cholinergic synaptic transmission in adult Drosophila Kenyon cells in sity. J. Neurosci. 26, 265-272 (2006).
- Boerner, J., Godenschwege, T. A. Application for the Drosophila ventral nerve cord standard in neuronal circuit reconstruction and in-depth analysis of mutant morphology. J. Neurogent. 24, 158-1567 (2010).
- Godenschwege, T. A., Kristiansen, L. V., Uthaman, S. B., Hortsch, M., Murphey, R. K. A conderved role for Drosophila Neuroglian and human L1-CAM in central-synapse formation. Curr. Biol. 16, 12-23 (2006).
- Uthaman, S. B., Godenschwege, T. A., Murphey, R. K. A mechanism distinct from highwire for the Drosophila ubiquitin conjugase bendless in synaptic growth and maturation. J. Neurosci. 28, 8615-8623 (2008).
- Storkebaum, E. Dominant mutations in the tyrosyl-tRNA synthetase gene recapitulate in Drosophila features of human Charcot-Marie-Tooth neuropathy. Proc. Natl. Acad. Sci. USA. 106, 11782-11787 (2009).
- Allen, M. J., Godenschwege, T. A. Electrophysiological recordings from the Drosophila giant fiber system (GFS). Cold Spring Harb. Protoc. 2010, pdb.prot5453-pdb.prot5453 (2010).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. , (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten