このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
成人の全体のマウントの準備ショウジョウバエ腹神経索
要約
アン in vivoで解剖ショウジョウバエ腹神経索(VNC)が示されています。この特定の解剖法は、高分解能のイメージングのための蛍光染料と巨大な繊維の神経細胞のその後のラベル付けを可能にするVNCへのダメージが少ない。
要約
ニューロンの軸索と樹枝状形態を分析するために、それはニューロン構造の正確なラベル付けを得るために不可欠です。ない組織の損傷に少しでも標識サンプルを準備するので変異体異常の同定を可能にする、私たちは細胞の形態を分析し、お互いに個々のサンプルを比較することができます。
実証解剖の方法では神経系は成人フライの内側主に残ります。背側を切開して、腹部と胸部が開かれ、ほとんどの内臓のが削除されます。 GFの細胞体と樹状突起を含む脳がそのまま頭に2のまま腹神経索(VNC)と巨大な繊維(GFS)1の大きい軸索を含む子宮頸結合(CVC)の唯一の背側は、公開されています。この準備ではVNCのほとんどの神経はそれらの筋肉に接続されたままにしてください。
解剖の後、蛍光色素を持つ巨大な繊維(GF)の細胞内の充填が実証される。 CVCにGFの軸索は、背面に配置されていますので、微分干渉コントラスト(DIC)光学系と顕微鏡下で容易に可視化することができる。これは、このサイトでは染料とGFの軸索の注入は、VNCの軸索とその端子を含む全体のGFにラベルを付けることができます。ニューロンは、落射蛍光顕微鏡で充填した後、直ちに画像化できるようにGFSの信頼性と強力な染色では、このメソッドの結果。また、蛍光シグナルは高分解能共焦点顕微鏡に適した標準的な免疫組織化学の手順3を使用して拡張することができます。
プロトコル
1。腹神経索の解剖
GF充填解剖と染料は、室温で行うことができます。すべての解剖が冷たいな手順については(4℃)生理食塩水は細胞の新陳代謝を遅くして、より長い神経細胞が生き続けるために使用する必要があります。
- CO 2の成人のハエ(4日以上)を麻酔またはそれらが固定化されるまで、氷上で冷やします。氷で麻酔すると、より時間がかかります(最大30分)が長いために固定化したハエ続けます。
- Sylgardコーティングしたペトリ皿内の1つフライを置きます。この解剖は、高倍率(80 - 100X)解剖の実体顕微鏡を使用する必要があります。
- Vannasのはさみで、足、テングザル、そして翼を取り外します。
- Sylgard皿の中で配向するフライ背側を粗鉗子と細かい虫ピンを(minutienピン)を使用してください。第一腹部を固定してから(図2を参照)首がわずかに伸張しており、アクセス可能であるように、頭の後ろ、首の両側にある2つのピンを配置することによって、わずかに動物を細長い。
- 新鮮な、冷たいショウジョウバエの生理食塩水のフライ水没。最も一般的に使用されるショウジョウバエのSalinesのは解剖のために十分な、しかしここで我々は、区とオダウド、2006年4で説明した生理食塩水を使用していました。気泡は、フライで囲まれます。シリンジで空気を取り外します。
- 腹部の背側端に短く、横方向の切開を加えます。切開から始まり、胸部に向かって腹部の背側正中線に沿って浅い、ストレートカットを行います。その後、結合に向かって正中線に沿って可能な限り正確な胸部の浅い、長手方向のカットを継続する。それは、VNC(図1)を損傷しないようにカットが浅いために重要です。
- 慎重に胸部を開くには2微細な昆虫ピンを使用してください。体がピンを使用して離れて半分に広がり、飛翔筋(図2)を介してピンを配置。キューティクルのリッピングを避けるために、図2に示すように胸部がさらに開かれるべきではない。 VNCの直線方向を確保するためのピンは両側で同じ前方後方位置に配置する必要があります。
- 色素注入と、適切なイメージングのためのVNCへのアクセスは、内部器官によって妨害されることがあります。したがって、胃、腸、心臓、生殖器官を削除するには鉗子やハサミを使う。 VNCの両側に横たわっている唾液腺を引き出します。フローティング組織と脂肪を除去するために新鮮な生理食塩水で慎重に解剖をすすぐ。
- 子宮頸結合(CVC)の下から体脂肪を取り除きます。脂肪体は、高倍率での最善表示されます。慎重にサイドから組織を把握し、それを引き出すために微細な鉗子を使用してください。
解剖は、5〜10分以内に行うことができます。新鮮な、冷たい生理食塩水を使用して解剖し、無傷の神経系は、少なくとも1時間のために生きているままになります。
2。細胞内GFフィル
それは解剖後できるだけ早く充填色素を実行することをお勧めします。
- 固定ステージ(図3)と10倍の空気を目的とした正立顕微鏡下で解剖フライでSylgard皿を置きます。センター染料フィル電極ホルダーに向けて配置さハエの後端とサンプル。 CVCの微分干渉コントラスト(DIC)モードとフォーカスを使用してください。 GFSの大きな軸索は、CVCの背側表面上にはっきりと見えるはずです。
- 1%の濃度まで脱イオン水でルシファーイエローCHジリチウム塩を希釈する。約の抵抗にフィラメントとホウケイ酸ガラス電極を引き出します。 MΩ60から80。ガラス電極の先端が長く、シャープにする必要があります。約のためのルシファーイエローソリューションへの電極の先端の反対側の端に電極を配置することにより1%ルシファーイエロー溶液を電極の先端を埋める。 30〜60秒。その後、染料とLiClの間に気泡を残してハミルトンシリンジを使用して3M LiClを持つ電極をバックフィル。ヘッドステージに染料充填電極を接続してください。
- 生理食塩水に塩化コーティングされた銀線の接地電極を挿入し、3次元油圧マイクロマニピュレーターを使用してVNCのフライ平行上記の色素の塗り電極を配置する。色素充填電極はそれぞれ、ハイパーまたは現在の脱分極を渡すことによって悪影響を解放したり、電極からの正に帯電した染料にするために電流を流すことができるアンプに接続する必要があります。
- 40倍水浸レンズに切り替えて、GFSの一つに色素充填電極の先端を下げる。 GFの軸索は、CVCの背側表面に近い置く。 GFに電極を挿入するために前方に(頭に向かって)動きを使用してください。
- 落射蛍光光とルシファーイエローフィルターのスイッチに光源を変更します。 GFにルシファーイエローを注入するために、アンプと染料フィル電極に分極電流を適用する。色素注入の量は目で制御することができます現在の電子の量は、渡されただけでなく、持続時間の電流が渡されます。注射部位または損傷GF外にこぼれることから色素を防ぐために、それを1〜5分間にわたり低電流(約3〜5 NA)を用いて注入することをお勧めします。
- VNCでのGFの端末がはっきりと見ることができるまで、現在適用されます(図4A)。シナプス後ニューロンのシナプス経由の染色に、染料もシナプス後ニューロンに見られるようになるまでに電流を流すために引き続き。現在のスイッチをオフにし、色素充填電極を取り外します。
3。代表的な結果:
代表的な色素ルシファーイエローを使用すると、ワンGFの塗りつぶしは、図4Aに示されています。画像は、顕微鏡に搭載されたスポットのカメラを使用してニコンの要素のソフトウェアで画像をスタックとして買収された。このサンプルでは、現在は約2分間電極を通過させた。 GFは、徹底的に満ちていると胸郭の大きなGF端子がよく(図4A、楕円)というラベルが付いています。ルシファーイエローは、ギャップジャンクションを通過するのに十分小さいですが、何シナプス後ニューロンは、この場合は表示されません。信号が検出されるには余りにも弱いため染料がGFに十分な長さに注入されていない場合は、トランスシナプスシナプス後ニューロンの塗りつぶしが見られていない可能性があります。 GFSへのシナプス後ニューロンが(図4B、矢印の頭)などNeurobiotinのようなさらに小さな神経トレーサーを使用して、より確実に可視化することができる。 2分間脱分極電流と2 M酢酸カリウム溶液で7%Neurobiotinを注入することを強くシナプス後ニューロンを標識するために十分です。 Neurobiotinは、異なる波長の色素に結合したストレプトアビジンを用いて共焦点顕微鏡のための視覚化できます。 Neurobiotinは蛍光色素、同じソリューション内にローダミン-デキストランまたはAlexaのヒドラジドの同時注入ではないため、GF(BoernerとGodenschwegeから図4C、、2010 5)に成功した注射を監視するために使用することができます。
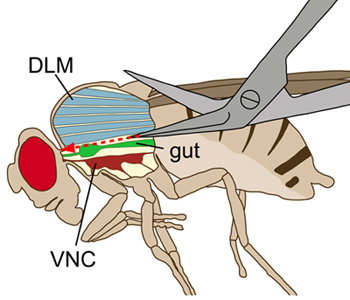
図1。フライの模式図が横方向に表示。胸部は内部構造を可視化するために縦切開で表示されます。解剖時には、背側縦飛翔筋(DLMS、青)は飛翔筋の腹側にある腹側神経索(VNC、深い赤)を、損なうことなく、カットされた。腸(緑)はVNCの上に位置しています。
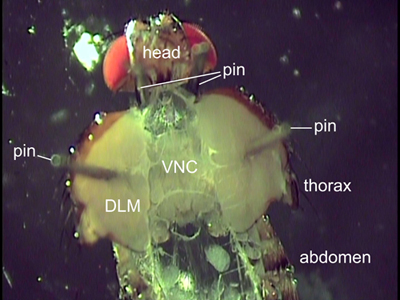
図2。解剖ハエの背ビュー。 2本のピンをフライの位置を頭の後ろに配置されます。飛翔筋(DLM)を介して貼付端子は胸部が開いて保持する。内臓は、腹側神経索(VNC)を公開する削除されました。

図3。色素充填セットアップ。
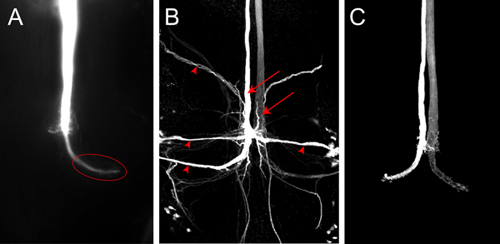
ルシファーイエローを充填した1 GFを示すVNCの後部の4)Z -射影図 。画像は、染料がスポットカメラで充填した後、すぐに買収された。野生型マウスでは胸部にある端末(楕円)がはっきりと見える。 B)GF色素の共焦点画像は、野生型のハエにNeurobiotinを詰めます。 GFS(矢印)とGFS(矢印の頭)にシナプス後ニューロンの両方が標識されている。 Neurobiotinは、ストレプトアビジンは、Cy3のために結合を持つ可視化した。 C)野生型GFSの共焦点画像は、Alexa555でいっぱい。
ディスカッション
神経系は、ハエの体からそれを抽出することなく解剖することができます。これは、最初、次の2つの利点が、解剖は神経系へのダメージが少ない、そして第二に、ほとんどの神経は、筋肉や感覚器官に付着したままでいる。解剖を行って、説明されているように、まっすぐ前方に色素標識GFSのためのサンプルを準備します。便利に、GFSにシナプス後ニューロンは、筋肉に付着したままでいる...
開示事項
謝辞
プロジェクトは、もっぱら著者の責任であり、必ずしも母子保健と人間開発や国立研究所の公式見解を表していないコンテンツをタグ付けするために母子保健と人間開発の国立研究所からの助成金番号R01HD050725によってサポートされていました説明国立衛生研究所。私たちは、原稿とビデオへの入力のためGodenschwegeラボだけでなく、バーバラSchreaderのメンバーに感謝。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| Sylgard 184シリコーンエラストマーキット | ダウコーニング | ||
| 解剖顕微鏡 | AmScope | SM - 2TZ | |
| Vannasはさみスーパーファイン | アカデミックインスツルメンツ | VS1023 | |
| デュモン鉗子Dumontstar 55 | ファイン科学ツール | 11295〜51 | |
| アウステルリッツの昆虫ピン | ファイン科学ツール | 26002〜10 | Ø 0.1ミリメートル |
| ホウケイ酸ガラス電極 | 世界の精密機器 | 1B100F - 4 | |
| 700C垂直ピペットプラー | デビッドKopfは楽器 | 700Cモデル | |
| ルシファーイエローCH二リチウム塩 | シグマ | L0259 | H 2 Oの1% |
| 固定ステージ正立顕微鏡とカメラ | ニコン | FN - 1&DS - U2カメラ | |
| 計画フルーア10Xエア目的 | ニコン | CFIプランフルーア16ミリメートル10倍、NA 0.3 WD | |
| フッ素40X水浸対物 | ニコン | CFIフルーア40X W NA 0.80 WD 2.0ミリメートル | |
| 3D油圧マニピュレーター | ナリシゲインターナショナル | モデルMW0 - 3 | |
| アンプ | 楽器をはじめ、(株) | モデル5A |
参考文献
- Power, M. E. The thoracico-abdominal nervous system of an adult insect Drosophila melanogaster. J. Comp. Neurol. 88, 347-409 (1948).
- Allen, M. J., Godenschwege, T. A., Tanouye, T. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Boerner, J., Duch, C. Average shape standard atlas for the adult Drosophila ventral nerve cord. J. Comp. Neurol. 518, 2437-2455 (2010).
- Gu, H., O'Dowd, D. K. Cholinergic synaptic transmission in adult Drosophila Kenyon cells in sity. J. Neurosci. 26, 265-272 (2006).
- Boerner, J., Godenschwege, T. A. Application for the Drosophila ventral nerve cord standard in neuronal circuit reconstruction and in-depth analysis of mutant morphology. J. Neurogent. 24, 158-1567 (2010).
- Godenschwege, T. A., Kristiansen, L. V., Uthaman, S. B., Hortsch, M., Murphey, R. K. A conderved role for Drosophila Neuroglian and human L1-CAM in central-synapse formation. Curr. Biol. 16, 12-23 (2006).
- Uthaman, S. B., Godenschwege, T. A., Murphey, R. K. A mechanism distinct from highwire for the Drosophila ubiquitin conjugase bendless in synaptic growth and maturation. J. Neurosci. 28, 8615-8623 (2008).
- Storkebaum, E. Dominant mutations in the tyrosyl-tRNA synthetase gene recapitulate in Drosophila features of human Charcot-Marie-Tooth neuropathy. Proc. Natl. Acad. Sci. USA. 106, 11782-11787 (2009).
- Allen, M. J., Godenschwege, T. A. Electrophysiological recordings from the Drosophila giant fiber system (GFS). Cold Spring Harb. Protoc. 2010, pdb.prot5453-pdb.prot5453 (2010).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. , (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved