Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation Mont entiers de l'Adulte Drosophile Chaîne nerveuse ventrale pour injection fibre Dye Géant
Dans cet article
Résumé
Une In vivo de l'adulte Drosophile nerveuse ventrale (VNC) est démontrée. Cette méthode de dissection particulier provoque peu de dégâts à l'VNC permettant l'étiquetage ultérieur de la fibre de neurones géants avec un colorant fluorescent pour l'imagerie haute résolution.
Résumé
Pour analyser la morphologie axonale et dendritique des neurones, il est essentiel d'obtenir un étiquetage précis des structures neuronales. Préparation des échantillons bien étiquetés avec peu ou pas endommager les tissus nous permet d'analyser la morphologie des cellules et de comparer des échantillons individuels les uns aux autres, permettant ainsi l'identification des anomalies mutant.
Dans la méthode de dissection démontré le système nerveux reste le plus souvent à l'intérieur de la mouche adulte. Grâce à une incision dorsale, l'abdomen et le thorax sont ouverts et la plupart des organes internes sont enlevés. Seule la face dorsale de la moelle nerveuse ventrale (VNC) et le connectif cervical (CVC) qui contient les axones des fibres grands géants (GFS) 1 sont exposées, tandis que le cerveau contenant le corps cellulaire et des dendrites GF reste deux dans la tête intacte . Dans cette préparation la plupart des nerfs de la VNC doit rester attachés à leurs muscles.
Après la dissection, le remplissage intracellulaire de la fibre géante (GF) avec un colorant fluorescent est démontrée. Dans le CVC les axones GF sont situés à la surface dorsale et peut donc être facilement visualisés au microscope à contraste d'interférence différentiel (DIC) optique. Cela permet l'injection du colorant axones GF avec ce site à l'étiquette du GF entier, y compris les axones et leurs terminaux dans le VNC. Cette méthode aboutit à coloration solide et fiable de l'ETG permettant aux neurones à imager immédiatement après le remplissage avec un microscope à épifluorescence. Alternativement, le signal fluorescent peut être améliorée en utilisant des procédures standard de 3 immunohistochimie adapté à la microscopie confocale à haute résolution.
Protocole
1. Dissection de la corde nerveuse ventrale
Dissection et de teinture de remplissage de la GF peut être effectuée à température ambiante. Pour tous les dissections étapes froid (4 ° C) une solution saline devrait être utilisé pour ralentir le métabolisme cellulaire et de garder les neurones en vie plus longtemps.
- Anesthetize mouches adultes (4 jours ou plus) avec CO 2 ou les refroidir sur glace jusqu'à ce qu'ils soient immobilisés. Anesthésier avec de la glace, il faudra plus de temps (jusqu'à 30 min), mais gardera les mouches immobilisé pendant plus longtemps.
- Placez une mouche dans une boîte de Pétri Sylgard couché. Cette dissection nécessite l'utilisation d'un fort grossissement (80-100X) stéréomicroscope dissection.
- Avec des ciseaux Vannas, retirez les jambes, trompe, et les ailes.
- Utilisez une pince grossières et fines broches insectes (broches minutien) pour orienter le côté volée dorsale dans le plat Sylgard. Pin de l'abdomen d'abord et ensuite allongé l'animal légèrement en plaçant deux broches de chaque côté du cou, derrière la tête, de sorte que le cou est légèrement étirée et accessibles (voir Figure 2).
- Immerger la volée dans l'eau douce, salée froide drosophile. Les plus couramment utilisés Salines drosophile sont suffisantes pour la dissection, mais ici nous avons utilisé une solution saline décrit dans Gu et O'Dowd, 2006 4. Une bulle d'air va entourer la volée. Retirer l'air avec une seringue.
- Faire une courte incision latérale dans l'extrémité postérieure de l'abdomen. À partir de l'incision, faire un peu profonde, coupe droite le long de la ligne médiane dorsale de l'abdomen vers le thorax. Puis poursuivre la faible profondeur, coupe longitudinale dans le thorax le plus précisément possible le long de la ligne médiane vers le conjonctif. Il est essentiel de faire des coupes peu profondes pour ne pas endommager la VNC (figure 1).
- Utiliser deux broches insectes amende à ouvrir avec précaution le thorax. Fais le corps moitiés part en utilisant les broches et le lieu des broches à travers les muscles de vol (figure 2). Le thorax ne doit pas être ouvert d'autres comme le montre le graphique 2 pour éviter de déchirer de la cuticule. Pour assurer une orientation droite de la VNC les broches doivent être placés dans la même position postérieure antérieure de chaque côté.
- L'accès à la VNC pour l'injection de colorant et d'imagerie appropriées peuvent être obstruées par des organes internes. Par conséquent, l'utilisation de pinces et de ciseaux pour retirer l'estomac, l'intestin, le cœur et les organes reproducteurs. Tirez sur les glandes salivaires couché sur les deux côtés de la VNC. Rincer soigneusement la dissection avec une solution saline douce pour enlever les tissus flottants et les graisses.
- Retirez la graisse du corps par le dessous du col de l'utérus conjonctifs (CVC). La graisse du corps est mieux visible à fort grossissement. Utilisez une pince fine à saisir attentivement le tissu sur le côté et tirez.
La dissection peut être effectuée dans les 5 à 10 minutes. En utilisant fraîche, salée froide de la disséquer, système nerveux endommagé restera vivant pendant au moins une heure.
2. Intracellulaire GF remplissez
Il est recommandé d'effectuer le colorant remplir dès que possible après la dissection.
- Placer le plat Sylgard à la mouche disséquée sous un microscope droit à une scène fixe (figure 3) et un objectif 10x de l'air. Centre de l'échantillon avec l'extrémité postérieure de la mouche positionné vers le support d'électrode de remplir colorant. Utilisez l'interférence contraste différentiel (DIC) de mode et se concentrer sur le CVC. Les axones des grands de la SFP devraient être clairement visibles sur la surface dorsale de la CVC.
- Diluer Lucifer Yellow CH dilithium sel dans H2O déionisée à une concentration de 1%. Tirez une électrode en verre borosilicate avec filament à une résistance d'env. 60-80 MQ. La pointe de l'électrode de verre doit être long et pointu. Remplissez la pointe de l'électrode avec une solution de jaune Lucifer% en plaçant l'électrode avec l'extrémité opposée de la pointe de l'électrode dans la solution de Lucifer Yellow pour env. 30-60 secondes. Puis remblai de l'électrode avec 3M LiCl utilisant une seringue Hamilton laissant une bulle d'air entre le colorant et LiCl. Connecter l'électrode de teinture de remplir le stade la tête.
- Insérer un chlorure d'argent au sol électrode enrobée fil dans la saline et placer l'électrode de teinture de remplir au-dessus des parallèles voler à la VNC en utilisant un micromanipulateur 3D hydraulique. L'électrode de teinture de remplissage doit être connecté à un amplificateur qui permet de passer en cours afin de libérer positivement ou négativement chargés colorants de l'électrode en passant hyper-ou courant dépolarisant, respectivement.
- Basculer vers un objectif à immersion d'eau 40x et inférieure de la pointe de l'électrode de teinture de remplir sur l'une des GFS. Les axones GF se trouvait près de la surface dorsale de la CVC. Utilisez un en avant (vers la tête) le mouvement d'insérer l'électrode dans la GF.
- Changez votre source de lumière à la lumière épifluorescence et passer à un filtre jaune Lucifer. Appliquer un courant hyperpolarisante à l'électrode de teinture de remplir avec l'amplificateur à injecter le jaune Lucifer dans la GF. La quantité de colorant injecté peut être commandé par ee montant du courant transmis ainsi que la durée du courant est passé. Pour empêcher la teinture de se répandre hors du site d'injection ou d'endommager le GF, il est recommandé d'injecter à l'aide d'un courant faible (environ 3-5 nA) sur 1-5 minutes.
- Appliquer en cours jusqu'à la terminale GF dans le VNC peut être vu clairement (figure 4A). Pour trans-synaptique des neurones postsynaptiques coloration, continuer à passer le courant jusqu'à ce colorant peut aussi être vu dans les neurones post-synaptiques. Couper le courant et retirez l'électrode de teinture de remplissage.
3. Les résultats représentatifs:
Un colorant représentant remplir pour un GF avec Lucifer jaune est montré dans la figure 4A. L'image a été acquise dans une pile d'images dans Nikon éléments logiciels en utilisant une caméra spot monté sur le microscope. Dans ce courant de l'échantillon a été adoptée par l'électrode pendant environ 2 minutes. Le GF est bien rempli et le terminal GF grande dans le thorax est bien étiqueté (figure 4A, ellipse). Pas de neurones postsynaptiques sont visibles dans ce cas, bien que Lucifer Yellow est assez petit pour passer à travers les jonctions communicantes. Si le colorant n'est pas injecté suffisamment longtemps dans le GF, puis trans-synaptiques remplit des neurones postsynaptiques peuvent pas été vu parce que le signal est trop faible pour être détecté. Les neurones postsynaptiques de la SFP (figure 4B, pointes de flèches) peuvent être visualisées en utilisant de façon plus fiable, même petits traceurs neuronaux, tels que Neurobiotin. L'injection d'un Neurobiotin 7% en solution 2 M d'acétate de potassium avec un courant de dépolarisation pendant 2 minutes est suffisante pour étiqueter les neurones postsynaptiques fortement. Neurobiotin peuvent être visualisées pour la microscopie confocale à l'aide de streptavidine couplée à des colorants de longueurs d'onde différentes. Parce Neurobiotin n'est pas un colorant fluorescent, co-injection de Rhodamine-dextran ou hydrazides Alexa dans la même solution, peut être utilisé pour surveiller une injection réussie dans la GF (figure 4C, à partir de Boerner et Godenschwege, 2010 5).
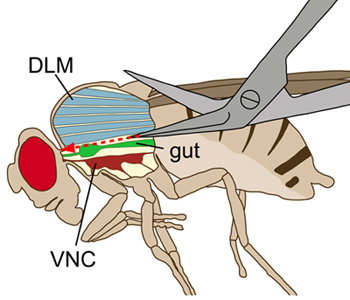
Figure 1. Schéma de principe d'une mouche vu latéralement. Le thorax est affiché avec une incision longitudinale de visualiser les structures internes. Lors de la dissection, les muscles dorsaux vol longitudinal (DLMS, bleu) ont été coupés, sans endommager la corde nerveuse ventrale (VNC, un rouge profond), qui se trouve dans les muscles ventraux vol. L'intestin (vert) se trouve au-dessus du VNC.
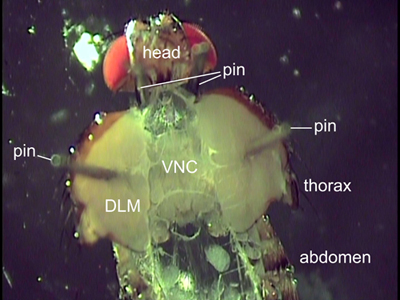
Figure 2. Vue dorsale d'une mouche disséquée. Deux broches sont placées derrière la tête à la position de l'avion. Les broches fixée à travers les muscles de vol (DLM) détiennent le thorax ouvert. Les organes internes ont été enlevés afin d'exposer la corde nerveuse ventrale (VNC).

Figure 3. Dye configuration de remplissage.
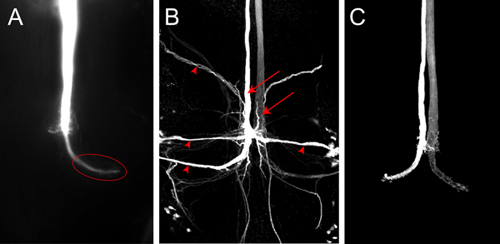
Figure 4. A) Z-projection de la partie postérieure de la VNC montrant un GF remplis avec Lucifer Yellow. L'image a été acquise immédiatement après le remplissage de teinture avec un appareil photo spot. En animaux de type sauvage du terminal (ellipse) dans le thorax est clairement visible. B) l'image confocale d'un colorant GF remplir de Neurobiotin dans un avion de type sauvage. Les deux GFS (flèches) et les neurones postsynaptiques de la SFP (pointes de flèches) sont étiquetés. Neurobiotin été visualisées avec streptavidine couplée à Cy3. C) l'image confocale de type sauvage rempli de GFS Alexa555.
Discussion
Le système nerveux peut être disséqués sans l'extraire du corps de la mouche. Cela a deux avantages, d'abord, la dissection cause peu de dommages au système nerveux et, deuxièmement, la plupart des nerfs restent attachés à des muscles et des organes sensoriels. Exécution de la dissection, comme décrit, prépare l'échantillon pour simple colorant d'étiquetage de la SFP. Idéalement, les motoneurones postsynaptiques au GFS rester attaché aux muscles. Les axones, par conséquent, ne sont pas en...
Déclarations de divulgation
Remerciements
Le projet décrit a été soutenue par la concession numéro R01HD050725 de l'Institut national de la santé infantile et le développement humain de baliser le contenu est exclusivement la responsabilité de leurs auteurs et ne représentent pas nécessairement les vues officielles de l'Institut national de la santé infantile et du développement humain ou de la National Institutes of Health. Nous remercions les membres du laboratoire Godenschwege ainsi que Barbara Schreader pour leur contribution au manuscrit et vidéo.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Sylgard 184 Kit élastomère de silicone | Dow Corning | ||
| Microscope à dissection | AmScope | SM-2TZ | |
| Vannas Ciseaux Superfine | Instruments académique | VS1023 | |
| Pince Dumont Dumontstar 55 | Outils Fine Science | 11295-51 | |
| Broches insectes Austerlitz | Outils Fine Science | 26002-10 | Ø 0,1 mm |
| Les électrodes de verre borosilicate | Instruments de précision du monde | 1B100F-4 | |
| Verticale pipette Extracteur 700c | David Kopf Instruments | Modèle 700C | |
| Lucifer Yellow CH dilithium sel | Sigma | L0259 | 1% dans H 2 O |
| Microscope scène fixe vertical et appareil photo | Nikon | FN-1 et DS-U2 Caméra | |
| Objectif du Plan Fluor Air 10X | Nikon | FCI plan Fluor 10X NA 0,3 16mm DEO | |
| Fluor 40X eau plongeant Objectif | Nikon | FCI Fluor 40X W NA 0,80 DEO 2.0mm | |
| 3D Micromanipulateur hydrauliques | Narishige international | Modèle MW0-3 | |
| Amplificateur | Obtenir Instruments, Inc | Modèle 5A |
Références
- Power, M. E. The thoracico-abdominal nervous system of an adult insect Drosophila melanogaster. J. Comp. Neurol. 88, 347-409 (1948).
- Allen, M. J., Godenschwege, T. A., Tanouye, T. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Boerner, J., Duch, C. Average shape standard atlas for the adult Drosophila ventral nerve cord. J. Comp. Neurol. 518, 2437-2455 (2010).
- Gu, H., O'Dowd, D. K. Cholinergic synaptic transmission in adult Drosophila Kenyon cells in sity. J. Neurosci. 26, 265-272 (2006).
- Boerner, J., Godenschwege, T. A. Application for the Drosophila ventral nerve cord standard in neuronal circuit reconstruction and in-depth analysis of mutant morphology. J. Neurogent. 24, 158-1567 (2010).
- Godenschwege, T. A., Kristiansen, L. V., Uthaman, S. B., Hortsch, M., Murphey, R. K. A conderved role for Drosophila Neuroglian and human L1-CAM in central-synapse formation. Curr. Biol. 16, 12-23 (2006).
- Uthaman, S. B., Godenschwege, T. A., Murphey, R. K. A mechanism distinct from highwire for the Drosophila ubiquitin conjugase bendless in synaptic growth and maturation. J. Neurosci. 28, 8615-8623 (2008).
- Storkebaum, E. Dominant mutations in the tyrosyl-tRNA synthetase gene recapitulate in Drosophila features of human Charcot-Marie-Tooth neuropathy. Proc. Natl. Acad. Sci. USA. 106, 11782-11787 (2009).
- Allen, M. J., Godenschwege, T. A. Electrophysiological recordings from the Drosophila giant fiber system (GFS). Cold Spring Harb. Protoc. 2010, pdb.prot5453-pdb.prot5453 (2010).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. , (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon