Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación Todo el montaje del Adulto Drosophila Cordón nervioso ventral para inyección gigante tinte de fibra
En este artículo
Resumen
Un In vivo La disección de los adultos Drosophila nervioso ventral (VNC) se demuestra. Este método de disección en particular causa pocos daños en el VNC que permite el posterior marcado de las neuronas de fibra gigante con tinte fluorescente para obtener imágenes de alta resolución.
Resumen
Para analizar la morfología axonal y dendrítico de las neuronas, es esencial para obtener un correcto etiquetado de las estructuras neuronales. La preparación de muestras y etiquetado con poco o ningún daño a los tejidos nos permite analizar la morfología celular y para comparar las muestras individuales entre sí, permitiendo así la identificación de anomalías mutante.
En el método de disección demostró que el sistema nervioso sigue siendo en su mayoría dentro de la mosca adulta. A través de una incisión dorsal, el abdomen y el tórax se abren y la mayor parte de los órganos internos son removidos. Sólo la parte dorsal del cordón nervioso ventral (VNC) y el conectivo cervical (CVC), que contiene los axones de las fibras grandes gigantes (FC) 1 se exponen, mientras que el cerebro contiene el cuerpo celular y las dendritas GF sigue siendo dos en la cabeza intacta . En esta preparación la mayoría de los nervios de la VNC debe permanecer unido a sus músculos.
Después de la disección, el relleno intracelular de la fibra gigante (GF), con un tinte fluorescente se demuestra. En la CVC de los axones GF se encuentran en la superficie dorsal y por lo tanto pueden ser fácilmente visualizados con un microscopio con contraste de interferencia diferencial (DIC) óptica. Esto permite la inyección de los axones GF con el tinte en este sitio para la etiqueta del GF completo, incluyendo los axones y sus terminales en el VNC. Este método da lugar a manchas confiable y fuerte de la FC que permite a las neuronas para formar una imagen inmediatamente después del llenado con un microscopio de epifluorescencia. Por otra parte, la señal fluorescente se puede mejorar utilizando los métodos convencionales de inmunohistoquímica 3 adecuada para la microscopía confocal de alta resolución.
Protocolo
1. La disección de la cuerda ventral del nervio
La disección y el tinte de llenado de la GF se puede realizar a temperatura ambiente. Para todos los pasos de la disección en frío (4 ° C) de solución salina se utiliza para disminuir el metabolismo celular y mantener las neuronas vivas por más tiempo.
- Anestesiar a las moscas adultas (4 días o más) con CO 2 o se ponen a enfriar en hielo hasta que se inmovilizan. Anestesia con hielo requerirá más tiempo (hasta 30 min), pero se mantienen las moscas inmovilizado durante más tiempo.
- Coloque una mosca en un plato de Petri recubiertas Sylgard. Esta disección requiere el uso de un gran aumento (80-100X) estereomicroscopio disección.
- Con unas tijeras Vannas, retire las patas, trompa y las alas.
- El uso de fórceps finos y gruesos alfileres de insectos (pins minutien) para orientar la cara dorsal volar en el plato Sylgard. Pin el abdomen y luego se alargan un poco el animal mediante la colocación de dos pines en cada lado del cuello, detrás de la cabeza, de modo que el cuello es un poco estirado y accesibles (ver Figura 2).
- Sumerja la marcha en una solución salina fría y fresca Drosophila. Más comúnmente utilizado salines Drosophila son suficientes para la disección, sin embargo aquí se utilizó una solución salina descrito en Gu y O'Dowd, 2006 4. Una burbuja de aire que rodean la marcha. Extraer el aire con una jeringa.
- Haga una pequeña incisión, lateral en el extremo dorsal del abdomen. A partir de la incisión, hacer un poco profundo, de corte recto a lo largo de la línea media dorsal del abdomen hacia el tórax. Luego continuar con el corte superficial, longitudinal en el tórax con la mayor precisión posible a lo largo de la línea media hacia el conectivo. Es muy importante para hacer los cortes superficiales para no dañar el VNC (Figura 1).
- Use dos pernos de insectos muy bien para abrir cuidadosamente el tórax. Corre el cuerpo mitades con los pernos y coloque los pasadores a través de los músculos de vuelo (Figura 2). El tórax no se debe abrir aún más como se muestra en la Figura 2 para evitar la extracción de la cutícula. A fin de garantizar una orientación hacia el VNC los pines deben ser colocados en la misma posición anterior, posterior a cada lado.
- El acceso a la VNC para la inyección de contraste y una imagen acústica correcta puede ser obstruida por los órganos internos. Por lo tanto, el uso de fórceps y tijeras para cortar el estómago, los intestinos, el corazón y los órganos reproductivos. Tire de las glándulas salivales tendido en ambos lados de la VNC. Enjuague la disección cuidadosa con solución salina para eliminar el tejido fresco flotantes y grasas.
- Retire la grasa corporal por debajo de la conectivo cervical (CVC). La grasa corporal se ve mejor en un gran aumento. Use unas pinzas finas de entender cuidadosamente el tejido de la cara y tire de ella.
La disección se puede realizar dentro de los 5 a 10 minutos. Mediante el uso de solución salina fría y fresca de la disección, el sistema nervioso en buen estado se mantendrá con vida durante al menos una hora.
2. Intracelular llenar GF
Se recomienda realizar el tinte de llenado tan pronto como sea posible después de la disección.
- Coloque el plato Sylgard con la mosca disecados bajo un microscopio vertical, con un escenario fijo (Figura 3) y un objetivo de 10x de aire. Centro de la muestra con el extremo posterior de la mosca colocado hacia el soporte del electrodo llenar tinte. Use el contraste de interferencia diferencial (DIC) y el modo de enfoque en la CVC. Los axones grandes de la FC debe ser claramente visible en la superficie dorsal de la CVC.
- Diluir Lucifer Amarillo CH sal de dilitio en H2O desionizada a una concentración del 1%. Tirar de un electrodo de vidrio borosilicato con filamento de una resistencia de aprox. 60-80 mW. La punta del electrodo de vidrio debe ser larga y afilada. Llenar la punta del electrodo con Lucifer solución al 1% Amarillo, colocando el electrodo con el extremo opuesto a la punta del electrodo en la solución de Lucifer amarillo durante aprox. 30-60 segundos. Luego rellenar el electrodo con 3M LiCl con una jeringa Hamilton dejando una burbuja de aire entre el colorante y LiCl. Conecte el electrodo de tinte de relleno para la etapa de la cabeza.
- Inserte un alambre recubierto de cloruro de plata en el electrodo de tierra salina y colocar el electrodo de tinte llenar por encima del paralelo volar a la VNC utilizando un micromanipulador hidráulico 3D. El electrodo de llenar tinte debe ser conectado a un amplificador que permite que la corriente que pasa a fin de liberar positiva o negativamente a los tintes cargados desde el electrodo al pasar hiper o despolarizante actual, respectivamente.
- Cambiar a una lente de 40x de inmersión en agua y baja la punta del electrodo de llenar tinte en una de las EFP. Los axones GF estaba cerca de la superficie dorsal de la CVC. Utilice una hacia adelante (hacia la cabeza), movimiento de insertar el electrodo en la GF.
- Cambiar la fuente de luz a la luz de epifluorescencia y cambiar a un filtro amarillo Lucifer. Aplicar una corriente hiperpolarizante al electrodo de llenar tinte con el amplificador para inyectar el amarillo Lucifer en el GF. La cantidad de colorante inyectado puede ser controlado por thcantidad de corriente e pasado, así como la duración se pasa la corriente. Para evitar que la tinta se derrame fuera del sitio de la inyección o el daño del FG, se recomienda inyectar con una corriente baja (aproximadamente 3.5 nA) durante 1-5 minutos.
- Aplicar actual hasta la terminal de GF en el VNC se puede ver claramente (Figura 4). Para trans-sináptica tinción de las neuronas postsinápticas, siguen paso de la corriente hasta el colorante también se puede ver en las neuronas postsinápticas. Desconecte la corriente y retire el electrodo llenar tinte.
3. Los resultados representativos:
Un tinte representante de relleno para un GF con Lucifer amarillo se muestra en la Figura 4. La imagen fue tomada como una pila de imágenes en el software Nikon elementos con una cámara montada en el lugar microscopio. En esta corriente de la muestra se pasó a través del electrodo durante unos 2 minutos. El GF es completamente llena y la terminal de GF grande en el tórax es bien marcado (Figura 4, la elipse). No neuronas post-sinápticas son visibles en este caso, aunque Lucifer amarillo es lo suficientemente pequeño para pasar a través de uniones. Si el tinte no se inyecta el tiempo suficiente en el GF se trans-sináptica se llena de las neuronas postsinápticas pueden no ser vistos, porque la señal es demasiado débil para ser detectada. Neuronas postsinápticas de la FC (Figura 4B, puntas de flecha) se pueden visualizar con mayor fiabilidad el uso aún más pequeños marcadores neuronales, como Neurobiotin. La inyección de un Neurobiotin 7% en solución de acetato de 2 M de potasio con una corriente de despolarización durante 2 minutos es suficiente para calificar las neuronas postsinápticas con fuerza. Neurobiotin puede ser visualizado por microscopía confocal utilizando estreptavidina acoplada a los tintes de diferentes longitudes de onda. Porque Neurobiotin no es un tinte fluorescente, co-inyección de rodamina-Dextran o hidrazidas Alexa en la misma solución, se puede utilizar para controlar una inyección de éxito en el GF (Figura 4C, de Boerner y Godenschwege, 2010 5).
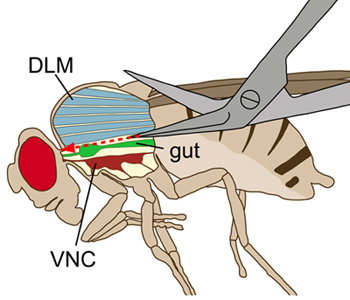
Figura 1. Esquema de una mosca visto lateralmente. El tórax se muestra con una incisión longitudinal para visualizar las estructuras internas. Durante la disección, los músculos dorsales longitudinales de vuelo (DLMS, azul) se cortaron sin dañar el cordón nervioso ventral (VNC, de color rojo oscuro), que se encuentra ventral a los músculos de vuelo. El intestino (verde) se encuentra por encima de la VNC.
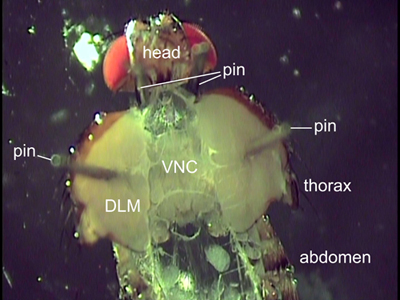
Figura 2. Vista dorsal de una mosca disecada. Dos se colocan clavos detrás de la cabeza a la posición de la marcha. Los pines fijada a través de los músculos de vuelo (DLM) tienen el tórax abierto. Los órganos internos fueron trasladados a exponer el cordón nervioso ventral (VNC).

Figura 3. Tinte de configuración de relleno.
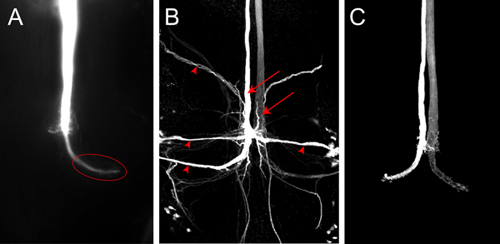
Figura 4. A) Z-proyección de la parte posterior de la VNC mostrando un GF lleno de Lucifer amarillo. La imagen fue tomada inmediatamente después de la tintura de relleno con una cámara de lugar. En animales de tipo salvaje de la terminal (elipse) en el tórax es claramente visible. B) la imagen confocal de un medio de GF se llenan de Neurobiotin en un vuelo de tipo salvaje. Tanto FC (flechas) y las neuronas postsinápticas de la FC (cabezas de flecha) están etiquetados. Neurobiotin se visualiza con estreptavidina acoplada a Cy3. C) la imagen confocal de tipo salvaje FC lleno de Alexa555.
Discusión
El sistema nervioso se puede diseccionar sin extraerlo del cuerpo volar. Esto tiene dos ventajas, en primer lugar, la disección causa poco daño al sistema nervioso, y en segundo lugar, la mayoría de los nervios permanecer conectados a los músculos y órganos sensoriales. Realización de la disección, como se describe, se prepara la muestra para el directo de tinte etiquetado de las finanzas públicas. Convenientemente, las motoneuronas postsináptica a la FC permanecer conectados a los músculos. Axones, por lo tan...
Divulgaciones
Agradecimientos
El proyecto descrito fue apoyada por número de concesión R01HD050725 del Instituto Nacional de Salud Infantil y Desarrollo Humano para etiquetar el contenido es de exclusiva responsabilidad de sus autores y no representa necesariamente las opiniones oficiales del Instituto Nacional de Salud Infantil y Desarrollo Humano o el Institutos Nacionales de Salud. Agradecemos a los miembros del laboratorio, así como Godenschwege Schreader Barbara por su aporte al manuscrito y video.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Sylgard 184 Kit de elastómero de silicona | Dow Corning | ||
| Microscopio de disección | AmScope | SM-2TZ | |
| Vannas tijeras superfinas | Instrumentos académicos | VS1023 | |
| Dumont Pinzas Dumontstar 55 | Herramientas de Bellas Ciencia | 11295-51 | |
| Austerlitz alfileres de insectos | Herramientas de Bellas Ciencia | 26002-10 | Ø 0,1 mm |
| Los electrodos de vidrio borosilicato | Mundial de Instrumentos de Precisión | 1B100F-4 | |
| Extractor vertical con una pipeta de 700c | David Kopf Instruments | Modelo 700C | |
| Lucifer Amarillo CH dilitio sal | Sigma | L0259 | 1% en H 2 O |
| Microscopio de fase fija vertical y cámara | Nikon | FN-1 y la cámara DS-U2 | |
| Plan Fluor Objetivo de aire 10 veces | Nikon | CFI Plan Fluor 10X NA 0.3 16 mm WD | |
| Agua Fluor 40x Objetivo de inmersión | Nikon | CFI Fluor 40x W NA 0.80 WD 2.0mm | |
| Micromanipulador hidráulica 3D | Narishige Internacional | Modelo MW0-3 | |
| Amplificador | Cómo Instruments, Inc. | Modelo 5A |
Referencias
- Power, M. E. The thoracico-abdominal nervous system of an adult insect Drosophila melanogaster. J. Comp. Neurol. 88, 347-409 (1948).
- Allen, M. J., Godenschwege, T. A., Tanouye, T. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Boerner, J., Duch, C. Average shape standard atlas for the adult Drosophila ventral nerve cord. J. Comp. Neurol. 518, 2437-2455 (2010).
- Gu, H., O'Dowd, D. K. Cholinergic synaptic transmission in adult Drosophila Kenyon cells in sity. J. Neurosci. 26, 265-272 (2006).
- Boerner, J., Godenschwege, T. A. Application for the Drosophila ventral nerve cord standard in neuronal circuit reconstruction and in-depth analysis of mutant morphology. J. Neurogent. 24, 158-1567 (2010).
- Godenschwege, T. A., Kristiansen, L. V., Uthaman, S. B., Hortsch, M., Murphey, R. K. A conderved role for Drosophila Neuroglian and human L1-CAM in central-synapse formation. Curr. Biol. 16, 12-23 (2006).
- Uthaman, S. B., Godenschwege, T. A., Murphey, R. K. A mechanism distinct from highwire for the Drosophila ubiquitin conjugase bendless in synaptic growth and maturation. J. Neurosci. 28, 8615-8623 (2008).
- Storkebaum, E. Dominant mutations in the tyrosyl-tRNA synthetase gene recapitulate in Drosophila features of human Charcot-Marie-Tooth neuropathy. Proc. Natl. Acad. Sci. USA. 106, 11782-11787 (2009).
- Allen, M. J., Godenschwege, T. A. Electrophysiological recordings from the Drosophila giant fiber system (GFS). Cold Spring Harb. Protoc. 2010, pdb.prot5453-pdb.prot5453 (2010).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. , (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados