A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הר הכנה שלמים של המבוגר תסיסנית עצבי חוט הגחון עבור הזרקת סיבים ענק דיי
In This Article
Summary
In vivo דיסקציה של המבוגר תסיסנית העצב הגחוני (VNC) הוא הוכיח. שיטה זו לנתיחה מסוים גורם נזק קטן של VNC המאפשר תיוג הבאים של נוירונים סיב ענק עם צבע פלואורסצנטי עבור הדמיה ברזולוציה גבוהה.
Abstract
כדי לנתח את המורפולוגיה axonal ו הדנדריטים של נוירונים, זה הכרחי כדי לקבל תיוג מדויק של מבנים עצביים. הכנת דוגמאות שכותרתו היטב עם מעט שום נזק לרקמות מאפשרת לנו לנתח מורפולוגיה תאים להשוות דגימות בודדות זה לזה, ולכן מאפשרת זיהוי של אנומליות מוטציה.
בשיטה לנתיחה הפגינו את מערכת העצבים נשאר בעיקר בתוך הזבוב הבוגר. דרך חתך הגב, הבטן החזה נפתחים ואת רוב האיברים הפנימיים יוסרו. רק בצד הגבי של חוט העצב הגחוני (VNC) ואת החיבור צוואר הרחם (CVC) המכיל את האקסונים גדולה של סיבי ענק (GFS) 1 חשופים, בעוד המוח המכיל את גוף התא GF ו נשאר דנדריטים 2 בראש שלם . בהכנה זו רוב העצבים של VNC צריך להישאר מחוברים השרירים שלהם.
בעקבות לנתיחה, ממלאים את תאיים של סיבים הענק (GF) עם פלורסנט לצבוע מודגם. ב CVC האקסונים GF ממוקמות על פני השטח הגבי, ולכן ניתן דמיינו בקלות תחת מיקרוסקופ עם ניגודיות ההפרש התערבות (DIC) אופטיקה. זה מאפשר הזרקה של אקסונים GF עם צבע באתר זה לתווית GF כולו כולל אקסונים ומסופי שלהם VNC. שיטה זו גורמת מכתים אמין וחזק של GFS המאפשר הנוירונים להיות צילמו מיד לאחר מילוי עם מיקרוסקופ epifluorescent. לחלופין, האות ניאון ניתן לשפר באמצעות נהלים אימונוהיסטוכימיה תקן 3 מתאים מיקרוסקופיה ברזולוציה גבוהה confocal.
Protocol
1. Dissection של חוט העצב הגחון
Dissection ואת צבע המילוי של GF יכול להתבצע בטמפרטורת החדר. עבור לנתיחה כל הצעדים קר (4 ° C) מלוחים יש להשתמש כדי להאט את חילוף החומרים של התא לנוירונים להמשיך בפעילותם יותר.
- הרדימי זבובים בוגרים (4 ימים ומעלה) עם CO 2 או לצנן אותם על הקרח עד שהם משותקים. הרדמה עם קרח ידרוש זמן רב יותר (עד 30 דקות) אבל ישמור על זבובים משותקת למשך זמן ארוך יותר.
- מקום אחד לטוס צלחת פטרי Sylgard מצופה. דיסקציה זה מחייב שימוש בהגדלה גבוהה (80-100x) stereomicroscope לנתיחה.
- עם מספריים Vannas, להסיר את הרגליים, חוטם, וכנפיים.
- שימוש במלקחיים גס סיכות חרקים קנס (סיכות minutien) כדי לכוון את הצד הגבי לטוס למעלה בצלחת Sylgard. הצמד את הבטן הראשון ולאחר מכן להאריך את חיה מעט על ידי הנחת שתי סיכות מכל צד של הצוואר, מאחורי הראש, כך הצוואר נמתח מעט נגיש (ראה איור 2).
- להטביע את לעוף טרי מלח, תסיסנית קר. הנפוץ ביותר salines תסיסנית מספיקים לנתיחה, אולם כאן השתמשנו מלוחים המתואר גו ו אודוד, 2006 4. בועת אוויר יקיפו את לעוף. מוציאים את האוויר בעזרת מזרק.
- ביצוע חתך קצר, לרוחב לתוך סוף הגבי של הבטן. החל החתך, להפוך רדוד, ישר לחתוך לאורך קו האמצע הגבי של הבטן לכיוון החזה. ואז להמשיך לחתוך רדוד, האורך של החזה באופן מדויק ככל האפשר לאורך קו האמצע לעבר החיבור. זה קריטי כדי לבצע חתכים הרדוד שלא לפגוע VNC (איור 1).
- השתמש שתי סיכות חרקים בסדר בזהירות לפתוח את בית החזה. מורחים הגוף חצאים בנפרד באמצעות סיכות המקום סיכות דרך השרירים טיסה (איור 2). החזה לא אמור להיפתח עוד כפי מתואר באיור 2, כדי למנוע קריעה של לציפורן. כדי להבטיח אוריינטציה ישר של VNC הסיכות יש להציב אותו בעמדה קדמית האחורי בכל צד.
- גישה VNC להזרקה לצבוע הדמיה נכונה עשויה להיות חסום על ידי האיברים הפנימיים. לכן, להשתמש במלקחיים ומספריים כדי להסיר את הבטן, המעיים, הלב, אברי הרבייה. משוך את בלוטות הרוק שוכב על שני הצדדים של VNC. שוטפים את לנתיחה בזהירות עם מלוחים טריים להסיר רקמת שומן צף.
- הסר את השומן בגוף מתחת חיבור צוואר הרחם (CVC). שומן נראה לעין הטובה ביותר בהגדלה גבוהה. שימוש במלקחיים בסדר בזהירות לתפוס את הרקמה מהצד למשוך אותו החוצה.
דיסקציה יכול להתבצע בתוך 5 עד 10 דקות. באמצעות מלוחים טריים, הקור גזור, מערכת העצבים ניזוק יישאר בחיים לפחות שעה אחת.
2. תאיים GF למלא
מומלץ לבצע את צבע מילוי בהקדם האפשרי לאחר הניתוח.
- מניחים את צלחת Sylgard עם לטוס גזור תחת מיקרוסקופ זקופה עם במה קבועה (איור 3) ו - מטרה אוויר 10x. מרכז המדגם עם סיום האחורי של הזבוב ממוקם כלפי בעל אלקטרודה צבע המילוי. השתמש התערבות ההפרש לעומת זאת (DIC) במצב ולהתמקד CVC. אקסונים גדול של GFS צריך להיות בבירור על פני השטח הגבי של CVC.
- המדולל לוציפר צהוב מלח CH dilithium ב H2O deionized ריכוז של 1%. משוך אלקטרודה זכוכית בורוסיליקט עם נימה התנגדות של כ. 60-80 MΩ. הטיפ של אלקטרודת זכוכית צריך להיות ארוכות וחדות. מלאו את קצה האלקטרודה בתמיסת 1% צהוב לוציפר ידי הצבת אלקטרודה עם בקצה השני קצה האלקטרודה לתוך פתרון הצהוב לוציפר עבור כ. 30-60 שניות. ואז למילוי האלקטרודה עם 3M LiCl שימוש במזרק המילטון עוזב בועת אוויר בין צבע ו LiCl. חבר את האלקטרודה למלא לצבוע לשלב את הראש.
- הכנס מצופה כסף כלוריד תיל אלקטרודה לתוך הקרקע מלוחים והמקום האלקטרודה למלא לצבוע מעל במקביל לטוס VNC באמצעות micromanipulator הידראולי 3D. אלקטרודה מילוי צבע צריך להיות מחובר מגבר המאפשר העברת זרם כדי לשחרר שלילי או חיובי צבעים טעונה מן האלקטרודה ידי העברת יתר או depolarizing הנוכחי, בהתאמה.
- החלף ל עדשה 40X טבילה במים ולהוריד את קצה האלקטרודה למלא צבע על אחד GFS. אקסונים GF שכב קרוב לפני השטח הגבי של CVC. השתמש תנועה קדימה (לכיוון הראש) להכניס את האלקטרודה לתוך GF.
- שינוי מקור האור שלכם לאור epifluorescent ולעבור מסנן צהוב לוציפר. החלת הנוכחית hyperpolarizing אל האלקטרודה למלא לצבוע עם המגבר להזריק הצהוב לוציפר לתוך GF. הכמות של צבע המוזרק יכול להיות נשלט על ידי הכמות הדואר הנוכחי עבר, כמו גם משך הזמן הנוכחי הוא עבר. כדי למנוע את שפיכת צבע מתוך מתוך הזריקה או נזק GF, מומלץ להזריק באמצעות זרם נמוכה (כ 3-5 NA) במשך 1-5 דקות.
- החל הנוכחי עד למסוף GF ב VNC ניתן לראות בבירור (איור 4 א). עבור מכתים טרנס סינפטיים של נוירונים postsynaptic, להמשיך להעביר הנוכחית עד לצבוע ניתן גם לראות בנוירונים postsynaptic. כבה הנוכחית להסיר את האלקטרודה למלא לצבוע.
3. נציג תוצאות:
לצבוע נציג למלא עבור GF אחד עם לוציפר צהוב מוצג באיור 4 א. התמונה נרכשה כמו ערימה תמונה תוכנה אלמנטים Nikon באמצעות מצלמה במקום רכוב על המיקרוסקופ. בחודש הנוכחי זה מדגם עברה דרך האלקטרודה למשך כ 2 דקות. GF הוא מילא ביסודיות את הטרמינל GF גדול החזה מסומן היטב (איור 4A, אליפסה). אין נוירונים postsynaptic נראים במקרה הזה, למרות לוציפר צהוב הוא קטן מספיק כדי לעבור דרך צמתים הפער. אם הצבע לא מוזרק מספיק זמן לתוך GF אז טרנס הסינפטי ממלא של נוירונים postsynaptic לא יכול היה לראות כי האות חלש מדי כדי להתגלות. נוירונים postsynaptic של GFS (איור 4B, ראשי חץ) ניתן דמיינו בצורה מהימנה יותר אפילו באמצעות קליעים נותבים נוירונים קטנים יותר, כגון Neurobiotin. הזרקת Neurobiotin 7% פתרון M 2 אצטט אשלגן עם זרם depolarizing 2 דקות מספיקה כדי תווית נוירונים postsynaptic בתוקף. Neurobiotin ניתן דמיינו עבור מיקרוסקופיה confocal באמצעות streptavidin מצמידים את צובעת של אורכי גל שונים. מכיוון Neurobiotin אינו צבע פלואורסצנטי, שיתוף הזרקת Rhodamin-dextran או hydrazides אלקסה בפתרון זהה, יכול לשמש כדי לפקח על הזרקה מוצלחת לתוך GF (איור 4C, מן Boerner ו Godenschwege, 2010 5).
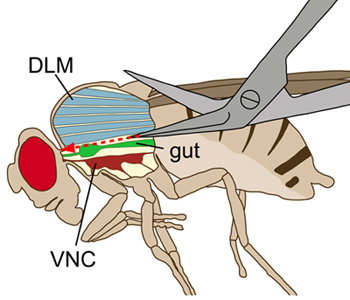
באיור 1. ציור סכמטי של זבוב הנצפים רוחבית. החזה מוצג עם חתך אורכי לדמיין את המבנים הפנימיים. במהלך הניתוח, שרירי הגב טיסה האורך (DLMs, כחול) נחתכו ללא פגיעה בחוט עצב הגחוני (VNC, אדום עמוק), הנמצאת הגחון לשרירים הטיסה. בטן (ירוק) נמצא מעל VNC.
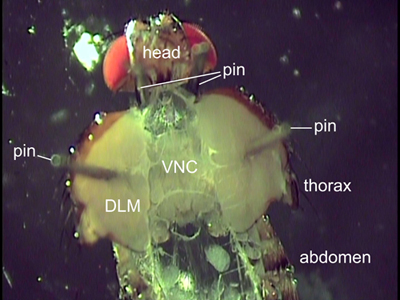
איור 2. התצוגה הגבי של זבוב גזור. שני הפינים ממוקמים מאחורי הראש כדי למקם את לעוף. סיכות מודבקת באמצעות השרירים טיסה (DLM) להחזיק בית החזה פתוח. איברים פנימיים הוצאו לחשוף את חוט העצבים הגחוני (VNC).

איור 3. ההתקנה דיי למלא.
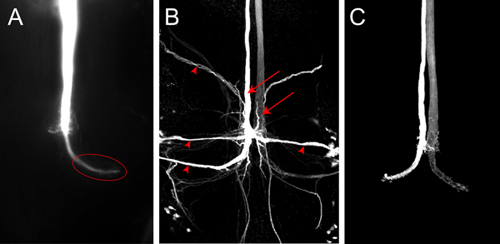
איור 4.) Z-השלכה של החלק האחורי של VNC להציג אחת GF מלא לוציפר צהוב. התמונה נרכשה מיד לאחר צבע מילוי עם מצלמה במקום. ב wild-type חיות הטרמינל (אליפסה) של בית החזה נראה בבירור. ב) תמונה Confocal של צבע GF להתמלא Neurobiotin ב לעוף wild-type. שני GFS (חיצים) ו נוירונים postsynaptic על GFS (ראשי חץ) מסומנים. Neurobiotin היה דמיינו עם streptavidin מצמידים את Cy3. ג) Confocal תמונה של wild-type GFS מלא Alexa555.
Discussion
מערכת העצבים יכולה להיות גזור ללא חילוץ אותו מהגוף לעוף. זו שני יתרונות, הראשון, דיסקציה גורמת נזק מועט במערכת העצבים, ושנית, עצבים ביותר להישאר מחוברים אל השרירים ואיברי חישה. ביצוע הנתיחה, כפי שתואר, מכין את המדגם עבור ישר תיוג, צבע לפנים של GFS. נוח, motoneurons postsynaptic של GFS ?...
Disclosures
Acknowledgements
הפרויקט מתואר נתמכה על ידי מספר גרנט R01HD050725 מהמכון הלאומי לבריאות הילד והתפתחות האדם לתייג התוכן הוא באחריות הבלעדית של הכותבים ולא בהכרח מייצגים את הדעות הרשמיות של המכון הלאומי לבריאות הילד והתפתחות האדם או המכונים הלאומיים לבריאות. אנו מודים לחברי במעבדה Godenschwege כמו גם ברברה Schreader עבור קלט שלהם כתב היד ווידאו.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| Sylgard 184 אלסטומר סיליקון Kit | Dow Corning | ||
| Dissection מיקרוסקופ | AmScope | SM-2TZ | |
| Vannas Superfine מספריים | האקדמית מכשירים | VS1023 | |
| דומון מלקחיים Dumontstar 55 | המדע כלים פיין | 11295-51 | |
| אוסטרליץ סיכות חרקים | המדע כלים פיין | 26002-10 | Ø 0.1mm |
| בורוסיליקט אלקטרודות זכוכית | העולם מכשירי דיוק | 1B100F-4 | |
| אנכי פיפטה פולר 700c | דוד Kopf מכשירים | דגם 700C | |
| לוציפר צהוב CH dilithium מלח | סיגמא | L0259 | 1% H 2 O |
| שלב מיקרוסקופ קבוע מצלמה זקופה & | ניקון | FN-1 & DS-U2 מצלמה | |
| תוכנית פלואוריד המטרה האוויר 10X | ניקון | CFI תוכנית פלואוריד 10X NA 0.3 WD 16mm | |
| פלואוריד במים 40X טבילה המטרה | ניקון | CFI פלואוריד 40X W NA 0.80 WD 2.0mm | |
| Micromanipulator הידראולי 3D | Narishige הבינלאומי | דגם MW0-3 | |
| מגבר | קבלת מכשירים, Inc | דגם 5A |
References
- Power, M. E. The thoracico-abdominal nervous system of an adult insect Drosophila melanogaster. J. Comp. Neurol. 88, 347-409 (1948).
- Allen, M. J., Godenschwege, T. A., Tanouye, T. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Boerner, J., Duch, C. Average shape standard atlas for the adult Drosophila ventral nerve cord. J. Comp. Neurol. 518, 2437-2455 (2010).
- Gu, H., O'Dowd, D. K. Cholinergic synaptic transmission in adult Drosophila Kenyon cells in sity. J. Neurosci. 26, 265-272 (2006).
- Boerner, J., Godenschwege, T. A. Application for the Drosophila ventral nerve cord standard in neuronal circuit reconstruction and in-depth analysis of mutant morphology. J. Neurogent. 24, 158-1567 (2010).
- Godenschwege, T. A., Kristiansen, L. V., Uthaman, S. B., Hortsch, M., Murphey, R. K. A conderved role for Drosophila Neuroglian and human L1-CAM in central-synapse formation. Curr. Biol. 16, 12-23 (2006).
- Uthaman, S. B., Godenschwege, T. A., Murphey, R. K. A mechanism distinct from highwire for the Drosophila ubiquitin conjugase bendless in synaptic growth and maturation. J. Neurosci. 28, 8615-8623 (2008).
- Storkebaum, E. Dominant mutations in the tyrosyl-tRNA synthetase gene recapitulate in Drosophila features of human Charcot-Marie-Tooth neuropathy. Proc. Natl. Acad. Sci. USA. 106, 11782-11787 (2009).
- Allen, M. J., Godenschwege, T. A. Electrophysiological recordings from the Drosophila giant fiber system (GFS). Cold Spring Harb. Protoc. 2010, pdb.prot5453-pdb.prot5453 (2010).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. , (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved