Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Всего Подготовка горе взрослых Drosophila Брюшной нервной для инъекций Гигантские Dye Волоконно
В этой статье
Резюме
В естественных условиях Рассечение взрослых Drosophila Брюшной нервной цепочки (VNC) демонстрируется. Данный метод вскрытия причин незначительный ущерб VNC позволяет последующих маркировки гигантские нейроны волокна с флуоресцентным красителем для высоким разрешением.
Аннотация
Для анализа аксонального и дендритные морфологии нейронов, крайне важно получить точную маркировку нейронных структур. Подготовка и помечены образцы с практически нет повреждения тканей позволяет проанализировать морфологии клеток и сравнивать отдельные образцы друг с другом, следовательно, позволяющие идентификацию мутантных аномалий.
В методе вскрытия показали нервной системы остается главным образом внутри взрослой мухи. Через спинной разрез брюшной полости и грудной клетки открыты, и большинство внутренних органов удаляются. Только спинной стороне брюшной нервной цепочки (VNC) и соединительной шейки (CVC), содержащих большое аксоны гигантских волокон (GFS) 1 подвергаются, в то время как мозг с телом Ф. клетки и дендриты остается 2 в нетронутыми голову . В этот препарат наиболее нервы VNC должна оставаться привязаны к своим мышцам.
После вскрытия, внутриклеточные заполнение гигантского волокна (GF) с флуоресцентным красителем демонстрируется. В CVC GF аксонов расположены на спинной поверхности и тем самым могут быть легко визуализированы под микроскопом с дифференциалом интерференционного контраста (DIC) оптики. Это позволяет инъекции аксонов GF с красителем на этом сайте для обозначения всей GF включая аксонов и их терминалов в VNC. Этот метод приводит к надежным и сильным окрашивание GFs позволяет нейронам для включения в образ сразу же после заполнения epifluorescent микроскопом. Кроме того, флуоресцентный сигнал может быть усилен с помощью стандартных процедур иммуногистохимии 3 подходит для высокое разрешение конфокальной микроскопии.
протокол
1. Рассечение брюшной нервной
Разбор и красителя заполнения GF могут быть выполнены при комнатной температуре. Для всех рассечение шаги холодного (4 ° С), солевой должны быть использованы для замедляют метаболизм клетки и держать нейронов живыми дольше.
- Обезболить взрослых мух (4 дня и старше) с СО 2 или холод их на лед, пока они не обездвижен. Обезболивающий со льдом потребует больше времени (до 30 мин), но будет держать мух иммобилизованных дольше.
- Разместите один летать в Sylgard покрытием чашке Петри. Это рассечение требует использования больших увеличениях (80-100X) рассечение стереомикроскопа.
- С ножницами Vannas, удалите ноги, хоботок и крылья.
- Используйте пинцет грубой и тонкой насекомых штифты (minutien контакта) ориентироваться летать спинной стороны в блюдо Sylgard. Pin живота, а затем удлиненное животное немного, поставив два штифта на каждой стороне шеи, за голову, так что шея слегка растягивается и доступным (см. Рисунок 2).
- Погрузите летать в свежей холодной солевой дрозофилы. Наиболее часто используемые дрозофилы солончаков являются достаточными для вскрытия, однако здесь мы использовали солевой описано в Гу и О'Дауд, 2006 4. Пузырек воздуха будет окружать летать. Удаление воздуха с помощью шприца.
- Сделать коротких боковых разреза в спинной части живота. Начиная с разрезом, сделать мелкий, прямой разрез вдоль спинной средней линии живота к грудной клетке. Затем продолжайте мелкий, продольного разреза в грудную клетку как можно более точно по средней линии в сторону соединительной. Очень важно, чтобы сокращение мелкой, чтобы не повредить VNC (рис. 1).
- Используйте два тонких контактов насекомого тщательно открытой грудной клетки. Распространение теле половин разделить при помощи булавки и место булавки полета мышц (рис. 2). Грудная клетка не должна быть открыта дальнейшем, как показано на рисунке 2, чтобы избежать копирования из кутикулы. Для обеспечения прямой ориентации VNC контакты должны быть размещены в том же самом переднем заднем положении на каждой стороне.
- Доступ к VNC для инъекций красителя и правильное изображение может быть ограничен внутренними органами. Поэтому, используйте щипцы и ножницы для удаления желудка, кишечника, сердца и половых органов. Вытяните слюнных желез лежащим по обе стороны VNC. Промыть тщательно рассечение со свежими физиологическим раствором для удаления плавающих ткани и жира.
- Удаление жира из-под шейки соединительной (CVC). Жира в организме лучше виден на большом увеличении. Использование тонких щипцов тщательно понять ткани со стороны и вытяните ее.
Рассечение может быть выполнена в течение 5 до 10 минут. При использовании свежей холодной солевой рассеченные, неповрежденной нервной системе останется жив, по крайней мере один час.
2. Внутриклеточное GF заполнить
Рекомендуется выполнять красителя заполнения как можно скорее после вскрытия.
- Место Sylgard блюдо с расчлененным летать под прямой микроскоп с фиксированным этапе (рис. 3) и 10-кратным цель воздуха. Центр образца с задним концом летать расположены к красителя заполнить держатель электрода. Используйте контраст дифференциальных помех (DIC) режиме и сосредоточиться на CVC. Больших аксонов GFs должны быть четко видны на дорсальной поверхности CVC.
- Развести Люцифер Желтый CH dilithium соли в деионизированной H2O до концентрации 1%. Вытяните Боросиликатное стеклянный электрод с нитью, чтобы сопротивление ок. 60-80 МОм. Кончика стеклянного электрода должен быть длинным и острым. Заполните кончик электрода с 1% Люцифер Желтый раствор путем размещения электрода с противоположным конце электрода в Люцифера Желтый раствор в течение ок. 30-60 секунд. Затем засыпки электрода с 3M LiCl при помощи шприца Гамильтона оставляя воздушный пузырь между красителем и LiCl. Подключите красителя заполнить электрод к голове сцены.
- Вставьте хлорида покрытые серебром провод заземления электрода в солевой раствор и место красителя заполнить электрод выше лететь параллельно VNC с использованием 3D гидравлического микроманипулятора. Красителя заполнить электрод должен быть подключен к усилителю, что позволяет передавать ток в целях высвобождения отрицательно или положительно заряженные красители от электрода, передавая гипер-или деполяризующего тока, соответственно.
- Переключить на 40x объектив погружением в воду и нижней оконечности красителя заполнить электрода на один из GFS. GF аксонов лежал рядом с дорсальной поверхности CVC. Используйте вперед (по направлению к голове) движение, чтобы вставить электрод в GF.
- Изменение источника света epifluorescent свет и перейти на Люцифера Желтый фильтр. Применить гиперполяризующих ток красителя заполнить электрод с усилителем для введения Люцифер Желтая в GF. Количество красителя вводят может управляться йэлектронная сумма текущих прошло, а также длительность ток. Для предотвращения красителя от разливать из места инъекции или повреждения GF, рекомендуется вводить использованием слаботочных (около 3-5 нА) по 1-5 минут.
- Применить текущие, пока терминал GF в VNC хорошо видно (рис. 4А). Для транс-синаптических окрашивание постсинаптических нейронов, продолжают проходить ток, пока краситель может также рассматриваться в постсинаптических нейронах. Выключите ток и удалить краситель заполнить электрод.
3. Представитель Результаты:
Представитель красителя заполнить для одного GF с Люцифером Желтый показан на рисунке 4A. Снимок был получен в виде образа стека программного обеспечения Nikon Элементы использованием месте камерой, установленной на микроскоп. В этом примере ток проходит через электрод в течение 2 минут. GF тщательно заполнен и крупного терминала GF в грудной клетке хорошо помечены (рис. 4а, эллипс). Нет постсинаптических нейронов видны в этом случае, хотя Люцифер Желтый достаточно мала, чтобы пройти через щелевые контакты. Если краска не вводится достаточно долго, в GF затем транс-синаптических заливками постсинаптических нейронов, возможно, не видели, потому что сигнал слишком слаб, чтобы быть обнаружены. Нейроны постсинаптических к GFs (рис. 4В, наконечники стрел) может быть представлена более надежно, используя даже меньше нейронов индикаторов, таких как Neurobiotin. Потребители инъекционных 7% Neurobiotin в 2 М раствор ацетата калия с деполяризующего тока в течение 2 минут достаточно, чтобы ярлык постсинаптических нейронов сильно. Neurobiotin могут быть визуализированы для конфокальной микроскопии с использованием Стрептавидином связан с красителями разных длин волн. Потому что Neurobiotin не флуоресцентный краситель, со-инъекция Rhodamin-декстрана или Alexa гидразидов в том же растворе, могут быть использованы для мониторинга успешной закачки в GF (рис. 4С, от Бернер и Godenschwege, 2010 5).
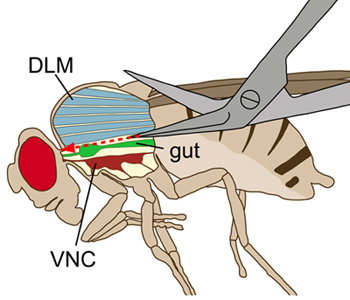
Рисунок 1. Схематическое изображение летать рассматривать сбоку. Грудной клетки отображается с продольным разрезом для визуализации внутренних структур. Во время вскрытия, продольные мышцы спины полета (DLMS, синий) были вырезаны без повреждения брюшной нервной цепочки (VNC, темно-красный), который лежит в вентральной полета мышцы. Кишечника (зеленый) лежит выше VNC.
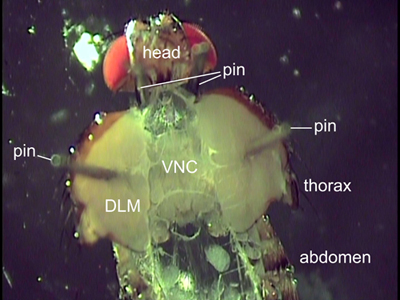
Рисунок 2. Спинной зрения расчлененные летать. Два контакта находятся за головой, чтобы положение летать. Контакты прикреплены через полет мышц (DLM) провести грудная клетка открыта. Внутренние органы были удалены, чтобы разоблачить брюшной нервной цепочки (VNC).

Рисунок 3. Dye заполнить установки.
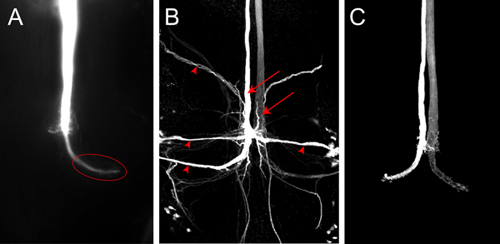
Рисунок 4.) Z-проекции задней части VNC показывает один GF заполнены с Люцифером желтый. Снимок был получен сразу после красителя заполнения месте камеры. В животных дикого типа терминала (эллипс) в области грудной клетки был четко виден. Б) конфокальной образ GF красителя заполнить Neurobiotin в дикого типа мухи. Оба СГФ (стрелки) и постсинаптических нейронов в СГФ (наконечники стрел) помечены. Neurobiotin были визуализированы с стрептавидином связан с Cy3. С) конфокальной образ дикого типа GFs заполнены Alexa555.
Обсуждение
Нервной системы можно разрезать, не извлекая его из летать тела. Это имеет два преимущества, во-первых, вскрытие причин незначительный ущерб нервной системе, во-вторых, большинство нервов пребывания придает мышц и органов чувств. Выполнение рассечение, как описано, готовит образец для ?...
Раскрытие информации
Благодарности
Проекта, описанного была поддержана грантом Количество R01HD050725 из Национального института детского здоровья и человеческого развития, TAG содержание несут их авторы и не обязательно отражает официальную точку зрения Национального института детского здоровья и человеческого развития или Национальный институт здоровья. Мы благодарим членов лаборатории Godenschwege а также Барбара Schreader к их участию в рукописи и видео.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| Sylgard 184 силиконового эластомера Kit | Dow Corning | ||
| Препарирование микроскоп | AmScope | SM-2TZ | |
| Vannas Ножницы Superfine | Академические инструменты | VS1023 | |
| Дюмон Пинцет Dumontstar 55 | Инструменты изобразительных наук | 11295-51 | |
| Контакты Аустерлицем насекомых | Инструменты изобразительных наук | 26002-10 | Ø 0,1 мм |
| Электроды из боросиликатного стекла | Инструменты Всемирного Precision | 1B100F-4 | |
| Вертикальная Внесите Puller 700c | Дэвид Kopf инструменты | Модель 700C | |
| Люцифер Желтый CH dilithium соли | Сигма | L0259 | 1% в H 2 O |
| Исправлена этап прямой микроскоп и камера | Nikon | FN-1 и DS-U2 камеры | |
| Plan Fluor 10X Цель воздуха | Nikon | CFI Plan Fluor 10X NA 0,3 WD 16 мм | |
| Ярко-40X воды погружения Цель | Nikon | CFI Fluor 40X NA 0,80 Вт WD 2,0 мм | |
| 3D гидравлического микроманипулятора | Международный Narishige | Модель MW0-3 | |
| Усилитель | Получение Instruments, Inc | Модель 5А |
Ссылки
- Power, M. E. The thoracico-abdominal nervous system of an adult insect Drosophila melanogaster. J. Comp. Neurol. 88, 347-409 (1948).
- Allen, M. J., Godenschwege, T. A., Tanouye, T. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Boerner, J., Duch, C. Average shape standard atlas for the adult Drosophila ventral nerve cord. J. Comp. Neurol. 518, 2437-2455 (2010).
- Gu, H., O'Dowd, D. K. Cholinergic synaptic transmission in adult Drosophila Kenyon cells in sity. J. Neurosci. 26, 265-272 (2006).
- Boerner, J., Godenschwege, T. A. Application for the Drosophila ventral nerve cord standard in neuronal circuit reconstruction and in-depth analysis of mutant morphology. J. Neurogent. 24, 158-1567 (2010).
- Godenschwege, T. A., Kristiansen, L. V., Uthaman, S. B., Hortsch, M., Murphey, R. K. A conderved role for Drosophila Neuroglian and human L1-CAM in central-synapse formation. Curr. Biol. 16, 12-23 (2006).
- Uthaman, S. B., Godenschwege, T. A., Murphey, R. K. A mechanism distinct from highwire for the Drosophila ubiquitin conjugase bendless in synaptic growth and maturation. J. Neurosci. 28, 8615-8623 (2008).
- Storkebaum, E. Dominant mutations in the tyrosyl-tRNA synthetase gene recapitulate in Drosophila features of human Charcot-Marie-Tooth neuropathy. Proc. Natl. Acad. Sci. USA. 106, 11782-11787 (2009).
- Allen, M. J., Godenschwege, T. A. Electrophysiological recordings from the Drosophila giant fiber system (GFS). Cold Spring Harb. Protoc. 2010, pdb.prot5453-pdb.prot5453 (2010).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. , (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены