Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yetişkin Tüm Dağı Hazırlık Drosophila Dev Fiber Boya Enjeksiyon Ventral Sinir Kablosu
Bu Makalede
Özet
Bir In vivo Yetişkin diseksiyonu Drosophila Ventral sinir kablosu (VNC) gösterilmiştir. Bu özel diseksiyon yöntemi, yüksek çözünürlüklü görüntüleme için floresan boya ile dev bir fiber nöronların sonraki etiketleme sağlayan VNC az zarar neden olur.
Özet
Nöronların aksonal ve dendritik morfoloji analiz etmek, doğru etiketleme nöronal yapıları elde etmek için esastır. Az doku hasarı iyi etiketli numunelerin hazırlanması dolayısıyla mutant anomalilerin kimlik sağlayan, bize hücre morfolojisi analiz etmek ve bireysel örnekleri birbirleriyle karşılaştırmak için sağlar.
Sinir sistemi göstermiştir diseksiyon yöntemi daha çok erişkin sinek içinde kalır. Dorsal bir kesiden karın ve göğüs açılır ve iç organların çoğu kaldırılır. GF hücre gövdesi ve dendritler içeren beyin sağlam bir kafa 2 kalırken ventral sinir kablosu (VNC) ve dev lifleri (GDS) 1 büyük aksonları içeren servikal bağ (CVC) sadece sırt tarafında açıkta . Bu hazırlanmasında VNC en sinirlerin kaslara bağlı kalmalıdır.
Diseksiyonu takiben, floresan boya ile dev bir lif (GF) hücre içi dolum gösterilmiştir. CVC GF aksonlar dorsal yüzeyinde bulunan ve bu nedenle diferansiyel girişim kontrast (DIC) optik bir mikroskop altında kolayca görüntülenebilmekte. Bu VNC akson ve kendi terminalleri dahil olmak üzere tüm GF GF akson boya ile bu sitede enjeksiyon etiket sağlar. Bu yöntem, nöronların bir epifluorescent mikroskop ile doldurduktan sonra hemen yansıması izin GF'lerin güvenilir ve güçlü boyama ile sonuçlanır. Alternatif olarak, floresan sinyali, yüksek çözünürlüklü konfokal mikroskopi için uygun standart immünohistokimya prosedürleri 3 kullanarak gelişmiş olabilir .
Protokol
1. Ventral sinir kablosu diseksiyonu
GF doldurarak Diseksiyon ve boya, oda sıcaklığında yapılabilir. Adımlar için tüm diseksiyon soğuk (4 ° C) serum fizyolojik hücre metabolizmasını yavaşlatır ve nöronlar daha uzun süre canlı tutmak için kullanılmalıdır.
- CO 2 yetişkin sinekler (4 gün veya daha büyük) anestezisi veya buz üzerinde hareketsiz kadar onları soğuk. Buz ile anestezi daha fazla zaman gerektirecektir (30 dakika kadar) ama, daha uzun süre hareketsiz sinekler devam edecektir.
- Sylgard kaplı bir Petri kabındaki bir sinek. Bu diseksiyon yüksek bir büyütme (80-100X) diseksiyonu stereomikroskopta kullanımını gerektirir.
- Vannas makasla, bacaklar, burnumun ve kanatları çıkartın.
- Sylgard çanağı yönlendirmek için sinek dorsal tarafı, kaba forseps ve ince böcek iğne (minutien pin) kullanın. İlk karın Pin ve sonra (bkz. Şekil 2) boyun biraz gergin ve erişilebilir şekilde, başın arkasında, boynun her iki tarafındaki iki iğne yerleştirerek hayvan biraz uzatıyoruz.
- Taze, soğuk Drosophila salin sinek Batmak. En sık kullanılan Drosophila Salines diseksiyon için, ancak biz burada Gu ve O'Dowd açıklanan tuzlu, 2006 4 yeterlidir. Bir hava kabarcığı sinek saracaktır. Bir şırınga ile havayı çıkarın.
- Karın ve sırt ucunu kısa bir yatay kesi olun. Kesi başlayarak, toraks doğru karın dorsal orta hat boyunca sığ, düz kesim yapmak. Sonra bağ doğru orta hat boyunca mümkün olduğunca tam olarak toraks sığ uzunlamasına kesilmiş devam edin. VNC (Şekil 1) zarar olarak sığ kesimler yapmak için kritik önem taşımaktadır.
- Toraks dikkatle açmak için iki güzel böcek pimleri kullanın. Pimleri kullanarak vücut dışında yarı yarıya yaymak ve uçuş kasları (Şekil 2) yoluyla pimleri. Şekil 2 manikür ripping önlemek için tasvir toraks daha fazla açılmamalıdır. VNC düz bir oryantasyon sağlamak için pimleri, her iki tarafında aynı anterior posterior pozisyonda yer almalıdır.
- Boya enjeksiyon ve uygun görüntüleme için VNC Erişim iç organları tarafından tıkalı olabilir. Bu nedenle, mide, bağırsak, kalp ve üreme organları çıkarmak için forseps ve makas kullanın. VNC her iki yakasında uzanan tükürük bezleri dışarı çekin. Dikkatli diseksiyon kayan doku ve yağ çıkarmak için taze tuzlu su ile durulayın.
- Servikal bağ (CVC) altından yağ vücut çıkarın. Yağlı vücut, yüksek büyütme en iyi görünür. Dikkatle yan doku kavrayın ve çekin ince forseps kullanın.
Diseksiyonu 5 ila 10 dakika içinde yapılabilir. Taze, soğuk tuzlu su kullanarak disseke, hasar sinir sistemi, en az bir saat ayakta kalacaktır.
2. Hücre içi GF dolgu
Bu diseksiyon sonra mümkün olduğunca çabuk dolum boya yapılması tavsiye edilir.
- Sabit bir aşamada (Şekil 3) ve 10x hava amacı ile dik bir mikroskop altında diseke sinek Sylgard çanak yerleştirin. Merkezi boya dolgu elektrot tutucu doğru konumlandırılmış sinek arka ucu ile örnek. CVC diferansiyel girişim kontrast (DIC) modu ve odak kullanın. GF'lerin büyük aksonlar CVC dorsal yüzey üzerinde açıkça görülebilir olmalıdır.
- % 1 'lik bir konsantrasyon deiyonize H2O Lucifer Sarı CH Dilithium tuz sulandırınız. Yaklaşık bir direnç filament ile borosilikat cam elektrot çekin. M 60-80. Cam elektrot ucu uzun ve keskin olmalıdır. Elektrodun ucu, yaklaşık Lucifer Sarı çözüm içine elektrod ucu ters sonunda elektrot yerleştirerek% 1 Lucifer Sarı solüsyonu ile doldurun. 30-60 saniye. Daha sonra boya ve LiCl arasında bir hava kabarcığı bırakarak Hamilton şırınga kullanarak 3M LiCl elektrot dolgu. Kafa aşamasına boya dolgu elektrot bağlayın.
- Tuzlu su içine bir klorür kaplı gümüş tel Toprak elektrodu takın ve 3D hidrolik mikromanipülatör kullanarak VNC sinek paralel üzerindeki boya dolgu elektrot yerleştirmek. Boya dolgu elektrodu, akım, sırasıyla geçen hiper-ya da depolarize elektrottan olumlu veya olumsuz ücret boyalar serbest akımı geçirilerek sağlayan bir amplifikatöre bağlı olmalıdır.
- 40x suya daldırma lens geçin ve GF'lerin üzerine boya dolgu elektrot ucu düşük. GF aksonlar CVC dorsal yüzeyine yakın yatıyordu. GF elektrot eklemek için ileri (doğru) baş hareketi kullanın.
- Epifluorescent ışık ışık kaynağı değiştirin ve Lucifer Sarı filtre geçmek. GF Lucifer Sarı içine enjekte etmek için amplifikatör ile boya dolgu elektrot hiperpolarizan mevcut uygulayın. Miktar boya enjekte th tarafından kontrol edilebilire akım miktarı akım geçirilen süre yanı sıra geçti. Boya enjeksiyon yerinde veya hasar GF dışarı dökülmesini önlemek için, düşük akım (yaklaşık 3-5 nA) ile 1-5 dakika içinde enjekte etmek için tavsiye edilir.
- VNC GF terminali (Şekil 4A) açıkça görülebilir kadar uygulayın. Postsinaptik nöronların trans-sinaptik boyanması için boya da postsinaptik nöron görülebileceği kadar geçerli geçmek için devam edin. Geçerli kapatın ve boya dolgu elektrot kaldırmak.
3. Temsilcisi Sonuçlar:
Şekil 4A bir temsilci boya Lucifer Sarı ile bir GF doldurunuz gösterilmiştir. Görüntü mikroskop üzerine monte edilmiş bir nokta kamerayı kullanarak Nikon Elements yazılımı bir görüntü yığını olarak satın alınmıştır. Bu örnek akım yaklaşık 2 dakika boyunca elektrot geçirildi. GF iyice doldurulur ve toraks büyük GF terminali (Şekil 4A, elips) olarak etiketlenir. Lucifer Sarı gap junction geçmesine kadar küçük olmasına rağmen postsinaptik nöronların, bu durumda görünür. Sinyal tespit edilmesi çok zayıf, çünkü boya GF yeterince uzun enjekte değilse trans-postsinaptik nöronların sinaptik doldurur görülmemiş olabilir. GF'lerin (Şekil 4B, ok başları) postsinaptik nöronlar gibi Neurobiotin bile küçük nöronal izleyiciler, daha güvenilir bir şekilde görüntülendi olabilir. 2 dakika boyunca bir depolarizan akımı ile 2 M potasyum asetat çözeltisi% 7 Neurobiotin enjekte güçlü postsinaptik nöron etiketlemek için yeterli. Neurobiotin konfokal mikroskopi için farklı dalga boylarında boyalar birleştiğinde Streptavidin kullanarak görüntülenebilmekte. Neurobiotin floresan boya olmadığından, aynı çözüm Rhodamin Dextran veya Alexa hydrazides ko-enjeksiyon, GF (Şekil 4C, Boerner ve Godenschwege, 2010 5) başarılı bir enjeksiyon izlemek için kullanılan olabilir.
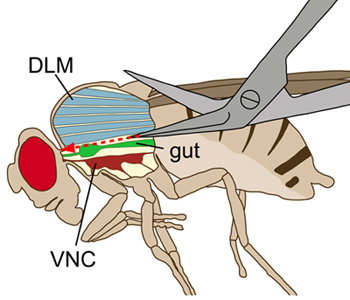
Şekil 1 bir sinek şematik çizimi yanal görüntülenebilir. Toraks, iç yapıları görselleştirmek için uzunlamasına bir kesi ile görüntülenir. Diseksiyon sırasında, dorsal longitudinal uçuş kasları (DLMS mavi), uçuş kaslarına ventral uzanan ventral sinir kablosu (VNC, koyu kırmızı), zarar vermeden kesilmiştir. Gut (yeşil) VNC üstünde yatıyor.
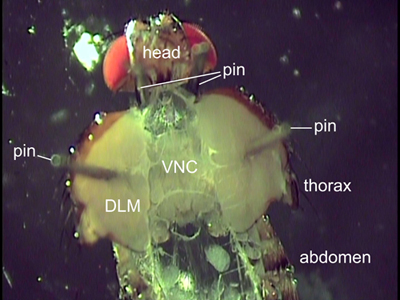
Şekil 2 disseke bir sineğin Dorsal görünümü. İki pimleri sinek konumuna başın arkasında yerleştirilir. Uçuş kasları (DLM) ile yapıştırılmış pimleri, toraks açık tutun. İç organları ventral sinir kablosu (VNC) ortaya çıkarıldı.

Şekil 3 Boya doldurun kurulum.
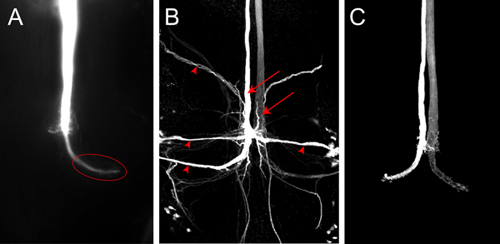
Şekil 4 A) Z-Lucifer Sarı ile dolu bir GF gösteren VNC arka kısmının projeksiyon. Görüntü bir noktaya kamera ile boya dolum hemen sonra elde edildi. Vahşi hayvanlarda toraks terminali (elips) olduğu açıkça görülebilir. B) GF boya Konfokal görüntü yabani tip bir sinek Neurobiotin ile doldurun. GF'lerin (oklar) ve GF'lerin (ok başları) postsinaptik nöronların her ikisi de etiketlenir. Streptavidin Cy3 akuple Neurobiotin görüntülendi. C) vahşi tip GF'lerin Konfokal görüntü Alexa555 ile doldurdu.
Tartışmalar
Sinir sistemi, anında vücuttan ayıklanan olmadan disseke edilebilir. Bu, iki avantajı vardır, ilk diseksiyon sinir sistemi için çok az hasara neden olur, ve ikincisi, sinirler, kaslar ve duyu organları bağlı kalmak. Olarak tanımlanan diseksiyonu, Sahne GF'lerin yalındır boya-etiketleme için örnek hazırlar. Elverişli, GF'lerin postsinaptik motor nöronlar kaslara bağlı kalmak. Aksonlar, bu nedenle, nöronlar daha uzun süre canlı tutmak, hasarsız. Buna ek olarak, sinir sistemine zarar gap jun...
Açıklamalar
Teşekkürler
Açıklanan projenin içeriği sadece yazarların sorumluluğundadır ve mutlaka, Ulusal Çocuk Sağlığı ve İnsan Gelişimi veya Enstitüsü resmi görüşlerini temsil etmemektedir TAG Hibe Numarası R01HD050725 Ulusal Çocuk Sağlığı ve İnsan Gelişimi Enstitüsü tarafından desteklenen Ulusal Sağlık Enstitüleri. Biz, el yazması ve video girişi için Godenschwege laboratuvar yanı sıra Barbara Schreader üyelerine teşekkür ediyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar |
|---|---|---|---|
| Sylgard 184 Silikon Elastomer Seti | Dow Corning | ||
| Diseksiyon Mikroskop | AmScope | SM-2TZ | |
| Vannas Makas Süper İnce | Akademik Aletleri | VS1023 | |
| Dumont Forseps Dumontstar 55 | Güzel Bilim Araçları | 11295-51 | |
| Austerlitz Böcek pimleri | Güzel Bilim Araçları | 26002-10 | Ø 0.1mm |
| Borosilikat Elektrotlar | Dünya Hassas Aletler | 1B100F-4 | |
| Dikey Pipet Çektirme 700C | David Kopf Aletleri | Model 700C | |
| Lucifer Sarı CH Dilithium tuz | Sigma | L0259 | H 2 O% 1 |
| Sabit Sahne Dikey Mikroskop ve Kamera | Nikon | FN-1 ve DS-U2 Kamera | |
| Plan Fluor 10X Hava Amaç | Nikon | CFI Planı Fluor 16mm 10X NA 0.3 WD | |
| Fluor 40X su Amaç daldırma | Nikon | CFI Fluor 40X W NA 0.80 WD 2.0mm | |
| 3D hidrolik Mikromanipülatör | Narishige Uluslararası | Model MW0-3 | |
| Amplifikatör | Araçların Başlarken, Inc. | Model 5A |
Referanslar
- Power, M. E. The thoracico-abdominal nervous system of an adult insect Drosophila melanogaster. J. Comp. Neurol. 88, 347-409 (1948).
- Allen, M. J., Godenschwege, T. A., Tanouye, T. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Boerner, J., Duch, C. Average shape standard atlas for the adult Drosophila ventral nerve cord. J. Comp. Neurol. 518, 2437-2455 (2010).
- Gu, H., O'Dowd, D. K. Cholinergic synaptic transmission in adult Drosophila Kenyon cells in sity. J. Neurosci. 26, 265-272 (2006).
- Boerner, J., Godenschwege, T. A. Application for the Drosophila ventral nerve cord standard in neuronal circuit reconstruction and in-depth analysis of mutant morphology. J. Neurogent. 24, 158-1567 (2010).
- Godenschwege, T. A., Kristiansen, L. V., Uthaman, S. B., Hortsch, M., Murphey, R. K. A conderved role for Drosophila Neuroglian and human L1-CAM in central-synapse formation. Curr. Biol. 16, 12-23 (2006).
- Uthaman, S. B., Godenschwege, T. A., Murphey, R. K. A mechanism distinct from highwire for the Drosophila ubiquitin conjugase bendless in synaptic growth and maturation. J. Neurosci. 28, 8615-8623 (2008).
- Storkebaum, E. Dominant mutations in the tyrosyl-tRNA synthetase gene recapitulate in Drosophila features of human Charcot-Marie-Tooth neuropathy. Proc. Natl. Acad. Sci. USA. 106, 11782-11787 (2009).
- Allen, M. J., Godenschwege, T. A. Electrophysiological recordings from the Drosophila giant fiber system (GFS). Cold Spring Harb. Protoc. 2010, pdb.prot5453-pdb.prot5453 (2010).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. , (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır