Method Article
在开发皮层网络功能钙成像
摘要
神经网络发展的自发活动可以使用AM酯钙敏感的指标染料形式。神经元的激活,细胞内钙的变化,说明被检测为指标荧光瞬态变化与一个或两个光子成像。此协议可适应的发展依赖的神经元网络的范围在体外。
摘要
一个标志图案在发育中的神经系统的活动是自发的,同步的网络活动。同步活动已被观察到完整的脊髓,脑干,视网膜,大脑皮层和分离神经元文化的准备工作。在自发活动期间,神经元去极化火单或阵阵动作电位,激活许多离子通道。去极化激活电压门控钙通道介导钙离子内流的树突和棘。高度同步的电活动已经从本地使用领域电极的神经网络测量。这项技术使高的时间采样率,但空间分辨率较低,由于集成读出多个神经元,在一个电极。单细胞神经元活动的决议是可能的使用来衡量发射活动的单个神经元膜片钳电。然而,从网络的能力来衡量的神经细胞修补小号数量是有限的imultaneously,通常只有一个或两个神经元。钙依赖的荧光指示剂染料的使用,使测量同步整个网络的细胞的活性。这种技术提供了两个高空间分辨率和足够的时间取样,记录网络发展的自发活动。
前和产后早期发展过程中新形成的皮层和海马网络的一个主要特点是自发的,同步的神经元活动(卡茨和Shatz,1996年; Khaziphov与卢曼,2006年)。此相关的网络活动,被认为是神经系统发育的功能电路(斯皮策,2006年)代必要。在灵长类动物和啮齿动物脑,早期的电气和钙网络波观察前和出生后在体内和体外(Adelsberger等,2005; Garaschuk等,2000;。Lamblin等,1999)。这些早期的活动模式,这是众所周知的几个控制包括神经细胞的分化,突触和可塑性(Rakic及小室,1995年;斯皮策等人,2004年)的发展进程,为正确的发展和成熟的皮质电路至关重要。
我们在此朱庇特的视频,展示形象的自发活动,在发展皮质网络使用的方法。钙敏感的指标,如FURA 2 - AM穿过细胞膜酯弥漫在细胞内酯酶活性切割上午离开指示剂细胞impermeant形式的酯类。指标impermeant形式能够检测和绑定细胞内钙离子的羧酸基团..钙敏感染料的荧光钙结合后,瞬时改变。单或者多光子成像技术是用来衡量在染料发出的光子的变化,从而表明在细胞内钙的改变。此外,这些钙- Dependent指标可与其他荧光标记相结合,调查活动的网络内的细胞类型。
研究方案
1。制作水平嗅海马脑片
嗅,海马脑片用解剖指南,详细的3D概述了该地区根据粤语,Wouterlood惠(2008)神经可塑性编号381243 9。
- 请500毫升片解决方案,与carbogen气体(氧气95%,5%的二氧化碳)氧化为至少20分钟,然后冻结,直到冰250毫升。分钟前切片,粉碎和混合片冰与解剖和切片室切割使用的其余250毫升冒泡片解决方案。
- 设为R -学联200毫升(恢复学联)和至少500毫升的E -学联(实验学联)解决方案。连续氧化carbogen气体(氧气95%,5%的二氧化碳)至少20分钟前,组织编制与这两种解决方案。
- 该协议有效期为0到3周的最大日龄小鼠。杀头的灵魂L,根据当地的伦理委员会的程序,并剖析了大脑迅速(含盘冰冷的片解决方案,准备在上面的第1步,在培养皿的解决方案及试剂见表1)。
- 与片溶液浸泡滤纸转移到大脑,并用锋利的刀片分开的两个半球。一个半球传输到冰冷的片解决方案。
- 取出另一半球小脑。翻转到大脑中线,并切断脑顶部一个微小的角度对喙端。
- 翻转到大脑,用棉签轻轻推切(背)面和胶水到组织切片机倒挂持有。
- 片300微米厚的脑片,用剩余的冰冷片在第1步解决方案低的频率和速度。根据我们的条件,我们使用了Thermo Fisher Scientific这vibratome(MICROM,航模650V),0.05 mm / s和36Hz设置。
- 至于尽快切片被切断,转移成片含有含氧人工脑脊髓液(ACSF)(2.5MM Mg 2 +的 ,1.6MM的Ca 2 +; 见表2)的持有人(淹没)在室温下。一个R -学联较高的镁离子浓度降低到通过NMDA受体的神经元的钙涌入切片和我们的经验后,会导致更好的切片实验的质量。如果需要,削减后的第二个大脑半球。
- 保留一小时,以恢复切片。
| 片解决方案(单位:mm) - 10 | |
| 110 | 氯化胆碱 |
| 25 | 碳酸氢钠3 |
| 11.6 | 11.6 |
| 10 | D -葡萄糖 |
| 7 | MgCl 2的 |
| 3.1 | sodiumpyruvate |
| 2.5 | 氯化钾 |
| 1.25 | 的NaH 2 PO 4 |
| 0.5 | 氯化钙 |
表1。食谱片解决方案。
| 学联(在MM) | |
| 125 | 氯化钠 |
| 26 | 碳酸氢钠3 |
| 10 | D -葡萄糖 |
| 3 | 氯化钾 |
| 2.5/1.5 | MgCl 2的 (复苏/实验) |
| 1.6 | 氯化钙 |
| 1.25 | 的NaH 2 PO 4 |
表2。食谱的恢复(R -学联)和实验(E -学联)解决方案。
2。制备染色CH琥珀
负载与钙依赖的指标或细胞特异性标记的细胞,切片需要被转移到染色过程室。虽然可能会商会,可以很容易地从标准实验室设备组装非常低的成本。这种分庭的主要特点是片预热30至35℃,在不断含氧介质和光屏蔽室培养。
- 使用加热棒,使小孔,只是足够大,允许部分硅管(直径约1.5毫米)通过在两个一次性聚苯乙烯培养皿侧壁(35和100mm直径)。
- 主题通过小培养皿中孔硅管内壁小碟内形成一个循环。
- 使用强力胶密封管开放,坚持其余油管内壁培养皿。
- 用针,使管内培养皿内均匀间隔的微细孔。
- 粘小培养皿内较大的一个,同时对准孔。穿过较大的培养皿壁孔硅管的另一端。
- 接口菜,半透膜细胞培养插入,并用加热的手术刀,切离顶部1厘米留下一个浅盘,孵化期间举行的片。
- 在较大的培养皿的盖子,使一个洞约。直径0.5 - 1CM carbogen(95%O2,5%CO 2)允许流量进入会议厅。
- 以一个5或10ml塑料注射器。使用加热的手术刀,使角度切割,去除注射器,并保持与尖数厘米长的注射器管。使用强力胶,附上注射器管的切割面培养皿盖,孔直径在0.5 - 1CM。
- 附加硅管和ubing注射器尖端的连接器。将另一个油管接头硅管,培养皿进入基地。
- 最多可连接两个管carbogen(95%O2,5%CO 2)供应的调节。将孵化一个热点板块之间的30-35染色室° C。确保光屏蔽室可在整个孵化过程中。染色室现在已准备就绪,组装和使用切片孵化。
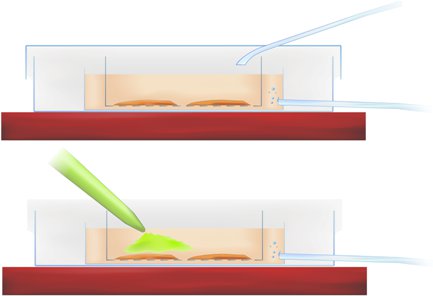
方法图1。截面染色切片孵化室(以上)和钙敏感指标( 下文绿色染料,吸管)的应用。
3。染色切片
纵观任何涉及荧光染料的处理,避免由小光漂白和保持染料和THE染色组织处理之间的暗。
- 放在一个加热板(35℃)染色室,将其连接到carbogen供气,填补约1.5毫升R -学联从片人。
- 在染色室接口盘和填充它用1ml学联。
- 确保一个良好的染色室carbogen供应保持在一个温和,稳定的速度学联冒泡。
- 添加到一小瓶50微克FURA 2 - AM 9μLDMSO和1μL嵌段酸(20%二甲基亚砜原液,Invitrogen公司 )。涡旋15分钟的染料混合。
- 转移到接口菜片和吸管进入R -学联染料,直接在海马和内嗅皮质区域利益,方法图1(以上)表示,,实现最终染料浓度为50mm。
- 关闭盖子的染色室和孵化染料为20 - 40分钟,取决于动物的年龄(见表3)。
- 横贯FER放回片持有人的切片。
| 年龄(出生后) | 孵化时间(分钟) |
| 20 | |
| P8 - P9 | 25 |
| P10 - P11 | 30 |
| P12 - 13 | 35 |
| > P13 | 40 |
表3为不同年龄段的孵化时间,凭经验决定在实验室中。
4。其他染料和旧组织
也许由于在脑组织的髓鞘增加,从年纪较大的啮齿动物的切片不占用FURA 2 - AM酯,容易。为了方便的一个步骤,使用聚氧乙烯蓖麻油EL(Sigma公司)预孵育小鼠大脑使用P13和旧 11染料的吸收。聚氧乙烯蓖麻油是一种非离子表面活性剂,在许多制药辅料人的应用。如果没有这一步,我们发现,细胞特异性标记极差,整个皮质切片不一致。
- 转移到一个充满3毫升R -学联和8μL0.5%的聚氧乙烯蓖麻油(Sigma公司)加热至35℃,3分钟的浅预孵育菜的老片。
- 转移到接口菜片,并按照正常的染色过程(步骤4-7,见上文)。
钙染料负载在片制备的神经元和非神经元。为了识别和区分这些类型的细胞内的网络,可以使用sulforhodamine 101(SR101)标签星形胶质细胞内片。
切片染色sulforhodamine 101
前(第3)按照步骤1-3。
取1μL10MM sulforhodamine(Sigma公司),其储存在-20 ° C原液,并溶解在999μLR -学联10微米的解决方案。移液器的紫色染料OVER片前(步骤5-7),离开片15分钟内孵化。
小胶质细胞和血管内皮细胞标记使用FITC标记的番茄凝集素染料
像以前那样按照步骤1-3。
取25μL2mg/ml番茄(西红柿)凝集素FITC标记共轭(L0401,Sigma公司)的股票进入2.5毫升R -学联的解决方案,给予20微克/毫升的浓度。移液器前(步骤5-7)片染料,离开片45分钟内孵化。
注意,它是不可能像FURA 2 - AM或俄勒冈州绿色BAPTA - 1(OGB - 1)的频谱范围自两种染料的光子绿色荧光将发出钙敏感的指标结合起来,这种染料在重叠的波长。不过,也有其他的钙指标,如钙橙,FURA红染料,可以使用适当的过滤器或得克萨斯州红凝集素结合物相结合,结合机智h钙指示剂染料在绿色光谱。
5。将切片录音室
在成像片需要在显微镜下的稳定。一般金属竖琴放在按住组织,但它可以不均,扭曲片表面,使集中在成像领域的唯一部分。为了避免这种情况,切片坚持使用聚乙烯亚胺(PEI)的录音室。
- 准备裴解决方案(1毫升250ml中硼酸缓冲液(表4)聚乙烯解决方案)。确保私立完全溶解(搅拌过夜)。
- 填写录音室,与裴解决方案,使底部流体至少一小时之前,你要申请的切片覆盖
- 洗净用蒸馏水,然后用R -学联从持有室录音室。
- 转移片进入录音室。
- 取出吸管和位置的SL,R -学联冰在中间用刷子。
- 使用滤纸件片周围,删除R -学联。稳定和坚持,重要的是,没有片周围学联了。
- 移液器约0.51毫升学联,录音室的大小取决于到切片。学联应该只盖片表面。
- 成一个大的加湿接口carbogen灌注的容器,放在切片与录音室,并让片恢复至少一个小时。
| 裴解决方案 | |
| 1毫升 | 保利(ethyleneimine)解决方案 |
| 250ml中硼酸缓冲 | |
| 40MM | 硼酸 |
| 10MM | 硼砂十水钠 |
表4。食谱裴解决方案。
6。进出口老龄化
钙依赖的指标染料可以使用任何一个或双光子显微镜成像。使用双光子成像激活在感兴趣的区域中心量的指示剂,从而减少了在组织中的光散射量。此外,它能够更好地成片的深度渗透。
功能钙成像,我们用一个钛蓝宝石激光相干耦合Olympus显微镜20倍的目标(NA 0.95)和LaVision生物技术Trimscope系统提供。 Trimscope系统使帧同时扫描64 beamlets加上一个滨松C9100 EM - CCD相机进行快速的帧扫描速率。
- 位置在显微镜下的录音室,并建立一个最小的30 ° C时的生理温度加热到稳定灌注成像E -学联(1.6的Ca 2 + / 1.5毫克2 +比值(表2 ))
- FOC我们进入的地区使用白光照明的利息率(ROI)。避免暴露在光片超过所需的时间。
- 选择波长,视场成像,扫描频率,像素密度和额外的软件选项,适用于要测量的组织和生物信号。 FURA网络成像钙2上午,我们通常选择820nm波长,宽250微米的角度成像领域,linescanning 1200Hz的频率和2 - 2分级。这样的结果大约为100ms,因此成像频率约10Hz的frametime。
- 检查您的投资回报率的重点是使用连续扫描模式和选择laserlight波长。调整的重点和激光的强度,以避免您的图像的像素饱和度和漂白。
- 请您的投资回报率timelapse电影。我们通常会获得2000年每帧timelapse电影。
- 细胞的检测和鉴定,采取Z - Stack的使用1微米的步长和imag E + / 20围绕重点微米成像平面。
7。代表性的成果
钙指标成功加载,FURA 2 - AM如图1所示,在使用多光子成像发展的新皮层和内嗅皮质网络。有些染料仍是目前的背景下,在组织,但细胞SOMA在某些情况下染色,近端树突清晰可见,周围神经纤维分离。如果加载没有成功,很少细胞特异性染色观察和染料点小群死膜碎片片表面上经常可见。
在这些截图中,细胞网络是在单一平面的同时细胞成像的重点清晰可见。使用一个金属片录音室的竖琴或不完整的坚持可能会导致不均匀的片表面进行成像。
550fig1.jpg“ALT =”图1“/>
图1。 FURA 2 - AM酯加载开发新皮层(左)和嗅(乙右)网络。比例尺100微米。
为星形胶质细胞分开的神经元,与FURA sulforhodamine 101联合应用2 - AM酯使网络内的细胞类型的分离。
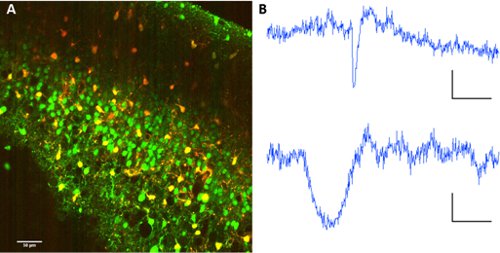
图2。星形胶质细胞的标签sulforhodamine 101。 FURA 2 - AM酯和sulforhodamine 101 共同的标签。激发波长:820nm。图像分色镜560/70nm波长分离的光电倍增管的集合,B代表从一个神经元(以上)和星形胶质细胞(下同)的荧光痕迹。比例尺60秒,ΔF10(AU荧光)。
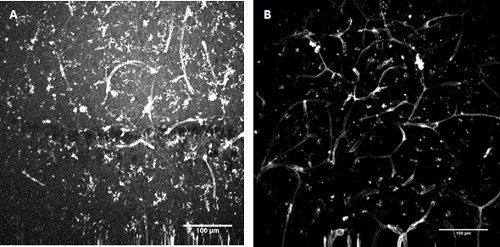
图3。 FITC标记的番茄(番茄)凝集素染色小胶质细胞和血管内皮细胞的小鼠海马(A)和肤浅的嗅皮层(二)在发展中的标签。
钙染料是用来读出多个细胞的活动同时在发展中国家皮层和海马的网络。
图4。在海马和皮层网络的动态钙瞬变 。
电影1:FURA 2 - AM酯小鼠嗅皮层加载在第二次产后一周。
点击这里观看电影1。
电影2:FURA 2,在产后第一周上午酯小鼠海马加载。
点击这里观看电影2。
电影3:荧光4加载在产后第一周,小鼠皮层。
50movie3.avi“>点击这里观看电影3。
FURA的情况下2 - AM酯,细胞活化涉及的钙去极化诱导的涌入,降低染料的荧光。如荧光染料,相反的是真实的,观察细胞去极化光子排放量的增加。体钙瞬变主要是测量,但较大的近端树突的活动也可以看出一些准备工作,如电影2所示。
读出网络活动可以量化使用商业或内部软件脚本。在我们的实验室,细胞识别和网络活动,是在一个半自动化的方式使用MATLAB(Mathworks公司)内部代码测量和分析。
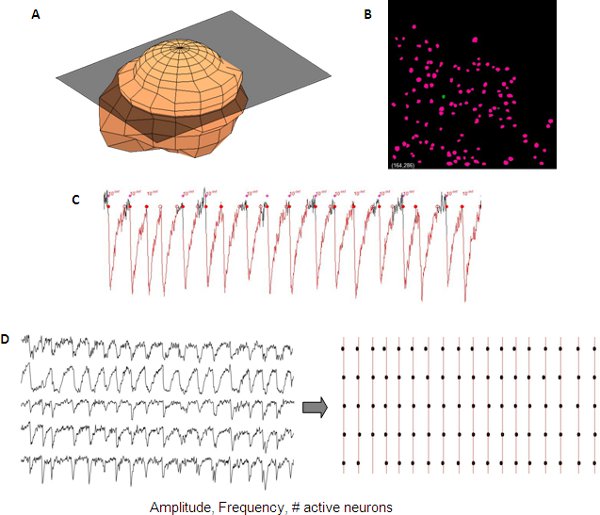
图5。一个神经元的三维表示(代表分析,从一个发展中的皮层网络同步的钙瞬变。 )用于自动创建一个(二)从Z - Stack的神经元为神经元的自动化检测的面具。测量钙瞬变幅度,频率可以读取从单一的神经元数据(三)活跃的细胞和#。可以可视化使用栅格图(四)不同的痕迹同步。
讨论
在这里我们展示的方法显示合适的钙成像网络的动态识别细胞内鼠标,并在大鼠脑皮层和海马网络协议。这些方法提供了最佳的空间分辨率,同时可视化测量阈上活动的细胞胞体的本地网络。网络活动的时间分辨率可以是多种多样的,这取决于帧采集CCD相机设置,优化信号:持续时间长阈上通常在神经系统发育中的事件,噪声测量。这些协议不仅限于海马和皮质的网络,而且在整个神经系统发育的标签细胞。这种方法的限制是可以记录,只有阈上活动。
披露声明
LaVision生物技术公司(德国Bielefeld)主办的这个手稿文章提交费。
致谢
在实验室的工作是由Nederlandse Organisatie voor Wetenschappelijk Onderzoek(NWO)(917.10.372)RMM的支持。 JD是隶属于欧盟第七框架计划BrainTrain方案( www.brain train.nl )。我们感谢彼得劳伦斯Baljon和萨宾施密茨(包括CNCR,阿姆斯特丹VU大学)FP多电极阵列波形和视频序列中使用的神经元文化的图像。
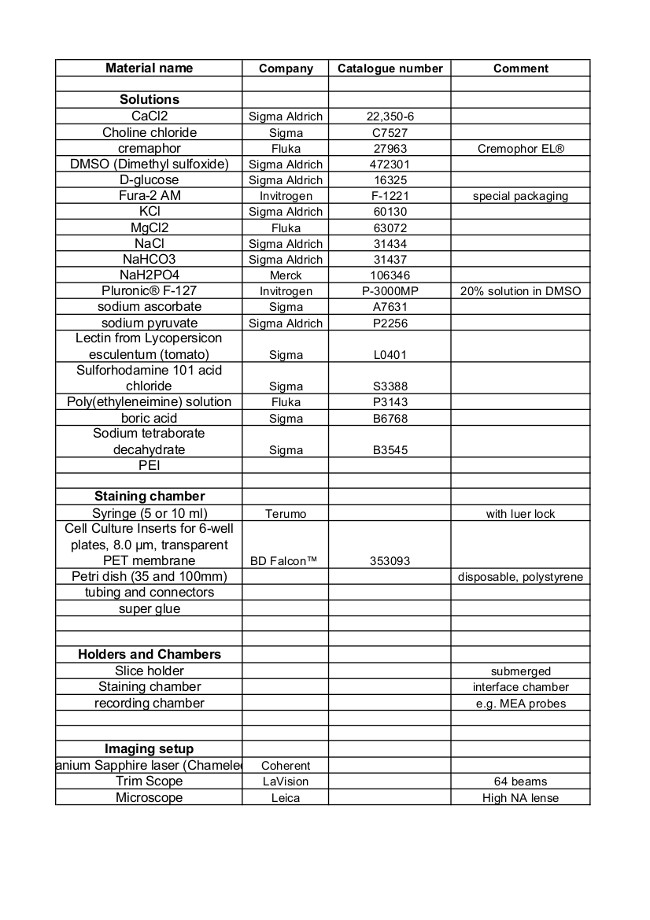
材料
参考文献
- Katz, L. C., Shatz, C. J. Synaptic activity and the construction of cortical circuits. Science. 274, 1133-1138 (1996).
- Khazipov, R., Luhmann, H. J. Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends in Neurosciences. 29, 414-418 (2006).
- Spitzer, N. C. Electrical activity in early neuronal development. Nature. 444, 707-712 (2006).
- Adelsberger, H., Garaschuk, O., Konnerth, A. Cortical calcium waves in resting newborn mice. Nat. Neurosci. 8, 988-990 (2005).
- Garaschuk, O., Linn, J., Eilers, J., Konnerth, A. Large-scale oscillatory calcium waves in the immature cortex. Nat. Neurosci. 3, 452-459 (2000).
- Lamblin, . Electroencephalography of the premature and term newborn. Maturational aspects and glossary. Neurophysiol. Clin. 29, 123-219 (1999).
- Rakic, P., Komuro, H. The role of receptor/channel activity in neuronal cell migration. J. Neurobiol. 26, 299-315 (1995).
- Spitzer, N. C., Root, C. M., Borodinsky, L. N. Orchestrating neuronal differentiation: patterns of Ca2+ spikes specify transmitter choice. Trends. Neurosci. 27, 415-421 (2004).
- Canto, C. B., Wouterlood, F. G., Witter, M. P. What does the anatomical organization of the entorhinal cortex tell us. Neural. Plast. , 381243-381243 (2008).
- Bureau, I., Shepherd, G. M., Svoboda, K. Precise development of functional and anatomical columns in the neocortex. Neuron. 42, 789-801 (2004).
- Ikegaya, Y., Le Bon-Jego, M., Yuste, R. Large-scale imaging of cortical network activity with calcium indicators. Neuroscience research. 52, 132-138 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。