Method Article
Calcio Imaging funzionale nello sviluppo di reti corticali
In questo articolo
Riepilogo
Attività spontanea di sviluppare le reti neuronali può essere misurato con AM-estere forme di calcio-sensibili coloranti indicatore. Variazioni di calcio intracellulare, indicando l'attivazione neuronale, vengono rilevati come variazioni transitorie della fluorescenza indicatore con uno o due fotoni di imaging. Questo protocollo può essere adattato per una serie di reti neuronali evolutivamente-dipendente In vitro.
Abstract
Un modello segno distintivo di attività nello sviluppo di sistemi nervosi è spontaneo, attività di rete sincronizzato. L'attività sincronizzata è stata osservata in intatti midollo spinale, tronco encefalico, retina, corteccia e dissociato preparati cultura neuronale. Durante i periodi di attività spontanea, i neuroni depolarizzare a fuoco singolo o raffiche di potenziali d'azione, l'attivazione di canali ionici molti. Depolarizzazione attiva voltaggio-dipendenti canali del calcio in dendriti e spine che mediano afflusso di calcio. Altamente sincronizzato attività elettrica è stata misurata dal livello locale reti neuronali utilizzando elettrodi di campo. Questa tecnica consente elevate velocità di campionamento temporale, ma più bassa risoluzione spaziale grazie alla lettura integrata di neuroni più a un elettrodo. Risoluzione singola cella di attività neuronale è possibile utilizzando patch-clamp su singoli neuroni elettrofisiologia per misurare l'attività di tiro. Tuttavia, la capacità di misurare da una rete è limitato al numero di neuroni patch simultaneously, ed è in genere solo una o due neuroni. L'uso di calcio-dipendente coloranti indicatore fluorescente ha permesso la misurazione dell'attività sincronizzate attraverso una rete di cellule. Questa tecnica dà sia ad alta risoluzione spaziale e temporale di campionamento sufficiente per registrare l'attività spontanea della rete di sviluppo.
Una caratteristica fondamentale di reti corticali e dell'ippocampo appena formatisi durante il pre-e del primo sviluppo post-natale è spontaneo, sincronizzato attività neuronale (Katz & Shatz, 1996; Khaziphov e Luhmann, 2006). Questa attività di rete correlati è ritenuta essenziale per la generazione di circuiti funzionali del sistema nervoso (Spitzer, 2006). In entrambi i primati e il cervello di roditori, i primi e le onde della rete elettrica di calcio sono stati osservati prima e dopo la nascita in vivo e in vitro (Adelsberger et al, 2005;. Garaschuk et al, 2000;.. Lamblin et al, 1999). Questi primi modelli di attività, che sono noti per il controllo diversiprocessi di sviluppo tra cui la differenziazione neuronale, sinaptogenesi e la plasticità (Rakic & Komuro, 1995;. Spitzer et al, 2004) sono di fondamentale importanza per il corretto sviluppo e la maturazione dei circuiti corticali.
In questo video Giove, ci dimostra i metodi utilizzati per attività immagine spontanea nello sviluppo di reti corticali. Calcio-sensibili indicatori, come Fura 2-AM diffuso estere attraverso la membrana cellulare dove l'attività esterasi intracellulari si unirà il AM esteri di lasciare la cellula-impermeant forma di colorante indicatore. La forma di impermeant indicatore ha gruppi acido carbossilico che sono in grado di rilevare e poi legare ioni calcio all'interno delle cellule .. La fluorescenza del colorante calcio-sensibile è transitoriamente alterata dal legame al calcio. Tecniche di imaging singola o multi-fotone vengono utilizzati per misurare la variazione di fotoni emessi dal colorante, e quindi indicare una alterazione di calcio intracellulare. Inoltre, questi calcio-dindicatori ependent può essere combinato con altri marcatori fluorescenti per indagare tipi di cellule all'interno della rete attiva.
Protocollo
1. Fare orizzontale entorinale, dell'ippocampo fettine di cervello
Entorinale, dell'ippocampo fettine di cervello sono realizzati con guide anatomiche, dettagliato in una visione 3D della regione secondo Canto, Wouterlood & Witter (2008) ID plasticità neurale 381.243 9.
- Fai 500ml di soluzione slice, ossigenare con CarboGen gas (95% di ossigeno, anidride carbonica del 5%) per almeno 20 minuti e poi congelare fino a 250ml ghiacciato. Minuti prima di tagliare, schiacciare e frullare il ghiaccio fetta con la soluzione rimanente fetta 250ml bolle da utilizzare per la dissezione e per il taglio nella camera di taglio.
- Fai 200ml di r-ACSF (recupero ACSF) e almeno 500 ml di e-ACSF (sperimentale ACSF) soluzione. Continuamente ossigenare entrambe le soluzioni con CarboGen gas (95% di ossigeno, anidride carbonica del 5%) per almeno 20 minuti prima di preparazione dei tessuti.
- Questo protocollo è valido per topi fin dal primo giorno post-natale 0 a un massimo di 3 settimane. Decapitare l'animal, secondo le procedure del comitato etico, e sezionare il cervello rapidamente in una capsula di Petri contenente ghiacciata soluzione fetta preparata nella fase 1, al di sopra (vedi Tabella 1 per le soluzioni e reagenti).
- Trasferire il cervello su un filtro di carta imbevuto di soluzione fetta e separare i due emisferi con una lametta affilata. Trasferire un emisfero indietro nel ghiacciata soluzione fetta.
- Rimuovere il cervelletto dell'altro emisfero. Capovolgere il cervello sulla sua linea mediana e tagliare la parte superiore del cervello con una leggera angolazione verso la fine rostrale.
- Capovolgere il cervello sul taglio (dorsale) della superficie e incollarla sul supporto del tessuto affettatrice a testa in giù spingendo delicatamente con un cotton fioc.
- Fetta 300 micron di spessore fettine di cervello usando una bassa frequenza e la velocità nel restante gelida soluzione fetta fatto al punto 1. Nelle nostre condizioni, usiamo un Thermo Fisher Scientific vibratome (Microm, HM 650V) con impostazioni di 0,05 mm / s e 36Hz.
- ComeAppena una fetta viene tagliata, trasferirlo in un supporto fetta (in immersione) contenente ossigenata artificiale fluido cerebro spinale (ACSF) (Mg 2 + 2,5 mm, 1,6 mm Ca 2 +, vedi Tabella 2) a temperatura ambiente. Una concentrazione di magnesio superiore a r-ACSF riduce l'afflusso di calcio nei neuroni attraverso i recettori NMDA seguenti affettamento e nella nostra esperienza, porta ad una migliore qualità di fette per gli esperimenti. Se necessario, tagliare il secondo emisfero cerebrale in seguito.
- Lasciate le fette per un'ora per recuperare.
| Slice soluzione (in mm) - 10 | |
| 110 | cloruro di colina |
| 25 | NaHCO 3 |
| 11,6 | 11,6 |
| 10 | D-glucosio |
| 7 | MgCl 2 |
| 3,1 | sodiumpyruvate |
| 2,5 | KCl |
| 1,25 | NaH 2 PO 4 |
| 0,5 | CaCl 2 |
Tabella 1. Ricetta per la soluzione fetta.
| ACSF (in mm) | |
| 125 | NaCl |
| 26 | NaHCO 3 |
| 10 | D-glucosio |
| 3 | KCl |
| 2.5/1.5 | MgCl 2 (recupero / esperimento) |
| 1,6 | CaCl 2 |
| 1,25 | NaH 2 PO 4 |
Tabella 2. Ricetta per entrambi il recupero (r-ACSF) e sperimentali (e-ACSF) soluzione.
2. Preparazione del ch colorazioneambra
Per caricare le celle con i calcio-dipendente indicatore o cellulo-specifici marcatori, le fette devono essere trasferiti in una camera per la procedura di colorazione. Sebbene camere di commercio possono essere disponibili, si può facilmente essere assemblato da apparecchiature di laboratorio standard per il costo molto poco. Le caratteristiche principali di questa camera sono che le fette vengono riscaldati a tra i 30 ei 35 ° C, incubate in un mezzo continuo ossigenato e che la camera è al riparo dalla luce.
- Con una bacchetta riscaldata, fare un piccolo foro nella parete laterale di due piatti usa e getta di Petri in polistirolo (35 e diametro 100 mm) che è appena abbastanza grande per consentire una sezione di tubo in silicone (diametro circa 1,5 mm) di passare.
- Infilare il tubo in silicone attraverso il foro nella piccola scatola di Petri e formare un anello all'interno della parete interna del piatto di piccole dimensioni.
- Usa supercolla per sigillare l'estremità aperta del tubo e bastone il resto del tubo alla parete interna della capsula di Petri.
- Usando un ago, eseguire fori bene ad intervalli distanziati uniformemente nel tubo all'interno il piatto interno di Petri.
- Incollare il piatto più piccolo di Petri all'interno del più grande, con due fori allineati. Infilare l'altra estremità del tubo di silicone attraverso il foro nella parete del piatto più grande di Petri.
- Per il piatto di interfaccia, prendere una coltura cellulare inserire bene con membrana semi-permeabile e utilizzando un bisturi riscaldata, tagliare i 1cm di distanza superiore a lasciare un piatto fondo per tenere le fette durante l'incubazione.
- Sul coperchio del piatto più grande di Petri, fare un buco circa. 0,5-1cm di diametro per consentire CarboGen (95% O 2, 5% CO 2) di fluire nella camera.
- Prendete un 5 o siringa di plastica da 10 ml. Usando un bisturi riscaldata, fare un taglio angolato per rimuovere alla fine della siringa e mantenere una lunghezza di pochi cm di tubo siringa con la punta. Utilizzando supercolla, fissare la superficie di taglio del tubo siringa al coperchio scatola di Petri, sopra il foro 0,5-1 centimetro di diametro.
- Collegare il tubo in silicone e inubing connettore per la punta della siringa. Collegare un altro connettore del tubo al tubo di silicone che entrano alla base delle piastre di Petri.
- Collegare entrambi i tubi fino ad un regolatore per CarboGen (95% O 2, 5% CO 2) fornitura. Posizionare la camera di colorazione su una piastra calda per l'incubazione tra i 30-35 ° C. Assicurarsi che la camera può essere al riparo dalla luce durante l'intero processo di incubazione. La camera di colorazione è pronto da montare ed utilizzare per l'incubazione fetta.
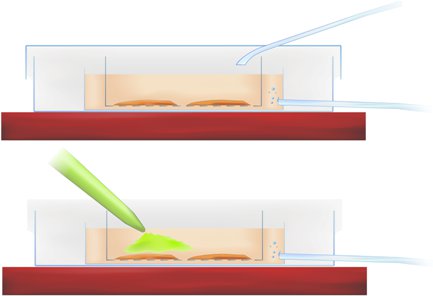
Metodologia Figura 1. Sezione della camera di colorazione che mostra fetta di incubazione (in alto) e l'applicazione di calcio-sensibile indicatore (pipettati colorante verde, sotto).
3. Colorazione delle fette
Nel corso di qualsiasi trattamento che coinvolgono coloranti fluorescenti, evitare photobleaching lavorando con poca luce e mantenere il colorante e tha macchiato il tessuto al buio tra maneggevolezza.
- Porre la camera di colorazione su un piatto caldo (35 ° C), collegarlo ad una fornitura di gas CarboGen e riempirlo con circa 1,5 ml r-ACSF dal titolare fetta.
- Posizionare il piatto interfaccia nella camera di colorazione e riempirlo con 1 ml ACSF.
- Garantire un buon apporto CarboGen nella camera di colorazione per mantenere la spumeggiante ACSF ad un delicato e costante.
- Aggiungere 9 DMSO microlitri e 1 acido Pluronic microlitri (20% in soluzione di DMSO magazzino, Invitrogen) in un flaconcino di mcg Fura 50 2-AM. Vortex il mix colorante per 15 minuti.
- Trasferire le fettine nel piatto di interfaccia e pipettare il colorante nella r-ACSF direttamente sulla regione dell'ippocampo e della corteccia entorinale di interesse, come indicato nella figura Metodologia 1 (sopra), ottenendo una concentrazione finale tintura di 50 mm.
- Chiudere il coperchio della camera di colorazione ed incubare il colorante per 20 - 40 minuti a seconda dell'età dell'animale (cfr. tabella 3).
- Transfer le fette nel supporto fetta.
| Età (giorno dopo la nascita) | Tempo di incubazione (min) |
| 20 | |
| P8-P9 | 25 |
| p10-p11 | 30 |
| p12-13 | 35 |
| > P13 | 40 |
Tabella 3. I tempi di incubazione per le diverse età, empiricamente determinato in laboratorio.
4. Altri coloranti e più tessuti
Forse a causa di un aumento della mielinizzazione del tessuto cerebrale, le fette da vecchi roditori non occupano Fura 2-AM estere che facilmente. Per facilitare l'assorbimento di questo colorante è utilizzato un passo di preincubazione con Cremophor EL (Sigma) per il cervello dei topi a P13 e oltre 11. Cremophor è un tensioattivo non ionico usato come eccipiente in molti farmaceuticaAl applicazioni. Senza questo passo, troviamo che cellula-specifica etichettatura è estremamente povera e inconsistente per tutta la fetta corticale.
- Trasferimento fette in un piatto vecchio preincubazione poco profondo riempito con 3 ml r-ACSF e 8 Cremophor microlitri 0,5% (Sigma), riscaldata a 35 ° C per 3 minuti.
- Trasferire le fettine nel piatto di interfaccia e seguire la normale procedura di colorazione (Fasi 4-7, vedi sopra).
Coloranti calcio caricare sia i neuroni e non i neuroni nella preparazione fetta. Per identificare e distinguere tra questi tipi di cellule all'interno della rete, solforodamina 101 (SR101) può essere utilizzato per gli astrociti etichetta all'interno della fetta.
Colorazione delle fette di solforodamina 101
Seguire i passaggi 1-3 come in precedenza (sezione 3).
Prendere 1 ml di soluzione madre 10mM di solforodamina (Sigma), dalla sua conservazione a -20 ° C e si sciolgono in 999 microlitri r-ACSF per dare una soluzione al 10 micron. Pipettare la porpora tinta over le fette come prima (passi 5-7), lasciando le fette in incubazione per un periodo di 15 minuti.
Microglia e le cellule endoteliali sono etichettati con FITC colorante lectina pomodoro
Seguire i passaggi 1-3 come prima.
Prelevare 25 ml di 2mg/ml Lycopersicon esculentum (pomodoro) lectine FITC coniugato (L0401, Sigma) in 2,5 ml soluzione stock r-ACSF dare 20 mg / ml concentrazione. Pipettare il colorante sulle fette come prima (passi 5-7), lasciando le fette di incubazione per un periodo di 45 minuti.
Nota, non è possibile combinare questo colorante con un calcio-sensibile indicatore di come Fura 2-AM o Oregon Verde Bapta-1 (OGB-1) che la fluorescenza nella gamma verde dello spettro in quanto i fotoni da entrambi i coloranti vengono emessi a lunghezze d'onda si sovrappongono. Tuttavia, ci sono altri calcio-indicatore di coloranti come il calcio arancione, rosso Fura che possono essere utilizzati in combinazione con filtri appropriati o Texas-Red coniugati lectina di unire ingegnoh calcio indicatore coloranti nello spettro verde.
5. Collegamento fette di camera di registrazione
Durante le fette di imaging devono essere stabili sotto il microscopio. Di solito un arpa metallo è in grado di tenere premuto il tessuto ma può distorcere in modo non uniforme la superficie della fetta, dando solo una parte del campo visivo per l'imaging a fuoco. Per evitare questo, le fette sono bloccati alla camera di registrazione utilizzando Polyethylenimine (PEI).
- Preparare la soluzione PEI (1 ml soluzione Polyethyleneimine in 250ml di buffer borico (tabella 4)). Assicurarsi che il PEI si dissolve completamente (mescolare durante la notte).
- Riempire le camere di registrazione con una soluzione di PEI in modo che il fondo è ricoperto di liquido almeno un'ora prima che si desidera applicare le fette
- Lavare le camere di registrazione con acqua distillata e poi con r-ACSF dalla camera di azienda.
- Trasferire una fetta in una camera di registrazione.
- Rimuovere la r-ACSF con una pipetta e posizionare la sldi ghiaccio a metà con un pennello.
- Rimuovere la r-ACSF tutto il fetta usando pezzi di filterpaper. Per la stabilità e l'aderenza, è importante che non ci sia ACSF intorno alla fetta più.
- Pipetta di circa 0,5-1ml ACSF, a seconda delle dimensioni della camera di registrazione, sulla fetta. ACSF deve solo coprire la superficie della fetta.
- Porre la camera di registrazione con la fetta in un grande contenitore umidificato interfaccia, perfusi con CarboGen, e lasciare le fette di recuperare per almeno un'ora.
| PEI soluzione | |
| 1 ml | Poli (etilenoimina) soluzione |
| in 250 ml di buffer borico | |
| 40mm | acido borico |
| 10mM | sodio tetraborato decaidrato |
Tabella 4. Soluzione Ricetta PEI.
6. Iminvecchiamento
Calcio-dipendente coloranti indicatore può essere ripreso utilizzando uno o due fotoni microscopia. L'uso di due fotoni di imaging si attiva solo colorante indicatore all'interno del volume focale della regione di interesse, riducendo così la quantità di diffusione della luce nel tessuto. Inoltre, consente una migliore penetrazione profondità della luce nel fetta.
Per l'imaging funzionale di calcio si usa un laser titanio zaffiro forniti da Coherent accoppiato ad un microscopio Olympus con un obiettivo 20x (NA 0,95) e un sistema di Trimscope da LaVision Biotec. Il sistema consente Trimscope telaio scansione con 64 beamlets contemporaneamente ed è accoppiato con un C9100 Hamamatsu EM-CCD per una rapida scansione frame-tassi.
- Posizionare la camera di registrazione sotto il microscopio e stabilire una perfusione stabile con l'imaging e-ACSF (1,6 Ca 2 + / 1.5 Mg 2 rapporto + (tabella 2)) riscaldato a una temperatura più fisiologico di minimo 30 ° C.
- Focnoi nella regione di interesse (ROI) con illuminazione a luce bianca. Evitare di esporre la fetta di luce più del necessario.
- Scegliere la lunghezza d'onda, campo dell'imaging di vista, la frequenza di scansione, la densità dei pixel e opzioni software aggiuntivo applicabile per i segnali biologici e tessuti si vuole misurare. Per l'imaging rete calcio con Fura 2-AM che di solito scelgono una lunghezza d'onda di 820nm, un campo di imaging 250x250 micron di vista, una frequenza di 1200Hz linescanning e 2-da-2 binning. Il risultato è una frametime di circa 100 ms e quindi una frequenza di imaging di circa 10Hz.
- Controlla se il tuo ROI è a fuoco utilizzando una modalità di scansione continua e lunghezza d'onda selezionata di Laserlight. Regolare messa a fuoco e intensità del laser al fine di evitare la saturazione dei pixel e sbiancamento della vostra immagine.
- Fare un film Timelapse del vostro ROI. Noi di solito acquistano due film Timelapse del 2000 fotogrammi ciascuna.
- Per il rilevamento e l'identificazione delle cellule, fare una Z-Stack con un passo di di 1 micron e imag e + / 20 micron intorno al vostro aereo immaginato di messa a fuoco.
7. Rappresentante risultati
Carico di successo degli indicatori di calcio, Fura 2-AM sono mostrati in figura 1 nello sviluppo di reti corteccia entorinale e neocorticale utilizzando l'imaging multiphoton. Alcuni colorante si presenta ancora come la colorazione di fondo nel soma cellulare e tissutale, ma in alcuni casi, dendriti prossimali sono chiaramente visibili e separata dal circostante neuropilo. Se il carico non ha avuto successo, molto poco specifico delle cellule colorazione è osservato e piccoli gruppi di macchie tintura sono spesso visibili sulla superficie della membrana fetta di detriti morti.
In questi screenshot, la rete di cellule è chiaramente visibile in un unico piano di messa a fuoco per l'imaging cellulare simultanea. L'uso di un arpa metallo o attaccare incompleta della fetta alla camera di registrazione può risultare in una superficie irregolare fetta da acquisire.
550fig1.jpg "alt =" Figura 1 "/>
Figura 1. Fura 2-AM-estere caricato sviluppo neocorticale (A, a sinistra) e entorinale (B, a destra) le reti. Barre Scala 100 micron.
Per separare i neuroni da astrociti, co-applicazione di solforodamina 101 con Fura 2-AM estere consente di separare i tipi di cellule all'interno della rete.
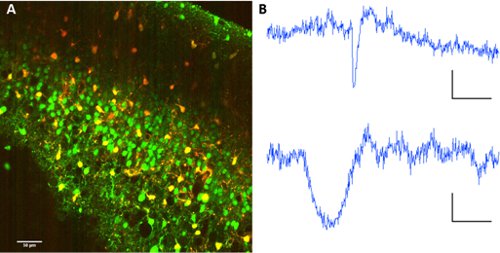
Figura 2. Etichettatura astrociti con solforodamina 101. A Co-etichettatura dei Fura 2-AM estere e solforodamina 101. Eccitazione lunghezza d'onda: 820nm. Raccolta di immagini su PMT con specchio dicroico a 560/70nm per la separazione lunghezza d'onda. B tracce Rappresentante fluorescenza da un neurone (sopra) e un astrociti (sotto). Scala bar 60 sec, ΔF 10 (au fluo).
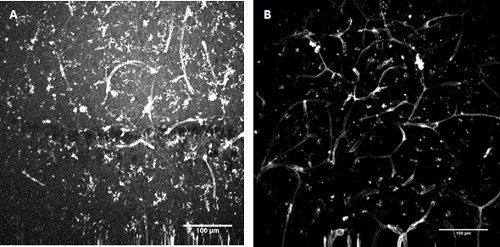
Figura 3. FITC-coniugato Lycopersicon esculentum (pomodoro) lectina colorazione . Etichettatura di microglia e le cellule endoteliali nello sviluppo dell'ippocampo mouse (A) e superficiale della corteccia entorinale (B).
Coloranti indicatore di calcio vengono utilizzati per attività di read-out da più celle contemporaneamente nello sviluppo di reti corticali e dell'ippocampo.
Figura 4. Transienti di calcio dinamica nelle reti ippocampali e corticali.
Video 1: Fura 2-AM carico estere del mouse corteccia entorinale durante la seconda settimana dopo la nascita.
Clicca qui per vedere film 1.
Movie 2: Fura 2-AM estere carico dell'ippocampo del mouse durante la prima settimana post-natale.
Clicca qui per vedere film 2.
Movie 3: Fluo-4 carico del mouse corteccia, durante la prima settimana post-natale.
50movie3.avi "> Clicca qui per vedere film 3.
Nel caso della Fura 2-AM estere, l'attivazione delle cellule che coinvolge una depolarizzazione indotta afflusso di calcio, diminuisce fluorescenza colorante. Per i coloranti come Fluo-4, è vero il contrario e depolarizzazione delle cellule si osserva come un aumento delle emissioni di fotoni. Transienti di calcio somatiche sono essenzialmente misurato ma l'attività in grandi dendriti prossimali può essere visto anche in alcune preparazioni, come mostrato in Movie 2.
Lettura delle attività di rete può essere quantificato utilizzando script software commerciale o in-house. Nel nostro laboratorio, l'identificazione delle cellule e l'attività di rete è misurato e analizzato in un modo semi-automatico con in-house codice Matlab (Mathworks).
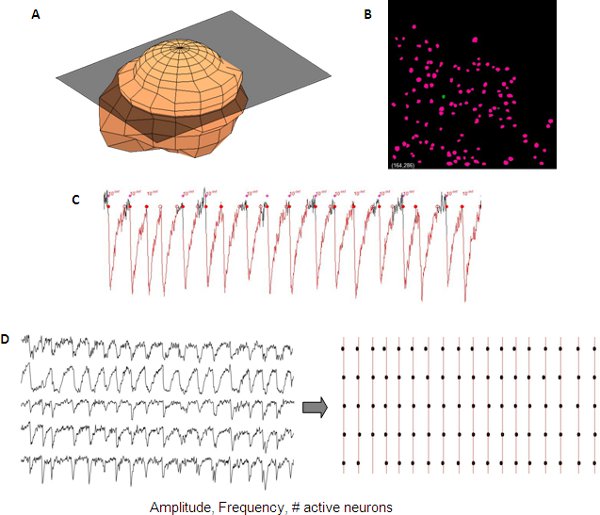
Figura 5. Analisi rappresentante dei transitori di calcio sincronizzato da una rete di sviluppo corticale. Rappresentazione 3D di un neurone ( A) utilizzato per creare automaticamente una maschera neurone (B) da un z-stack per il rilevamento automatico dei neuroni. Misure di transienti di calcio sono l'ampiezza, frequenza e numero delle cellule attive che possono essere letti dal singolo neurone dati (C). Sincronia tra diverse tracce possono essere visualizzati con un plot raster (D).
Discussione
I metodi si dimostra qui mostrano protocolli idonei per l'imaging di calcio delle dinamiche di rete a partire da cellule identificabile all'interno di sviluppo di reti corticali e dell'ippocampo nel topo e anche nel cervello di ratto. Questi metodi forniscono ottimale risoluzione spaziale di visualizzare una rete locale di somas cellula contemporaneamente per la misurazione dell'attività suprathreshold. Risoluzione temporale di attività di rete può essere variata, a seconda del telaio acquisizione CCD impostazioni della fotocamera, per ottimizzare il segnale: misure di rumore per gli eventi suprathreshold lunga durata, tipici di sviluppo del sistema nervoso. Questi protocolli non sono limitate alle reti ippocampali e corticali ma anche le cellule etichetta per tutto lo sviluppo del sistema nervoso. La limitazione di questo metodo è che l'attività suprathreshold solo possono essere registrati.
Divulgazioni
LaVision Biotec GmbH (Bielefeld, Germania) ha sponsorizzato la presentazione onorari di questo articolo manoscritto.
Riconoscimenti
Lavoro in laboratorio è supportato da Organisatie Nederlandse Wetenschappelijk voor Onderzoek (NWO) (917.10.372) per RMM. JD è affiliata alla 7 ° PQ dell'UE BrainTrain programma ( www.brain-train.nl ). Ringraziamo Pieter Laurens-Baljon e Sabine Schmitz (entrambi CNCR, VU University Amsterdam) per le immagini delle forme d'onda multielectrode serie FP e culture neuronali usati nella sequenza video.
Materiali
Riferimenti
- Katz, L. C., Shatz, C. J. Synaptic activity and the construction of cortical circuits. Science. 274, 1133-1138 (1996).
- Khazipov, R., Luhmann, H. J. Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends in Neurosciences. 29, 414-418 (2006).
- Spitzer, N. C. Electrical activity in early neuronal development. Nature. 444, 707-712 (2006).
- Adelsberger, H., Garaschuk, O., Konnerth, A. Cortical calcium waves in resting newborn mice. Nat. Neurosci. 8, 988-990 (2005).
- Garaschuk, O., Linn, J., Eilers, J., Konnerth, A. Large-scale oscillatory calcium waves in the immature cortex. Nat. Neurosci. 3, 452-459 (2000).
- Lamblin, . Electroencephalography of the premature and term newborn. Maturational aspects and glossary. Neurophysiol. Clin. 29, 123-219 (1999).
- Rakic, P., Komuro, H. The role of receptor/channel activity in neuronal cell migration. J. Neurobiol. 26, 299-315 (1995).
- Spitzer, N. C., Root, C. M., Borodinsky, L. N. Orchestrating neuronal differentiation: patterns of Ca2+ spikes specify transmitter choice. Trends. Neurosci. 27, 415-421 (2004).
- Canto, C. B., Wouterlood, F. G., Witter, M. P. What does the anatomical organization of the entorhinal cortex tell us. Neural. Plast. , 381243-381243 (2008).
- Bureau, I., Shepherd, G. M., Svoboda, K. Precise development of functional and anatomical columns in the neocortex. Neuron. 42, 789-801 (2004).
- Ikegaya, Y., Le Bon-Jego, M., Yuste, R. Large-scale imaging of cortical network activity with calcium indicators. Neuroscience research. 52, 132-138 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon