Method Article
סידן הדמיה תפקודית בפיתוח רשתות קליפתיים
In This Article
Summary
פעילות ספונטנית של פיתוח רשתות נוירונים ניתן למדוד באמצעות AM-אסתר צורות של סידן רגיש צבעים אינדיקטור. שינויים סידן תוך תאי, המציין ההפעלה העצבית, מזוהים כמו שינויים חולפות הקרינה אינדיקטור עם אחד או שני פוטונים הדמיה. פרוטוקול זה יכול להיות מותאמים עבור מגוון של רשתות נוירונים התפתחותית תלויי במבחנה.
Abstract
דפוס סימן ההיכר של פעילות בפיתוח מערכות העצבים היא פעילות ספונטנית, רשת מסונכרן. פעילות מסונכרן נצפתה פגע בחוט השדרה, המוח קליפת המוח, הרשתית ניתק ההכנות תרבות עצביים. בתקופות של פעילות ספונטנית, הנוירונים depolarize לפטר אחד או התפרצויות של הפוטנציאלים לפעולה, הפעלת תעלות יונים רבות. שלילת קוטביות מפעיל מתח מגודרת ערוצי סידן על דנדריטים קוצים לתווך זרימת סידן. הפעילות החשמלית מסונכרן מאוד כבר נמדד מרשתות נוירונים המקומית באמצעות אלקטרודות השדה. טכניקה זו מאפשרת דגימה גבוה שיעורי הזמני אך ברזולוציה מרחבית נמוכה עקב משולב לקריאה מתוך נוירונים מרובים בו אלקטרודה אחת. ברזולוציה של תא יחיד הפעילות העצבית אפשרי באמצעות תיקון-clamp electrophysiology על נוירונים בודדים כדי למדוד פעילות ירי. עם זאת, היכולת למדוד מרשת מוגבל במספר הנוירונים תוקנו simultaneously, ובדרך כלל הוא רק אחד או שניים נוירונים. השימוש סידן תלויי צבעי ניאון אינדיקטור אפשרה מדידה של פעילות מסונכרנת ברשת של תאים. טכניקה זו מאפשרת הן ברזולוציה מרחבית גבוהה הדגימה הזמני מספיק כדי לתעד פעילות ספונטנית של הרשת המתפתחת.
תכונה מרכזית של החדש יוצרי רשתות הקורטיקליים בהיפוקמפוס במהלך התפתחות טרום לידה מוקדמת ספונטנית, מסונכרן הפעילות העצבית (כץ & שץ, 1996; Khaziphov & Luhmann, 2006). פעילות זו רשת בקורלציה הוא האמין להיות חיונית עבור הדור של מעגלים תפקודית במערכת העצבים המתפתח (שפיצר, 2006). ב הפרימטים וגם המוח מכרסם, חשמל מוקדם רשת גלי סידן הם נצפו מראש ו לאחר הלידה in vivo ו in vitro (Adelsberger et al, 2005;. Garaschuk et al, 2000;.. Lamblin et al, 1999). אלה דפוסי הפעילות המוקדמות, אשר ידועים לשלוט בכמהתהליכים התפתחותיים כולל synaptogenesis העצבית בידול, ואת הפלסטיות (Rakic & Komuro, 1995;. שפיצר et al, 2004) הם בעלי חשיבות קריטית לפיתוח התבגרות נכונה של המעגלים קליפת המוח.
בסרטון זה יופיטר, אנו מדגימים את שיטות לפעילות תמונה ספונטנית בפיתוח רשתות קליפת המוח. סידן רגיש אינדיקטורים, כגון Fura 2-AM אסתר מפוזר על פני קרום התא שבו פעילות esterase תאיים cleaves AM אסטרים לעזוב את צורת התא impermeant של צבע אינדיקטור. צורת impermeant של אינדיקטור יש קבוצות חומצה carboxylic אשר מסוגלים לזהות אז לאגד יוני סידן intracellularly .. הקרינה של סידן צבען רגיש משתנה transiently על כבילת סידן. שיטות הדמיה יחיד או רב פוטון משמשים למדידת השינוי הפוטונים הנפלטים להיות צבע, ובכך להצביע על שינוי בסידן תאיים. יתר על כן, אלה סידן-dהאינדיקטורים ependent יכול להיות משולב עם סמנים ניאון אחרים לחקור סוגי תאים בתוך רשת פעיל.
Protocol
1. ביצוע אופקי entorhinal-בהיפוקמפוס פרוסות המוח
Entorhinal-בהיפוקמפוס פרוסות המוח נעשים באמצעות מדריכי אנטומי, מפורט סקירה 3D של האזור על פי קנטו, Wouterlood & לקשקש (2008) מזהה פלסטיות עצבית 381,243 9.
- הפוך את 500ml של תמיסת פרוסה, חמצן עם carbogen גז (95% חמצן, פחמן דו חמצני 5%) לפחות 20 דקות ולאחר מכן להקפיא 250 מ"ל עד קר. דקות לפני חיתוך, ומערבלים לרסק את הקרח פרוסה עם הפתרון הנותרים פרוסה 250 מ"ל מבעבע לשמש לנתיחה עבור חיתוך בחדר חיתוך.
- הפוך את 200 מ"ל של r-ACSF (התאוששות ACSF) ולפחות 500ml של דואר ACSF (ניסיוני ACSF) פתרון. חמצן ברציפות עם שני פתרונות carbogen גז (95% חמצן, פחמן דו חמצני 5%) לפחות 20 דקות לפני ההכנה רקמות.
- פרוטוקול זה תקף עכברים מיום הלידה 0 עד למקסימום של 3 שבועות. לערוף את האנימהאני, על פי נהלי הוועדה המקומית אתית לנתח את המוח במהירות בצלחת פטרי המכילות קר כקרח פתרון פרוסה מוכן בשלב 1 לעיל (ראה לוח 1 עבור פתרונות & ריאגנטים).
- מעבירים את המוח על נייר מסנן ספוגה פתרון פרוסה להפריד את שתי ההמיספרות בסכין גילוח חדה. העברת המיתחם בחזרה פתרון קרים כקרח פרוסה.
- הסר את המוח הקטן של חצי הכדור השני. תהפכו את המוח על קו האמצע שלה לחתוך את החלק העליון של המוח עם זווית קלה לקראת סוף מקורי.
- תהפכו את המוח על החתך (הגבי) משטח ודבק אותו על בעל רקמה של מבצעה במהופך על ידי דוחף בעדינות עם ניצן כותנה.
- פורסים בעובי 300 מיקרומטר פרוסות המוח באמצעות תדר במהירות נמוכה ועל הפתרון הנותרים קרים כקרח פרוסה שנעשו שלב 1. בתנאים שלנו, אנו משתמשים פישר Thermo Scientific vibratome (Microm, HM 650V) בשעה ההגדרות 0.05 מ"מ / s ו - 36Hz.
- כמוברגע פרוסה נחתך, ולהעביר אותו לתוך מחזיק פרוסה (שקוע) המכיל חמצן מלאכותית Cerebro נוזל עמוד השדרה (ACSF) (2.5mm Mg 2 +, Ca 2 + 1.6mM; ראו טבלה 2) בטמפרטורת החדר. ריכוז המגנזיום הגבוהה r-ACSF מפחית את זרם סידן לתוך הנוירונים באמצעות קולטני NMDA בעקבות חיתוך ועל הניסיון שלנו, מוביל באיכות טובה יותר של פרוסות לניסויים. במידת הצורך, לחתוך את הכדור מוחין second לאחר מכן.
- השאירו את פרוסות במשך שעה אחת כדי להתאושש.
| פורסים את פתרון (מ"מ) - 10 | |
| 110 | כולין כלוריד |
| 25 | NaHCO 3 |
| 11.6 | 11.6 |
| 10 | D-גלוקוז |
| 7 | MgCl 2 |
| 3.1 | sodiumpyruvate |
| 2.5 | KCl |
| 1.25 | לאא 2 PO 4 |
| 0.5 | CaCl 2 |
טבלה 1. מתכון לפתרון פרוסה.
| ACSF (מ"מ) | |
| 125 | NaCl |
| 26 | NaHCO 3 |
| 10 | D-גלוקוז |
| 3 | KCl |
| 2.5/1.5 | MgCl 2 (התאוששות / ניסוי) |
| 1.6 | CaCl 2 |
| 1.25 | לאא 2 PO 4 |
טבלה 2. מתכון התאוששות הן (r-ACSF) ו ניסיוני (e-ACSF) פתרון.
2. הכנת פרק מכתיםענבר
כדי לטעון את התאים עם מחוון סידן תלויי או תאים ספציפיים סמן, פרוסות צריכים להיות מועברים לחדר עבור ההליך מכתים. למרות לתאי מסחריים יהיו זמינים, ניתן בקלות להרכיב מ ציוד מעבדה סטנדרטי עבור עלות קטנה מאוד. התכונות העיקריות של חדר כאלה כי הם חיממו את הפרוסות על בין 30 ל 35 מעלות צלזיוס, מודגרות בתווך מחומצן ברציפות וכי קאמרית הוא מוגן מפני אור.
- באמצעות מוט מחומם, לעשות חור קטן בקיר הצדדי של שתי בצלחות פטרי הפנויה פוליסטירן (35 ו בקוטר 100 מ"מ), כי הוא גדול מספיק כדי לאפשר קטע צינור סיליקון (בערך בקוטר 1.5 מ"מ) לעבור.
- נושא סיליקון צינורות דרך החור בצלחת פטרי קטנה בצורת לולאה בתוך הקיר הפנימי של צלחת קטנה.
- השתמש בדבק כדי לאטום את הקצה הפתוח של הצינור מקל את שאר הצינור אל הקיר הפנימי של צלחת פטרי.
- באמצעות מחט, לעשות חורים בסדר במרווחים שווים ברווח בצינור בתוך צלחת פטרי הפנימית.
- דבק קטן צלחת פטרי בתוך גדול אחד, עם שני חורים מיושר. נושא את הקצה השני של צינור סיליקון דרך החור בקיר של צלחת פטרי גדולה.
- למנה את ממשק, לקחת תרבית תאים להכניס היטב עם קרום חדיר למחצה באמצעות אזמל מחוממת, לחתוך את 1cm למעלה ממנו להשאיר צלחת שטוחה להחזיק את פרוסות במהלך הדגירה.
- על המכסה של צלחת פטרי גדולה, לעשות חור בערך. 0.5-1cm בקוטר כדי לאפשר carbogen (95% O 2, CO 5% 2) לזרום אל תוך החדר.
- קחו 5 או 10 מ"ל מזרק פלסטיק. באמצעות אזמל לוהט, לעשות לחתוך בזווית כדי להסיר את סופו של המזרק ולשמור על אורך ס"מ ספורים של הצינור מזרק עם קצה. באמצעות דבק מגע, לצרף את פני השטח חתך של הצינור מזרק כדי המכסה צלחת פטרי, מעל החור בקוטר 0.5-1cm.
- צרף צינורות סיליקון בביתubing מחבר אל קצה המזרק. צרף אחר מחבר צינורות צינורות סיליקון כדי להיכנס לבסיס של בצלחות פטרי.
- חבר את שני הצינורות כדי הרגולטור עבור carbogen (95% O 2, 5% CO 2) לספק. הנח את החדר מכתים על צלחת חמה הדגירה בין 30-35 ° C. ודא קאמרית יכול להיות מוגן מפני האור במהלך תהליך הדגירה כולו. תא מכתים מוכן כעת להרכיב לשימוש הדגירה פרוסה.
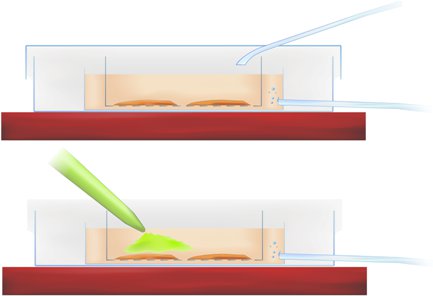
מתודולוגיה באיור 1. חתך של החדר מכתים מראה הדגירה פרוסה (לעיל) יישום מחוון סידן רגיש (pipetted צבע ירוק, להלן).
3. הכתמה של פרוסות
לאורך כל הטיפול הכרוך צבעי ניאון, להימנע photobleaching ידי עבודה עם אור קטן ולשמור על צבע ו-tהוא מוכתם רקמות בחושך בין טיפול.
- שים את החדר מכתים על צלחת חום (35 ° C), לחבר אותו אספקת גז carbogen ולמלא אותו 1.5ml כ r-ACSF מבעל פרוסה.
- מניחים את צלחת ממשק בחדר מכתים ולמלא אותו 1ml ACSF.
- להבטיח אספקת carbogen טוב בחדר מכתים לשמור על מבעבע ACSF בקצב, עדין ויציב.
- הוסף 9 DMSO μl 1 ו חומצה pluronic μl (20% בפתרון מניות DMSO, Invitrogen) לתוך בקבוקון של 50 מיקרוגרם Fura 2-PM. וורטקס תמהיל לצבוע במשך 15 דקות.
- מעבירים את הפרוסות לתוך קערה את הממשק פיפטה לצבוע אל r-ACSF ישירות על האזור בקליפת המוח בהיפוקמפוס entorhinal של עניין, כמפורט באיור מתודולוגיה 1 (לעיל), השגת ריכוז הצבע הסופי של 50mm.
- סגור את המכסה של החדר מכתים ו דגירה צבע עבור 2-40 דקות בהתאם לגיל של בעל החיים (ראה טבלה 3).
- טרנסfer את הפרוסות בחזרה מחזיק את הפרוסה.
| גיל (ימים לאחר הלידה) | זמן הדגירה (דקות) |
| 20 | |
| p8-P9 | 25 |
| P10-p11 | 30 |
| P12-13 | 35 |
| > P13 | 40 |
לוח 3. פעמים דגירה לגילאים שונים, באופן אמפירי שנקבע במעבדה.
4. צבעים אחרים רקמות מבוגרים
אולי בגלל myelination גדל רקמת המוח, פרוסות של מכרסמים מבוגרים אינם תופסים Fura 2-AM אסתר בקלות. כדי להקל על קליטת הצבע הזה צעד preincubation באמצעות Cremophor EL (Sigma) משמש במוחם של עכברים ב P13 ומעלה 11. Cremophor הוא שטח בלתי יוניים משמש excipient ב pharmaceutic רביםאל יישומים. ללא צעד זה, אנו מוצאים כי תא ספציפי תיוג הוא עני מאוד עקביים לאורך הפרוסה קליפת המוח.
- העברת פרוסות הישן לתוך צלחת preincubation רדוד מלא 3ml r-ACSF ו 8 cremophor 0.5% μl (Sigma) מחומם ל 35 מעלות צלזיוס למשך 3 דקות.
- מעבירים את הפרוסות לתוך קערה את הממשק בצע את ההליך מכתים רגילה (שלבים 4-7, ראה לעיל).
צבעים סידן לטעון הן נוירונים שאינם נוירונים בהכנת פרוסה. כדי לזהות ולהבחין בין סוגי תאים בתוך הרשת, sulforhodamine 101 (SR101) ניתן להשתמש כדי האסטרוציטים התווית בתוך הפרוסה.
הכתמה של פרוסות עבור sulforhodamine 101
בצע את השלבים 1-3 כמו קודם (סעיף 3).
קח 1 μl של פתרון של המניה 10mm sulforhodamine (Sigma) מ האחסון שלה ב -20 מעלות צלזיוס, נמסים 999 μl r-ACSF לתת פתרון 10 מיקרומטר. פיפטה הסגול צבע ovאה את פרוסות כמו קודם (שלבים 5-7), עוזב את פרוסות דוגרים במשך 15 דקות.
Microglia ותאי האנדותל מסומנים באמצעות צבע FITC לקטינים עגבניות
בצע את השלבים 1-3 כמו קודם.
קח 25 μl של 2mg/ml Lycopersicon esculentum (עגבניות) לקטינים FITC המצומד (L0401, Sigma) פתרון המניות לתוך 2.5ml r-ACSF לתת 20 מיקרוגרם / מ"ל ריכוז. פיפטה לצבוע מעל את פרוסות כמו קודם (שלבים 5-7), עוזב את פרוסות דוגרים במשך 45 דקות.
שים לב, לא ניתן לשלב זה עם מחוון סידן צבען רגיש כמו Fura 2-AM או אורגון גרין BAPTA-1 (OGB-1) כי לזרוח בטווח ירוק של הספקטרום מאז פוטונים מקרינת צבעים הן יהיו הנפלטים באורכי גל חופפים. עם זאת, ישנם אחרים סידן אינדיקטור צבעים כגון סידן כתום, אדום Fura כי ניתן להשתמש בשילוב עם מסננים מתאימים או טקסס האדום conjugates לקטינים לשלב שנינותh סידן אינדיקטור צבעים בספקטרום הירוק.
5. הצמדת פרוסות לתא הקלטה
במהלך פרוסות הדמיה צריכים להיות יציבים מתחת למיקרוסקופ. בדרך כלל הנבל מתכת ממוקם להחזיק את הרקמות בצורה לא אחידה, אבל זה יכול לעוות את פני השטח של הפרוסה, נותן רק חלק בתחום להציג הדמיה בפוקוס. כדי להימנע מכך, פרוסות תקועים לתא הקלטה באמצעות Polyethylenimine (PEI).
- הכן את הפתרון PEI (1ml פתרון Polyethyleneimine במאגר בור 250 מ"ל (טבלה 4)). ודא PEI נמס לגמרי (מערבבים בין לילה).
- ממלאים את חדרי הקלטה עם פתרון PEI כך התחתונה היא מכוסה בנוזל לפחות שעה אחת לפני ברצונך להחיל את פרוסות
- שטפו את חדרי הקלטה עם מים מזוקקים ולאחר מכן עם r-ACSF מתא המעצר.
- העברת פרוסה אחת אל חדר ההקלטה.
- הסר את r-ACSF עם טפטפת ולמקם את slקרח באמצע בעזרת מברשת.
- הסר את r-ACSF סביב פרוסה בעזרת פיסות filterpaper. עבור יציבות ועמידה, חשוב כי אין ACSF סביב הפרוסה יותר.
- פיפטה כ 0.5-1ml ACSF, תלוי בגודל של החדר הקלטה, על הפרוסה. ACSF פשוט צריך לכסות את פני השטח פרוסה.
- שים את תא הקלטת עם הפרוסה לתוך מיכל ממשק גדול humidified, perfused עם carbogen, ולתת הפרוסות להתאושש במשך שעה אחת לפחות.
| PEI פתרון | |
| 1ml | פולי (ethyleneimine) פתרון |
| במאגר בור 250 מ"ל | |
| 40mm | חומצה בורית |
| 10mm | tetraborate נתרן decahydrate |
4. טבלת מתכון PEI פתרון.
6. Imהזדקנות
סידן תלויי צבעים אינדיקטור ניתן הדמיה או באמצעות אחת או שתיים פוטון מיקרוסקופית. שימוש של שני פוטונים הדמיה רק מפעיל צבע אינדיקטור בתוך נפח המוקד של האזור של עניין, ובכך להקטין את כמות פיזור האור בתוך הרקמה. יתר על כן, היא מאפשרת חדירה טובה יותר של עומק האור לתוך הפרוסה.
הדמיה תפקודית סידן אנו משתמשים ספיר טיטניום לייזר מסופק על ידי מצמידים קוהירנט אל מיקרוסקופ אולימפוס במטרה 20x (NA 0.95) ומערכת Trimscope ידי LaVision BIOTEC. המערכת מאפשרת Trimscope מסגרת סריקה עם 64 beamlets בו זמנית, והוא יחד עם המצלמה C9100 EM-CCD Hamamatsu עבור מסגרת שיעורי סריקה מהירה.
- מקם את חדר ההקלטה מתחת למיקרוסקופ ולהקים זלוף יציב עם הדמיה דואר ACSF (1.6 Ca 2 + / 2 + 1.5 מ"ג תפעוליות (טבלה 2)) מחומם לטמפרטורה של 30 פיזיולוגיים יותר מינימלי ° C.
- Focאותנו לאזור של עניין (ROI) באמצעות תאורה אור לבן. הימנע חשיפת פרוסה לאור יותר מהנחוץ.
- בחר את אורך הגל, בתחום ההדמיה של נוף, תדר סריקה, צפיפות פיקסל ואפשרויות תוכנה נוספת ישים את האותות רקמות ביולוגיות אתה רוצה למדוד. עבור הדמיה סידן רשת עם Fura 2-AM אנו בדרך כלל לבחור אורך גל של 820nm, 250x250 הדמיה מיקרומטר שדה הראיה, תדר linescanning של 1200Hz ו 2-by-2 binning. התוצאה frametime של כ 100ms ולכן תדירות הדמיה של כ 10Hz.
- בדוק אם ההחזר על ההשקעה שלך היא להתמקד באמצעות מצב סריקה רציפה באורך גל של נבחרת laserlight. התאם את המיקוד ואת עוצמת הלייזר, כדי למנוע הרוויה פיקסל הלבנה של התמונה שלך.
- לעשות סרט timelapse של ההחזר על ההשקעה שלך. אנחנו בדרך כלל לרכוש שני סרטים timelapse של 2000 מסגרות אחד.
- לאיתור וזיהוי תאים, לקחת Z-מחסנית באמצעות stepsize של 1 מיקרומטר ו מתאר לעצמי דואר + / 20 מיקרומטר סביב המטוס צילמו שלך להתמקד.
7. נציג תוצאות
טעינה מוצלחת של אינדיקטורים סידן, Fura 2-AM מוצגים באיור 1 בפיתוח רשתות קליפת neocortical ו entorhinal באמצעות דימות multiphoton. לצבוע חלק עדיין קיים כפי מכתים רקע סומה רקמות אבל התא, ובמקרים מסוימים, דנדריטים הפרוקסימלי נראים בבירור להפריד בין הסביבה neuropil. אם הטעינה לא הייתה מוצלחת, מעט מאוד תאים ספציפיים מכתים הוא ציין ו אשכולות קטנים של נקודות צבע לעיתים קרובות נראו על פני השטח פרוסה פסולת קרום מת.
ב מסך האלה, רשת של תאים נראה בבירור במישור אחד של מוקד הדמיה התא בו זמנית. השימוש נבל מתכת או דבק שלם של הפרוסה לתא הקלטה יכול לגרום משטח אחיד פרוסה להיות הדמיה.
550fig1.jpg "alt =" איור 1 "/>
באיור 1. Fura 2-AM אסתר טעון פיתוח neocortical (א, משמאל) entorhinal (B, מימין) רשתות. ברים סולם 100 מיקרומטר.
כדי להפריד בין הנוירונים האסטרוציטים, שיתוף יישום sulforhodamine 101 עם Fura 2-AM אסתר מאפשרת הפרדה של סוגי תאים בתוך הרשת.
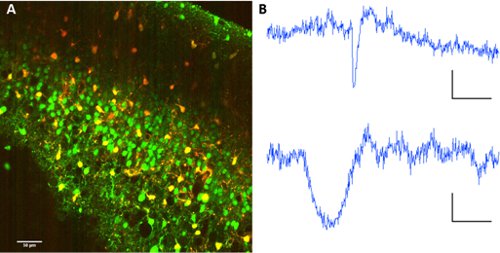
באיור 2. תיוג Astrocyte עם sulforhodamine 101. Co-תיוג של Fura 2-AM ו - אסתר sulforhodamine 101. גל עירור: 820nm. אוסף תמונות על PMTs עם מראה dichroic ב 560/70nm להפרדת אורכי גל. B נציג עקבות הקרינה מן הנוירון (לעיל) astrocyte (להלן). סולם ברים 60 שניות, ΔF 10 (au fluo).
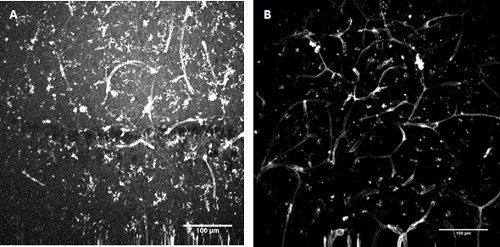
באיור 3. FITC-מצומדות Lycopersicon esculentum (עגבניות) לקטינים מכתים . Labelling של microglia ותאי האנדותל בפיתוח ההיפוקמפוס עכבר (א) ו בקליפת entorhinal שטחית (B).
אינדיקטור צבעים סידן משמשים לקריאה מתוך פעילות של תאים מרובים בו זמנית בפיתוח רשתות הקורטיקליים בהיפוקמפוס.
איור 4. סידן הארעיים דינמי ברשתות בהיפוקמפוס קליפת המוח.
סרט 1: Fura 2-AM הטעינה של אסתר עכבר entorhinal הקורטקס במהלך השבוע לאחר הלידה השנייה.
לחץ כאן לצפייה בסרט 1.
סרט 2: Fura 2-AM טעינת אסתר של ההיפוקמפוס עכבר במהלך השבוע לאחר הלידה הראשונה.
לחץ כאן לצפייה בסרט 2.
סרט 3: Fluo-4 הטעינה של העכבר קליפה, במהלך השבוע לאחר הלידה הראשונה.
50movie3.avi "> לחצו כאן כדי לצפות בסרט 3.
במקרה של Fura 2-AM, אסתר תא ההפעלה מעורבים שלילת קוטביות זרם המושרה של סידן, מקטין צבע פלואורסצנטי. עבור צבעים כגון Fluo-4, ההיפך הוא הנכון ואת שלילת קוטביות התא כפי שנצפה גידול פליטת פוטון. הארעיים סומטיים סידן נמדדים בעיקר, אך פעילות יותר דנדריטים הפרוקסימלי ניתן לראות בהכנות מסוימים, כפי שמוצג סרט 2.
לקריאה מתוך פעילות הרשת ניתן לכמת באמצעות תסריטים תוכנה מסחרית או בתוך הבית. במעבדה שלנו זיהוי התאים, פעילות הרשת נמדדת וניתח באופן חצי אוטומטי באמצעות in-house קוד Matlab (Mathworks).
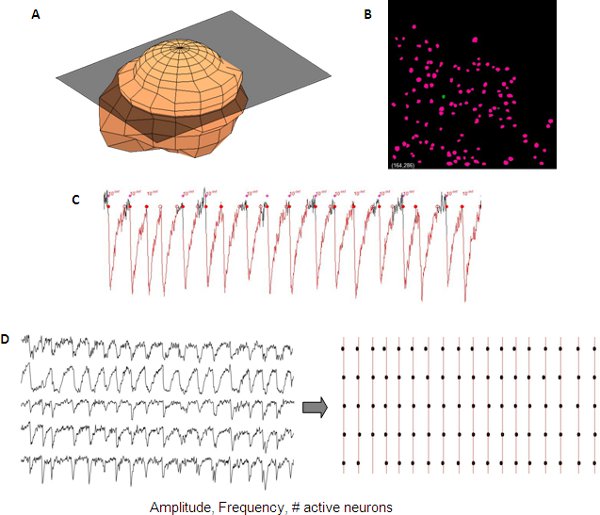
איור 5. ניתוח נציג הארעיים סידן מסונכרן מרשת קליפת המוח המתפתח. ייצוג 3D של נוירון אחד ( ) משמש באופן אוטומטי ליצור מסכה נוירון (ב) מתוך ערימה-z עבור זיהוי אוטומטי נוירון. מדידות של הארעיים סידן כוללים אמפליטודה, תדירות # של תאים פעילים שניתן לקרוא מן הנתונים נוירון יחיד (C). בתיאום בין עקבות שונות ניתן דמיינו באמצעות העלילה raster (ד ').
Discussion
שיטות אנחנו מדגימים כאן להראות פרוטוקולים מתאימים הדמיה סידן של רשת דינמיקה מתאי לזיהוי בתוך בפיתוח רשתות הקורטיקליים בהיפוקמפוס העכבר גם במוח חולדה. שיטות אלו מספקות רזולוציה מרחבית אופטימלית לדמיין רשת מקומית של somas תא בו זמנית למדידת פעילות suprathreshold. החלטה הזמני של פעילות הרשת יכולים להיות מגוונים, בהתאם למסגרת הרכישה הגדרות מצלמת CCD, כדי לייעל את האות: מדידות רעש לאורך זמן suprathreshold אירועים משך, נמצא בדרך כלל למערכת העצבים המתפתחת. פרוטוקולים אלה אינם מוגבלים לרשתות בהיפוקמפוס קליפת המוח, אלא גם תאים תווית ברחבי מערכת העצבים המתפתחת. המגבלה של שיטה זו הוא כי פעילות suprathreshold רק ניתן להקליט.
Disclosures
LaVision BIOTEC GmbH (בילפלד, גרמניה) בחסות דמי הגשת כתב היד של מאמר זה.
Acknowledgements
עבודה במעבדה נתמך על ידי Nederlandse Organisatie voor Wetenschappelijk Onderzoek (NWO) (917.10.372) כדי rmm. JD המזוהה עם האיחוד האירופי FP7 BrainTrain התוכנית ( www.brain-train.nl ). אנו מודים פיטר לורנס ו-Baljon סבין שמיץ (שניהם CNCR, אוניברסיטת VU באמסטרדם) עבור תמונות של מערך FP multielectrode גל ותרבויות עצבי המשמשים רצף וידאו.
Materials
References
- Katz, L. C., Shatz, C. J. Synaptic activity and the construction of cortical circuits. Science. 274, 1133-1138 (1996).
- Khazipov, R., Luhmann, H. J. Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends in Neurosciences. 29, 414-418 (2006).
- Spitzer, N. C. Electrical activity in early neuronal development. Nature. 444, 707-712 (2006).
- Adelsberger, H., Garaschuk, O., Konnerth, A. Cortical calcium waves in resting newborn mice. Nat. Neurosci. 8, 988-990 (2005).
- Garaschuk, O., Linn, J., Eilers, J., Konnerth, A. Large-scale oscillatory calcium waves in the immature cortex. Nat. Neurosci. 3, 452-459 (2000).
- Lamblin, . Electroencephalography of the premature and term newborn. Maturational aspects and glossary. Neurophysiol. Clin. 29, 123-219 (1999).
- Rakic, P., Komuro, H. The role of receptor/channel activity in neuronal cell migration. J. Neurobiol. 26, 299-315 (1995).
- Spitzer, N. C., Root, C. M., Borodinsky, L. N. Orchestrating neuronal differentiation: patterns of Ca2+ spikes specify transmitter choice. Trends. Neurosci. 27, 415-421 (2004).
- Canto, C. B., Wouterlood, F. G., Witter, M. P. What does the anatomical organization of the entorhinal cortex tell us. Neural. Plast. , 381243-381243 (2008).
- Bureau, I., Shepherd, G. M., Svoboda, K. Precise development of functional and anatomical columns in the neocortex. Neuron. 42, 789-801 (2004).
- Ikegaya, Y., Le Bon-Jego, M., Yuste, R. Large-scale imaging of cortical network activity with calcium indicators. Neuroscience research. 52, 132-138 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved