Method Article
Kortikal Ağları Geliştirme Fonksiyonel Kalsiyum Görüntüleme
Bu Makalede
Özet
Nöron ağları geliştirme spontan aktivite, kalsiyum duyarlı göstergesi boyalar AM ester formları kullanarak ölçülebilir. Nöronal aktivasyon gösteren hücre içi kalsiyum değişiklikler, bir veya iki foton görüntüleme göstergesi floresan geçici değişiklikler olarak algılanır. Bu protokol, gelişimsel bağımlı nöron ağları bir dizi için adapte edilebilir In vitro.
Özet
Sinir sistemleri gelişmekte olan faaliyet damgasını deseni kendiliğinden, senkronize ağ etkinliği. Senkronize aktivite, sağlam, spinal kord, beyin, retina, korteks ve ayrışmış nöronal kültür hazırlıkları görülmüştür. Spontan aktivite dönemlerinde, birçok iyon kanallarını aktive eden, tek ya da aksiyon potansiyelleri patlamaları yangın nöronlar depolarize. Depolarizasyon kalsiyum girişini arabuluculuk dendritler ve dikenler voltaj kapılı kalsiyum kanalları harekete geçirir. Yüksek senkronize elektriksel aktivite alanında elektrotlar kullanarak yerel nöronal ağlardan ölçülmüştür. Bu teknik bir elektrot okuma birden fazla nöron entegre nedeniyle yüksek zamansal örnekleme oranları ancak daha düşük uzaysal çözünürlüğü sağlar. Tek hücre çözünürlük nöronal aktivitenin faaliyet ateş ölçmek için tek nöron patch-kelepçe elektrofizyoloji kullanarak mümkündür. Ancak, ölçmek için bir ağ yeteneği, nöron yamalı s sayısı ile sınırlıdırimultaneously ve tipik olarak sadece bir ya da iki nöron. Kalsiyum-bağımlı floresan gösterge boyaların kullanımı hücrelerden oluşan bir ağ üzerinden senkronize aktivitesi ölçümü sağladı. Bu teknik, gelişmekte olan ağ spontan aktivite kayıt için yüksek uzaysal çözünürlüğü ve yeterli zamansal örnekleme verir.
Öncesi ve erken doğum sonrası gelişimi sırasında yeni oluşum kortikal ve hipokampal ağları önemli bir özelliği de, nöronal aktivitenin senkronize (Khaziphov & Luhmann'ın, 2006 Katz & Shatz, 1996), spontan. Bu korelasyon ağ aktivite, fonksiyonel devreleri nesil (Spitzer, 2006) gelişmekte olan sinir sistemi için gerekli olduğuna inanılmaktadır. Primat ve kemirgen beyin hem de, erken, elektrik ve kalsiyum ağ dalgaları gözlenir pre-ve postnatal in vivo ve in vitro (Adelsberger ve ark, 2005; Garaschuk ve ark, 2000;. Lamblin ve ark, 1999). Birkaç kontrol etmek için bilinen bu ilk çalışma, desen,nöronal farklılaşma, sinaptogenez ve plastisite (Rakic & Komuro, 1995, Spitzer ve ark, 2004) de dahil olmak üzere gelişimsel süreçleri kortikal devre doğru gelişmesi ve olgunlaşması için kritik öneme sahiptir.
Bu jove video, kortikal ağları geliştirmek görüntü spontan aktivite için kullanılan yöntemler göstermektedir. Intrasellüler esteraz aktivitesi parçalayarak hücre zarından gibi Fura Kalsiyum duyarlı göstergeler, 2-AM ester diffüz gösterge boya hücre geçirgenliği olmayan formu terk esterleri AM. Göstergesi laktobionat formu sonra algılar ve intraselüler kalsiyum iyonları bağlamak mümkün karboksilik asit grupları .. Kalsiyum duyarlı boya floresan geçici kalsiyum bağlayıcı üzerine değişir. Tek veya çoklu foton görüntüleme teknikleri boya yayılan fotonlar değişimi ölçmek için kullanılır ve böylece hücre içi kalsiyum bir değişiklik gösterir. Ayrıca, bu kalsiyum-dependent göstergeleri aktif ağ içindeki hücre türlerini araştırmak için diğer floresan işaretleri ile kombine edilebilir.
Protokol
1. Yatay entorinal hipokampal beyin dilimleri yapma
Entorinal-hipokampal beyin dilimleri Canto, Wouterlood & Witter Sinir Plastisite kimliği 381.243 9 (2008) göre, bölgenin 3 boyutlu bir bakış ayrıntılı anatomik kılavuzları, kullanılarak yapılır .
- Carbogen gaz (% 95 oksijen,% 5 karbon dioksit) ile en az 20 dakika süreyle oksijen, dilim çözüm 500ml olun ve sonra buzlu kadar 250ml dondurma. Dilimleme önce Dakika, ezmek ve diseksiyonu ve dilimleme odasında kesmek için kullanılacak kalan 250ml köpüren dilim çözüm dilim buz karışımı.
- R-ACSF 200ml (kurtarma ACSF) ve e-ACSF (deneysel ACSF) çözümü en az 500ml olun. Carbogen gaz (% 95 oksijen,% 5 karbon dioksit) ile en az 20 dakika önce doku hazırlanması için sürekli oksijen hem de çözümler.
- Bu protokol, 3 hafta eski bir maksimum 0 doğum sonrası günden itibaren fareler için geçerlidir. Anima başını kesmekl, yerel etik kurul prosedürlere göre, yukarıdaki Adım 1 hazırlanan buz dilim çözüm içeren bir Petri kabındaki hızlı bir şekilde beyin teşrih (çözümleri ve reaktifler için bkz. Tablo 1 ).
- Dilim çözümü ile ıslatılmış bir filtre kağıdı üzerine beyin transferi ve keskin bir jilet ile iki yarımküresinin ayrı. Bir yarımkürede buz dilim çözüm içine aktarın.
- Diğer yarımkürenin beyincik çıkarın. Beyin, orta hat üzerine Flip ve rostral sonuna doğru hafif bir açı ile beynin üst kesilir.
- Ters dilimleyiciyi doku tutucu üzerine kesme (dorsal) yüzey ve yapıştırıcı bu pamuklu bir çubukla hafifçe iterek üzerine beyin çevirin.
- Adım 1 kalan buz soğuk dilim çözüm düşük bir frekans ve hızı kullanarak Dilim 300 mikron kalınlığında beyin dilimleri. Koşullar altında, 0.05 mm / s ve 36Hz ayarlarını az bir Thermo Fisher Scientific vibratome (Microm, HM 650V) kullanın.
- Gibioda sıcaklığında, en kısa sürede bir dilim, oksijenli Yapay Cerebro Omurilik Sıvısı (ACSF) (bkz. Tablo 2 2.5mm Mg 2 +, 1,6 Ca 2 +) içeren bir dilim tutucu (batık) transfer R-ACSF yüksek magnezyum konsantrasyonu dilimleme ve deneyimlerimiz aşağıdaki NMDA reseptörleri üzerinden nöronların içine kalsiyum akışı azaltır, deneyler için daha kaliteli bir dilim açar. Gerekirse, daha sonra ikinci serebral hemisferin kesti.
- Kurtarmak için bir saat dilimleri bırakın.
| Dilim çözeltisi (mM) - 10 | |
| 110 | kolin klorür |
| 25 | NaHCO 3 |
| 11,6 | 11,6 |
| 10 | D-glukoz |
| 7 | MgCl 2 |
| 3,1 | sodiumpyruvate |
| 2,5 | KCl |
| 1,25 | NaH 2 PO 4 |
| 0,5 | CaCl 2 |
Tablo 1 dilim çözümü için Reçete.
| ACSF (mM) | |
| 125 | NaCl |
| 26 | NaHCO 3 |
| 10 | D-glukoz |
| 3 | KCl |
| 2.5/1.5 | MgCl 2 (kurtarma / deney) |
| 1,6 | CaCl 2 |
| 1,25 | NaH 2 PO 4 |
Tablo 2: Tarif için hem de kurtarma (r-ACSF) ve deneysel (e-ACSF) çözümü.
2. Boyama ch hazırlanmasıkehribar
Hücrelerin kalsiyum-bağımlı bir göstergesi ya da hücre-spesifik bir işaretleyici ile yüklemek için, dilimler, boyama işlemi için bir oda transfer edilmesi gerekir. Ticari odaları mevcut olsa da, bir çok az maliyet için kolayca standart laboratuar ekipmanları monte edilebilir. Böyle bir odasının temel özellikleri dilim 30 ve 35 arasında kaynaştı olduğunu ° C, sürekli oksijenli bir ortamda inkübe ve odanın ışık korumalıdır.
- Isıtılmış bir çubuk kullanarak, sadece silikon hortumun bir bölümü (çapı yaklaşık 1.5mm) geçmesine izin için yeterince büyük iki tek polistiren petri kutularının yan duvar (35 ve 100 mm çaplı) küçük bir delik olun.
- Konu silikon küçük petri delikten borular ve küçük bir çanak iç duvarına içinde bir döngü oluşturur.
- Hortumun açık ucunu mühür ve petri iç duvara geri kalanı boru sopa superglue kullanın.
- Ince bir iğne kullanarak, iç petri içinde tüp eşit aralıklı aralıklarla delikler.
- Yapıştırıcı hizalanmış iki delikli büyük içinde küçük petri,. Büyük petri duvardaki delikten silikon hortumun diğer ucunu geçirin.
- Arayüz çanak için, hücre kültürü, yarı geçirgen bir zar ile de eklemek alabilir ve ısıtılmış bir neşter kullanılarak, inkübasyon sırasında dilim tutmak için sığ bir çanak terk üst 1cm uzakta kesti.
- Büyük petri kapağı, bir delik yaklaşık olun. 0.5-1cm çaplı carbogen (% 95 O 2,% 5 CO 2) odasına akışına izin vermek için.
- 5 veya 10 ml'lik plastik şırınga alın. Isıtılmış bir neşter kullanarak, şırınga sonuna kaldırmak ve şırınga tüpün ucu ile birkaç cm uzunluğunda tutmak için açılı kesim yapmak. Superglue kullanarak, 0.5-1 cm çapında delik üzerine, petri kapağını şırınga tüp kesme yüzeyi eklemek.
- Silikon tüp ve takınşırınga ucu bağlantısı ubing. Petri kutularının temel giren silikon tüp için bir başka boru konnektörü takın.
- Carbogen (% 95 O 2,% 5 CO 2) tedariki için bir regülatör hem de tüpleri bağlayın. Inkübasyon 30-35 arasında sıcak bir plaka boyama odasına ° C yerleştirin Odanın tüm kuluçka işlemi sırasında ışıktan korumalı olabilir emin olun. Boyama odasına şimdi montaj ve dilim de kuluçka alanı olarak kullanmak için hazır.
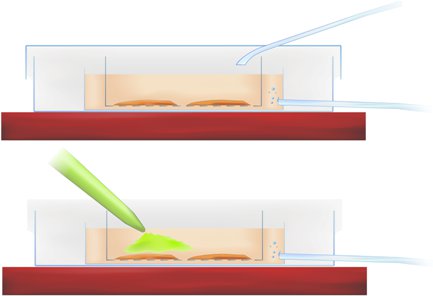
Metodoloji Şekil 1 dilim inkübasyon (üstte) ve kalsiyum hassas göstergesi (aşağıya yeşil boya, pipetle) uygulaması gösteren boyama odasının kesiti.
3. Dilimleri boyanması
Floresan boyalar içeren herhangi bir taşıma boyunca, az ışık ile çalışma photobleaching önlemek ve boya ve t tutmaktaşıma arasındaki karanlık doku boyandı.
- Boyama odası, bir ısı plakası (35 ° C) koyun, bir carbogen gaz tedarik bağlamak ve dilim sahibinden yaklaşık 1.5ml r-ACSF ile doldurun.
- Boyama odasında arayüz tabağına yerleştirin ve 1 ml ACSF ile doldurun.
- ACSF köpüren yumuşak, sabit bir hızda tutmak için boyama odasında iyi bir carbogen layın.
- Bir şişe içine 50 mg Fura 2-AM 9 ul DMSO ve 1 ul pluronic asit (% 20 DMSO stok solüsyonu, Invitrogen) ekleyin. Vortex 15 dakika boyunca boya karışımı.
- Dilimleri arayüzü çanak içine aktarın ve 50mm nihai boya konsantrasyonu elde Metodoloji Şekil 1 (yukarıda) belirtildiği gibi ilgi, hipokampus ve entorhinal korteks bölgesi üzerinde, doğrudan r-ACSF içine boya pipetle.
- Boyama odanın kapağını kapatın ve 20 dakika boyunca boya hayvanın yaşına göre (bkz. Tablo 3) 40 dakika inkübe edin.
- Transiçine dilim dilim sahibinin ferin.
| Yaş (doğum sonrası gün) | İnkübasyon süresi (dk) |
| 20 | |
| p8-p9 | 25 |
| p10-p11 | 30 |
| p12-13 | 35 |
| > P13 | 40 |
Tablo 3 farklı yaş grubu için Kuluçka süreleri, laboratuvarda deneysel olarak belirlenir.
4. Diğer boyalar ve eski doku
Belki de beyin dokusunda artan miyelinasyonun nedeniyle, büyük kemirgenler dilimleri Fura sürebilir yok o kadar kolay ester 2-AM. Cremophor EL (Sigma) kullanarak preinkübasyon adım P13 ve 11 yaşlı farelerin beyinleri için kullanılan bu boya alımını kolaylaştırmak için. Cremophor birçok ecza bir yardımcı madde olarak kullanılan bir non-iyonik yüzeyal uygulamaları. Bu adım olmadan, hücre spesifik etiketleme kortikal dilim boyunca son derece kötü ve tutarsız olduğunu bulabilirsiniz.
- 3ml r-ACSF ve 8, 35 ° C'de 3 dakika ısıtılmış ul% 0.5 cremophor (Sigma) ile dolu sığ bir preinkübasyon çanak eski dilim aktarın.
- Dilim arayüzü çanak içine aktarın ve normal boyama prosedürünü takip (4-7 Adımlar, yukarıya bakınız).
Kalsiyum boyalar dilim hazırlık nöronlar ve olmayan nöronlar hem de yük. Belirlemek ve ağ içinde bu hücre tipleri arasında ayrım sulforhodamine 101 (SR101) dilim içinde etiket astrositler kullanılan olabilir.
Sulforhodamine 101 dilim boyanması
(Bölüm 3) daha önce olduğu gibi, 1-3 arasındaki adımları izleyin.
1 ul sulforhodamine (Sigma) -20 ° C'de depolama 10mM stok solüsyonu ve 10 mcM bir çözüm sağlamak için 999 ul r-ACSF çözülür. Mor boya ov Pipeter dilim daha önce olduğu gibi (5-7), 15 dakikalık bir süre için kuluçka dilim bırakarak.
Mikroglia ve endotel hücreleri FITC domates lektin boya etiketli.
Daha önce olduğu gibi, 1-3 arasındaki adımları izleyin.
25 ul 2mg/ml Lycopersicon esculentum (domates) lektin FITC konjuge (L0401, Sigma) stok solüsyonu 20 mg / ml konsantrasyonu vermek için 2.5ml r-ACSF içine atın. (Adım 5-7) daha önce olduğu gibi dilimleri üzerinde boya Pipet bırakarak, 45 dakikalık bir süre için kuluçka dilim.
Not: Bu boya Fura 2-AM veya Oregon Yeşil BAPTA-1 hem de boyalar fotonlar beri spektrumun yeşil alanda floresan (ÖGB-1) yayılan olacak gibi kalsiyum duyarlı bir göstergesi ile kombine etmek mümkün değildir çakışan dalga boylarında. Ancak, wit birleştirmek için, uygun filtreler veya Texas-Kırmızı lektin konjugatları ile birlikte kullanılmış olabilir, Kalsiyum, turuncu, Fura Kırmızı gibi diğer kalsiyum göstergesi boyalar vardıryeşil spektrum h kalsiyum göstergesi boyalar.
5. Kayıt odasına dilim takılması
Sırasında görüntüleme dilim mikroskop altında kararlı olması gerekir. Genellikle bir metal arp doku basılı tutun yerleştirilir ama dengesiz odak görüntüleme için görüş alanında sadece bir bölümünü vererek, dilim yüzeyi bozabilir. Bunu önlemek için, dilim Polyethylenimine (PEI) kullanarak kayıt odasına sıkışmış.
- PEI solüsyonu (250ml borik tampon (Tablo 4) 1ml polietilenimin çözüm) hazırlayın. PEI (bir gecede heyecan), tamamen eriyene emin olun.
- PEI çözüm dilim uygulamak istiyorsanız önce en az bir saat altındaki sıvı ile kaplıdır, böylece kayıt odaları doldurun
- Distile su ile ve sonra holding odasından r-ACSF ile kayıt odalarına yıkayın.
- Bir kayıt odasının içine bir dilim aktarın.
- R-ACSF bir pipet ve pozisyon sl kaldırınBir fırça yardımıyla ortasında buz.
- Filterpaper parçaları kullanarak dilim etrafında r-ACSF çıkarın. Istikrar ve bağlılık için, artık dilim etrafında hiçbir ACSF olduğunu önemlidir.
- Pipet yaklaşık 0.5-1ml ACSF, dilim üzerine, kayıt odasının boyutuna bağlı. ACSF sadece dilim yüzeyini kaplayan gerekir.
- Carbogen ile perfüze büyük nemlendirilmiş bir arayüz konteyner, dilim ile kayıt odasına koyun ve en az bir saat dilimleri kurtarmanızı sağlar.
| PEI çözümü | |
| 1ml | Poli (ethyleneimine) çözümü |
| 250ml borik tampon | |
| 40mm | asit borik |
| 10mM | sodyum tetraborat dekahidrat |
Tablo 4: Reçete PEI çözüm.
6. Imyaşlanma
Kalsiyum bağımlı göstergesi boyalar tek veya iki foton mikroskopi kullanılarak görüntülenebilir. Iki foton görüntüleme kullanın böylece dokuda ışık saçılımı miktarını azaltarak, faiz bölgenin odak hacmi içinde sadece gösterge boya harekete geçirir. Ayrıca, bu dilim içine ışık daha derinlemesine nüfuz sağlar.
Fonksiyonel kalsiyum görüntüleme için 20x objektif (NA 0.95) ve LaVision Biotec bir Trimscope sistemi, bir mikroskop Tutarlı birleştiğinde tarafından sağlanan bir Titanyum safir lazer kullanır. Trimscope sistemi aynı anda 64 küçük ışın tarama çerçeve sağlar ve bir kare hızlı tarama oranları için Hamamatsu C9100 EM-CCD kamera ile birleştirilmiştir.
- Mikroskop altında kayıt odasına yerleştirin ve daha fizyolojik bir sıcaklık minimum 30 ° C'ye kadar ısıtılır görüntüleme, e-ACSF (1.6 Ca 2 + / 1.5 Mg 2 + oranı (tablo 2)) ile istikrarlı bir perfüzyon kurmak
- Focbizi bölgeye beyaz ışık aydınlatması ile faiz getirisi (ROI). Dilim gerekli olandan daha uzun süre ışığa maruz bırakmayın.
- Dalga boyu, görüş görüntüleme alanında, tarama frekansı, piksel yoğunluğu ölçmek için istediğiniz doku ve biyolojik sinyaller için ek yazılım seçenekleri seçin. Fura ile kalsiyum ağ görüntüleme için 2-AM biz genellikle 820nm dalga boyu, 250x250 mikron görüntüleme alanında bir görüş, bir linescanning 1200Hz sıklığı ve 2-by-2 binning seçin. Bu sonuç bir frametime dolayısıyla yaklaşık 100ms ve 10Hz ile ilgili bir görüntüleme frekansı.
- YG'nizi sürekli bir tarama modu ve laserlight seçilen dalga boyu kullanarak odak olup olmadığını kontrol edin. Görüntünün piksel doygunluk ve ağartma önlemek için odak ve lazer yoğunluğunu ayarlayın.
- YG'nizi bir timelapse film yapın. Biz tipik olarak 2000 kare her iki timelapse filmleri kazanır.
- Hücre algılama ve tanımlama için, 1 mikron stepSize ile görüntüleme z-yığını e + / 20, odak görüntülü düzlemi etrafında mikron.
7. Temsilcisi sonuçları
Başarılı yükleme, kalsiyum göstergeler Fura 2-AM multiphoton görüntüleme kullanarak neokortikal ve entorhinal korteks ağları geliştirmek Şekil 1'de gösterilmiştir. Bazı boya doku değil hücre soma ve bazı durumlarda arka plan boyama olarak hala mevcut, proksimal dendritler açıkça görünür ve neuropil çevreleyen ayrı. Yükleme başarılı olmamışsa, çok az hücre spesifik boyanması gözlenen ve boya lekeleri küçük kümeleri genellikle ölü membran enkaz dilim yüzeyinde görülebilir.
Bu ekran, hücre ağı, eş zamanlı olarak hücre görüntüleme için odak tek bir düzlemde açıkça görülebilir. Metal bir arp veya kayıt odasına dilim eksik yapışmasını kullanımı görüntülü, pürüzlü bir dilim yüzeye neden olabilir.
550fig1.jpg "alt =" Şekil 1 "/>
Şekil 1. Fura 2-AM ester yüklenmiş neokortikal gelişmekte olan (A, sol) ve (B, sağ) entorinal ağları Ölçek bar 100 mikron.
Astrositler gelen nöronlar ayırmak için, sulforhodamine 101 Fura ile ortak uygulama 2-AM ester ağ içindeki hücre tiplerinin ayrımı sağlar.
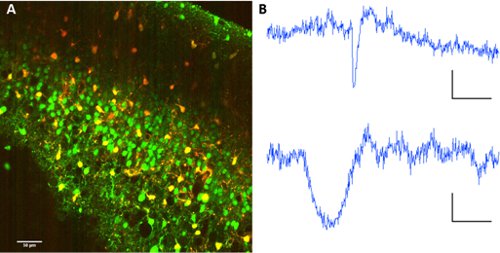
Şekil 2. Sulforhodamine 101 ile astrosit etiketleme. Fura 2-AM ester ve sulforhodamine 101 Co-etiketleme. Dalgaboyu 820nm. Bir nöron (üstte) ve astrosit (aşağıda) dalga boyu ayrılması için 560/70nm dikroik ayna ile Proje Yönetim Ekipleri Görüntü toplama B Temsilcisi floresan izleri. Ölçek bar 60 sn, mesafe kadar taşınmış 10 (au fluo).
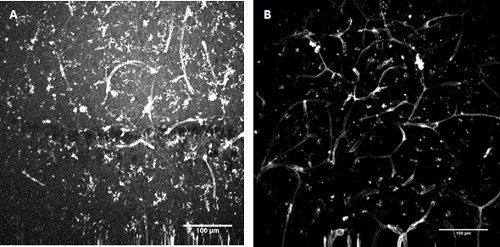
Şekil 3. FITC-konjuge Lycopersicon esculentum (domates) lektin boyama Fare hipokampus (A) ve yüzeysel entorhinal korteks (B) gelişmekte olan mikroglia ve endotel hücreleri Etiketleme.
Kalsiyum göstergesi boyalar, gelişmekte olan kortikal ve hipokampal ağlar aynı anda birden fazla hücrelerden faaliyet okumak için kullanılır.
Şekil 4. Hipokampal ve kortikal ağları Dinamik kalsiyum transientler.
Film 1: Fura 2-ikinci postnatal haftasında fare entorhinal korteks ester yükleme.
Film 1 görmek için buraya tıklayın.
Movie 2: Fura 2-doğum sonrası ilk haftasında fare hipokampus ester yükleme.
Film 2 görmek için buraya tıklayın.
Film 3: doğum sonrası ilk haftasında fare korteksin Fluo-4 yükleme.
50movie3.avi "> 3 film izlemek için buraya tıklayın.
Fura durumunda 2-AM, kalsiyum depolarizasyon indüklenen akını içeren ester, hücre aktivasyonu, boya floresan azalır. Fluo-4 gibi boyalar için, bunun tam tersi doğrudur ve hücre depolarizasyon foton emisyon artış olarak görülmektedir. Somatik kalsiyum transientler ağırlıklı olarak ölçülür ama daha çok proksimal dendritler faaliyet Movie 2 gösterildiği gibi, bazı hazırlıklar olabilir.
Salt ağ etkinliği, ticari ya da in-house yazılım komut dosyalarını kullanarak belirlenebilir. Laboratuarı, hücre tanımlama ve ağ etkinliği ölçülür ve Matlab (Mathworks) in-house kodu kullanarak yarı otomatik bir şekilde analiz edilmiştir.
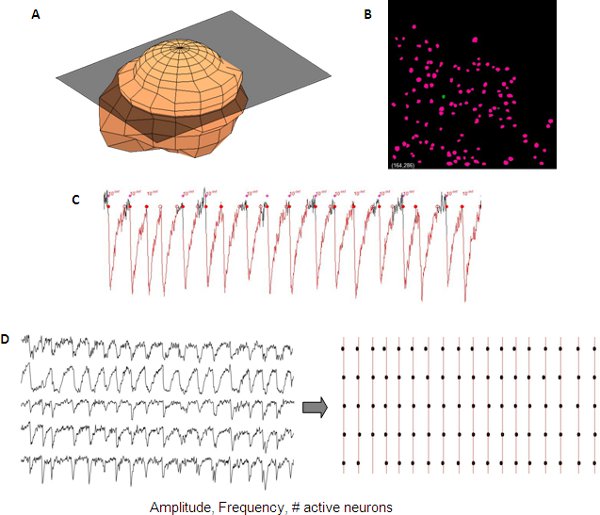
Şekil 5. Tek bir nöronun 3D gösterimi (gelişmekte olan kortikal ağ senkronize kalsiyum transientler Temsilcisi analizi . A), (B) z-yığını otomatik nöron tespiti için bir nöron maske otomatik olarak oluşturmak için kullanılmaktadır. Kalsiyum transientler ölçümleri, tek bir nöron veri (C) okunabilir aktif hücrelerinin genlik, frekans ve # içerir . Farklı izleri arasında senkronize bir raster arsa (D) kullanılarak görüntülenebilir.
Tartışmalar
Fare ve sıçan beyin kortikal ve hipokampal ağların geliştirilmesi içinde tanımlanabilir hücreler ağ dinamikleri kalsiyum görüntüleme için uygun protokoller burada göstermek yöntemleri. Bu yöntemler aynı zamanda hücre somas suprathreshold aktivitesi ölçümü için bir yerel ağ görselleştirmek için en iyi uzaysal çözünürlüğü sağlar. Gürültü ölçümleri, genellikle gelişmekte olan sinir sistemi uzun süre suprathreshold olaylar, ağ etkinliği Zamansal çözünürlük çerçeve satın alma CCD kamera ayarları bağlı olarak, sinyal optimize etmek için, çeşitli olabilir. Bu protokoller, gelişmekte olan sinir sistemi boyunca hipokampal ve kortikal ağları değil, aynı zamanda etiket hücreleri sınırlı değildir. Bu yöntemin sınırlama sadece suprathreshold faaliyet kaydedilebilir.
Açıklamalar
LaVision Biotec GmBH (Bielefeld, Almanya) Bu yazının makale gönderme ücreti sponsor oldu.
Teşekkürler
Laboratuarda çalışmalar RMM için Nederlandse Organisatie voor Wetenschappelijk Onderzoek (NWO) (917.10.372) tarafından desteklenmektedir. JD AB 7.ÇP BrainTrain programı (bağlı www.brain-train.nl ). Pieter Laurens-Baljon ve Sabine Schmitz (her ikisi de CNCR, Amsterdam VU Üniversitesi) Biz FP multielectrode dizi video sekansında kullanılan dalga şekilleri ve nöronal kültürlerin görüntüler için teşekkür ederiz.
Malzemeler
Referanslar
- Katz, L. C., Shatz, C. J. Synaptic activity and the construction of cortical circuits. Science. 274, 1133-1138 (1996).
- Khazipov, R., Luhmann, H. J. Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends in Neurosciences. 29, 414-418 (2006).
- Spitzer, N. C. Electrical activity in early neuronal development. Nature. 444, 707-712 (2006).
- Adelsberger, H., Garaschuk, O., Konnerth, A. Cortical calcium waves in resting newborn mice. Nat. Neurosci. 8, 988-990 (2005).
- Garaschuk, O., Linn, J., Eilers, J., Konnerth, A. Large-scale oscillatory calcium waves in the immature cortex. Nat. Neurosci. 3, 452-459 (2000).
- Lamblin, . Electroencephalography of the premature and term newborn. Maturational aspects and glossary. Neurophysiol. Clin. 29, 123-219 (1999).
- Rakic, P., Komuro, H. The role of receptor/channel activity in neuronal cell migration. J. Neurobiol. 26, 299-315 (1995).
- Spitzer, N. C., Root, C. M., Borodinsky, L. N. Orchestrating neuronal differentiation: patterns of Ca2+ spikes specify transmitter choice. Trends. Neurosci. 27, 415-421 (2004).
- Canto, C. B., Wouterlood, F. G., Witter, M. P. What does the anatomical organization of the entorhinal cortex tell us. Neural. Plast. , 381243-381243 (2008).
- Bureau, I., Shepherd, G. M., Svoboda, K. Precise development of functional and anatomical columns in the neocortex. Neuron. 42, 789-801 (2004).
- Ikegaya, Y., Le Bon-Jego, M., Yuste, R. Large-scale imaging of cortical network activity with calcium indicators. Neuroscience research. 52, 132-138 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır